马兜铃酸作用下肾小管上皮细胞尾加压素Ⅱ、转化生长因子-β1的表达及相互关系
陈素贤 万义增 杨 悦 李敬岩 李 伦
(辽宁医学院附属第三医院病理科,辽宁 锦州 121000)
马兜铃酸作用下肾小管上皮细胞尾加压素Ⅱ、转化生长因子-β1的表达及相互关系
陈素贤万义增杨悦李敬岩李伦
(辽宁医学院附属第三医院病理科,辽宁锦州121000)
目的观察马兜铃酸(AA)作用下尾加压素(U)Ⅱ和转化生长因子(TGF)-β1在肾小管上皮细胞(NRK-52E)中的表达及相互关系。方法常规培养的NRK-52E细胞分别加入DMEM培养基、AA、AA+ UⅡ、AA+ UⅡ+抗UⅡ抗体,培养24、36、48 h,用RT-PCR技术检测UⅡ、TGF-β1mRNA表达水平。结果与DMEM组比较,AA组NPK-52E细胞UⅡ和TGF-β1基因表达均明显增强(P<0.05);与AA组比较,AA+ UⅡ组TGF-β1表达明显增强(P<0.01);与AA+ UⅡ组比较,AA+ UⅡ+抗UⅡ抗体组TGF-β1基因表达显著降低(P<0.05,P<0.01)。结论AA作用下,NRK-52E细胞UⅡ和TGF-β1表达水平均升高,且UⅡ可诱导TGF-β1的表达,提示二者在AA肾病发生发展中可能有一定作用,且二者相互关联。
马兜铃酸;尾加压素Ⅱ;转化生长因子-β1
含马兜铃酸(AA)的药物主要在肾脏代谢,并且可以不断蓄积,且病变多为不可逆,成为许多老年患者肾衰竭的主要原因。尾加压素(U)Ⅱ是迄今发现的最强的体内缩血管活性物质,在肾脏尤其是近曲小管有丰富的表达。UⅡ及其受体mRNA在AA肾病的肾脏表达增强〔1〕。诸多研究表明,UⅡ在肾脏疾病中有一定作用。转化生长因子(TGF)-β1具有多种功能,在细胞的免疫调节、生长分化、损伤修复等方面发挥着重要作用。TGF-β1可诱导肾小管上皮细胞转分化〔2〕。UⅡ与TGF-β1在肾脏疾病中均有重要作用,但二者在AA发病中有无作用、有无关系及关系如何尚未见报道。本研究从细胞水平探讨AA作用下二者的表达规律及其相互关系。
1 材料与方法
1.1材料马兜铃酸钠购自中国药品生物制品检定所。DMEM为Gibco公司产品。UⅡ及抗UⅡ抗体购自Sigma公司。 Trizol、逆转录酶AMV 、TaqDNA聚合酶等购自新西兰Invitrogen公司。肾小管上皮细胞NRK-52E由吉林大学药学院药理与毒理学教研室馈赠。
1.2细胞培养与处理常规培养的NRK-52E细胞,用胰酶消化(0.25%),制成悬液,接种于12孔培养板,每组设6个复孔,细胞数1×104个/孔。贴壁培养24 h后,用含0.5%胎牛血清培养基培养,细胞同步后分别加入:单纯DMEM、AA(40 mg/L)、AA+ UⅡ(10-8mol/L)、AA+ UⅡ+抗UⅡ抗体(10-5mol/L)。继续培养24、36、48 h,收集细胞用于RT-PCR检测。
1.3指标检测RT-PCR检测细胞UⅡ和TGF-β1 mRNA的表达。UⅡ正义引物:5′-TGC CTG CTC TTC GTA GGA CT-3′,反义:5′-AGA GCC TTC CTC AAG CTT CC-3′,扩增产物242 bp。 TGF-β1正义引物:5′-GAC CTC AAT TGC GAG CTT TC-3′,反义:5′-AGT CCT CCT TCC GCC TTT AG-3′,扩增产物382 bp。内参GAPDH引物,正义:5′-ACC ACA GTC CAT GCC ATC AC-3′,反义:5′-TCC ACC ACC CTG TTG CTG TA-3′,扩增产物450 bp。提取细胞总RNA,总体积为25 μl。94℃变性5 min后,94℃变性45 s,退火45 s,72℃延伸45 s。退火温度分别为:UⅡ为53℃,TGF-β1为59℃,GAPDH为55℃。经过30个循环,72℃再次延伸10 min。运用凝胶成像处理系统,对琼脂糖凝胶电泳结果进行灰度扫描,以GAPDH密度作为参考定量标准,UⅡ、TGF-β1的表达量以UⅡ、TGF-β1与GAPDH密度之比来表示。
1.4统计学处理采用SPSS13.0软件进行t检验。
2 结 果
2.1AA组UⅡ和TGF-β1基因表达与单纯DMEM培养基组比较,AA组NRK-52E细胞UⅡ基因表达在实验的3个时间段均明显增强(P<0.05);TGF-β1 mRNA的表达在48 h明显增强(P<0.05)。见图1,表1。
2.2各组TGF-β1 mRNA表达见表2,图2。与AA组比较,AA+ UⅡ组TGF-β1 mRNA表达36 h、48 h明显升高(P<0.01)。与马兜铃酸钠+ UⅡ组比较,工+ UⅡ+抗UⅡ抗体组TGF-β1 mRNA表达36 h明显降低(P<0.05),48 h显著降低(P<0.01)。

1:24 h DMEM组;2:24 h AA组;3:36 h DMEM组;4:36 h AA组;5:48 h DMEM组;6:48 h AA组图1 AA作用下大鼠NRK-52E细胞UⅡ和TGF-β1基因的表达
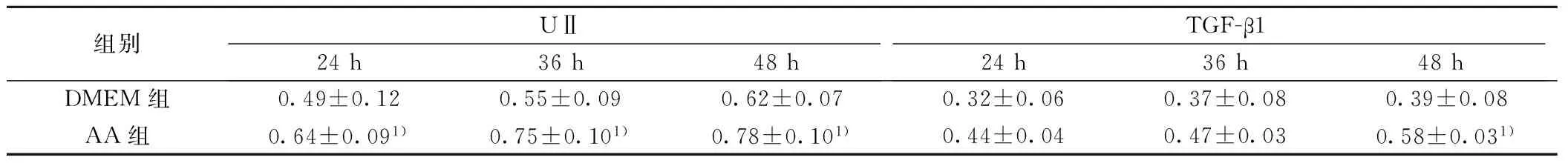
组别UⅡ24h36h48hTGF-β124h36h48hDMEM组0.49±0.120.55±0.090.62±0.070.32±0.060.37±0.080.39±0.08AA组0.64±0.091)0.75±0.101)0.78±0.101)0.44±0.040.47±0.030.58±0.031)
与DMEM组比较:1)P<0.05
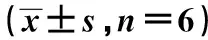
表2 TGF-β1 mRNA在各组NRK-52E细胞中的表达
与AA组比较:1)P<0.01;与AA+UⅡ组比较:2)P<0.01,3)P<0.05
3 讨 论
UⅡ最初作为一种血管活性肽被发现,随着对它研究的不断深入,UⅡ的非血流动力学作用被揭示:它不仅能促进细胞外基质表达、调节内分泌,还能促进肾小管上皮细胞的增殖〔3,4〕,激活大鼠肾小管上皮细胞的表皮生长因子受体〔5〕,抑制钾、钠的重吸收〔6〕,促进细胞内Ca2+的释放〔7〕,抑制NRK-52E细胞的凋亡〔8〕。总之,UII与肾脏及其疾病的病理生理学改变密切相关。
TGF-β1是一种多功能的细胞因子,它既可以促进ECM的积聚,使肾脏疾病向纤维化的方向发展,同时又是组织损伤、自身修复的重要成分,在多种疾病中发挥着重要作用。正常情况下,TGF-β1在近曲小管和集合管有表达。急性缺血性肾损伤时,新生NRK-52E细胞TGF-β1的表达及活性均明显增加,提示TGF-β1在肾小管再生中有重要作用。但在损伤修复后TGF-β1持续增加可使胶原沉积,导致肾的纤维化的发生。
糖尿病肾脏纤维化时UⅡ、TGF-β1表达均增强,二者很可能是通过自分泌和(或)旁分泌机制,在肾脏纤维化中发挥着重要作用〔8〕。Kemp等〔9〕发现,高剂量UⅡ可使肝细胞中TGF-β上升。Zhang等〔10〕发现TGF-β1参与UⅡ诱导的大鼠主动脉成纤维细胞的表型分化。本研究表明UⅡ与TGF-β1在AA肾病的发生发展中具有一定的作用,且UⅡ可诱导TGF-β1的表达,UⅡ的这种作用其中至少一部分是通过抗原-抗体途径来实现的,至于是否存在其他途径,还有待进一步研究。
1陈素贤,李才,于晓艳,等.尾加压素Ⅱ及其受体在急性肾损伤大鼠肾组织中的表达〔J〕.中国病理生理杂志,2011;27(7):1406-8.
2曾红,周懿,姚国媛.转化生长因子诱导人肾小管上皮细胞转分化:Notch1受体阻断剂的影响〔J〕.中国组织工程研究,2014;18(51):8261-8.
3陈素贤,李才,苗春生,等.尾加压素Ⅱ对大鼠肾小管上皮细胞的促丝裂作用〔J〕.吉林大学学报(医学版),2007;33(2):204-6.
4Sue YM,Chen CH,Hsu YH,etal.Urotensin Ⅱ induces transactivation of the epidermal growth factor receptor via transient oxidation of SHP-2 in the renal tubular cell line NRK-52E〔J〕.Growth Factors,2009;27(3):155-62.
5Abdel-Razik AE,Forty EJ,Balment RJ,etal.Renal haemodynamic and tubular actions of urotensin Ⅱ in the rat〔J〕.J Endocrinol,2008;198(3):617-24.
6Adebivi A.RGS2 regulates urotensin Ⅱ-induced intracellular Ca2+elevation and contraction in glomerular mesangial cells〔J〕.J Cell Physiol,2014;229(4):502-11.
7Hsu YH,Chen TH,Chen YC,etal.Urotensin Ⅱ exerts antiapoptotic effect on NRK-52E cells through prostacyclin-mediated peroxisome proliferator-activated receptor alpha and Akt activation〔J〕.Mol Cell Endocrinol,2013;381(1-2):168-74.
8Tian L,Li C,Qi J,etal.Diabeles-induced upregulation of urotensin Ⅱ and its receptor plays an important role in TGF-beta 1-mediated renal fibrosis and dysfunction〔J〕.Am J Physiol Endocrinol Melab,2008;295(5):1234-42.
9Kemp W,Kompa A,Phrommintikul A,etal.Urotensin Ⅱ modulates hepatic fibrosis,and portal hemodynamic alterations in rats〔J〕.Am J Physiol Gastrointest Liver Physol,2009;297(4):762-7.
10Zhang YG,Hu YC,Mao YY,etal.Transforming growth factor-beta1 involved in urotensin Ⅱ-induced phenotypic differetiation of adventitial fibro blasts from rat aorta〔J〕.Chin Med J,2010;123(24):3634-9.
〔2015-10-20修回〕
(编辑滕欣航)
10.3969/j.issn.1005-9202.2016.14.013
辽宁省自然基金资助项目(No.2013022007)
万义增(1961-),男,教授,硕士生导师,主要从事临床病理学研究。
陈素贤(1972-),女,教授,硕士生导师,主要从事临床病理学研究。
R282
A
1005-9202(2016)14-3379-;

