大孔树脂纯化栾树叶多酚工艺研究
李衍方, 高彩霞, 韩相恩
(1. 中国矿业大学 化工学院,江苏 徐州 221116; 2. 徐州市产品质量监督检验中心,江苏 徐州 221000; 3. 北京海德润制药有限公司,北京 101113)
大孔树脂纯化栾树叶多酚工艺研究
李衍方1,2, 高彩霞3, 韩相恩1*
(1. 中国矿业大学 化工学院,江苏 徐州 221116; 2. 徐州市产品质量监督检验中心,江苏 徐州 221000; 3. 北京海德润制药有限公司,北京 101113)
摘要:以栾树叶多酚提取物为原料,比较了7种大孔树脂对栾树叶多酚的静态吸附与解吸效果,结果表明AB-8树脂性能最佳,其24 h静态吸附量为13.74 mg/g,解吸率为98.35 %, 3 h内达到吸附平衡与解吸平衡。AB-8树脂动态吸附较佳条件为上样液质量浓度为4 g/L,上样液pH值为6,在此条件下吸附率为88.21 %,动态洗脱较佳条件为洗脱剂乙醇体积分数为60 %,洗脱速度为1 mL/min,解吸率达到89.91 %,在该条件下栾树叶总多酚经AB-8树脂纯化后,质量分数由50.36 %增加到72.37 %,回收率为86.83 %。
关键词:栾树叶多酚;纯化;大孔树脂
栾树(KoelreuteriapaniculataLaxm.),无患子科(Sapindaceae)栾树属(Koelreuteria)植物,落叶灌木或乔木。栾树属共有4种、 1变种,中国产3种、 1变种,另1种产于大洋洲斐济群岛。该属植物在我国资源丰富,药用价值高,汉代《神农本草经》记载栾华(花)“主目痛,泪出伤眦,消目肿”;唐代《唐本草》记载“合黄连共煎,疗目赤”,我国民间以摇钱树的花和根做“疏风清热、止咳杀虫”药,栾树所含成分的生物活性主要有抑菌[1]、细胞毒性和抗癌[2]、抗氧化[3-4]、杀虫[5]等。栾树叶含有大量多酚物质,主要组分为山奈酚及其衍生物、没食子酸及其衍生物、β-谷甾醇及其衍生物、金丝桃苷及槲皮苷等[6-7]。大孔树脂具有吸附快、吸附量大、稳定性好、选择性高、易解吸、易再生等诸多优点,近年来被广泛用于多酚类物质的分离与富集[8-9]。本研究选取了7种对多酚分离纯化效果较好的树脂,从中筛选出一种性能较佳树脂,考察该树脂对栾树叶多酚的静态、动态吸附与解吸性能及主要影响因素,从而确定栾树叶多酚的较佳纯化方法。
1实 验
1.1材料与试剂
栾树(KoelreuteriapaniculataLaxm.)叶多酚提取物按文献[10]自制。具体制备过程如下:称取一定质量粉碎后的栾树叶粉末,以液料比25∶1 (mL∶g)加入72 %乙醇水溶液,超声波功率200 W,提取温度60 ℃,超声波提取时间为每次15 min,提取3次,过滤,合并滤液,滤液于45 ℃减压浓缩至30 mL,加水至200 mL,先以石油醚萃取3次,每次60 mL,再以乙酸乙酯萃取3次,每次60 mL,合并乙酸乙酯萃取液,45 ℃下减压浓缩至干,得栾树叶多酚提取物。
大孔树脂AB-8、D101、HPD100、HPD400、HPD500、HPD600、HPD750,沧州宝恩化工有限公司。没食子酸对照品(110831-201204),中国食品药品检定研究院;无水乙醇、石油醚、乙酸乙酯,分析纯,国药集团化学试剂有限公司;蒸馏水,自制。
1.2仪器
KQ-200KDB型高功率数控超声波清洗器,昆山市超声仪器有限公司;Lambda 25紫外可见分光光度计,珀金埃尔默仪器(上海)有限公司;玻璃层析柱(Φ2 cm×30 cm),泰兴市三爱思实验仪器厂。
1.3总多酚测定
1.3.1标准曲线的绘制参考文献[10]进行绘制,线性回归方程Y=0.132 99+0.063 39,R=0.999 26,线性范围为1~10 mg/L。
1.3.2样品中总多酚质量分数的测定精确称取0.020 0 g待测样品,少量无水乙醇溶解后,加入蒸馏水定容至100 mL,得到0.2 g/L样品溶液,取1 mL样品溶液至10 mL容量瓶中,加入1 mL蒸馏水,摇匀,加入1 mL福林酚试剂,摇匀,静置4 min后,加入2 mL饱和Na2CO3溶液,蒸馏水定容,摇匀,25 ℃下避光放置2 h,于750 nm处重复测定3次吸光值,取平均值,代入1.3.1节的回归方程,计算样品溶液中总多酚质量浓度,按照式(1)计算栾树叶多酚提取物中多酚质量分数:
w=C×V/(n×m)×100 %
(1)
式中:w—多酚质量分数,%; C—多酚质量浓度,mg/L; V—样品体积,mL; n—稀释倍数,10; m—样品质量,g。
通过计算得到提取物中多酚的质量分数为50.36 %。
1.4大孔树脂的预处理
将大孔树脂于95 %乙醇中浸泡24 h,不断搅拌,除去气泡,用蒸馏水洗至无乙醇味,然后用5 %HCl溶液浸泡3 h,再用蒸馏水洗至中性,最后用5 % NaOH溶液浸泡3 h,用蒸馏水洗至中性。
1.5大孔树脂的静态吸附和解吸实验
1.5.1静态吸附以80 %乙醇水溶液为溶剂,配制一系列质量浓度的栾树叶多酚提取物。称取经预处理的7种型号的大孔树脂各2 g,用滤纸吸干表面水分后,置于150 mL具塞磨口三角瓶中,加入一定质量浓度的栾树叶多酚提取物80 %乙醇溶液40 mL,置于摇床上, 25 ℃下,以转速120 r/min振荡24 h,取上清液测定溶液中总多酚质量浓度,按照式(2)和(3)计算吸附量和吸附率:
Q=(C0-C1)×V/m
(2)
A=(C0-C1)/C0×100 %
(3)
式中:Q—树脂吸附量,mg/g;A—树脂吸附率,%; C0—起始溶液中总多酚质量浓度,g/L;C1—上清液中总多酚质量浓度,g/L;V—溶液体积,mL;m—树脂质量,g。
1.5.2静态解吸将充分吸附后的树脂用蒸馏水快速洗至大孔树脂表面无多酚溶液残留,加入体积分数80 %乙醇水溶液40 mL于各吸附完全的树脂中,置于摇床上, 25 ℃下,以转速120 r/min振荡24 h,取上清液测定洗脱液中总多酚质量浓度,按照式(4)计算解吸率:
D=(Cd×Vd)/(m×Q)×100 %
(4)
式中:D—树脂解吸率,%;Cd—解吸后溶液中总多酚质量浓度,g/L;Vd—解吸液体积,mL。
1.5.3AB-8树脂静态吸附与解吸动力学曲线的绘制比较了7种大孔树脂对栾树叶多酚的静态吸附和解吸性能,最终选取了吸附和解吸性能均较好的AB-8大孔树脂进行静态吸附动力学特性的研究。
称取3份经预处理好的AB-8树脂2 g,多酚质量浓度2.85 g/L的栾树叶多酚提取物80 %乙醇溶液40 mL,按1.5.1节操作静态吸附12 h,每隔0.5 h取0.1 mL溶液测定总多酚质量浓度,计算吸附率,绘制吸附动力学曲线。
按1.5.2节的操作将充分吸附的树脂解吸12 h,每隔0.5 h取0.1 mL溶液测定总多酚质量浓度,计算解吸率,绘制静态解吸动力学曲线。
1.6AB-8树脂对栾树叶多酚纯化条件的确定
1.6.1上样液质量浓度对树脂吸附率的影响将预处理好的树脂20 g装入玻璃层析柱中(30 cm×2 cm),树脂填充高度为20 cm,将栾树叶多酚提取物溶液配置成6个不同质量浓度的上样液,分别为2、 3、 4、 5、 6和8 g/L,上样体积分别为8.0、 5.3、 4.0、 3.2、 2.7和2.0 mL,上样速度为2 mL/min,上样液pH值为6,分别上样,吸附2 h后测定吸附后溶液中多酚质量浓度,计算吸附量。
1.6.2上样液pH值对树脂吸附率的影响将预处理好的树脂20 g装入玻璃层析柱中(30 cm×2 cm),树脂填充高度为20 cm,将质量浓度为4 g/L栾树叶多酚提取物溶液分成5份,分别调节其pH值为2、 4、 6、 8、 10后上样,上样液体积4 mL,上样速度2 mL/min,吸附2 h后,测定吸附后溶液中多酚质量浓度,计算吸附量。
1.6.3洗脱剂体积分数对树脂解吸率的影响将预处理好的树脂20 g装入玻璃层析柱中(30 cm×2 cm),树脂填充高度为20 cm,加入4 g/L栾树叶多酚提取物溶液4 mL,上样速度2 mL/min,吸附2 h后,用体积分数分别为40 %、50 %、60 %、70 %、80 %、90 %乙醇溶液作为洗脱剂进行洗脱,洗脱流速为1 mL/min,每5 mL收集1管,共收集24管,测定每管洗脱液中多酚质量浓度,计算解吸率。
1.6.4洗脱剂流速对树脂解吸率的影响将预处理好的树脂20 g装入玻璃层析柱中(30 cm×2 cm),树脂填充高度为20 cm,加入质量浓度为4 g/L栾树叶多酚提取物溶液4 mL,上样速度2 mL/min,吸附2 h后,用体积分数为60 %乙醇溶液作为洗脱剂进行洗脱,洗脱流速分别为0.5、 1、 2、 3 mL/min,每5 mL收集1管,共收集24管,测定每管洗脱液多酚质量浓度,计算解吸率。
1.7动态洗脱曲线及多酚纯度
将预处理好的树脂20 g装入玻璃层析柱中(30 cm×2 cm),树脂填充高度为20 cm,加入质量浓度为4 g/L的栾树叶多酚提取物溶液,上样速度2 mL/min,吸附2 h后,用体积分数为60 %乙醇溶液洗脱,洗脱流速为1 mL/min,同时于柱末端收集流出液,每5 mL收集1管,共收集24管,测定每管中总多酚的质量浓度,绘制动态洗脱曲线,收集洗脱液,于50 ℃下减压浓缩至干,得浓缩物,称质量,按1.3.2节计算浓缩物中多酚质量分数。
2结果与讨论
2.1大孔树脂的筛选
2.1.1不同树脂吸附与解吸附能力的比较大孔树脂吸附能力的大小与树脂的极性、比表面积、孔径、能否与吸附物形成氢键等因素有关,对7种大孔树脂进行吸附和解吸附实验,结果见表1。由表1可知:HPD500树脂吸附率最高为89.01 %,其次是HPD400树脂吸附率为88.95 %,虽然AB-8树脂吸附率略低于HPD500及HPD400,但其解吸率最高为98.35 %。综合考虑吸附和解吸附效果,选择AB-8树脂进行后续的纯化工作。

表 1 不同大孔树脂对栾树叶多酚的吸附和解吸性能
2.1.2AB-8大孔树脂静态吸附与解吸曲线图1给出了AB-8树脂的吸附与解吸曲线。由图1可知:AB-8树脂在3 h基本达到饱和,再延长吸附时间,吸附率变化不大,属于快速平衡型。树脂在3 h内基本完全解吸,解吸率达到98.29 %。

图 1 AB-8树脂的吸附(a)与解吸(b)曲线Fig. 1 Adsorption (a) and desorption (b) curves of AB-8
2.2AB-8树脂对栾树叶多酚的纯化条件
2.2.1上样液质量浓度由图2可知:当多酚质量浓度在2~4 g/L时,树脂吸附率随着多酚质量浓度的增加而迅速增加,当多酚质量浓度在4~8 g/L时,树脂吸附率随着多酚质量浓度的增加而降低。上样液质量浓度为4 g/L时,吸附率达到最大,为87.45 %。这是因为当样液质量浓度较低时,AB-8树脂的吸附量随着样液质量浓度的增加而增加,但是,当样液质量浓度继续增大时,与多酚竞争吸附的杂质也在增加,导致树脂吸附量有所下降。因此选择上样液质量浓度为4 g/L。
2.2.2上样液pH值由图3可知:上样液pH值较小,酸性较强时,树脂吸附率较小,上样液pH值为6时,树脂吸附率最大,为88.21 %,上样液碱性增大时,树脂吸附率降低明显。这可能是由于栾树叶中多酚大多属于黄酮类物质,含酚羟基较多,呈弱酸性,故在弱酸性条件下吸附效果好。因此选择上样液较佳pH值为6。

图 2 上样液质量浓度对树脂吸附率的影响 图 3 上样液pH值对树脂吸附率的影响Fig. 2 Effect of sample mass concentration on absorption Fig. 3 Effect of sample pH value on absorption
2.2.3洗脱剂体积分数由图4可知:随着乙醇体积分数的增大,多酚解吸率呈现先增大后下降的趋势,当乙醇体积分数为60 %时,解吸率达到最大值,为88.89 %。这可能是由于乙醇极性比水弱,故体积分数大的乙醇能溶解出更多的弱极性物质,同时,更多的杂质也被溶解出来。因此选用60 %乙醇为柱层析纯化用洗脱剂。
2.2.4洗脱剂流速由图5可知:洗脱剂流速低于1 mL/min时,多酚类化合物的死吸附过多,解吸率低;洗脱剂流速高于1 mL/min时,洗脱剂没来得及与吸附在树脂上的多酚充分接触,使其不能将多酚完全置换出来,致使多酚类化合物解吸率降低明显。因此较佳洗脱速率为1 mL/min,解吸率为89.91 %。
2.3动态洗脱曲线及多酚含量
由图6可知:开始时,洗脱液中多酚质量浓度随着洗脱体积的增加而增大,当洗脱至第9管时,多酚质量浓度增加显著,第12管时洗脱液中多酚质量浓度达到最大值,之后随着洗脱体积的增加,多酚质量浓度逐渐下降,第16管后多酚质量浓度下降明显,因此收集9~16管的40 mL洗脱液,于50 ℃下减压浓缩至干,称质量,得浓缩物,测定浓缩物中多酚质量分数为72.37 %,回收率为86.83 %。
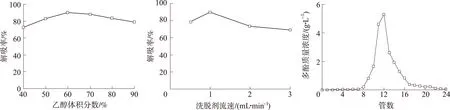
图 4洗脱剂浓度对多酚解吸率的影响
图 5洗脱剂流速对多酚解吸率的影响
图 6栾树叶多酚动态洗脱曲线
Fig. 4Effect of ethanol concentration on desorption rate
Fig. 5Effect of elution speed on desorption rate
Fig. 6Dynamic desorption curve of polyphenols ofK.paniculata
3结 论
3.1以栾树叶多酚提取物为原料,研究了7种大孔树脂对栾树叶多酚的静态吸附与解吸附效果,从7种大孔树脂中筛选出最为适宜的AB-8树脂,其24 h静态吸附量为13.74 mg/g,解吸率为98.35 %。
3.2以栾树叶多酚提取物为原料,通过动态吸附与解吸研究,确定AB-8树脂动态吸附较佳条件为上样液质量浓度为4 g/L,上样液pH值为6,此时,吸附率为88.21 %。AB-8树脂动态洗脱较佳条件为洗脱剂乙醇体积分数为60 %,洗脱速度为1 mL/min,解吸率为89.91 %。
3.3按照以上较佳柱层析条件纯化栾树叶多酚提取物,总多酚质量分数由50.36 %增加到72.37 %,回收率为86.83 %。
参考文献:
[1]翟梅枝,郭景丽,王磊,等. 栾树花黄酮类化合物的提取工艺研究[J]. 西北林学院学报,2010,25 (2):136-139.
[2]CHIANG Y Y,WANG S L,YANG C L,et al. Extracts ofKoelreuteriahenryiDummer induce apoptosis and autophagy by inhibiting dihydrodiol dehydrogenase thus enhancing anticancer effects[J]. International Journal of Molecular Medicine,2013,32:577-584.
[3]LEE T H,CHIANG Y H,CHEN C H,et al. A new flavonol galloylrhamnoside and a new lignan gluoside from the leaves ofKoelreuteriahenryiDummer[J]. Journal of Natural Medicines,2009,63(2):209-214.
[4]KUMAR M,CHANDEL M,SHARMA N,et al. Efficacy of golden rain tree against free radicals and H2O2-induced damage to pUC18/calf thymus DNA[J]. Asian Pacific Journal of Tropical Biomedicine,2012,2(S2):781-787.
[5]MIKOLAJCZAK K L,SMITH C R,TJARKS L W. Cyanolipids ofKoelreuteriapaniculataLaxm seed oil[J]. Lipids,1970,5(8):672-677.
[6]马柏林,梁淑芳,田鹏. 栾树的化学成分及其利用[J]. 陕西林业科技,2003(3):68-72.
[7]SUTIASHVILI M G,ALANIYA M D,MSHVILDADZE V D,et al. Flavonoid and cycloartane glycosides from seeds ofKoelreuteriapaniculata[J]. Chemistry of Natural Compounds,2013,49 (2):395-397.
[8]白万明,黄根胜,孔维宝,等. AB-8大孔树脂吸附分离橄榄油加工废液中的橄榄多酚[J]. 中国油脂,2015,40 (1):74-77.
[9]董琦,高珊,曹龙奎,等. 大孔树脂纯化桦褐孔菌多酚及其成分分析[J]. 食品科学,2015,36 (22):131-136.
[10]李衍方,高彩霞,韩相恩. 栾树叶总多酚的超声波辅助提取工艺及其抗氧化活性[J]. 生物质化学工程,2016,50 (3):27-34.
doi:10.3969/j.issn.1673-5854.2016.04.008
收稿日期:2015-12-29
基金项目:中央高校基本科研业务费专项基金(2015XKZD08)
作者简介:李衍方(1982— ),女,江苏徐州人,工程师,博士生,主要从事天然资源化学利用工作 *通讯作者:韩相恩,教授,博士,博士生导师,研究领域:天然资源化学利用;E-mail:xiangenh@163.com。
中图分类号:TQ35;Q946.82
文献标识码:A
文章编号:1673-5854(2016)04-0042-05
Purification of Polyphenols from Koelreuteria paniculata Laxm. Leaves by Macroporous Resin
LI Yan-fang1,2, GAO Cai-xia3, HAN Xiang-en1
(1. China University of Mining and Technology,School of Chemical Engineering and Technology, Xuzhou 221116, China;2. Xuzhou Products Quality Supervision and Inspection Center, Xuzhou 221000, China; 3. Beijing Haiderun Pharmaceutical Co. Ltd, Beijing 101113, China)
Abstract:The absorption and desorption behaviors of seven macroporous resins for polyphenols from Koelreuteria paniculata Laxm. were investigated. The 24 h static adsorption capacity and desorption rate of AB-8 resin was 13.74 mg/g and 98.35 %,respectively. The static adsorption and desorption equilibrium time of AB-8 resin was both less than 3 h. The optimum conditions of dynamic absorption and desorption by AB-8 were sample mass concentration 4 g/L,sample pH value 6,and volume fraction of ethanol 60 %,elution speed 1 mL/min,respectively.Under these conditions,the adsorption rate was 88.21 % and desorption rate was 89.91 %.The purity of polyphenols from Koelreuteria paniculata Laxm. increased from 50.36 % to 72.37 % after purification using AB-8 resin and the recovery rate was 86.83 %.
Key words:polyphenols of Koelreuteria paniculata Laxm. leaves;purification;macroporous resin
·研究报告——生物质天然活性成分·

