饲料氧化鱼油引起草鱼肠道结构损伤、通透性增加
陈科全叶元土蔡春芳吴 萍黄雨薇吴 韬林秀秀罗其刚张宝彤萧培珍,
饲料氧化鱼油引起草鱼肠道结构损伤、通透性增加
陈科全1叶元土1蔡春芳1吴 萍1黄雨薇1吴 韬1林秀秀1罗其刚1张宝彤2萧培珍1, 2
(1. 苏州大学基础医学与生物科学学院, 江苏省水产动物营养重点实验室, 苏州 215123;2. 北京营养源研究所, 水产动物系统营养研究开放实验室, 北京 100000)
为了探讨饲料氧化鱼油对草鱼(Ctenopharyngodon idellus)肠道组织结构及其通透性的影响, 本实验以豆油、鱼油及氧化鱼油作为饲料脂肪源, 分别设计鱼油组(6F)、豆油组(6S)、2%氧化鱼油(4S2OF)、4%氧化鱼油(2S4OF)及6%氧化鱼油(6OF) 5组等氮、等能的半纯化饲料。经72d池塘网箱养殖后, 实验结果显示: (1)氧化鱼油显著增加(P<0.05)草鱼血清和肠道MDA含量、增加肠道GSH含量(P<0.05), 但随氧化产物含量上升GSH含量出现下降。(2)氧化鱼油会显著降低肠道内胆汁酸的含量(P<0.05)。(3)氧化鱼油会显著增加肠道绒毛中杯状细胞的数量(P<0.05), 且随着氧化产物的增加, 肠道微绒毛高度呈现先上升后下降趋势。(4)氧化鱼油会导致肠道紧密连接间隙增大, 增加肠道通透性, 使血清中D-乳酸及内毒素含量显著增加(P<0.05)。结果表明, 饲料中鱼油氧化产物损伤了草鱼肠道组织结构, 尤其是肠道上皮细胞紧密连接结构损伤严重, 从而破坏了肠道黏膜的机械屏障功能, 使肠道通透性显著增加, 肠道细菌内毒素等发生转移。鱼油氧化产物会引起草鱼肠道氧化与抗氧化应激反应, 干扰草鱼“肝-肠”正常胆汁酸循环, 致使草鱼肠道胆汁酸不足。
氧化鱼油; 肠道; 结构; 通透性; 草鱼
鱼油因其富含EPA、DHA等高不饱和脂肪酸对鱼类具有很好的营养作用, 而其高含量的不饱和脂肪酸会在光照、温度和氧气等因素的影响下迅速被氧化产生过氧化物、醛、酮等氧化产物而对动物体造成损害[1], 这就是鱼油对于养殖水产动物所具有的营养作用、氧化损伤副作用的两面性。已有研究表明氧化鱼油会对动物体机体有损伤作用, 但大多报道都集中在对生产性能[2—4]和肝胰脏[5—7]的研究上, 关于氧化油脂对水产动物肠道结构与功能研究的还不够系统、深入。
草鱼是中国主要淡水养殖经济鱼类, 在实际养殖中也是病害较多养殖鱼类之一, 其中肠炎作为“草鱼三大病”之一, 一直被人们所关注[8]。肠道是动物最大的消化、吸收器官, 也是最大的免疫、防御器官和内分泌器官。其作为动物体消化系统的第一道屏障, 起着分隔肠腔内物质, 防止致病性抗原侵入的作用[9]。近年来, 饲料物质对肠道组织结构和功能的影响日益受到关注, 饲料营养物质在维护鱼类肠道屏障结构与功能方面有重要的作用, 而饲料中潜在的有毒有害物质如油脂的氧化产物也是破坏肠道结构屏障与功能的主要因素, 并可能作为病原生物感染的原发性因素[10]。已有研究表明,油脂氧化产物会引起小鼠肠道应激而导致肠炎[11]。因此, 本文以草鱼为实验对象, 以豆油为对照, 研究氧化鱼油对草鱼肠道结构及其通透性的影响, 期望为阐述油脂氧化产物对鱼体肠道结构与功能损伤作用机制及其作用方式等科学问题提供依据, 为实际生产中饲料油脂的选择与质量控制提供参考。
1 材料与方法
1.1 草鱼
草鱼来源于浙江一星饲料有限公司养殖基地,为池塘培育的1冬龄鱼种, 共350尾, 平均体重为(74.82±1.49) g。草鱼随机分为5组, 每组设3重复,每重复20尾。分组剩余草鱼用于养殖前期取样分析。
1.2 饲料
以酪蛋白和秘鲁蒸汽鱼粉为主要蛋白源, 采用等氮、等能方案设计基础饲料, 设置了6%豆油组(简称6S组)、6%鱼油组(6F组)、4%豆油组+2%氧化鱼油(4S2OF组)、2%豆油组+4%氧化鱼油(2S4OF组)、6%氧化鱼油组(6OF组)共5种半纯化饲料, 配方及实测营养指标见表 1。
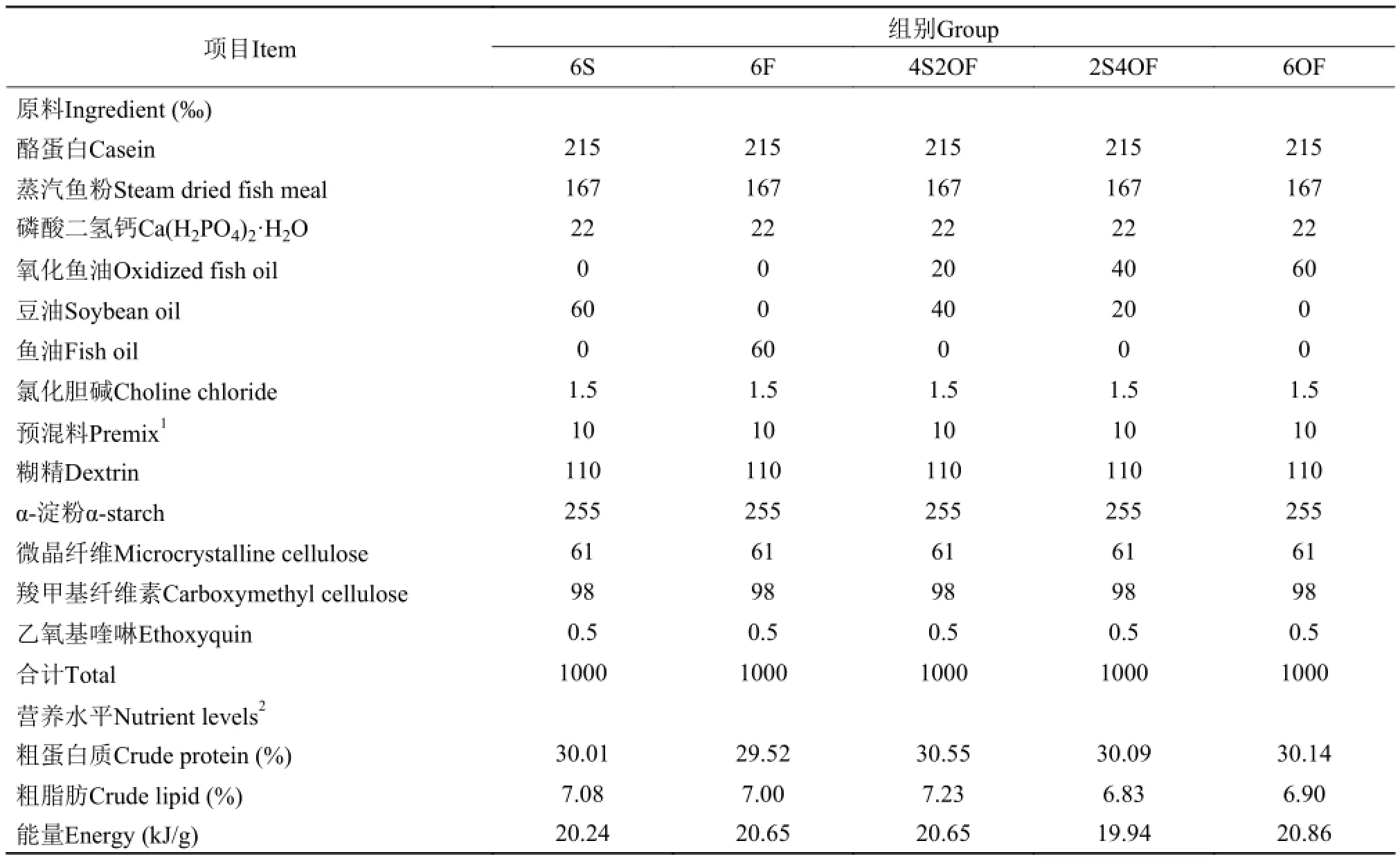
表 1 实验饲料组成及营养水平Tab. 1 Formulation and proximate compositions of experiment diets (DM basis)
饲料原料粉碎过60目筛, 用绞肉机制成直径1.5 mm的长条状, 切成1.5 mm×2 mm的颗粒状, 风干。饲料置于-20℃冰柜保存备用。
豆油为“福临门”牌一级大豆油。鱼油来源于广东省良种引进服务公司生产的“高美牌”精炼鱼油, 氧化鱼油参考[12]方法制备。分别测定3种油脂过氧化值(POV)、酸价(AV)、丙二醛(MDA), 并计算饲料中POV、AV、MDA值(饲料中AV、POV、MDA测定尚无有效方法, 故采用油脂测定结果的计算值)(表 2)。
由表 2可知, 在本实验中使用的鱼油有一定程度的氧化, 由于其在饲料中比例为6%, 而氧化鱼油组是由氧化鱼油和豆油按比例混合作为脂肪源, 所以6F组的实际POV值比4S2OF组高12.25%, 而AV值则比4S2OF和2S4OF组分别高出100%和3.9%。
1.3 饲养管理
养殖实验在浙江一星饲料有限公司实验基地进行。在面积为5 m×667 m (平均水深1.8 m)的池塘中设置网箱, 网箱规格为1.0 m×1.5 m×2.0 m。将各组实验草鱼随机分配在5组、15个网箱中。
分别用实验饲料驯化实验鱼1周后, 开始正式投喂, 每天7:00和16:00定时投喂, 投饲率为3%—4%。每10天据投饲量估算鱼体增重并调整投饲率, 记录每天投饲量。正式实验共养殖72d。
每周测定水质1次, 实验期间溶解氧浓度>8.0 mg/L, pH 7.8—8.4, 氨氮浓度<0.2 mg/L, 亚硝酸盐浓度<0.01 mg/L, 硫化物浓度<0.05 mg/L。养殖期间水温25—33℃。

表 2 实验饲料中POV值、AV及MDA含量分析结果Tab. 2 Peroxide value, Acid value and MDA content in diets
1.4 样品采集及其分析方法
经72d养殖、禁食24h后进行样品采集。
肠道组织学样品制备及分析 每网箱取4尾鱼、每组12尾, 于中肠前1/4处取1—2 cm肠管1段,纵向剖开用磷酸缓冲液冲洗后, 立即将其投入4%戊二醛中固定, 用于透射和扫描电镜分析。每网箱另取2尾、每组6尾鱼于中肠前1/4处取肠管2段置于Bouin试液固定, 用于组织学切片分析。
组织学切片采用石蜡切片进行组织学切片, 苏木精-伊红染色, 中性树胶封片, 光学显微镜下观察肠道组织结构并采用Nikon COOLPIX4500型相机进行拍照。
透射电镜采用锇酸固定、丙酮脱水, 最后放入胶囊内包埋切片染色, 用日立HT7700透射式电子显微镜观察肠道组织结构并拍照。
扫描电镜采用锇酸固定, 缓冲液洗涤, 乙醇梯度脱水, 醋酸异戊酯置换, 临界点干燥, 镀膜最后用导电胶胶于样品台, 采用飞利浦XL-20型扫描电子显微镜观察肠道组织结构、测量肠道微绒毛高度并拍照。
肠道组织匀浆样品制备与分析 取部分新鲜中肠, 称重后加入10倍体积0.02 mol/L磷酸缓冲液(pH7.4), 匀浆器10000 r/min匀浆1min, 3000 r/min冷冻离心10min, 取上清液分装, 液氮速冻后-80℃冰箱保存。MDA、GSH采用南京建成试剂盒测定。
MDA采用南京建成试剂盒, D-乳酸、内毒素采用购于南京建成的Elisa试剂盒测定。血清胆固醇、胆汁酸采用雅培C800全自动生化分析仪测定。
饲料油脂样品分析 油脂过氧化值测定参照GB/T 5538-2005, 酸价测定参照GB/T 5530-2005,MDA采用南京建成试剂盒测定。
1.5 数据处理
实验结果用SPSS 21.0软件进行统计分析, 采用平均值±标准差(Mean±SD)表示, 在单因素方差分析的基础上, 采用Duncan氏法多重比较检验组间差异显著性, 用Pearson分析方法检验数据相关性, 并用Excel 2013作回归分析, 以P<0.05表示差异显著。
2 结果
2.1 草鱼血清、肠道丙二醛(MDA)及肠道谷胱甘肽(GSH)含量
以丙二醛作为氧化标志物, 以谷胱甘肽作为抗氧化损伤标志物, 经72d养殖实验后, 测定各组草鱼血清、肠道MDA及GSH含量(表 3)。
由表11可知,以上39个处理组合中,单位面积合格插穗数在8333-62223个之间,其中处理A1B4(株行距30cm×50cm,定芽数4)最高为62223个。

表 3 氧化鱼油对草鱼血清、肠道丙二醛(MDA)及肠道谷胱甘肽(GSH)含量的影响Tab. 3 Effects of oxidized fish oil on serum and intestine MDA and GSH content of Ctenopharyngodon idellus
由表 3可知, 相对于6S组, 添加鱼油或氧化鱼油组草鱼血清及肠道MDA含量均出现上升。其中,血清中6F、4S2OF及2S4OF组显著大于6S组(P<0.05), 6OF组则显著大于6S及6F组(P<0.05); 肠道中6S与6F组无显著差异(P>0.05), 4S2OF及6OF组显著大于6S及6F组(P<0.05), 2S4OF组显著大于所有组(P<0.05)。4S2OF、2S4OF及6OF组肠道GSH含量则显著大于6S组(P<0.05), 6F组除与4S2OF组差异不显著(P>0.05)外, 显著大于其他3组(P<0.05)。
2.2 草鱼肠道胆固醇及胆汁酸含量
前期研究结果发现[13], 氧化鱼油损伤肠道后,会导致肠道组织胆固醇、胆汁酸生物合成通路基因表达活性显著上调, 显示胆固醇、胆汁酸在肠道结构与功能维护中具有重要的作用。经72d养殖实验后, 测定各组草鱼肠道胆固醇及胆汁酸含量(表 4)。

表 4 氧化鱼油对草鱼肠道胆固醇及胆汁酸含量的影响Tab. 4 Effects of oxidized fish oil on intestine bile acid and cholesterol content of Ctenopharyngodon idellus
由表 4可知, 在添加鱼油或氧化鱼油后, 草鱼肠道中胆汁酸含量出现不同程度下降, 下降率为50.9%—97.1%, 且差异具有显著性(P<0.05); 肠道胆固醇含量出现不同程度上升, 上升率为3.9%—29.4%, 其中6F组及2S4OF组显著大于其余3组(P<0.05)。
2.3 草鱼血清内毒素及D-乳酸含量
经72d养殖实验后, 测定各组草鱼血清内毒素及D-乳酸含量(表 5)。由表 5可知, 6OF组草鱼血清中内毒素及D-乳酸均显著高于其他组(P<0.05),6S组则具有最小值, 除内毒素中与6F组没有显著差异外(P>0.05)均显著小于其他各组(P<0.05)。

表 5 氧化鱼油对草鱼肠道通透性的影响Tab. 5 Effects of oxidized fish oil on the permeability of intestine of Ctenopharyngodon idellus
2.4 草鱼肠道、血清生化指标与饲料油脂氧化产物的相关性分析
将血清MDA、内毒素、D-乳酸和肠道MDA、GSH含量分别与饲料油脂POV、AV及MDA做Pearson相关性分析, 检验双侧显著性, 样本量n=5(表 6)。
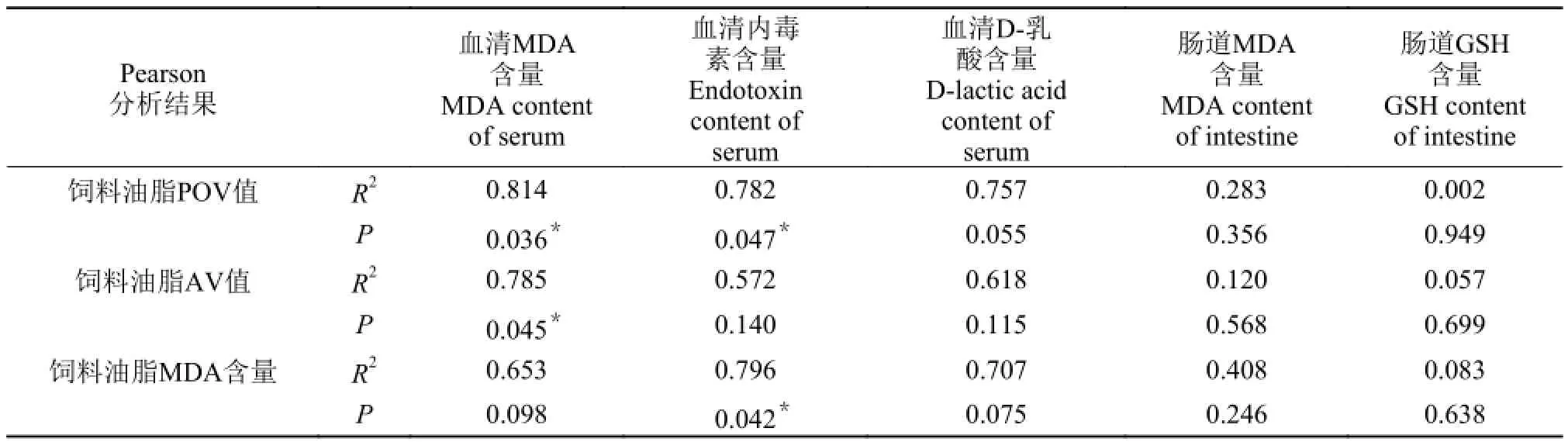
表 6 草鱼肠道、血清生化指标与饲料油脂氧化产物的相关性分析Tab. 6 The correlation analysis of the biochemical criterion of intestine and serum with the oxidative product of oil in diets
由表 6可知, 血清MDA与内毒素含量与饲料油脂POV值的相关性显著水平(双侧)检测值小于0.05,即血清MDA与内毒素含量与饲料油脂POV值显著相关。血清MDA含量与饲料油脂AV值显著相关,血清内毒素与饲料油脂MDA含量显著相关。将上述指标做回归分析发现, 血清MDA与饲料油脂POV及AV值以幂函数关系拟合度最高, 血清内毒素与饲料POV值及MDA含量以二次函数关系拟合度最高(图 1 a-d)。
由图 1 a-d可知, 血清MDA和内毒素含量与饲料中POV、AV 值及MDA含量具有显著的正相关关系, 即血清MDA、内毒素含量变化很大程度上受饲料油脂氧化程度的影响。
2.5 草鱼肠道黏膜组织观察结果
经72d养殖实验后, 各组草鱼肠上皮黏膜细胞结构见图版Ⅰ-A-E。A-E分别为6S、6F、4S2OF、2S4OF及6OF组。由图版Ⅰ-B-D可以得到以下结果:
氧化鱼油影响了肠道绒毛组织形态, 并使微绒毛高度下降 相比较6S组6F、4S2OF及2S4OF组肠道绒毛间隙扩大, 排列不整齐, 中央乳糜管明显扩增。图版Ⅰ-E中6OF组肠道绒毛明显增生水肿。
经72d养殖实验后, 各组草鱼肠道微绒毛高度(表 6)。肠道微绒毛高度中6OF具有最小值, 且显著小于其余各组(P<0.05)。除6OF组外, 其余各组差异不显著(P>0.05), 但相对于6S组有升高的趋势。
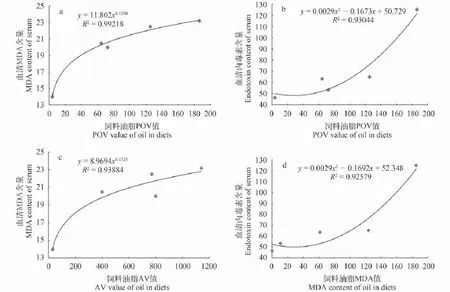
图 1 血清MDA、内毒素含量与饲料中油脂POV、AV值及MDA含量的关系Fig. 1 Relationship between serum MDA and endotoxin content with dietary oil POV value, AV value and MDA content
氧化鱼油使草鱼肠道杯状细胞数量增加
经72d养殖实验后, 各组草鱼肠道杯状细胞数量(表7)。由表 7可知, 添加鱼油或氧化鱼油后草鱼肠道绒毛杯状细胞个数增加56.7%—312.8%, 且各组间具有显著性差异(P<0.05)。
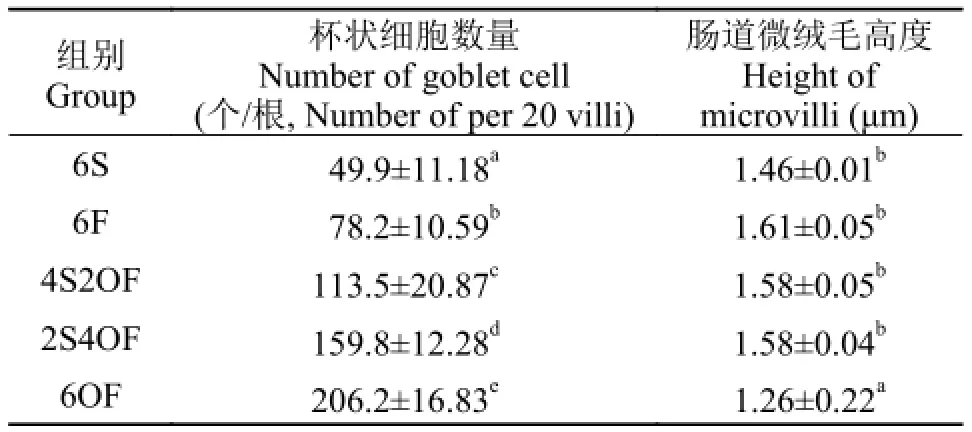
表 7 氧化鱼油对草鱼肠道草鱼肠道杯状细胞数量、微绒毛高度的影响Tab. 7 Effects of oxidized fish oil on the number of goblet cell and the height of microvilli of intestine of Ctenopharyngodon idellus
2.6 氧化鱼油对草鱼肠道紧密连接结构有破坏作用
经72d养殖实验后各组草鱼肠道紧密连接结构见图版Ⅰ-F-J。
图版Ⅰ-F-J分别为6S、6F、4S2OF、2S4OF及6OF组。图中尖头所示为草鱼肠道紧密连接结构,图版Ⅰ-F可见 6S组紧密连接结构没有空隙, 图版Ⅰ-G-J箭头所示处可以发现紧密连接结构出现空隙, 并且逐步扩大, 6OF组整个通路基本已打开。
3 讨论
3.1 氧化鱼油对草鱼肠道健康有显著的损伤作用
在饲料中, 鱼油高不饱和脂肪酸的营养作用、脂肪酸氧化产物的毒副作用交互影响, 对草鱼肠道的结构与功能产生重大的影响。
(1)鱼体氧化损伤程度及其抗氧化能力的强弱与饲料中油脂氧化产物及其含量有直接关系。本实验结果显示, 氧化鱼油对草鱼肠道健康具有损伤作用。鱼油氧化会产生大量的氢过氧化物、醛、酮等氧化产物, 对草鱼机体造成损害。过氧化氢能引发生物膜磷脂双分子层结构中多不饱和脂肪酸发生氧化反应而产生MDA[14], MDA可交联蛋白质及磷脂的氨基, 生成Scihff氏碱, 从而进一步降低细胞膜的流动性[15]。而谷胱甘肽GSH作为抗氧化剂能有效清除超氧自由基, 保护细胞膜, 抵御膜损伤[16, 17]。本实验结果可以看出, 随饲料中油脂氧化产物含量的上升, 草鱼血清MDA含量呈上升趋势,且血清MDA含量与饲料油脂POV及AV值呈幂函数正相关关系。这说明饲料油脂氧化程度、氧化产物含量(POV及AV值)对草鱼血清MDA含量有促进作用, 并且饲料中较低的POV和AV值即会显著提高草鱼血清中MDA的含量, 但随着POV与AV值的增大其对血清MDA含量的影响将减小。在饲料中添加鱼油或氧化鱼油后, 肠道MDA含量除6OF组外呈上升趋势, 最大值出现在2S4OF组。结合肠道透射电镜结果, 肠道MDA含量在6OF组出现下降的原因很可能是, 高浓度的油脂氧化产物破坏肠道结构, 增加肠道通透性, 使肠道中MDA大量进入血液循环所导致的。
一般认为肠道对氧化油脂的吸收与肠道GSH的含量呈负相关[18], 而本实验中肠道GSH含量与饲料油脂POV、AV值及MDA含量相关性为0.002—0.083, 说明肠道GSH含量与饲料油脂中氧化产物含量基本不相关。这可能是由于少量的氧化产物即会引起草鱼体内的抗氧化应激, 从而使作为GSH主要合成器官的肝胰脏[19]的GSH产量上升,因此6F组肠道GSH含量具有最大值。但随着饲料中氧化产物含量的上升, 超过草鱼的耐受范围后,草鱼肝胰脏功能受到损伤而使其抗氧化能力下降(待发表), GSH分泌量下降, 肠道GSH含量便出现下降, 肠道对氧化油脂的吸收增加。这与本实验中6S与6F组肠道MDA含量差异不显著, 而4S2OF、2S4OF及6OF组中血清MDA含量上升相一致。
(2)在氧化鱼油对肠道损伤作用下, 肠道组织胆汁酸、胆固醇的作用值得进一步的研究。鱼体生理性的“肠-肝轴”中, 胆汁酸的“肠-肝循环”是其重要物质基础之一。肝胰脏、肠道组织都具有以乙酰辅酶A为原料的胆固醇生物合成的能力。肝胰脏以胆固醇为原料合成初级胆汁酸, 初级胆汁酸进入肠道后, 在肠道细菌等作用下转变为次级胆汁酸,并在肠道后段被重新吸收回到肝胰脏, 这就是典型的胆汁酸“肝-肠循环”通路。
Dibner等[20]通过标记公鸡肠绒毛上皮细胞的研究发现, 氧化油脂会降低肠上皮细胞的存活率并促进细胞增殖更新。而前期实验研究结果也显示出[13, 21, 22], 饲料氧化油脂对肠道黏膜造成了严重损伤, 同时也会引起草鱼肝胰脏、肠道胆固醇生物合成通路基因表达活性显著上调。
本实验结果显示, 添加鱼油及氧化鱼油后, 中肠胆汁酸呈现明显下降趋势, 这是由于鱼油氧化产物损伤肝胰脏而使大量胆汁酸淤积在肝胰脏中所导致的(待发表)。而胆固醇含量有不同程度的上升, 这与前期实验[21]得到的氧化鱼油导致草鱼肠道黏膜胆固醇的逆转运代谢减弱, 肠道黏膜细胞内胆固醇的外流转运能力增加及肠道黏膜胆固醇生物合成能力及其调节作用增加的结果相一致。
上述结果表明胆固醇、胆汁酸在维护肠道黏膜结构与功能完整性方面可能具有特殊的生理作用, 其具体原理有待进一步研究。
3.2 氧化鱼油对草鱼肠道结构造成显著性的损伤作用
(1)饲料鱼油氧化产物对肠道组织结构、肠道上皮细胞间紧密连接有显著的损伤作用。现有研究表明氧化油脂会对动物消化系统造成损伤, 如鱼肠道内无食物[23], 肠壁变薄[24], 肠绒毛萎缩[25], 降低消化道内酶活性[26]等。正常肠道屏障功能中, 最关键的屏障是肠黏膜上皮屏障, 肠黏膜上皮屏障由肠黏膜表面的黏液层、肠上皮细胞及其紧密连接、黏膜下固有层等组成的。一般认为氧化油脂对肠道的损伤都是通过氧化产物如过氧化物、MDA等影响细胞膜的完整性, 增加细胞内ATP的消耗而导致ATP耗竭和酸中毒, 而从破坏肠道黏膜以增加肠道通透性[27, 28]。
本实验肠道切片结果显示, 鱼油氧化产物增加了肠道绒毛的间隙, 扩大了中央乳糜管。荣新洲等[29]在大鼠严重烧伤后的肠道也发现这个现象, 他认为中央乳糜管的扩张是一种代偿性改变以增加肠道绒毛的吸收能力。Berman等[30]发现, 肠道受损时中央乳糜管中淋巴管会扩张以增加肠道抵御细菌和毒素的能力。史桂芝等[31]在诱导小鼠内毒素血症时发现小鼠肠道绒毛水肿、中央乳糜管扩张, 这与Elias等[32]在羊上得到的结果相一致。她认为这个现象可能是脂多糖及其诱导的炎性介质作用下致使血浆渗出、组织液增多, 机体相应淋巴液生成增加所导致的。这与本实验草鱼血清内毒素含量显著增加结果相一致。
光学显微镜观察黏膜上皮柱状细胞后发现, 杯状细胞数量在草鱼摄食鱼油和氧化鱼油后明显增加。杯状细胞是一种糖蛋白分泌细胞, 其分泌的黏蛋白能润滑肠道, 保护肠上皮黏膜[33]。并且它产生的三叶状蛋白, 能在上皮黏膜受损时与细胞因子和生长因子的协同下加快上皮细胞的愈合[34]。因此,杯状细胞的增多表明草鱼肠道黏膜受到了损伤。肠道扫描电镜结果显示, 除6OF组肠道微绒毛高度低于6S组外, 其余几组均高于6S组。这可能是由于鱼油氧化产物对草鱼造成损伤, 使草鱼需要更多营养物质来修复这些损伤, 从而使肠道微绒毛增生以增加肠道吸收营养的能力, 这与人类短肠综合症病人残余肠道的代偿、适应过程[35]有相似之处。6OF组微绒毛高度减小可能是鱼油氧化产物超出草鱼的耐受范围而造成微绒毛的萎缩。从肠道透射电镜图版Ⅰ-F中可以看出, 6S组肠道紧密连接结构为一条黑色的致密电子带, 而添加鱼油或氧化鱼油后此结构出现明显空隙。紧密连接常见于单层柱状上皮, 位于相邻细胞间隙的顶端侧面[36], 具有渗透性调节功能[37]和维持细胞极性[38]这两个功能。紧密连接在细菌及其毒素或炎症细胞因子等外界因素的影响下功能会丧失[39], 最终导致组织浮肿和损伤[40], 并使肠道通透性增加。
(2)饲料鱼油氧化产物导致肠道通透性显著增加, 形成对其他器官组织损伤作用通路。D-乳酸是肠道固有细菌的代谢终产物, 动物体内一般不具有将其快速代谢分解的酶, 因而血中D-乳酸水平常用来反应肠道通透性[41]。内毒素是G-菌细胞璧的脂多糖部分, 可以引起黏膜水肿并引起缺血, 肠绒毛顶端细胞坏死, 肠道通透性增加[42], 同时还能引起谷氨酰胺代谢紊乱, 进而影响肠道黏膜的修复[43]。本实验添加鱼油和氧化鱼油后, 血清中D-乳酸和内毒素含量均出现不同程度的上升。尤其是6OF组,其D-乳酸和内毒素含量较6S组分别上升146.5%和234.2%, 这说明鱼油氧化产物会导致肠道通透性增加。内毒素含量的上升可能是由于鱼油氧化产物导致肠道蠕动能力和机械清除能力减弱, 进而增强了细菌易位和定植的能力, 而需氧菌的大量聚集和繁殖可产生高浓度的内毒素[44]。血清中内毒素含量与饲料油脂中POV值和MDA呈二元函数正相关,这表明血清内毒素含量增加的速率会随着饲料油脂中POV值及MDA含量的上升而增快。血清D-乳酸含量与饲料油脂氧化产物含量也呈正相关, 其相关系数为61.8%—75.7%。因此肠道通透性和饲料油脂氧化程度呈正相关。
肠道通透性增加可以有2个通路, 一是细胞内通路, 即由于上皮细胞微绒毛、肠腔方面细胞膜损伤, 导致内毒素等经过上皮细胞→基底层→毛细血管的通路进入血液循环; 二是细胞间通络, 即由于上皮细胞间紧密连接的破坏, 导致内毒素等经过上皮细胞间隙通路进入血液系统[45, 46]。当肠道黏膜组织的屏障结构完整性受到破坏后, 肠道内的细菌、细菌内毒素等即可越过肠道屏障而进入血液系统, 并对其他远程器官组织如肝胰脏等形成损伤作用。因此, 肠道损伤、尤其是肠道屏障完整性损伤常常被视为体内炎症的始发器官。本实验结果表明, 鱼油氧化产物会损伤肠道并使其通透性增加,进而导致肠道内有害物质大量进入血液循环而对草鱼造成进一步损伤。并且结合血清内毒素、D-乳酸和肠道切片及透射电镜结果可知, 在6F、4S2OF及2S4OF组中, 肠道黏膜并没有被严重损伤,只有紧密连接明显被损伤。且6OF组血清内毒素和D-乳酸较2S4OF分别上升92.2%和133.5%, 而2S4OF较6S组分别上升40.2%和43.1%, 由此可见血清内毒素和D-乳酸在6OF组中出现较大幅度上升,再结合切片照片结果, 推测只有在6OF组中肠道黏膜才明显受损, 进而导致有害物质通过肠道黏膜直接进入血液循环。
4 结论
在饲料中鱼油氧化产物损伤了草鱼肠道组织结构, 尤其是肠道上皮细胞紧密连接结构损伤严重,从而破坏了肠道黏膜的机械屏障功能, 使肠道通透性显著增加, 肠道细菌内毒素等发生转移, 可能对其他器官组织也形成损伤作用。鱼油氧化产物会引起草鱼肠道氧化与抗氧化应激反应, 可干扰草鱼“肝-肠”正常胆汁酸循环, 致使草鱼肠道胆汁酸不足。
[1]Yao S B, Ye Y T, Li J, et al. Oxidation index and its fatty acid composition changes in fish oil during oxidation [J]. Feed Research, 2012, 6: 74—76 [姚仕彬, 叶元土, 李洁,等. 鱼油在氧化过程中氧化指标及其脂肪酸组成的变化. 饲料研究, 2012, 6: 74—76]
[2]Gao J, Koshio S, Ishikawa M, et al. Effect of dietary oxidized fish oil and vitamin C supplementation on growth performance and reduction of oxidative stress in Red Sea Bream Pagrus major [J]. Aquaculture Nutrition, 2013,19(1): 35—44
[3]Ren Z L, Huo Q G, Zeng H, et al. Effect of oxidized fish oil on the performance and muscular histological structure of carps [J]. Chinese Journal of Animal Nutrition,2001, 13(1): 59—64 [任泽林, 霍启光, 曾虹, 等. 氧化鱼油对鲤鱼生产性能和肌肉组织结构的影响. 动物营养学报, 2001, 13(1): 59—64]
[4]Huang K, Ruan D J, Zhan G, et al. Effect of oxidized oils on the growth and antioxidant activities of juvenile Tilapia [J]. Freshwater Fisheries, 2006, 36(6): 21—24[黄凯, 阮栋俭, 战歌, 等. 氧化油脂对奥尼罗非鱼生长和抗氧化性能的影响. 淡水渔业, 2006, 36(6): 21—24]
[5]Park S I. Nutritional liver disease in cultured yellowtail,Seriola quinqueradiata, caused by feed deficiency [J]. Korean Journal of Fisheries and Aquatic Sciences, 1978,11(1): 1—4
[6]Mourente G, Dıaz-Salvago E, Bell J G, et al. Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L.) fed dietary oxidised oil: attenuation by dietary vitamin E [J]. Aquaculture, 2002, 214(1): 343—361
[7]Ren Z L, Zeng H. Effect of oxidized fish oil on the antioxidative function and histological structure of carp hepatopancreas [J]. Journal of Dalian Fisheries University,2000, 15(4): 235—243[任泽林, 曾虹. 氧化鱼油对鲤肝胰脏抗氧化机能及其组织结构的影响. 大连海洋大学学报, 2000, 15(4): 235—243]
[8]Jiang T. Comprehensive prevention and control three disease of grass carp [J]. Chongqing Fisheries, 2005, (4):31—32 [江涛. 草鱼“三病”的综合防治. 重庆水产, 2005,(4): 31—32]
[9]Wu G H. Barrier function of intestinal [J]. Parenteral & Enteral Nutrition, 2004, 11(1): 44—47 [吴国豪. 肠道屏障功能. 肠外与肠内营养, 2004, 11(1): 44—47]
[10]Lin C Y, Zhu H L. Technology of comprehensive prevention of grass carp aquaculture in pond with enteritis [J]. Hebei Fishery, 2010, (4): 33—34 [林春友, 朱宏利. 池塘养殖草鱼肠炎病综合防治技术. 河北渔业, 2010, (4):33—34]
[11]Bagchi M, Milnes M, Williams C, et al. Acute and chronic stress-induced oxidative gastrointestinal injury in rats,and the protective ability of a novel grape seed proanthocyanidin extract [J]. Nutrition Research, 1999, 19(8):1189—1199
[12]Yin Y F, Ye Y T, Cai C F, et al. Variation of the oxidation index of soybean oil in homemade oxidation device at different time [J]. Journal of Anhui Agriculture Science, 2011, 39(7): 4052—4054 [殷永风, 叶元土, 蔡春芳, 等. 在自制氧化装置中氧化时间对豆油氧化指标的影响. 安徽农业科学, 2011, 39(7): 4052—4054]
[13]Yao S B, Ye Y T, Cai C F, et al. The water soluble matter from oxidized soybean oil damages dissociated intestinal epithelial cells of grass carp (Ctenopharyngodon idella) [J]. Acta Hydrobiologica Sinica, 2014, 38(4):689—698 [姚仕彬, 叶元土, 蔡春芳, 等. 氧化豆油水溶物对离体草鱼肠道黏膜细胞的损伤作用. 水生生物学报, 2014, 38(4): 689—698]
[14]Pan H Z, Feng L M, Xu C M, et al. Effect of malondialdehyde on red blood cells [J]. Progress in Biochemistry and Biophysics,1984, 2: 34—37 [潘华珍, 冯立明, 许彩民, 等. 丙二醛对红细胞的作用. 生物化学与生物物理进展, 1984, 2: 34—37]
[15]Lin Y H, Zhang J J. Protective effect of sodium ferulate on damage of the rat liver mitochondria induced by oxygen free radicals [J]. Acta Pharmaceutica Sinica, 1994,(3): 171—175 [林迎晖, 张家俊. 阿魏酸钠对大鼠肝线粒体氧化性损伤的保护作用. 药学学报, 1994, (3):171—175]
[16]Gong H W, Ma L J. Changes in glutathione peroxidase activity and MDA content category 2 male sterile wheat sensitive period [J]. Anhui Agriculture Science, 2013,41(7): 60—62 [龚宏伟, 马翎健. 2类小麦雄性不育系育性敏感时期谷胱甘肽过氧化物酶活性及丙二醛含量变化. 江苏农业科学, 2013, 41(7): 60—62]
[17]Liu Z Y. Research and application of glutathione [J]. Chemistry of Life, 1995, (1): 19—21 [刘振玉. 谷胱甘肽的研究与应用. 生命的化学, 1995, (1): 19—21]
[18]Agerbo P, Jørgensen B M, Jensen B, et al. Enzyme inhibition by secondary lipid autoxidation products from fish oil [J]. The Journal of Nutritional Biochemistry, 1992,3(10): 549—553
[19]Zhang X Y, Yang J, Yin X F, et al. Hepatobiliary transport of glutathione and its role in cholestasis [J]. Acta Pharmaceutica Sinica, 2009, 44(4):327—332 [张雪莹,杨劲, 尹雪芬, 等. 谷胱甘肽的肝脏转运及其在胆汁淤积中的作用. 药学学报, 2009, 44(4): 327—332]
[20]J Dibner J, A Atwell C, L Kitchell M, et al. Feeding of oxidized fats to broilers and swine: effects on enterocyte turnover, hepatocyte proliferation and the gut associated lymphoid tissue [J]. Animal Feed Science and Technology, 1996, (1): 1—13
[21]Ye Y T, Cai C F, Xu F, et al. Feeding grass carp (Ctenopharyngodon idellus) with oxidized fish oil up-regulates the gene expression in the cholesterol and bile acid synthesis pathway in intestinal mucosa [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 94—104 [叶元土, 蔡春芳, 许凡, 等. 灌喂氧化鱼油使草鱼肠道黏膜胆固醇胆汁酸合成基因通路表达上调. 水生生物学报, 2015, 39(1):94—104]
[22]Yao S B, Ye Y T, Cai C F, et al. Damage of MDA on intestinal epithelial cells in vitro of grass carp (Ctenopharyngodon idella) [J]. Acta Hydrobiologica Sinica, 2015,39(1): 137—146 [姚仕彬, 叶元土, 蔡春芳, 等. 丙二醛对离体草鱼肠道黏膜细胞的损伤作用. 水生生物学报,2015, 39(1): 137—146]
[23]Moccia R D, Hung S O, Slinger S J, et al. Effect of oxidized fish oil, vitamin E and ethoxyquin on the histopathology and haematology of rainbow trout, Salmo gairdneri Richardson [J]. Journal of Fish Diseases, 1984, 7:269-282
[24]Řehulka J. Effect of hydrolytically changed and oxidized fat in dry pellets on the health of rainbow trout, Oncorhynchus mykiss (Richardson) [J]. Aquaculture Research,1990, 21: 419-434
[25]M Engberg R, F Borsting C. Inclusion of oxidized fish oil in mink diets. 2. The influence on performance and health considering histopathological, clinical-chemical, and haematological indices [J]. Journal of Animal Physiology and Animal Nutrition, 1994, 72: 146-157
[26]Kanazawa K, Kanazawa E, Natake M. Uptake of secondary autoxidation products of linoleic acid by the rat [J]. Lipids, 1985, 20(7): 412—419
[27]Asfaha S, Bell C J, Wallace J L, et al. Prolonged colonicepithelial hyporesponsiveness after colitis: role of inducible nitric oxide synthase [J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 1999,276(3): 703—710
[28]Wardle T D, Hall L, Turnberg L A. Platelet activating factor: release from colonic mucosa in patients with ulcerative colitis and its effect on colonic secretion [J]. Gut,1996, 38(3): 355—361
[29]Rong X Z, Zhang T, Yang R H, et al. Morphological changes in intestinal villi after severe burns in rats [J]. Chinese Journal of Burns, 2005, 21(6): 459—461 [荣新洲, 张涛, 杨荣华, 等. 大鼠严重烧伤后肠绒毛的改变.中华烧伤杂志, 2005, 21(6): 459—461]
[30]Berman I R, Moseley R V, Lamborn P B, et al. Thoracic duct lymph in shock: gas exchange, acid base balance and lysosomal enzymes in hemorrhagic and endotoxin shock [J]. Annals of Surgery, 1969, 169(2): 202
[31]Shi G Z, Wang B H. Histochemical study on the change in lymphatic motion and nitric oxide synthase in the early phase of acute rat endotoxemia [J]. Chinese Journal of Pathophysiology, 2001, 17(3): 223—225 [史桂芝, 王宝恒. 急性内毒素血症早期大鼠淋巴管运动变化及其一氧化氮合酶组织学研究. 中国病理生理杂志, 2001,17(3): 223—225]
[32]Elias R M, Johnston M G, Hayashi A, et al. Decreased lymphatic pumping after intravenous endotoxin administration in sheep [J]. American Journal of Physiology,1987, 253(6): H1349—H1357
[33]Huerta B, Arenas A, Carrasco L, et al. Comparison of diagnostic techniques for porcine proliferative enteropathy (Lawsonia intracellularis Infection) [J]. Journal of Comparative Pathology, 2003, 129(2): 179—185
[34]Wattanaphansak S, Asawakarn T, Gebhart C J, et al. Development and validation of an enzyme-linked immunosorbent assay for the diagnosis of porcine proliferative enteropathy [J]. Journal of Veterinary Diagnostic Investigation, 2008, 20(2): 170—177
[35]Wu G H. Short bowel syndrome patients residual intestinal compensatory [J]. Chinese Journal of Practical Surgery, 2006, 25(11): 655—657 [吴国豪. 短肠综合征病人残余肠道的代偿. 中国实用外科杂志, 2006, 25(11):655—657]
[36]Wolburg H, Lippoldt A. Tight junctions of the bloodbrain barrier: development, composition and regulation [J]. Vascular Pharmacology, 2002, 38(6): 323—337
[37]Bernacki J, Dobrowolska A, Nierwiñska K, et al. Physiology and pharmacological role of the blood-brain barrier [J]. Pharmacologica Reports, 2008, 60(5):600—622
[38]Ueno M. Molecular anatomy of the brain endothelial barrier: an overview of the distributional features [J]. Current Medicinal Chemistry, 2007, 14(11): 1199—1206
[39]Gao Z G, Qin H L. The biological functions of intestinal epithelial tight junctions and its role in intestinal barrier [J]. Parenteral & Enteral Nutrition, 2005, 12(5):299—302 [高志光, 秦环龙. 肠上皮细胞紧密连接的生物学功能及在肠屏障中的作用. 肠外与肠内营养, 2005,12(5): 299—302]
[40]Förster C. Tight junctions and the modulation of barrier function in disease [J]. Histochemistry and Cell Biology,2008, 130(1): 55—70
[41]Smith S M, Eng R H K, Buccini F. Use of D-lactic acid measurements in the diagnosis of bacterial infections [J]. Journal of Infectious Diseases, 1986, 154(4): 658—664
[42]Berg R D, Garlington A W. Translocation of certain indigenous bacteria from the gastrointestinal tract to the mesenteric lymph nodes and other organs in a gnotobiotic mouse model [J]. Infection and Immunity, 1979, 23(2):403—411
[43]Shi G, Chen J Y, Xu P Y. The injury and the protection of intestinal barrier [J]. Parenteral & Enteral Nutrition,2004, 11(1): 61—63 [石刚, 陈嘉勇, 徐鹏远. 肠道黏膜屏障的损伤与保护. 肠外与肠内营养, 2004, 11(1):61—63]
[44]Bauer T M, Schwacha H, Steinbrückner B, et al. Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxemia [J]. The American Journal of Gastroenterology, 2002, 97(9): 2364—2370
[45]Sigalet D L, Kneteman N M, Fedorak R N, et al. Intestinal function following allogeneic small intestinal transplantation in the rat [J]. Transplantation, 1992, 53(2):264—271
[46]Wu Z W. Intestinal barrier and the intestinal microflora [J]. Chinese Critical Care Medicine, 2005, 16(12):768—770 [吴仲文. 肠道屏障与肠道微生态. 中国危重病急救医学, 2005, 16(12): 768—770]
EFFECTS OF DIETARY OXIDIZED FISH OIL ON THE INTESTINAL STRUCTURE AND PERMEABILITY OF GRASS CARP (CTENOPHARYNGODON IDELLUS)
CHEN Ke-Quan1, YE Yuan-Tu1, CAI Chun-Fang1, WU Ping1, HUANG Yu-Wei1, WU Tao1,LIN Xiu-Xiu1, LUO Qi-Gang1, ZHANG Bao-Tong2and XIAO Pei-Zhen1, 2
(1. Key Laboratory of Aquatic Animal Nutrition in Jiangsu Province, Preclinical Medicine and Biological Science College of Soochow University, Suzhou 215123, China; 2. Beijing Institute of Nutrition, Laboratory of Aquatic Animal Nutrition Research System, Beijing 100000, China)
To investigate effects of oxidized fish oil on the structure and permeability of intestine of grass carp (Ctenopharyngodon idellus), five iso-nitrogen and iso-energy diets were formulated with soybean oil, fish oil and oxidized fish oil at different concentrations: 6% fish oil, 6% soybean oil, 2% oxidized fish oil and 4% soybean oil, 4% oxidized fish oil, and 2% soybean oil, 6% oxidized fish oil, respectively. Compared with the 6% soybean oil, the oxidative product of fish oil at low level increased serum and intestine MDA and GSH content but diminished the GSH content at high level. The oxidized fish oil significantly reduced intestine bile acid content (P<0.05). The oxidized fish oil enhanced the number of goblet cell (P<0.05), The microvilli of intestine was enlarged by low oxidized fish oil level and atrophied by high level. Serum D-lactic acid and endotoxin content increased significantly by oxidized fish oil because of the enlarged gap between tight junction, the hyperplasia and edema of villi. Thus, the oxidized fish oil might damage the intestinal epithelial tight junction and destroy the intestinal mucosal epithelium, which would increase intestinal oxidative stress and interfere the bile acids-cholesterol circulation of grass carp.
Dxidized fish oil; Intestine; Structure; Permeability; Ctenopharyngodon idellus

图版Ⅰ 氧化鱼油对草鱼中肠形态、结构的影响Plate Ⅰ Effects of oxidized fish oil on the morphology and structure of grass carp midgut
S965.1
A
1000-3207(2016)04-0804-10
10.7541/2016.104
2015-06-05;
2015-10-15
国家自然科学基金项目(31172417); 苏州市应用基础研究项目(SYN201316)资助 [Supported by the National Natural Science Foundation of China (31172417); Applied Basic Research Programs of Suzhou City (SYN201316)]
陈科全(1990—), 男; 浙江诸暨人; 硕士研究生; 研究方向为水产动物营养与饲料。E-mail: 326088246@qq.com
叶元土, 教授, 硕士生导师; E-mail: yeyt@suda.edu.cn

