饲料丙二醛对草鱼生长、肝胰脏及肠道结构和功能的影响
陈科全叶元土蔡春芳吴 萍黄雨薇吴 韬林秀秀罗其刚张宝彤萧培珍, 周亚琴
饲料丙二醛对草鱼生长、肝胰脏及肠道结构和功能的影响
陈科全1叶元土1蔡春芳1吴 萍1黄雨薇1吴 韬1林秀秀1罗其刚1张宝彤2萧培珍1, 2周亚琴1
(1. 苏州大学基础医学与生物科学学院, 江苏省水产动物营养重点实验室, 苏州 215123;2. 北京营养源研究所, 水产动物系统营养研究开放实验室, 北京 100000)
为了探讨丙二醛(MDA)对草鱼Ctenopharyngodon idellus (74.82±1.49) g生长、肝胰脏及肠道结构和功能的影响并初步对比MDA与其他油脂氧化产物的毒副作用, 本试验以新鲜豆油、低氧化程度的鱼油为饲料脂肪源, 制成豆油组(S组)、鱼油组(F组), 并在豆油组中喷涂不同浓度的MDA, 制成MDA水平为61.59 (M1组)、123.92 (M2组)、185.04 (M3组) mg/kg的5种等氮等能的试验饲料。经72d池塘网箱养殖后, 试验结果显示:(1)饲料中MDA及油脂其他氧化产物均可显著增加草鱼饲料系数(FCR) (P<0.05), 显著降低特定生长率(SGR)、蛋白质沉积率(PRR) (P<0.05), MDA还可显著降低草鱼脂肪沉积率(LRR) (P<0.05); (2)饲料中MDA及油脂其他氧化产物均可显著降低血清总胆汁酸(TBA)含量(P<0.05), 并使血清总胆固醇(TC)、甘油三酯(TG)、MDA含量及超氧化物歧化酶(SOD)酶活性显著上升(P<0.05), 饲料中MDA还可显著增加血清丙氨酸氨基转移酶(ALT)含量(P<0.05), 显著降低血清高密度脂蛋白与低密度脂蛋白之比(HDL/LDL)、白蛋白与球蛋白之比(A/G)比值(P<0.05); (3)饲料中MDA及油脂及其他氧化产物会显著增加肝胰脏脂肪(P<0.05), 且MDA还会显著增加肝胰脏SOD含量(P<0.05), 导致草鱼肝胰脏氧化应激; (4)饲料中MDA会损伤肝胰脏细胞线粒体, 降低细胞核数量, 使肝胰脏细胞有明显纤维化趋势; (5)饲料MDA及鱼油其他氧化产物均会引起草鱼肠道黏膜杯状细胞数量增加, 损伤肠道微绒毛, 并会损伤肠道紧密连接结构, 增加肠道通透性, 导致血清内毒素及D-乳酸含量显著增加(P<0.05)。上述结果表明: (1)饲料MDA会引起草鱼鱼体应激, 并通过干扰正常胆汁酸循环来干扰草鱼对脂肪的消化吸收, 最终导致草鱼生长性能下降; (2)MDA会引起肝胰脏氧化应激, 并可通过损伤肝胰脏细胞线粒体内部结构来损伤草鱼肝胰脏, 增加其发生脂肪性肝炎机率, 而鱼油其他氧化产物则是通过影响线粒体膜结构改变线粒体形态来损伤肝胰脏; (3)饲料MDA及鱼油其他氧化产物均会损伤草鱼肠道绒毛和微绒毛来降低其消化吸收能力, 还可损伤肠道紧密连接结构, 增加肠道通透性。
血清; 脂肪代谢; 胆汁酸; 线粒体; 紧密连接
本实验室前期研究表明, 分别用豆油和鱼油(两者与本实验中豆油及低氧化程度鱼油相同)以及高氧化程度的氧化鱼油作为饲料脂肪源来饲喂草鱼, 鱼油中氧化产物会显著降低草鱼生长效率[1], 干扰胆汁酸“肝-肠”循环, 损伤草鱼肝胰脏线粒体形态和内部结构, 并通过损伤草鱼肠道紧密连接来增加肠道通透性[2]。而MDA作为油脂氧化的终产物之一[3], 可以交联蛋白质及磷脂的氨基, 使细胞膜流动性下降[4], 从而导致细胞生理功能改变[5], 最终对动物机体造成影响。但关于MDA对草鱼健康的影响尚没有系统、深入的研究, 并且由于MDA在酸性环境下不稳定, 易转变成丙二酸, 因此关于MDA对动物的损伤性研究大多是基于MDA对体外培养细胞的影响而进行的[6, 7]。
草鱼(Ctenopharyngodon idellus)作为我国主要的淡水养殖经济鱼类之一, 其在实际养殖中也存在着较多病害[8]。本文以草鱼为试验对象, 以豆油为对照, 研究MDA对草鱼生长性能, 肝胰脏及肠道健康的影响, 期望为阐述饲料中MDA对草鱼生长性能的影响及其对肝胰脏和肠道结构、功能损伤机制和作用方式等科学问题提供依据, 并初步比较MDA与油脂其他氧化产物的毒副作用。
1 材料与方法
1.1 草鱼
草鱼来源于浙江一星饲料有限公司养殖基地,为池塘培育的1冬龄鱼种, 共350尾, 平均体重为(74.82±1.49) g。草鱼随机分为5组, 每组设3重复,每重复20尾。分组剩余草鱼用于养殖前期取样分析, 测定其全鱼、肌肉和肝胰脏水分、测蛋白、测脂肪及能量。
1.2 饲料
以酪蛋白和秘鲁蒸汽鱼粉为主要蛋白源, 采用等氮等能方案设计基础饲料, 设置了S组(对照)、M1组、M2组、M3组和F组5种半纯化饲料, 其中S组、M1组、M2组和M3组共用一个基础配方, 配方及实测营养指标见表 1。
饲料原料粉碎过60目筛, 用绞肉机制成直径1.5 mm的长条状, 切成1.5 mm×2 mm的颗粒状, 风干。饲料置于-20℃冰柜保存备用。
M1、M2和M3组3组不同MDA浓度试验组饲料的制作是通过在S组饲料中喷洒4 mL不同浓度MDA溶液制得。MDA溶液浓度根据每天实际投喂饲料量计算, 使最终M1、M2、M3组饲料MDA浓度分别为61.59、123.92和185.04 mg/kg。MDA浓度根据本实验室前期试验中高氧化程度鱼油中MDA含量设定[1]。
MDA制备方法(GB/T 5009.181-2003): 精确称取31.5000 g 1, 1, 3, 3四乙氧基丙烷(购于上海将来实业股份有限公司), 用95%乙醇溶解后定容至100 mL, 搅拌15min, 置于-20℃冰箱内保存备用。此溶液MDA浓度实测值为1388 μmol/mL。
豆油为“福临门”牌一级大豆油。鱼油来源于广东省良种引进服务公司生产的“高美牌”精炼鱼油。分别测定2种油脂POV (GB/T 5538-2005)、AV (GB/T 5530-2005)、MDA (南京建成试剂盒), 并计算饲料中POV、AV、MDA值(饲料中AV、POV、MDA测定尚无有效方法, 故采用油脂测定结果的计算值), 结果分别见表 2。

表 1 试验饲料组成及营养水平Tab. 1 Formulation and proximate compositionof experiment diets (DM basis)
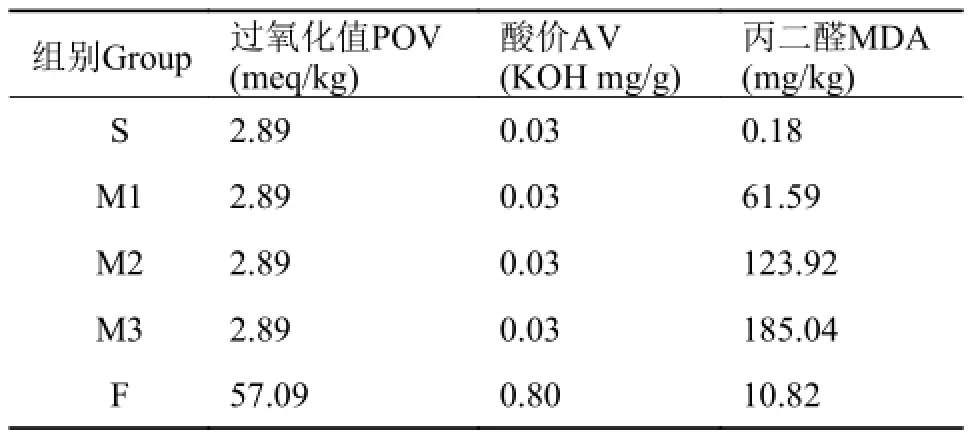
表 2 试验饲料中POV值、AV及MDA含量Tab. 2 Peroxide value, acid value and MDA content of the experimental diets
1.3 饲养管理
养殖试验在浙江一星饲料有限公司试验基地进行。在面积为5 m×667 m (平均水深1.8 m)的池塘中设置网箱, 网箱规格为1.5 m × 1.0 m ×2.0 m。将各组试验草鱼随机分配在5组、15个网箱中。
分别用试验饲料驯化试验鱼1周后, 开始正式投喂, 每天7:00和16:00定时投喂, 投饲率为3%—4%。每10天据投饲量估算鱼体增重并调整投饲率, 记录每天投饲量。正式试验共养殖72d。
每周测定水质一次, 试验期间溶解氧浓度>8.0 mg/L, pH 7.8—8.4, 氨氮浓度<0.2 mg/L, 亚硝酸盐浓度<0.01 mg/L, 硫化物浓度<0.05 mg/L。养殖期间水温25—33℃。
1.4 样品采集及分析方法
生长性能指标和分析方法 养殖72d后, 禁食24h, 分别捞取各网箱草鱼, 滤水后称重, 并记录尾数, 计算存活率、饲料系数和特定生长率; 随机从每个网箱里抽取6尾鱼测量体长与体重, 计算肥满度; 并解剖, 取内脏团分离出肝胰脏, 称重, 用于计算肝胰脏指数; 另取2尾鱼并收集所有可用肝胰脏和鱼体侧线鳞以上肌肉(不含红色肉), 用于测定水分、粗脂肪和粗蛋白。
饲料原料及所有试验鱼样品均在冷冻干燥机(北京四环科学仪器厂LGJ-18B型)中干燥至恒重,然后进行营养成分测定。采用凯氏定氮法测定粗蛋白; 索氏抽提法测定粗脂肪; 总能使用上海吉昌公司XRY-1型氧弹仪, 采用燃烧能测定方法测定。
相关评价指标计算方法如下:
成活率(SR, %)=(终尾数/初尾数)×100
饲料系数(FCR)=饲料摄入量/(网箱末总重-网箱初总重)
肥满度(CF)=鱼体重量/体长3×100
特定生长率(SGR, %/d)=(Ln末均重-Ln初均重)/饲养天数×100
肝胰脏指数(HSI, %)=肝胰脏重/体重×100
蛋白质沉积率(PRR, %)=全鱼增重蛋白质含量/(摄入饲料总重×饲料蛋白质含量)×100
脂肪沉积率(LRR, %)=全鱼增重脂肪含量/(摄入饲料总重×饲料脂肪含量)×100
鱼类部分生化指标及分析方法 血清: 每个网箱随机取10尾鱼, 以无菌1 mL注射器自尾柄静脉采血, 置于Eppendorf离心管中室温自然凝固0.5h,3000 r/min冷冻离心10min, 取上清液分装后, 液氮速冻并于-80℃冰箱中保存。
白蛋白(ALB)、球蛋白(GLB)、谷丙转氨酶(ALT)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、甘油三酯(TG)、血清胆固醇(TC)、胆汁酸(TBA)采用雅培C800全自动生化分析仪测定。MDA、SOD采用南京建成试剂盒。D-乳酸、内毒素采用购于南京建成的Elisa试剂盒测定。
肝胰脏匀浆液制备: 取部分新鲜肝胰脏, 称重后加入10倍体积0.02 mol/L磷酸缓冲液(pH 7.4), 匀浆器10000 r/min匀浆1min, 3000 r/min冷冻离心10min, 取上清液分装, 液氮速冻后-80℃冰箱保存。
丙二醛(MDA)、超氧化物歧化酶(SOD)采用南京建成试剂盒测定, 胆固醇(TC)、胆汁酸(TBA)采用雅培C800全自动生化分析仪测定。
肠道匀浆液制备: 取部分新鲜中肠, 称重后加入10倍体积0.02 mol/L磷酸缓冲液(pH 7.4), 匀浆器10000 r/min匀浆1min, 3000 r/min冷冻离心10min,取上清液分装, 液氮速冻后-80℃冰箱保存。
MDA、GSH采用南京建成试剂盒测定, 胆固醇(TC)、胆汁酸(TBA)采用雅培C800全自动生化分析仪测定。
肝胰脏组织学样品制备 每网箱取3尾鱼,于肝胰脏左叶取1 mm3组织块各1块, 分别放入4%戊二醛溶液及Bouin试液中固定, 用于透射电镜和组织学切片分析。
组织学切片采用石蜡切片方法, 苏木精-伊红染色, 中性树胶封片, 光学显微镜下观察肝胰脏组织结构并采用Nikon COOLPIX4500型相机进行拍照。
透射电镜采用锇酸固定、丙酮脱水, 最后放入胶囊内包埋切片染色, 用日立HT7700透射式电子显微镜观察肝胰脏组织结构并拍照。
肠道组织学样品制备 每网箱取4尾鱼、每组12尾, 于中肠前1/4处取1—2 cm肠管1段, 纵向剖开用磷酸缓冲液冲洗后, 立即将其投入4%戊二醛中固定, 用于透射和扫描电镜分析。每网箱另取2尾、每组6尾鱼于中肠前四分之一处取肠管2段置于Bouin试液固定, 用于组织学切片分析。
组织学切片采用石蜡切片进行组织学切片, 苏木精-伊红染色, 中性树胶封片, 光学显微镜下观察肠道组织结构并采用Nikon COOLPIX4500型相机进行拍照。
透射电镜采用锇酸固定、丙酮脱水, 最后放入胶囊内包埋切片染色, 用日立HT7700透射式电子显微镜观察肠道组织结构并拍照。
扫描电镜采用锇酸固定, 缓冲液洗涤, 乙醇梯度脱水, 醋酸异戊酯置换, 临界点干燥, 镀膜最后用导电胶胶于样品台, 采用飞利浦XL-20型扫描电子显微镜观察肠道组织结构、测量肠道微绒毛高度并拍照。
1.5 数据分析
试验结果用SPSS 21.0软件进行统计分析, 采用平均值±标准差(mean±SD)表示, 在单因素方差分析的基础上, 采用Duncan氏法多重比较检验组间差异显著性, 用Pearson分析方法检验数据相关性, 以P<0.05表示差异显著, P<0.01表示差异极显著(由于F组添加的鱼油中POV及AV值与添加豆油的4个试验组不同, 因此饲料中MDA含量与相关数据的相关性分析只涉及添加豆油的4个试验组。
2 结果
2.1 MDA对草鱼生长性能、饲料效率及形体指标的影响
经72d养殖试验后, 各组草鱼生长性能、饲料效率及形体指标结果见表 3。

表 3 MDA对草鱼生长性能、饲料效率及形体指标的影响Tab. 3 Effects of MDA on the growth performance, feed utilization and biometric parameters of grass carp
由表 3可知, 饲料添加MDA后, 对草鱼存活率没有显著影响; M1、M2、M3组草鱼SGR显著下降(P<0.05), FCR显著增加(P<0.05), PRR、LRR除M1外, M2、M3组均显著下降(P<0.05); M1、M2、M3组草鱼CF出现显著下降(P<0.05), HSI则先上升后下降, S组显著小于M1、M2组(P<0.05), 与M3组没有显著差异。在饲料中添加鱼油与豆油相比,F组存活率也没有显著差异; SGR显著小于S组(P<0.05), 与M1组没有显著差异; FCR显著大于S组(P<0.05), 与M1组没有显著差异; PRR显著小于S、M1组(P<0.05), 与M2、M3组没有显著差异; LRR与S、M1组没有显著差异, 但显著大于M2、M3组(P<0.05); F组CF显著大于M3组(P<0.05), 与S、M1、M2组没有显著差异; F组HIS显著大于S、M3组(P<0.05), 与M1、M2组没有显著差异。
相关性分析及回归分析结果显示: SGR(y)与饲料MDA (x)呈线性函数负相关关系, 回归方程为y=-0.001x+1.717, R2=0.936; FCR(y)与饲料MDA (x)呈线性函数正相关关系, 回归方程为y=0.002x+1.615, R2=0.953; PRR(y)与饲料MDA (x)呈线性函数负相关关系, 回归方程为y=-0.028x+35.457, R2=0.912。
上述结果显示, 草鱼SGR、PRR会随着饲料中MDA的上升而呈线性下降, FCR则与之相反。
2.2 MDA对草鱼全鱼、肝胰脏及肌肉组成成分的影响
经72d养殖试验后, 各组草鱼全鱼、肝胰脏及肌肉组成成分结果见表 4。
由表 4可知, 各组间全鱼蛋白、肌肉蛋白、肌肉脂肪、肌肉水分、肝胰脏蛋白和肝胰脏水分之间均无显著差异。与S组相比, 全鱼脂肪除M1外,M2、M3组均显著下降(P<0.05); 全鱼水分除M3组显著上升(P<0.05)外, M1、M2组均无显著差异; 肝胰脏脂肪除M1组外, M2、M3组均显著上升(P<0.05)。添加鱼油组与豆油组相比, F组全鱼脂肪与S组、M1组无显著差异; 全鱼水分显著大于S组(P<0.05); 肝胰脏脂肪显著大于S组(P<0.05)。相关性分析结果显示, 草鱼全鱼、肝胰脏及肠道组成成分与饲料MDA之间没有显著的相关性。
2.3 MDA对草鱼血清生化指标的影响
经72d养殖试验后, 各组草鱼血清生化指标结果见表 5。
由表 5可知, 与S组相比, 添加MDA会使草鱼血清TBA含量显著下降(P<0.05); TC含量除M1组均外显著上升; HDL/LDL显著下降(P<0.05); TG含量显著升高(P<0.05); 血清ALT含量, 除M1组外, 其余各组均显著上升(P<0.05); A/G显著下降(P<0.05);血清MDA、SOD、内毒素及D-乳酸含量均显著上升(P<0.05)。添加鱼油组与豆油组相比, F组血清TBA显著小于S组(P<0.05); TC含量显著大于S组(P<0.05); HDL/LDL与S组无显著差异; TG显著大于S组(P<0.05); ALT及A/G与S组无显著差异;MDA、SOD含量均显著大于S组(P<0.05); F组血清内毒素及D-乳酸含量均显著大于S组(P<0.05), 其中内毒素与M1组没有显著差异, D-乳酸含量鉴于M1组与M2组之间, 且差异具有显著性(P<0.05)。

表 4 MDA对草鱼全鱼、肝胰脏及肌肉组成成分的影响Tab. 4 Effects of MDA on whole-body, hepatopancreas and muscle composition of grass carp

表 5 MDA对草鱼血清生化指标的影响Tab. 5 Effects of MDA on haematological parameters of grass carp
相关性分析及回归分析结果显示: TC (y)与饲料MDA (x)呈线性正相关关系, 回归方程为y=0.005x+5.399, R2=1.000; 内毒素(y)与饲料MDA (x)呈线性正相关关系, 回归方程为y=0.151x+46.10,R2=0.997。上述结果显示, 草鱼血清TC及内毒素含量会随着饲料MDA含量的上升而线性上升。
2.4 MDA对草鱼肝胰脏功能、结构的损伤
MDA对草鱼肝胰脏功能指标的影响 由表6可知, 相比S组, 添加MDA后各组草鱼肝胰脏TC含量均显著上升(P<0.05), TBA则没有显著差异; 肝胰脏MDA含量除M3组显著上升(P<0.05)外, M1、M2组均无显著差异; 肝胰脏SOD含量均显著下降(P<0.05), 但M1、M2、M3组之间无显著差异。添加鱼油组与豆油组相比, F组较S组TC含量显著上升(P<0.05), TBA也无显著差异; 肝胰脏MDA含量与S组无显著差异; S O D含量显著小于S组(P<0.05)。
相关性分析结果显示, 草鱼肝胰脏TC、TBA、MDA含量和SOD活性与饲料MDA之间没有直接相关性。

表 6 MDA对草鱼肝胰脏SOD活性和MDA、TBA、TC含量的影响Tab. 6 Effects of MDA on the activity of SOD and the content of MDA, TBA and TC of hepatopancreas of grass carp
草鱼肝胰脏组织学观察 经72d养殖试验后,各组草鱼肝胰脏组织切片结果见图版Ⅰ-A-E, 肝胰脏细胞核数量与细胞数量之比(Mn/Mc)见表 7。

表 7 肝胰脏细胞核数量与细胞个数之比(Mn/Mc)Tab. 7 Ratio of the number of hepatopancreas nucleus and hepatopancreas cells
由图版Ⅰ-A-E可知, S、F、M1组草鱼肝胰脏细胞排列整齐, 大小均一; M2组草鱼肝胰脏中明显出现部分细胞细胞核缺失(见图中箭头所示); M3组草鱼肝胰脏细胞形态明显发生改变, 结缔组织增生,有明显的纤维化趋势(见图中箭头所示)。
由表 7可知, 添加MDA后, 除M1组Mn/Mc没有显著下降外, 其余各组均显著降低(P<0.05), F组虽小于S组, 但无显著差异。
相关性分析结果显示, 草鱼肝胰脏细胞核数量与细胞个数之比与饲料MDA之间没有相关性。
MDA对草鱼肝胰脏细胞线粒体的损伤 经72d养殖试验后, 各组草鱼肝胰脏细胞线粒体透射电镜结果见图版Ⅰ-F-J。
由图版Ⅰ-F-J可知, S组草鱼肝胰脏细胞线粒体形态正常, 内部结构清晰完整, 随着饲料中MDA含量的上升, 线粒体形态并未发生改变, 但内部结构逐渐模糊混乱, 嵴数量下降; F组草鱼肝胰脏细胞线粒体内部结构尚为清晰, 但其形态已发生明显变化,由长杆型变为椭圆型。
2.5 MDA对草鱼肠道结构功能的影响
MDA对草鱼肠道MDA、TBA、TC含量的影响 经72d养殖试验后, 各组草鱼肠道MDA、TBA、TC含量见表 8。
由表 8可知, 与S组相比, 添加MDA会使肠道MDA含量有所上升, 但除M3组差异显著外(P<0.05), M1、M2组均没有显著差异; 肠道胆汁酸含量显著下降(P<0.05), 胆固醇含量除M3组与S组没有显著差异外, M1、M2组均显著大于S组(P<0.05)。添加鱼油组与豆油组相比, F组肠道MDA含量与S组没有显著差异; 肠道胆汁酸含量显著小于S组(P<0.05), 但显著大于M1、M2及M3组(P<0.05), 肠道胆固醇含量显著大于S组(P<0.05), 与M1、M2组没有显著差异。
相关性分析及回归分析结果显示: 肠道MDA (y)与饲料MDA (x)呈线性函数正相关关系, 回归方程为y=0.033x+25.378, R2=0.936。
上述结果显示, 草鱼肠道MDA含量会直接受饲料MDA含量的影响, 且会随饲料MDA含量的上升而线性增加。
草鱼肠道黏膜组织学观察 经72d养殖试验后, 各组草鱼肠道上皮黏膜细胞结构见图版Ⅱ-AE。图A-E分别为S、M1、M2、M3及F组。由图中标注箭头可知, S组肠道绒毛排列整齐, F组与M1组绒毛排列较整齐, 但中央乳糜管扩大, M2组绒毛密度下降, 绒毛间隙增加, 中央乳糜管扩大, M3组绒毛出现假复层柱状上皮结构。
MDA对草鱼肠道绒毛的影响 各组草鱼肠道杯状细胞个数及微绒毛高度结果见表 9。

表 8 MDA对草鱼肠道MDA、TBA、TC含量的影响Tab. 8 Effects of MDA on the content of MDA, TBA and TC in intestine of grass crap
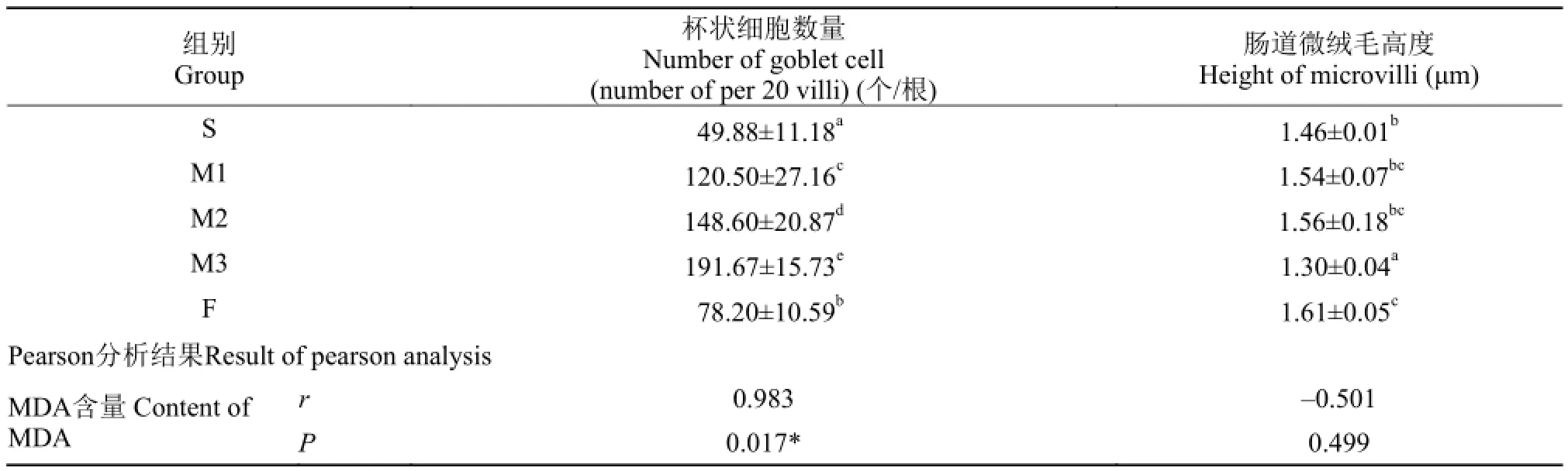
表 9 MDA对草鱼肠道草鱼肠道杯状细胞数量、微绒毛高度的影响Tab. 9 Effect of MDA on the number of goblet cell and the height of microvilli of intestine of grass crap
由表 6可知, 相比S组, 添加MDA后, M1、M2组草鱼肠道微绒毛高度上升, 但没有显著差异,M3组微绒毛高度显著下降(P<0.05); 草鱼肠道杯状细胞数量显著增加(P<0.05), 且M3组具有最大值。添加鱼油与豆油组相比, F组微绒毛高度具有最大值, 且显著大于所有组(P<0.05); F组肠道杯状细胞数量显著大于S组(P<0.05), 但显著小于M1组(P<0.05)。
相关性分析结果显示, 草鱼肠道绒毛杯状细胞数量(y)与饲料MDA (x)呈线性函数正相关关系, 回归方程为y=0.735x+59.556, R2=0.966。
上述结果表明, 草鱼肠道绒毛杯状细胞数量会直接受到饲料MDA的影响, 且会随饲料MDA含量的增加而线性增加。
MDA对草鱼肠道紧密连接结构的影响 经72d养殖试验后, 各组草鱼肠道紧密连接结构见图版Ⅱ-F-J。
图版Ⅱ-F-J分别为S、M1、M2、M3、F组, 图中箭头所示为草鱼肠道紧密连接结构。图中可知,S组紧密连接结构没有空隙, M1、M2及F组紧密连接结构出现空隙, M3组紧密连接结构基本完全打开。
3 讨论
在本试验中F组所添加的鱼油为略有一定氧化程度的鱼油, 其MDA含量高于S组, 但低于M1、M2、M3组, 而POV含量和AV值则高于所有添加豆油组。因此, 对比添加鱼油组与添加豆油组可以从侧面比较MDA与其他氧化产物的毒性。
3.1 MDA对草鱼生长性能的影响
本试验结果显示, MDA会显著降低草鱼的生长速度。
相较S组, 添加MDA组其蛋白沉积率和脂肪沉积率都出现显著下降, 而F组蛋白沉积率接近M3组,但脂肪沉积率却接近M1组。这说明氧化油脂对草鱼脂肪消化吸收的影响可能主要来源于MDA, 而MDA及其他过氧化产物均可降低草鱼对蛋白质的利用率。
在本试验中, 添加MDA后草鱼肌肉蛋白质含量没有显著变化, 但CF值显著下降, 这与草鱼蛋白沉积率下降结果相一致, 说明草鱼可能有发生瘦背病的趋势。这与任泽林等[9]在用氧化鱼油饲喂鲤9周后发现虽然鲤没有表现出明显的瘦背病的症状,但其肌肉切片显示氧化鱼油导致肌纤维间隙扩大,肌原纤维降解, 及Murai和Andrews[10]在斑点叉尾鲖上得到的结果相类似。叶仕根等[11]在饲喂鲤氧化鱼油的阶段性实验中发现56d后鲤肌肉出现水肿,肌纤维肿胀变粗, 84d后肌纤维坏死、溶解, 严重时肌纤维消失并且被增生的结缔组织取代。因此, 在本实验中草鱼没有观察到明显的病变症状可能是因为养殖时间较短。有研究认为氧化油脂对动物生产性能的影响可能是由于油脂氧化产物使肌肉蛋白质交联造成的(Chio和Tappel[12], Chiba等[13])。而结合本试验结果, F组CF值与S组没有显著差异,M1、M2、M3组肥满度则显著低于S组, 本实验认为上述油脂氧化产物可能是MDA。
上述结果表明, MDA主要是通过降低草鱼对脂肪及蛋白质的利用率而降低其生长性能的, 并且高MDA含量是降低草鱼脂肪沉积率的主要原因。对于MDA引起草鱼瘦背病的可能性, 有待进一步研究。
3.2 MDA对草鱼肝胰脏结构和功能的影响
MDA增加草鱼发生脂肪性肝炎的机率 一般认为MDA是通过直接攻击蛋白质的氨基和巯基,导致蛋白质结构的变化和功能的缺失, 从而对机体造成损伤[14]。而在本试验中, 添加MDA后, 各组草鱼肝胰脏HSI先上升后下降, 在M1组出现最大值,这说明在少量MDA情况下, 肝胰脏会出现代偿性增生以缓解MDA的毒性, 但当MDA含量过高后, 肝胰脏抗氧化能力受到抑制并出现萎缩; 各组草鱼肝胰脏脂肪含量显著上升, 说明肝胰脏脂肪代谢功能受到干扰; 血清中HDL/LDL 显著下降, 说明从外周组织转运到肝胰脏的胆固醇的量下降, 这与血清中TC含量上升结果相一致; 血清中TC、TG、HDL和LDL含量的上升, 说明草鱼草鱼血脂含量整体上升。
上述结果表明, 添加MDA会导致草鱼血清和肝胰脏中脂肪含量显著上升, 因此, MDA会引起草鱼发生脂肪肝的可能。
结合肝胰脏组织切片(图版Ⅰ-A-E)可以发现:S、F、M1组草鱼肝胰脏细胞排列整齐、大小均一、细胞核形态明显, 且基本都居于细胞中间位置; M2组部分肝胰脏区域肝胰脏细胞细胞核缺失(如图中箭头所示), 这与表 7中M2组草鱼肝胰脏细胞核与细胞个数比值显著下降结果相一致; M3组肝胰脏细胞结构发生显著变化, 细胞膜有明显的纤维化趋势, 肝胰脏细胞出现坏死, 细胞核与细胞个数比值进一步减少。这与任泽林等[15]用氧化鱼油饲喂鲤后发现鲤肝胰脏细胞损伤的结果相似, 说明可能MDA是油脂氧化产物中能引起肝胰脏细胞纤维化的有效成分之一。
通过肝胰脏透射电镜结果(图版Ⅰ-F-J)可以发现: S组草鱼肝胰脏细胞线粒体形态正常, 内部结构清晰完整; M1组草鱼肝胰脏细胞线粒体形态正常,但部分嵴形态发生改变(如图中箭头所示); M2组草鱼肝胰脏细胞线粒体形态正常, 嵴形态较为模糊;M3组草鱼肝胰脏细胞线粒体形态正常, 内部结构混乱, 嵴数量明显减少。此结果与用MDA作用小鼠海马神经元后发现的MDA虽然会降低线粒体细胞膜的流动性, 但其并不会直接改变线粒体形态的结果相似[16]。而F组草鱼肝胰脏细胞线粒体则是形态发生明显改变, 但内部结构清晰完整。
这说明MDA对线粒体的影响以损伤其内部结构为主, 而油脂其他氧化产物则是损伤线粒体膜结构为主。
现有研究表明, MDA可能会首先通过抑制线粒体膜上钙离子ATPase的活性, 使线粒体膜电位去极化, 降低膜流动性并破坏线粒体内外物质交换的动态平衡[17]。其次通过抑制丙酮酸脱氢酶、α-酮戊二酸脱氢酶等活性, 损伤线粒体的呼吸功能[18]。其后导致线粒体功能紊乱, 内部ROS生成量大量增加, 最终损伤线粒体[19]。
上述结果表明, MDA会增加草鱼肝胰脏发生脂肪肝的机率。且当MDA含量较低时, 草鱼肝胰脏脂肪代谢即会受到干扰, 但肝胰脏会代偿性增生以增强其抵御MDA的能力。随着MDA含量的上升, 草鱼肝胰脏受到实质性损伤, 出现肝胰脏细胞数量下降, 肝胰脏细胞线粒体功能受损, 严重可导致肝胰脏发生纤维化萎缩。
MDA引起草鱼氧化应激并损伤肝胰脏Tocher等[20]在用含有氧化鱼油和维生素E的饲料饲喂金头鲷(Sparus aurata)、大菱鲆(Scophthalmus maximus)及比目鱼(Hippoglossus hippoglossus)后发现, 氧化油脂会显著引起金头鲷和大菱鲆肝脏的氧化应激, 并且在添加维生素E后氧化应激程度得到缓和, 然而氧化鱼油和维生素E都没有对比目鱼的肝脏造成预期的影响。因此他认为, 关于氧化鱼油是否会引起水产动物肝胰脏的氧化应激取决于物种本身。但对于MDA这一单一物质是否会引起水产动物肝胰脏氧化应激尚无相关报导。
Mourente等[2 1]在用氧化油脂饲喂金头鲷(Sparus aurata)后认为, 油脂氧化产物在肝胰脏CAT、SOD等抗氧化酶的作用下, 其在肝胰脏中的含量并不会上升。这与本试验中F组较S组, 其血清中MDA含量显著上升, 但肝胰脏中MDA含量没有显著差异这一结果相一致。但相比较S组, 添加MDA组草鱼血清及肝胰脏MDA含量均出现上升,说明肝胰脏中SOD等抗氧化酶无法有效清除单一的MDA物质。
ALB只能由肝胰脏合成, GLB则是机体主要血清免疫球蛋白, 两者比值通常用来反映肝脏的病理损伤程度[22]。本实验中在饲料中添加MDA后草鱼血清A/G值显著下降, 说明MDA有引起草鱼肝胰脏发生炎症的可能, 而F组与S组没有显著差异, 说明油脂氧化产物中MDA较其他物质更容易对肝胰脏造成损伤。
ALT作为反映肝脏健康的标志之一, 当肝脏受到损伤且细胞通透性增加时, 血清中ALT含量便会显著上升[23]。本试验中, 饲料添加MDA后草鱼血清ALT含量显著上升, 而F组血清ALT含量没有显著变化, 说明油脂氧化产物对肝胰脏细胞细胞膜的损伤及细胞膜通透性的增加主要是由MDA造成的。
上述结果表明, 肝胰脏中抗氧化酶可以有效清除少量油脂氧化产物。而单一的MDA尤其是高浓度的MDA则可在肝胰脏中累积, 从而引起草鱼鱼体氧化应激并损伤肝胰脏, 导致肝胰脏细胞细胞膜通透性增加。
3.3 MDA对草鱼肠道结构和功能的影响
MDA对草鱼肠道结构的影响 本试验结果表明, 饲料添加MDA后各组草鱼肠道及血清MDA含量均显著增加。而相比添加鱼油组, 肠道MDA含量相比S组没有显著差异, 但其血清MDA含量显著增加。Du等[24]用不同脂肪源饲喂草鱼后发现, 血清中MDA含量与饲料中不饱和脂肪酸含量有明显的相关性, 血清MDA会随着饲料多不饱和脂肪酸含量的上升而上升。Gray等[25]也发现脂肪酸的不稳定性与其不饱和程度有几何相关性。Stephan等[26]证实, 饲料中高鱼油含量会增加大菱鲆体内脂肪酸的过氧化程度, 导致过氧化物含量的上升, 多不饱和脂肪酸含量的下降。
上述结果表明, F组中血清MDA含量的显著上升主要是由于F组以鱼油作为脂肪源所引起的。
姚仕彬等[27]在草鱼肠道黏膜细胞培养液中加入MDA后发现, MDA对原代草鱼肠道黏膜细胞的生长产生了抑制作用, 同时会改变细胞形态、损伤细胞内部结构如线粒体, 并且其作用程度与MDA浓度和作用时间呈正相关关系。并且他还认为, MDA对草鱼细胞抗氧化系统有重大影响,MDA损伤细胞膜结构完整性的作用点可能在于细胞膜结构, 作用途径可能是促进细胞膜脂质过氧化,最终导致细胞的凋亡。
本试验肠道切片结果显示, M1、M2及F组中草鱼肠道绒毛中央乳糜管出现扩增。中央乳糜管作为动物肠道的内外物质交换的重要通道之一, 其发生扩张的原因之一便是动物体受到损伤后中央乳糜管代偿性扩增以增强肠道绒毛的吸收能力[28, 29]。M3组中肠道的单层柱状上皮细胞出现增生, 这与肠道杯状细胞数量增加相一致。
上述结果表明, 少量的MDA与鱼油其他氧化产物均会导致肠道绒毛中央乳糜管代偿性扩增, 而大剂量的MDA会使肠道绒毛单层柱状上皮细胞变成假复层柱状上皮细胞。
光学显微镜观察肠道黏膜单层柱状上皮细胞后发现, 添加MDA后各组草鱼肠黏膜杯状细胞数量会随着MDA含量的增加而显著增加, F组相比S组显著增加但显著小于M1组。杯状细胞是一种可以分泌糖蛋白的细胞, 其分泌的黏蛋白能够润滑肠道, 进而保护肠上皮黏膜[30]。并且它所产生的三叶状蛋白能在肠上皮黏膜受损时与细胞因子和生长因子发生协同作用, 加快上皮细胞的愈合[31]。因此, 本试验中草鱼肠道杯状细胞的增多表明草鱼肠道黏膜可能受到了一定程度的损伤。
上述结果表明, 鱼油氧化产物均会导致草鱼肠道柱状细胞增加, 但其中主要有效成分可能是MDA。
肠道扫描电镜结果显示, M3组草鱼肠道微绒毛高度显著低于其余各组, S组虽低于M1、M2组,但差异没有显著性, F组显著大于S组, 但与M1、M2组没有显著差异。这说明低剂量的MDA或鱼油其他氧化产物均会使草鱼肠道微绒毛代偿性增长以吸收更多营养物质来修复机体损伤, 此情况与人类短肠综合症病人残余肠道的代偿、适应过程[32]的原理相似。且上述结果与切片中中央乳糜管的扩增结果相一致。而当MDA含量超出草鱼耐受范围后, 微绒毛受到实质性损伤而出现萎缩。
MDA导致草鱼肠道通透性增加, 并可能对其他器官组织造成损伤 肠道通透性增加可以有2个通路: 一是细胞内部通路, 即由于肠上皮细胞微绒毛、肠腔方面细胞膜受损, 导致肠道内部内毒素等物质经由上皮细胞→基底层→毛细血管的通路进入血液循环; 二是细胞间通路, 即由于上皮细胞间紧密连接结构的破坏, 导致内毒素等经过上皮细胞间隙通路进入血液系统[33, 34]。
本试验肠道透射电镜结果显示, MDA和鱼油其他氧化产物均可导致草鱼肠道紧密连接结构受到损伤。紧密连接常见于肠道单层柱状上皮, 位于相邻细胞间隙的顶端的侧面[35], 其一般具有渗透性调节[36]和维持细胞极性[37]这两个功能。紧密连接在细菌及其毒素或炎症细胞因子等外界因素的影响下, 其功能会下降[38], 最终导致组织浮肿和损伤[39], 并增加肠道的通透性。
D-乳酸是肠道内部固有细菌的代谢终产物, 动物体内一般不具有能将其快速代谢的酶, 因而血中D-乳酸含量常用来反应肠道通透性[40]的正常与否。内毒素是G-菌细胞璧的脂多糖部分, 高含量的内毒素可以引起肠黏膜水肿并引起缺血, 还可导致肠绒毛顶端细胞的坏死, 增加肠道的通透性[41], 并且还可引起机体体内谷氨酰胺代谢紊乱, 进而影响肠道黏膜的修复[42]。体内内毒素含量的上升还能增强细菌易位和定植的能力, 同时大量需氧菌的聚集和繁殖又能产生高浓度的内毒素[43], 因此如果高浓度的内毒素通过血液循环进入其他组织, 也会对其造成损伤。在本试验中, MDA和鱼油其他氧化产物均可显著增加草鱼血清中D-乳酸和内毒素的含量, 这与透射电镜中紧密连接结构被破坏的结果相一致。
李莉等[44]在给小鼠腹腔注射MDA后发现,MDA的代谢途径是由血液流向肝胰脏, 再由肝胰脏流向机体其他组织。因此当肠道通透性增加使得内毒素、MDA等有害物质大量进入草鱼血液循环时, 机体其他组织中有害物质的含量增加的机率上升, 其被损伤的可能性也增大。
上述结果表明, F、M1、M2组草鱼肠道通透性增加可能只是中央乳糜管的扩张和紧密连接的受损, 其肠道黏膜并没有受损, 而M3组中其中央乳糜管并没有扩张, 因此M3组的肠道黏膜可能受到损伤加上紧密连接的严重受损, 进而导致有害物质大量进入血液循环。
3.4 MDA对草鱼“肠-肝轴”的影响
鱼体生理性的“肠-肝轴”中, 胆汁酸的“肠-肝循环”是其重要物质基础之一[45]。肝胰脏和肠道组织都具有以乙酰辅酶A为原料合成胆固醇的能力。而肝胰脏以胆固醇为原料合成初级胆汁酸, 初级胆汁酸进入肠道后在细菌等物质的作用下转变为次级胆汁酸, 次级胆汁酸最终在肠道后段被重新吸收回到肝胰脏的过程就是典型的胆汁酸“肝-肠循环”通路[46]。
本试验结果显示, MDA会显著降低血清和肠道TBA含量, 而对肝胰脏TBA含量没有显著影响;MDA会导致草鱼血清、肝胰脏和肠道TC含量上升。这说明MDA可能并不会损伤草鱼肝胰脏合成胆汁酸的能力, 其主要是通过影响肠道来降低肠道胆汁酸的含量, 以此来破坏草鱼体内正常的胆汁酸“肠-肝轴”。草鱼血清、肝胰脏和肠道整体胆固醇含量的上升也说明了草鱼可能因体内胆汁酸的不足而增加其对胆固醇的需求。而MDA减少草鱼肠道胆汁酸含量的途径可能是降低胆汁酸回收效率,使其大部分随粪便排出体外; 也有可能是MDA本身或MDA促使肠道内部某种物质大量消耗胆汁酸;也有可能两者同时发生。
上述结果表明, MDA对草鱼体内胆汁酸“肠-肝循环”的影响主要是MDA对肠道的影响从而减少了肠道胆汁酸的含量, 进而使重吸收回血清中的胆汁酸含量也减少, 其具体机理有待进步一研究。
胆汁酸是以胆固醇为原料在肝脏中合成的一种重要物质, 其对胆固醇代谢的调控、及胆汁胆固醇的溶解[47]。胆汁酸的“肠-肝轴”是调节胆汁酸合成速率的重要调节机制[48], 以防止具有毒性的疏水性胆汁酸在肝胰脏内大量聚积而损伤肝胰脏。胆汁酸的“肠-肝循环”过程中任何一个环节发生障碍,都会导致胆汁酸在肝细胞和肝内胆管内淤积, 从而发生肝胰脏增大、黄疸等疾病[49]。
肠道中胆汁酸的作用主要包括[50]: 乳化脂肪并增强脂肪酶活性, 从而增加脂肪在肠道中的消化吸收; 提高肠道免疫力, 减少肠道对内毒素的吸收, 防止食糜在肠道的堵塞; 有效抑制大肠杆菌、链球菌等有害菌群的增殖, 还能防止食物在肠道的腐烂和发酵, 并能预防气胀和腹肿胀等疾病。因此, 肠道胆汁酸的缺乏会显著影响草鱼肠道的健康。
综上所述, 胆汁酸的“肠-肝循环”是维系肠道和肝胰脏健康的重要途径。而以胆汁酸的“肠-肝循环”的基础, 我们推测MDA对草鱼肠道、肝胰脏损伤的先后顺序可能是: MDA减少草鱼肠道胆汁酸含量, 使肠道功能紊乱, 细菌大量滋生、内毒素含量上升, 最终导致肠道通透性受损, 从而使大量肠道内有毒有害物质经血液循环到达肝胰脏, 在超出肝胰脏耐受范围后对肝胰脏造成实质损伤。
4 结论
本试验初步揭示了饲料MDA对草鱼生长性能、肝胰脏及肠道健康的影响, 并比较MDA及鱼油其他氧化产物对草鱼损伤方式的区同, 得到结论如下:
(1)饲料中MDA会引起草鱼鱼体应激, 并通过降低草鱼蛋白质沉积率和脂肪沉积率来降低草鱼生长性能, 且初步比较MDA与油脂其他氧化产物的毒副作用后发现, MDA是导致草鱼脂肪沉积率下降的主要因素。对鱼体瘦背病的影响及其作用机制等问题仍待进一步研究解答。
(2)MDA可引起肝胰脏氧化应激, 并通过损伤线粒体功能, 降低肝胰脏抗氧化能力, 导致肝纤维化机率增加, 并增加肝胰脏发生脂肪性肝炎机率。油脂其他氧化产物在肝胰脏抗氧化酶的作用下, 其在肝胰脏中含量并不会增加, 而对于单一MDA物质, 其可在肝胰脏中堆积。并且MDA对草鱼肝胰脏线粒体的影响主要集中在对其内部结构的改变,而油脂其他氧化产物则是主要影响线粒体的形态。
(3)MDA和鱼油其他氧化产物均会破坏肠道紧密连接结构, 从而破坏草鱼的机械屏障功能, 使肠道通透性显著增加, 血清中有毒物质含量增加, 并可能会影响机体其他组织。
(4)MDA会通过降低从草鱼肠道回收会血清中的胆汁酸的含量来阻碍草鱼体内正常的胆汁酸“肝-肠循环”, 但并不会直接损伤肝胰脏的胆汁酸合成能力。关于MDA如何减少肠道胆汁酸含量的问题有待进一步研究。
[1]Chen K Q, Ye Y T, Cai C F, et al. Effects of dietary oxidizes fish oil on growth and muscle fatty acid composition of grass carp (Ctenopharyngodon idellus) [J]. Chinese Journal of Animal Nutrition, 2015, 27(6):1698—1708 [陈科全, 叶元土, 蔡春芳, 等. 饲料中氧化鱼油对草鱼生长及肌肉脂肪酸组成的影响. 动物营养学报, 2015, 27(6): 1698—1708]
[2]Huang Y W, Ye Y T, Cai C F, et al. The damage of intestinal mucosa barrier structure and the effect of cholesterol and bile acid synthesis pathway in the liver and intestine under MDA in grass carp (Ctenopharyngodon idella) [J]. Acta Hydrobiologica Sinica, 2016, 40(4):869—878 [黄雨薇, 叶元土, 蔡春芳, 等. MDA对草鱼肠道黏膜结构屏障损伤和肝胰脏、肠道胆固醇、胆汁酸合成影响. 水生生物学报, 2016, 40(4): 869—878]
[3]Benzie I F F. Lipid peroxidation: a review of causes, consequences, measurement and dietary influences [J]. International Journal of Food Sciences and Nutrition, 1996,47(3): 233—261
[4]Lin Y H, Zhang J J, Chen W W. Protective effect of sodium ferulate on damage of the rat liver mitochondria induced by oxygen free radicals [J]. Acta Pharmaceutica Sinica, 1993, 29(3): 171—175
[5]Hellberg K, Grimsrud P A, Kruse A C, et al. X-ray crystallographic analysis of adipocyte fatty acid binding protein (aP2) modified with 4-hydroxy-2-nonenal [J]. Protein Science, 2010, 19(8): 1480—1489
[6]Cai J G, Tang H, Tang H, et al. Signaling mechanisms of calcium homeostasis disruption induced by malondialdehyde in primary culture rat hippocampal neurons [J]. Acta Laboratorium Animalis Scientia Sinica, 2013, 21(1):32—37 [蔡建光, 汤华, 唐晖, 等. 丙二醛破坏大鼠海马神经元胞质钙离子稳态的信号机制. 中国实验动物学报, 2013, 21(1): 32—37]
[7]Cheng J. The protective effect and mechanism of Malondialdehyde on primary cultured rat cortical neurons and the ability of learning and memory [D]. Huazhong University of Science and Technology. 2010 [程瑾. 丙二醛对大鼠原代培养皮层神经元和学习记忆能力的损伤作用及其机制. 华中科技大学. 2010]
[8]Jiang T. Comprehensive prevention and control three disease of grass carp [J]. Chongqin Fisheries, 2005, 73(4):31—32 [江涛. 草鱼“三病”的综合防治. 重庆水产, 2005,73(4): 31—32]
[9]Ren Z L, Huo Q G, Zeng H, et al. Effect of oxidized fish oil on the performance and muscular histological structure of carps [J]. Chinese Journal of Animal Nutrition,2001, 13(1): 59—64 [任泽林, 霍启光, 曾虹, 等. 氧化鱼油对鲤鱼生产性能和肌肉组织结构的影响. 动物营养学报, 2001, 13(1): 59—64]
[10]Murai T, Andrews J W. Interactions of dietary α-tocopherol, oxidized menhaden oil and ethoxyquin on channel catfish (Ictalurus punctatus) [J]. The Journal of Nutrition, 1974, 104(11): 1416—1431
[11]Ye S G, Wang K Y, He X R. Pathological changes in common carp Cyprinus carpio fed oxidized fish oil [J]. Journal of Dalian Fisheries University, 2006, 21(1): 1—6[叶仕根, 汪开毓, 何显荣. 鲤摄食含氧化鱼油的饲料后其病理学的变化. 大连海洋大学学报, 2006, 21(1):1—6]
[12]Chio K S, Tappel A L. Synthesis and characterization of the fluorescent products derived from malonaldehyde and amino acids [J]. Biochemistry, 1969, 8(7): 2821—2827
[13]Chiba H, Doi H, Yoshikawa M, et al. Deterioration of casein components by malonaldehyde [J]. Agricultural and Biological Chemistry, 1976, 40(5): 1001—1010
[14]Li Y, Yang M S, Liu W F, et al. Effects of malondialdehyde on the osteogenic differentiation of mouse bone marrow-derived mesenchymal stem cells [J]. Life Science Research, 2012, 16(6): 496—500 [李烨, 杨沐思, 刘文锋,等. 丙二醛对小鼠骨髓间充质干细胞成骨分化的影响.生命科学研究, 2012, 16(6): 496—500]
[15]Ren Z L, Zeng H. Effect of oxidized fish oil on the antioxidative function and histological structure of carp hepatopancreas [J]. Journal of Dalian Fisheries University,2000, 15(4): 235—243 [任泽林, 曾虹. 氧化鱼油对鲤肝胰脏抗氧化机能及其组织结构的影响. 大连海洋大学学报, 2000, 15(4): 235—243]
[16]Cai J G, Tang H, Tang H, et al. The effects of malondialdehyde on the cellular structures of hippocampal neurons and its calcium homeostasis in SD rats [J]. Life Science Research, 2011, 15(4): 283—289 [蔡建光, 汤华, 唐晖,等. 丙二醛对大鼠海马神经元结构的破坏和钙离子稳态的影响. 生命科学研究, 2011, 15(4): 283—289]
[17]Cai J G, Tang H, Tang H, et al. Signaling mechanisms of calcium homeostasis disruption induced by malondialdehyde in primary cultures rat hippocampal neurons [J].Acta Laboratorium Animalis Scientia Sinica, 2013, 21(1):32—37 [蔡建光, 汤华, 唐晖, 等. 丙二醛破坏大鼠海马神经元胞质钙离子稳态的信号机制. 中国实验动物学报, 2013, 21(1): 32—37]
[18]Long J G, Wang X M, Gao H X, et al. Malonbaldehyde inhibits respiratory function and enzyme activities in isolated rat liver mitochondria [J]. Academic Journal of Second Military Medical University, 2005, 26(10):1131—1135 [龙建纲, 王学敏, 高宏翔, 等. 丙二醛对大鼠肝线粒体呼吸功能及相关脱氢酶活性影响. 第二军医大学学报, 2005, 26(10): 1131—1135]
[19]Willis M S, Klassen L W, Tuma D J, et al. Malondialdehyde-acetaldehyde-haptenated protein induces cell death by induction of necrosis and apoptosis in immune cells [J]. International Immunopharmacology, 2002, 2(4):519—535
[20]Tocher D R, Mourente G, Van der Eecken A, et al. Comparative study of antioxidant defence mechanisms in marine fish fed variable levels of oxidised oil and vitamin E [J]. Aquaculture International, 2003, 11(1—2): 195—216
[21]Mourente G, Dıaz-Salvago E, Bell J G, et al. Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L.) fed dietary oxidised oil: attenuation by dietary vitamin E [J]. Aquaculture, 2002, 214(1): 343—361
[22]Xie Q L, Wang G S, Liu M H. The correlation between serum markers of liver fibrosis and Alb, Glb, Alb/Glb in chronic hepatitis [J]. Modern Medicine & Health, 2005,21(13): 1638—1639 [谢秋里, 王功遂, 刘梅华. 白蛋白、球蛋白、白/球比值与肝组织病理的关系. 现代医药卫生, 2005, 21(13): 1638—1639]
[23]Peng W F, Zhong Z Y. Significance of combined detection of ADA and ALT, ASt, GGT in the diagnosis of liver diseases [J]. Contemporary Medicine, 2011, 17(9):4—6 [彭文锋, 钟政永. ADA 与ALT, AST, GGT 联合检测在肝脏疾病诊断中的意义. 当代医学, 2011, 17(9):4—6]
[24]Du Z Y, Clouet P, Huang L M, et al. Utilization of different dietary lipid sources at high level in herbivorous grass carp (Ctenopharyngodon idella): mechanism related to hepatic fatty acid oxidation [J]. Aquaculture Nutrition, 2008, 14(1): 77—92
[25]Gray J I. Measurement of lipid oxidation: a review [J]. Journal of the American Oil Chemists’ Society, 1978,55(6): 539—546
[26]Stéphan G, Guillaume J, Lamour F. Lipid peroxidation in turbot (Scophthalmus maximus) tissue: effect of dietary vitamin E and dietary n- 6 or n- 3 polyunsaturated fatty acids [J]. Aquaculture, 1995, 130(2): 251—268
[27]Yao Y B, Ye Y T, Cai C F, et al. Damage of MDA on intestinal epithelial cells in vitro of grass carp (Ctenopharyngodon idellus) [J]. Acta Hydrobiologica Sinica, 2015,39(1): 133—141 [姚仕彬, 叶元土, 蔡春芳, 等. 丙二醛对离体草鱼肠道黏膜细胞的损伤作用. 水生生物学报,2015, 39(1): 133—141]
[28]Rong X Z, Zhang T, Yang R H, et al. Morphological changes in intestinal villi after severe burns in rats [J]. Chinese Journal of Burns, 2005, 21(6): 459—461 [荣新洲, 张涛, 杨荣华, 等. 大鼠严重烧伤后肠绒毛的改变.中华烧伤杂志, 2005, 21(6): 459—461]
[29]Shi G Z, Wang B H. Histochemical study on the change in lymphatic motion and nitric oxide synthase in the early phase of acute rat endotoxemia [J]. Chinese Jouranl of Pathophysiology, 2001, 17(3): 223—225 [史桂芝, 王宝恒. 急性内毒素血症早期大鼠淋巴管运动变化及其一氧化氮合酶组织学研究. 中国病理生理杂志, 2001,17(3): 223—225]
[30]Huerta B, Arenas A, Carrasco L, et al. Comparison of diagnostic techniques for porcine proliferative enteropathy (Lawsonia intracellularis infection) [J]. Journal of Comparative Pathology, 2003, 129(2): 179—185
[31]Wattanaphansak S, Asawakarn T, Gebhart C J, et al. Development and validation of an enzyme-linked immunosorbent assay for the diagnosis of porcine proliferative enteropathy [J]. Journal of Veterinary Diagnostic Investigation, 2008, 20(2): 170—177
[32]Wu G H. Short bowel syndrome patients residual intestinal compensatory [J]. Chinese Journal of Practical Surgery, 2006, 25(11): 655—657 [吴国豪. 短肠综合征病人残余肠道的代偿. 中国实用外科杂志, 2006, 25(11):655—657]
[33]Sigalet D L, Kenteman N M, Fedorak R N, et al. Intestinal function following allogeneic small intestinal transplantation in the rat [J]. Transplantation, 1992, 53(2):264—271
[34]Wu Z W. Intestinal barrier and the intestinal microflora [J]. Chinese Critical Care Medicin, 2005, 16(12):768—770 [吴仲文. 肠道屏障与肠道微生态. 中国危重病急救医学, 2005, 16(12): 768—770]
[35]Wolburg H, Lippoldt A. Tight junctions of the bloodbrain barrier: development, composition and regulation [J]. Vascular Pharmacology, 2002, 38(6): 323—337
[36]Bernacki J, Dobrowolska A, Nierwiñska K, et al. Physiology and pharmacological role of the blood-brain barrier [J]. Pharmacological Reports, 2008, 60(5):600—622
[37]Ueno M. Molecular anatomy of the brain endothelial barrier: an overview of the distributional features [J]. Current Medicinal Chemistry, 2007, 14(11): 1199—1206
[38]Gao Z G, Qin H L. The biological functions of intestinal epithelial tight junctions and its role in intestinal barrier [J]. Parenteral & Enteral Nutrition, 2005, 12(5):299—302 [高志光, 秦环龙. 肠上皮细胞紧密连接的生物学功能及在肠屏障中的作用. 肠外与肠内营养, 2005,12(5): 299—302]
[39]Förster C. Tight junctions and the modulation of barrier function in disease [J]. Histochemistry and Cell Biology,2008, 130(1): 55—70
[40]Smith S M, Eng R H K, Buccini F. Use of D-lactic acid measurements in the diagnosis of bacterial infections [J]. Journal of Infectious Diseases, 1986, 154(4): 658—664
[41]Berg R D, Garlington A W. Translocation of certain indigenous bacteria from the gastrointestinal tract to the mesenteric lymph nodes and other organs in a gnotobioticmouse model [J]. Infection and Immunity, 1979, 23(2):403—411
[42]Shi G, Chen J Y, Xu P Y. The injury and the protection of intestinal barrier [J]. Parenteral & Enteral Nutrition,2004, 11(1): 61—63 [石刚, 陈嘉勇, 徐鹏远. 肠道黏膜屏障的损伤与保护. 肠外与肠内营养, 2004, 11(1):61—63]
[43]Bauer T M, Schwacha H, Steinbrückner B, et al. Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxemia [J]. The American Journal of Gastroenterology, 2002, 97(9): 2364—2370
[44]Li L, Chen Q Q, Li F X, et al. Toxic effects of oxidative stress product malondialdehyde (MDA) on mice physical stamina and metabolism in vivo [J]. Journal of Natural Science of Human Normal University, 2006, 29(2):97—101 [李莉, 陈菁菁, 李方序, 等. 氧应激毒性产物丙二醛(MDA)对小鼠体能的影响及其体内代谢. 湖南师范大学自然科学学报, 2006, 29(2): 97—101]
[45]Cortes V A, Busso D, Mardones P, et al. Advances in the physiological and pathological implications of cholesterol [J]. Biological Reviews, 2013, 88(4): 825—843
[46]Kullak-ublick G A, Stieger B, Meier P J. Enterohepatic bile salt transporters in normal physiology and liver disease [J]. Gastroenterology, 2004, 126(1): 322—342
[47]Davis M. Cholestasis and endogenous opioids [J]. Clinical Pharmacokinetics, 2007, 46(10): 825—850
[48]Anwer M S. Cellular regulation of hepatic bile acid transport in health and cholestasis [J]. Hepatology, 2004,39(3): 581—590
[49]Nakajima T, Okuda Y, Chisaki K, et al. Bile acids increase intracellular Ca2+concentration and nitric oxide production in vascular endothelial cells [J]. British Journal of Pharmacology, 2000, 130(7): 1457—1467
[50]Zeng D, Li L, Wang Q C, et al. Research of bile acid function in animal nutrition [J]. Guangdong Feed, 2002,11(3): 34—35 [曾端, 李力, 王群初, 等. 胆汁酸在动物营养研究中的应用. 广东饲料, 2002, 11(3): 34—35]
EFFECTS OF MDA ON THE GROWTH PERFORMANCE, STRUCTURE AND FUNCTION OF HEPATOPANCREAS AND INTESTINE OF GRASS CARP (CTENOPHARYNGODON IDELLUS)
CHEN Ke-Quan1, YE Yuan-Tu1, CAI Chun-Fang1, WU Ping1, HUANG Yu-Wei1, WU Tao1, LIN Xiu-Xiu1,LUO Qi-Gang1, ZHANG Bao-Tong2, XIAO Pei-Zhen1, 2and ZHOU Ya-Qin1
(1. Key Laboratory of Aquatic Animal Nutrition In Jiangsu Province, Preclinical Medicine and Biological Science College of Soochow University, Suzhou 215123, China; 2. Laboratory of Aquatic Animal Nutrition Research System, Beijing Institute of Nutrition, Beijing 100000, China)
The study investigated effects of MDA on the growth performance, structure and function of hepatopancreas and intestine of grass carp (Ctenopharyngodon idellus) and evaluated effects between MDA and other products of oxidized fish oil. Five isonitrogenous and isoenergetic diets were prepared with soybean oil, fish oil and different level of MDA for a 72-day experiment. The results indicated that MDA and other products of oxidized fish oil both significantly increased the FCR of grass carp and decreased the SGR and PRR of grass carp (P<0.05). Only MDA significantly decreased the LRR (P<0.05). Moreover, MDA and other products of oxidized fish oil both significantly decreased the TBA content in serum (P<0.05), and increased the content of TC, TG and MDA and the activity of SOD in serum (P<0.05). Only MDA significantly increased ALT content and decreased the radio between HDL and LDL in serum (P<0.05). MDA and other products of oxidized fish oil both significantly increased the lipid content of hepatopancreas (P<0.05) and stimulated the oxidative stress of hepatopancreas. MDA damaged the morphology in hepatopancreas cell and significantly decreased the number of nucleus of hepatopancreas cell (P<0.05), which lead to the obviously trend of fibrosis of the hepatopancreas cell. MDA and other products of oxidized fish oil both significantly increased the number of goblet cells in the microvilli (P<0.05). To the permeability, serum D-lactic acid and endotoxin significantly increased because of the defect of the tight junction, the hyperplasia and edema of villi. In conclusion,MDA decrease the growth performance of grass carp by regulating the oxidative stress and lipid metabolism. MDA and other products of oxidized fish oil affect the hepatopancreas with different mechanism. Both MDA and other products of oxidized fish oil can mediate the function of intestine.
Sreum; Fat Metabolism; Bile Acid; Morphology; Tight Junction

图版Ⅰ MDA对草鱼肝胰脏形态、结构的影响Fig.Ⅰ Effect of MDA on morphology and structure of grass carp hepatopancreas

图版Ⅱ 饲料MDA对草鱼中肠形态、结构的影响Fig. Ⅱ Effect of MDA on morphology and structure of Gross carp midgut
S963.73
A
1000-3207(2016)04-0779-14
10.7541/2016.102
2015-05-18;
2015-12-14
国家自然科学基金项目(31172417); 苏州市应用基础研究项目(SYN201316)资助 [Supported by the National Natural Science Foundation of China (31172417); Applied Basic Research Programs of Suzhou City (SYN201316)]
陈科全(1990—), 男, 浙江诸暨人; 硕士研究生; 主要从事水产动物营养与饲料研究。E-mail: 326088246@qq.com
叶元土, 教授, 硕士生导师。E-mail: yeyt@suda.edu.cn, Tel/Fax:+86-0512-65880179

