氧化鱼油对草鱼肠道黏膜抗氧化应激通路基因表达水平的影响
叶元土蔡春芳许 凡林秀秀黄雨薇董娇娇张宝彤萧培珍
(1. 苏州大学基础医学与生物科学学院, 江苏省水产动物营养重点试验室, 苏州 215123;2. 北京营养源研究所水产动物系统营养研究开放试验室, 北京 100000)
氧化鱼油对草鱼肠道黏膜抗氧化应激通路基因表达水平的影响
叶元土1蔡春芳1许 凡1林秀秀1黄雨薇1董娇娇1张宝彤2萧培珍2
(1. 苏州大学基础医学与生物科学学院, 江苏省水产动物营养重点试验室, 苏州 215123;2. 北京营养源研究所水产动物系统营养研究开放试验室, 北京 100000)
为了探讨氧化鱼油对草鱼肠道黏膜损伤后, 参与抗氧化应激的基因通路及其通路基因表达活性的变化,以草鱼为试验对象, 灌喂氧化鱼油7d后, 采集肠道黏膜组织并提取总RNA, 采用RNA-seq方法, 进行了氧化鱼油组和正常鱼油组草鱼肠道黏膜基因注释、IPA基因通路分析和基因表达活性差异分析。结果显示, 组织切片观察发现氧化鱼油导致草鱼肠道黏膜出现严重的损伤; 肠道黏膜中具有较为完整的“Keap1-Nrf2-ARE”基因调控通路。肠道黏膜在受到氧化鱼油的氧化损伤作用后, 激活了细胞的抗氧化损伤保护机制, 使NRF2介导的氧化应激反应通路基因差异表达显著性地上调, 并导致了下游的GSH/GSTs通路基因差异表达显著性上调, 促进了GSH的生物合成和GSTs的抗氧化作用; 导致“Keap1-Nrf2-ARE”信号通路下游的热休克蛋白和泛素-蛋白酶体通路基因差异表达显著性上调, 清除受损伤蛋白质, 保护细胞结构完整性。研究表明, 上述三类抗氧化应激通路构成了对肠道黏膜损伤细胞、损伤蛋白质的降解系统和清除系统, 显示其对肠道黏膜组织和黏膜细胞的保护、修复发挥了重要的作用。
草鱼; 肠道黏膜; 氧化鱼油; RNA-seq; Nrf2; GSH/GSTs; 泛素-蛋白酶体
油脂如鱼油、豆油等是水产饲料中的主要能量物质之一[1], 而油脂中不饱和脂肪酸容易氧化酸败, 其氧化产物如过氧化物、丙二醛等对养殖鱼类如大西洋鲑(Salmo salar)[2]、草鱼(Ctenopharyngodon idellus)[3]等的器官组织、鱼体健康具有显著的损伤作用, 其中损伤较大的器官组织为肠道黏膜[1, 4]。我们也分别研究了氧化豆油水溶物、丙二醛对草鱼肠道离体黏膜细胞生长和结构的影响, 均显示出直接性的氧化损伤作用[5, 6]。鱼体自身具备抗氧化损伤系统如谷胱甘肽/谷胱甘肽转移酶系统, 体内也含有抗氧化物质如维生素E[4], 以便清除有毒有害物质等, 保护细胞和组织免受进一步的损伤打击作用[4, 7]。灌喂氧化鱼油可以在短期内对鱼体肠道黏膜造成急性损伤, 利用急性损伤的肠道组织提取总RNA并采用RNA-seq方法完成核酸序列分析、基因注释, 并进行转录水平的基因表达差异分析、代谢途径基因表达通路分析, 可以从基因表达层面,更为宏观地了解氧化鱼油对肠道黏膜组织整体性的损伤用、黏膜细胞对损伤的应答。本实验室已经进行了灌喂氧化鱼油后草鱼肠道黏膜胆固醇、胆汁酸代谢通路基因差异表达的分析, 结果表明灌喂氧化鱼油导致草鱼肠道黏膜组织胆固醇、胆汁酸合成通路基因差异表达整体上调, 显示出胆固醇、胆汁酸合成在应对氧化鱼油损伤方面具有重要的作用[8]。本文主要分析了灌喂氧化鱼油对草鱼肠道黏膜组织抗氧化应激通路基因的差异表达, 包括Keap1-Nrf2-ARE通路、GSH/GSTs系统、热休克蛋白和泛素-蛋白酶体系统基因的差异表达结果,对于了解肠道黏膜组织抗氧化损伤作用机制、对黏膜组织和细胞的保护机制具有重要意义。
1 材料与方法
1.1 氧化鱼油
以鳀和带鱼为原料提取、经过精炼的精制鱼油, 购自中国福建高龙实业有限公司。按照姚仕彬等[9]方法制备氧化鱼油, 于-80℃冰箱中保存备用。
采用常规方法测定鱼油和氧化鱼油的氧化指标, 碘价(IV)分别为(67.19±3.32)和(61.99±4.03) g/ kg、酸价分别为(AV)(0.51±0.04)和(3.64±0.23) mg KOH/g、过氧化值(POV)分别为(10.86±1.26)和(111.27±2.85) meq/kg、丙二醛(MDA)分别为(7.50±1.600)和(72.20±10.0) μmol/mL。鱼油经过14d的氧化后, IV下降了7.74%, 而AV、POV、MDA分别增加了613.73%、924.59%和862.67%, 表明鱼油已经被深度氧化。
1.2 草鱼及其氧化鱼油灌喂方法
试验草鱼来自于江苏常州养殖池塘, 用常规草鱼饲料在室内循环养殖系统中养殖20d后, 选择平均体重(108.4±6.2) g草鱼42尾, 分别饲养于单体容积0.3 m3的6个养殖桶中, 每个养殖桶饲养7尾试验草鱼。设置鱼油组和氧化鱼油组、每组各3个平行。灌喂期间水温(23±1)℃、溶解氧6.4 mg/L、pH7.2。
将鱼油、氧化鱼油分别与大豆磷脂(食品级)以质量比4∶1的比例混匀、搅拌乳化, 作为灌喂用的鱼油、氧化鱼油, 于4℃冰箱中保存备用。选取内径2.0 mm的医用软管(长度5 cm)安装在5 mL一次性注射器上, 作为灌喂工具。灌喂试验开始前鱼体停食24h, 将草鱼用湿毛巾包住身体, 按照试验鱼体体重的1%分别吸取乳化后的鱼油、氧化鱼油, 待鱼嘴张开时, 将灌喂软管送入口中, 感觉到管口通过咽喉进入食道时, 通过注射器注入鱼油或氧化鱼油。注射完毕后, 保持注射姿势15—20s, 之后快速退出注射软管, 将草鱼放入养殖桶中。于每天上午9: 00对试验鱼定量灌喂, 下午投喂草鱼饲料1次, 连续灌喂7d。
1.3 肠道黏膜肠道组织切片
在第7天灌喂后24h, 常规解剖取出肠道, 清除肠道外脂肪组织, 在肠道全长的1/2处, 按照组织学切片要求切出1 cm长的肠管, 生理盐溶液清洗肠道。用苦杏仁酸固定肠道组织, 用冰冻切片机对肠道进行切片, 切片厚度5 μm。苏木精-伊红染红后,显微镜观察肠道组织形态, 并照相。
1.4 肠道黏膜
在第7天灌喂后24h, 分别在氧化鱼油组、鱼油组的3个平行养殖桶中各取3尾、每组各9尾试验草鱼, 常规解剖、分离内脏团, 将肠道剖开, 浸于预冷PBS中漂洗2次, 之后转入另一个预冷培养皿中, 培养皿置于冰盘上, 用手压住前肠端、用解剖刀从前向后一次刮取得到黏膜, 装入1.5 mL离心管中, 液氮速冻, 保存于-80℃备用。每尾鱼肠道黏膜独立分装、保存。
1.5 RNA提取
每尾试验草鱼肠道黏膜独立用于提取总RNA。氧化鱼油组、正常鱼油组各9个肠道黏膜样品, 按照总RNA提取试剂盒(NewBioIndustry)操作进行。RNA提取后经过电泳检测RNA质量, 在3个平行桶各取1尾、共3尾鱼RNA质量好的样本(电泳条带亮度高、清晰、无拖尾)进行等量混合为1个样本, 同样方法再混合一个样本, 其余的舍弃。鱼油组、氧化鱼油组分别得到2个(n=2)平行样本、共4个混合RNA样本, 分别用于RNA-seq。混合后的RNA提取液轻轻吹打充分混匀后, 加入到专用的RNA保存管, 真空干燥, 一般60 µL干燥6—7h, 80 µL干燥9—10h。干燥样品用于总RNA测序。
1.6 RNA鉴定、文库构建、Illumina测序和基因注释
采用RNA纳米生物分析芯片和量子比特套件(RNA Nano Bioanalysis chip and Qubit Kit)测定(仪器为Agilent 2100)氧化鱼油组和正常鱼油组RNA完整性和浓度, RNA完整性RIN (RNA Integrity Number)值分别为9.10和8.70; RNA浓度分别为190和121 ng/μL。
分别取等量(约2.5 μg)的氧化鱼油组和正常鱼油组草鱼肠道黏膜RNA, 采用Illumina公司TruSeq 的RNA试剂盒制备cDNA文库, PCR循环15次。利用Illumina的HiSeq2000进行文库的聚类和序列分析, 配对末端(PE)的读段为50 bp。原始测序读段中除去接头序列、序列质量分数小于20、读长序列小于30的短读段后用于基因的从头组装。基因的从头组装使用Brujin图形方式进行装配(CLC Bioversion5.5)。转录组的注释和基因定位是利用UniProtKB/ SwissPro和NCBI进行基因top hits (E-value为1e-6)的BLAST检索。基因的注释采用 UniProtKB/ SwissProt数据库(Blast2GO version 2.5.1)进行。
鱼油和氧化鱼油组分别合并2个平行RNA样本的试验数据, 依据RNA-seq分析结果和基因表达分析结果做差异表达分析和IPA (Ingenuity Pathways Analysis)基因通路分析, 在CLC Genomics Work bench (version5.5)进行基因的差异表达分析, 映射参数分别设置为95%, P<0.05。以正常组草鱼结果为对照, 灌喂氧化鱼油组基因具有显著差异表达的界定条件为fold绝对值大于2、读段数大于10。fold绝对值越大表明差异表达越显著, 其绝对值大于3可视为具有显著性的差异。依据P值和具有显著差异表达基因数占通路基因总数的比例确认基因通路。
2 结果
2.1 肠道组织切片观察结果
灌喂鱼油和氧化鱼油7d后, 草鱼肠道组织学切片观察结果见图 1。鱼油组肠道绒毛顶端(→指示点)完整, 绒毛边缘清晰。氧化鱼油组肠道绒毛顶端已经破裂、黏膜脱落。从绒毛的顶端开始向肠道壁基部的黏膜出现梯次性的破裂、脱落。结果显示,氧化鱼油对草鱼肠道黏膜造成了严重的结构性损伤, 这种损伤作用是从绒毛顶端开始的, 造成绒毛顶端损伤最为严重。
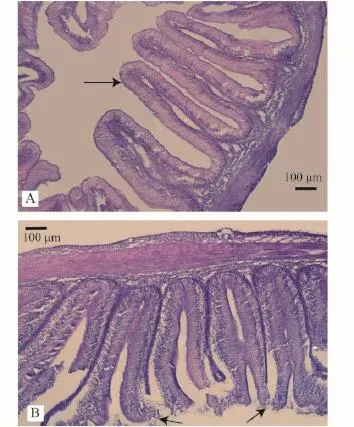
图 1 氧化鱼油导致草鱼肠道黏膜组织损伤Fig. 1 Experimental grass carp intestinal tissue
2.2 Keap1-Nrf2-ARE 通路基因差异表达
依据基因注释结果, 结合Keap1-Nrf2-ARE 通路基因组成, 得到该通路的19个差异表达显著的基因信息, 被注释的基因序列与斑马鱼、草鱼等物种同类基因的相似度在68.6%—97.1%。由表 1可知,草鱼在灌喂氧化鱼油后, Keap1-Nrf2-ARE通路上游基因在肠道黏膜中KEAP1 (fold为2.87)和Nrf2b (fold为2.26)都差异表达上调, 显示出对下游抗氧化基因通路具有差异表达上调的可能性。
由该通路调控的下游多种抗氧化基因和II相解毒酶基因的转录结果也显示差异表达, 只是不同的基因差异表达程度不同。通过IPA (Ingenuity Pathways Analysis)基因通路分析, 其通路基因差异表达“-log (p-value)”为5.39, 具有显著性差异; 组成通路的不同基因差异表达结果显示, Nrf2介导的氧化应激反应通路中有10个基因(基因全名见表 1)HO1、MGST1、USP14、ABCC2、DNAJA4、GCLC、SQSTM1、DNAJB1、ABCC4、GSTω1差异表达的fold值>3, 差异表达显著性上调, 仅有AOX1差异表达显著下调(fold值<-3)。
属于II相解毒酶基因的NAD (P) H醌氧化还原酶1 (NQO1)(fold为-1.20)差异表达下调, 过氧化氢酶(fold为-1.37)差异表达下调, 而3种超氧化物歧化酶(SOD1 的fold为2.33、SOD2的fold为1.54、SOD3的fold为1.12)则差异表达上调; 溶菌酶(fold为-2.41)差异表达下调。
上述结果显示, 在灌喂氧化鱼油的急性刺激下,肠道黏膜细胞自我保护机制被激活, 产生显著的基因表达应答, 主要表现为Keap1-Nrf2-ARE抗氧化应激通路基因显著性地差异表达, 其中, 清除氧化损伤物质如过氧化物基因表达上调、清除受到损伤的细胞组分如蛋白质等通路的下游基因差异表达显著上调, 而细胞质中II相解毒酶基因差异表达下调。这是典型的抗氧化应激生理反应, 也表明氧化鱼油对草鱼肠道黏膜的损伤为氧化性损伤。
2.3 蛋白质泛素化通路
通过IPA (Ingenuity Pathways Analysis)基因通路分析, 显示蛋白质泛素化通路基因差异表达, 其通路基因差异表达的“-log (p-value)”为10.4, 其中有19个基因的fold值>3.0或<-3.0, 达到显著性水平(表2)。该通路基因主要有PSMβ7、PSMα6b、USP14、PSMβ5、PSMC4、PSMb3、PSMc1、PSMd1、PSMc5、PSMb6、PSMc2、UBE2V2、USP14、UCHL1、HSP10、HSP90αA1、PSMd6、PSMα5、DNAJB1共19个基因(基因全名见表 2)的fold值>3, 差异表达显著性地上调; 仅有PSMβ9的fold值<-3.0, 为差异表达显著性地下调。上述基因序列与斑马鱼等物种相同基因的相似度为84.7%—99.1%。
上述结果显示, 灌喂氧化鱼油后, 草鱼肠道黏膜组织中的蛋白质发生改变, 被热休克蛋白(如HSP90αA1)、泛素标记(如泛素结合蛋白P62), 再激活蛋白酶系统(如26S蛋白酶体)并被分解, 以清除受到损伤的蛋白质, 保护细胞的正常结构和功能。这也是黏膜细胞自我保护、对抗氧化鱼油损伤的应答。

表 1 草鱼肠道黏膜Keap1-Nrf2-ARE和NRF2介导的氧化应激反通路基因Tab. 1 Keap1-Nrf2-ARE and NRF2-mediated oxidative stress response pathway genes in the intestinal mucosal of grass carp (Ctenopharyngodon idella)
2.4 谷胱甘肽/谷胱甘肽转移酶通路
通过IPA (Ingenuity Pathways Analysis)基因通路分析, 显示谷胱甘肽/谷胱甘肽转移酶(GSH/GSTS)基因差异表达, 其通路基因差异表达的“-log (pvalue)”为5.53, 达到显著差异水平。其中, 控制谷胱甘肽生物合成的G6PD、GCLC、GCLM、GGT1、GSS、GSR、GST、GSTω1、GSTα、GSTpi、GSTθ1b、MGSt1、PGD、GPX1a共14个基因的fold值>3.0, 差异表达显著性上调, 其基因序列与斑马鱼、草鱼、鲢等物种相同基因序列的相似度为76.9%—96.4%(表 3)。
上述结果表明, 草鱼灌喂氧化鱼油后, 肠道黏膜中的谷胱甘肽/谷胱甘肽转移酶系统的蛋白和酶基因的表达增强, 以便及时清除氧化损伤物质, 保护细胞的正常结构和功能。
3 讨论
本试验是以正常鱼油为对照, 在灌喂氧化鱼油7d后, 采用RNA-seq方法[10, 11], 即利用草鱼肠道黏膜组织的总RNA逆转录为cDNA后, 通过核酸序列分析、基因拼接、基因注释而获得转录组基因信息,并与灌喂正常鱼油肠道黏膜的结果对比进行差异表达分析, 得到灌喂氧化鱼油试验组肠道黏膜基因的差异表达结果。首先, 能够被注释的基因都是已经转录为RNA的基因, 即得到转录表达的基因; 其次, 得到的差异表达结果就是与正常鱼油组对比的差异结果, 当fold绝对值>2时具有较显著性的差异表达, 当≥3时达到显著差异水平, 如果fold值为正值表示是差异表达上调, 负值则为差异表达下调。
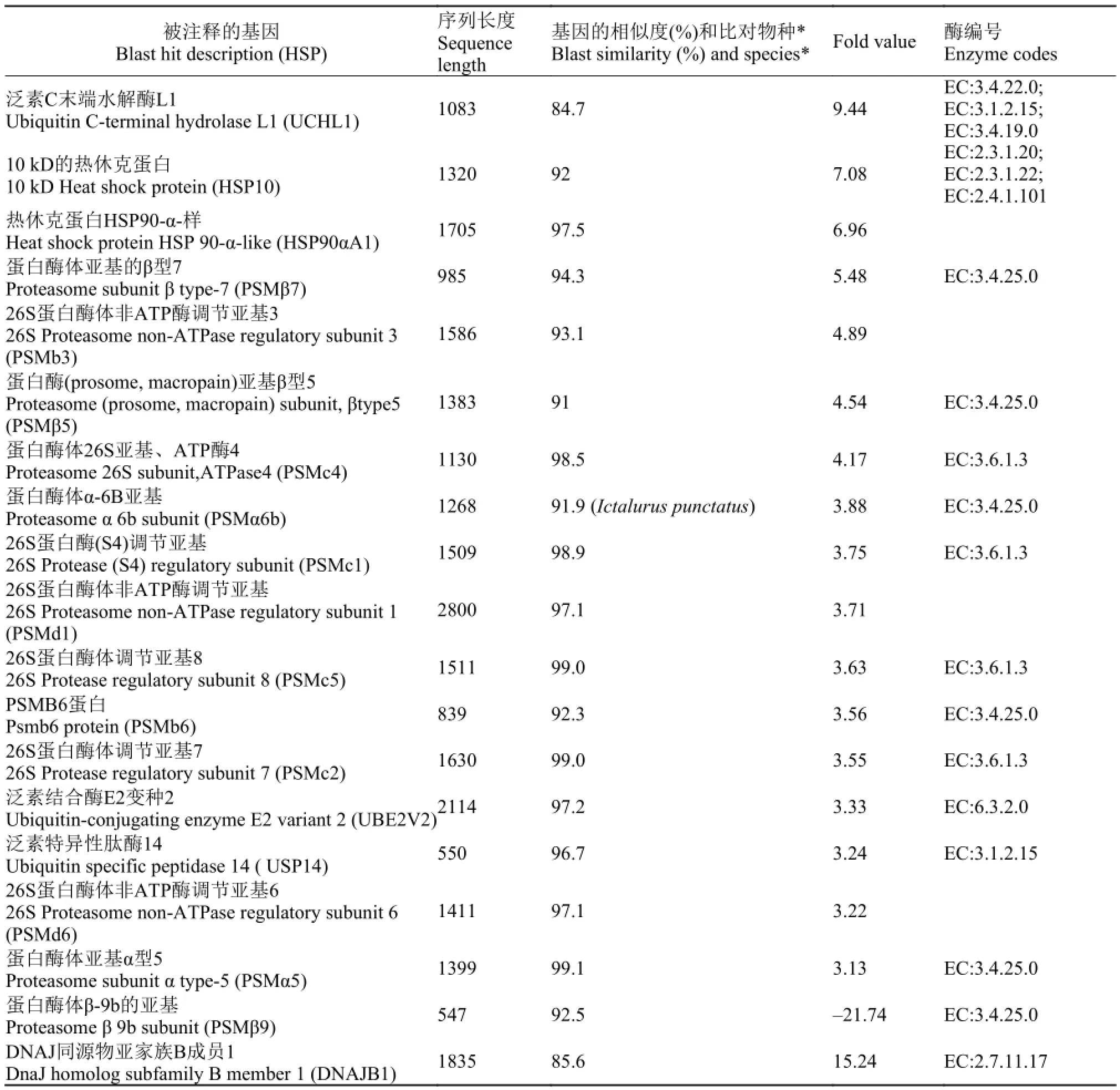
表 2 草鱼肠道黏膜蛋白质泛素化通路基因Tab. 2 Protein ubiquitination pathways in the intestinal mucosal of grass carp (Ctenopharyngodon idella)
3.1 灌喂氧化鱼油导致草鱼肠道黏膜抗氧化应激基因差异表达上调
鱼油氧化的产物包括过氧化物、游离脂肪酸、丙二醛等物质, 对动物具有普遍的毒副作用[1, 2, 5]。Keap1-Nrf2-ARE通路是细胞内的抗氧化应激代谢通路[12—14], 其主要生理作用是及时清除来自于外界的、或细胞内产生的氧化损伤物质如氧自由基、过氧化物等, 是细胞内的广泛性抗氧化代谢途径,保护多种细胞和组织免收氧化损伤, 维持机体氧化-抗氧化的生理平衡。
Keap1-Nrf2-ARE通路的反应基本过程为, 在正常生理条件下,Nrf2在细胞质中与Keap1 结合, 形成Nrf2-Keap1复合体, 并处于非活性状态; 在受到细胞内、外界自由基或化学物质刺激时, Keap1 的构象改变、或者Nrf2磷酸化被激活,导致Nrf2 与Keap1解离[12, 13], Nrf2处于活化状态; 活化的Nrf2由细胞质进入细胞核, 与抗氧化反应元件(ARE)结合,启动下游的Ⅱ相解毒酶、抗氧化蛋白、蛋白酶体/分子伴侣(热休克蛋白泛素化系统)、GSH/GST系统等基因的转录和表达, 以抵抗内外界的有害刺激[12—14], 成为细胞内的抗氧化机制, 保护多种细胞和组织, 维持机体氧化-抗氧化的生理平衡。ARE是一个特异的DNA启动子结合序列,是II相解毒酶和细胞保护蛋白基因表达的上游调节区,Nrf2是这一序列的激活因子[13, 14]。
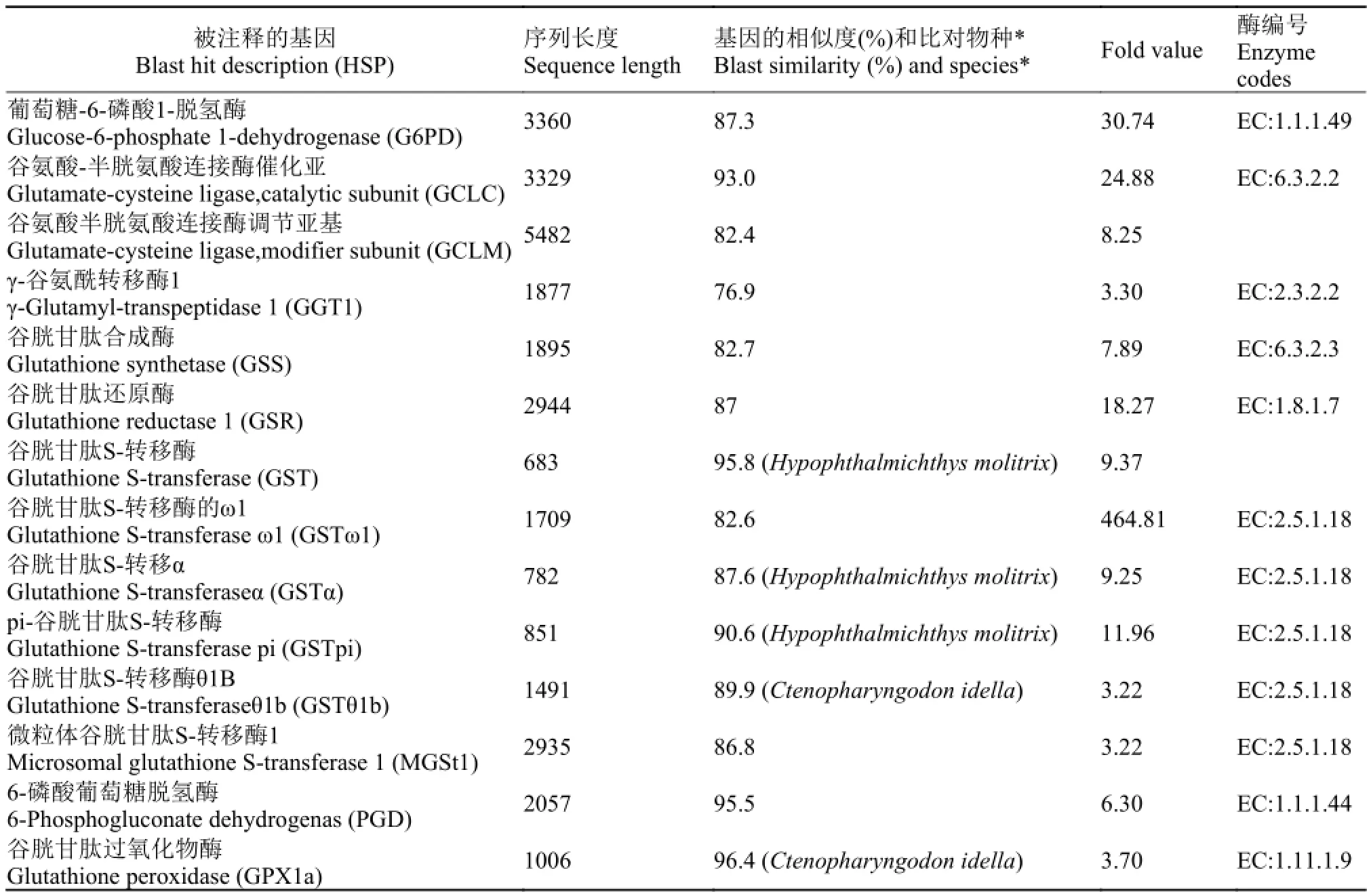
表 3 草鱼肠道黏膜谷胱甘肽/谷胱甘肽转移酶通路基因Tab. 3 GSH/GSTSMetabolism pathways in the intestinal mucosal of grass carp (Ctenopharyngodon idella)
在本试验中, 作为NRF2诱导的抗氧化应激通路的主要组成部分, DNAJA4、DNAJB1与底物蛋白质结合防止其聚合[13, 14]。USP14则通过对Ubiquitination 链的修剪防治基质的降解。多药耐药相关蛋白ABCC4 (MRP4)、ABCC2 (MRP2)是重要的跨膜转运解毒体系; 血红素氧化合酶(HO-1)是血红素降解的限速酶, HO1及其酶解产物直接影响抗氧化损伤能力的变化, 是机体最重要的内源性保护体系之一。MGST1、GCLC、GSTω1作为II相代谢过程主要物质[15], 清除细胞内的有毒物质和氧化物质, 避免对DNA及生物功能蛋白的破坏, 以维持机体内环境的稳定。这些基因差异表达均显著上调, 表明草鱼肠道受到氧化鱼油急性损伤后, 使这些基因的表达增强, 肠道黏膜细胞产生了强烈的抗氧化应激反应, 以便清除鱼油氧化产物, 尤其是受到鱼油氧化产物损伤而导致死亡或凋亡的肠道黏膜细胞碎片、损伤蛋白质等, 并参与修复细胞的损伤、保护其他细胞免受损伤, 是一种典型的抗氧化损伤与修复、保护生理机制。
依赖NAD (P) H醌氧化还原酶1是降解醌、醌亚胺、氮氧化合物的酶[15], 其基因差异表达下调,溶菌酶基因差异表达下调, 以及依赖过氧化氢酶清除过氧自由基的基因差异表达下调, 而三种超氧化物酶SOD1、SOD2和SOD3清除过氧化物的基因均差异表达上调。这些结果显示, 氧化鱼油对草鱼肠道黏膜的损伤不是产生过氧化氢、醌类有毒物质损伤作用类型, 从前面的分析结果看, 属于自由基为主的氧化损伤、蛋白质直接性损伤的氧化损伤类型。
试验表明, 在灌喂氧化鱼油后, 作为“Keap1-Nrf2-ARE”信号调控的下游靶向通路, 谷胱甘肽/谷胱甘肽转移酶(GSH/GSTs)代谢通路基因、热休克蛋白和蛋白质泛素化通路基因显著性上调, 这些结果同时也表明: “Keap1-Nrf2-ARE”信号通路在转录水平参与了肠道黏膜细胞对氧化鱼油损伤的应激反应, 表明在草鱼肠道中存在Keap1-Nrf2-ARE通路所需要的主要基因, 并且在氧化鱼油损伤下被激活。灌喂氧化鱼油对草鱼肠道的损伤作用是以氧化损伤、对细胞蛋白质损伤为主要损伤类型。草鱼肠道在受到氧化损伤后, 激活了多个抗氧化应激基因通路以应对氧化性损伤和对蛋白质的损伤作用, 使NRF2介导的氧化应激反应信号通路、GSH/GSTs系统、热休克蛋白和蛋白质泛素化通路基因等差异表达显著性上调, 以便清除氧化损伤物质、修复氧化损伤细胞, 对黏膜组织、细胞进行损伤修复和保护。
3.2 灌喂氧化鱼油使草鱼肠道黏膜谷胱甘肽/谷胱甘肽转移酶代谢通路基因差异表达上调
GSH/GSTs是动物重要的解毒、抗氧化系统[15]。在本试验中, 涉及到GSH的合成系列酶、转移解毒系列酶或蛋白质的基因, 构成了一个完整的GSH/ GSTs功能系统, 以谷氨酸、半胱氨酸为原料的谷胱甘肽合成途径和谷胱甘肽转移酶通路示意图见图 2所示。GSH/GSTs系统的基因差异表达显著,且均是显著上调, 成为氧化鱼油对肠道黏膜损伤后被激活的主要抗氧化损伤应激作用系统之一。

图 2 GSH/GSTs通路示意图(黑体斜体为催化反应的酶缩写)Fig. 2 GSH/GSTs pathway (Italics is abbreviation of the enzyme)
谷氨酸-半胱氨酸合成酶(GCL)是GSH生物合成的限速酶[16], 由催化亚基(GCLC)和调节亚基(GCLM)组成, 其活性影响着GSH 合成的速度, 如果GCL 的活性增高, 则可使GSH 合成加速, 从而提高细胞内外GSH 浓度。GSR保持了GSH处于还原状态。本试验中, 它们都差异表达显著性上调, 表明灌喂氧化鱼油激活了GSH 合成速度。
GSH作为体内重要的抗氧化剂和自由基清除剂, 一方面, GSH可直接单独作用于许多自由基(如烷自由基、过氧自由基、半醌自由基等), 另一方面, 作为谷胱甘肽过氧化物酶的底物, 发挥清除细胞内过氧化物的作用[15, 16]。GSH能够把机体内有害的物质转化为无害的物质, 排泄出体外, 减少氧化应激对脂质、DNA及蛋白质造成损伤, 因此GSH通常被认为是机体抗氧化能力的一个重要指标。本试验中, GSH生物合成途径控制反应的酶的基因均达到显著性的差异表达上调, GSH生物合成量增加是细胞防御氧化应激损伤、加强自我保护的重要途径之一。表明草鱼肠道在受到氧化鱼油急性损伤后, 显著性地刺激了肠道黏膜细胞GSH生物合成的强度, 合成了大量的GSH以用于抗氧化应激的需要。
谷胱甘肽转移酶(GSTs)有多个亚类, 如GST、GSTω1、GSTα、GSTpi、GSTθ1b、MGSt1等[15, 16]。在本试验中, 这些亚类谷胱甘肽转移酶的基因均达到差异表达显著性的上调。GSTs 的主要功能是催化内源性或外来有害物质的亲电子基团与还原型谷胱甘肽的巯基(-SH)结合, 形成更易溶解的、没有毒性的衍生物。例如, GSTω1是细胞内降解生物异源物质的一类酶, 能够催化还原型谷胱甘肽上的硫原子亲核攻击底物上的亲电子基团,降低细胞内有毒物质水平。此外, GSTS 还可以结合一些亲脂性化合物, 甚至还作为过氧化酶和异构酶发挥作用。
上述结果显示, 在灌喂氧化鱼油后, 草鱼肠道黏膜中的GSH/GSTs被激活, 通过清除自由基、过氧化合物等抗氧化应激作用, 实现对肠道黏膜进行保护。这个结果也显示, 氧化鱼油对草鱼肠道黏膜的损伤类型为氧化性损伤作用。
3.3 灌喂氧化鱼油使草鱼肠道黏膜热休克蛋白-蛋白质泛素化通路基因差异表达上调
饲料油脂、或动物体内脂质(如细胞膜磷脂)氧化后可能产生丙二醛, 而丙二醛则通过其醛基(-CHO)与蛋白质肽链中赖氨酸、精氨酸的ε-NH2发生交联反应, 形成丙二醛-肽链复合体[17], 导致这类蛋白质变性、失去原有的生理功能, 形成对细胞蛋白质的损伤作用。在动物体内, 泛素-蛋白酶体途径是细胞内较普遍的一种非依赖溶酶体的内源蛋白降解方式, 主要是对损伤蛋白进行识别、标记和酶解, 是细胞的一种保护机制。
当细胞蛋白质损伤后, 细胞内的保护机制将被激活, 如激活热休克蛋白表达并对损伤蛋白质进行标记、或将损伤的蛋白质进行泛素化标记, 之后通过蛋白酶体对标记的蛋白质进行降解。这里需要有2个主要过程, 首先是要将细胞不再需要的蛋白质、或者受到损伤的蛋白质进行识别并进行标记,包括热休克蛋白和蛋白质泛素化来完成这类工作。热休克蛋白主要有Hsp90、Hsp70、Hsp27等[18], 主要作用是提高泛素-蛋白酶体系统的活性, 对错误的、损伤的蛋白质进行识别和泛素化标记, 而泛素连接酶也可以直接对错误的、损伤的蛋白质进行识别和泛素化标记[19, 20]。之后, 依赖蛋白酶体的作用对标记的蛋白质进行降解, 所产生的氨基酸再被利用。蛋白酶体的主要作用是降解细胞不需要的或受到损伤的蛋白质, 这一作用是通过断裂肽键的化学反应来实现。这种包括泛素化和蛋白酶体降解的整个系统被称为“泛素-蛋白酶体系统”[19, 20]。
在本试验中, 依据通路分析方法, 泛素-蛋白酶体通路的-log (p-value)为10.4, 差异显著。有19个基因进入该通路。作为对错误或损伤蛋白质的识别, 并完成泛素化标记、包括对泛素化调控的生理反应, 以热休克蛋白识别和标记为主的HSP10 (fold为7.08)、HSP90αA1 (fold为6.96)二种热休克蛋白得到显著性的差异表达上调; 以泛素化识别、标记的UBE2V2 (fold为3.33)、USP14 (fold为3.24)、DNAJB1 (fold为15.24)也是差异表达显著性的上调。关于被识别、标记的损伤蛋白质的酶解反应过程中, PSMb3 (fold为4.89)、PSMβ7 (fold为5.48)、PSMβ5 (fold为4.54)、PSMc4 (fold为4.17)、PSMα6b (fold为3.88)、PSMc1 (fold为3.75)、PSMd1 (fold为3.71)、PSMc5 (fold为3.63)、PSMb6 (fold为3.56)、PSMc2 (fold为3.55)、PSMd6 (fold为3.22)、PSMα5 (fold为3.13)、UCHL1 (fold为9.44)等蛋白质或酶, 是26S蛋白酶体的主要构件物质, 其主要作用是完成对识别、标记蛋白质的完全降解过程。在草鱼肠道黏膜被氧化鱼油损伤后, 均得到差异表达显著性的上调。
上述结果表明, 草鱼肠道黏膜在受到氧化鱼油的严重氧化损伤后, 产生的大量的损伤细胞或损伤蛋白质, 激活了肠道黏膜细胞中热休克蛋白和泛素-蛋白酶体系统, 并得到差异表达显著性的上调, 以便清除这些损伤或错误的蛋白质, 保护肠道黏膜组织和细胞。
4 结论
在鱼油氧化后, 可产生自由基、过氧化物、丙二醛等产物, 对动物具有毒副作用。对草鱼灌喂氧化鱼油后, 肠道黏膜组织受到显著损伤, 对肠道黏膜进行转录组分析结果发现, 草鱼肠道黏膜组织中存在着完整的“Keap1-Nrf2-ARE”基因调控通路, 并激活了其下游通路-GSH/GSTs通路基因差异表达显著性上调, 促进了GSH的生物合成和GSTs的抗氧化作用; 同时, 也激活了“Keap1-Nrf2-ARE”通路下游的泛素-蛋白酶体通路基因差异表达及显著性上调, 对损伤的细胞蛋白质经热休克蛋白和泛素标记后被26S蛋白酶体水解, 及时清除受损伤的蛋白质。这些结果也表明, Keap1-Nrf2-ARE信号通路在转录水平显著地参与了对对氧化鱼油导致的肠道黏膜病理损伤的应答。依据参与氧化鱼油损伤应答的主要蛋白(酶)基因的差异表达结果, 表明氧化鱼油诱导的草鱼肠道黏膜损伤作用类型为以自由基、过氧化物、丙二醛等造成的损伤为主的氧化损伤和蛋白质损伤是主要损伤类型; 而以激活溶酶体的蛋白降解机制、以清除过氧化氢或醌类有毒物质损伤的解毒作用机制表现不显著。
[1]Ye Y T, Cai C F. Fish Nutrition and Feed Formulation [M]. Beijing: Chemistry and Chemical Press. 2013,33—104 [叶元土, 蔡春芳. 鱼类营养与饲料配制. 北京:化学化工出版社. 2013, 33—104]
[2]Kristin H, Kjersti K, Kjartan S, et al. Feed intake and absorption of lipid oxidation products in Atlantic salmon (Salmo salar) fed diets coated with oxidised fish oil [J]. Fish Physiology and Biochemistry, 2001, 25(3):209—219
[3]Du Z Y, Clouet P, Huang L M. Utilization of different dietary lipid sources at high level in herbivorous grass carp (Ctenopharyngodon idella): mechanism related to hepatic fatty acid oxidation [J]. Aquaculture Nutrition, 2008,14(1): 77—92
[4]Tocher D R, Mourente G, Van D E, et al. Comparative study of antioxidant defence mechanisms in marine fish fed variable levels of oxidised oil and vitamin E [J]. Aquaculture International, 2003, 11(1): 195—216
[5]Yao S B, Ye Y T, Cai C F, et al. The water soluble matter from oxidized soybean oil damages dissociated intestinal epithelial cells of grass carp (Ctenopharyngodon idella) [J]. Acta Hydrobiologica Sinica, 2014, 38(4):690—699 [姚仕彬, 叶元土, 蔡春芳, 等. 氧化豆油水溶物对离体草鱼肠道黏膜细胞的损伤作用. 水生生物学报, 2014, 38(4):690—699]
[6]Yao S B, Ye Y T, Cai C F, et al. Damage of MDA on intestinal epithelial cellls in vitro of grass carp (Ctenopharyngodon idella) [J]. Acta Hydrobiologica Sinica, 2015,39(1): 133—141 [姚仕彬, 叶元土, 蔡春芳, 等. 丙二醛对离体草鱼肠道黏膜细胞的损伤作用. 水生生物学报,2015, 39(1): 133—141]
[7]Poomima K, Cariappa M, Asha K, et al. Oxidant and antioxidant status in vegetarins and fish eaters [J]. Indian Journal of Clinical Biochemistry, 2003, 18(2): 197—205
[8]Ye Y T, Cai Ch F, Xu F, et al. Feeding grass carp (Ctenopharyngodon idella) with oxidized fish oil up-regulates the gene expression in the Cholesterol and bile acid synthesis pathway in intestinal mucosa [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 90—100 [叶元土, 蔡春芳, 许凡, 等. 灌喂氧化鱼油使草鱼肠道黏膜胆固醇胆汁酸合成基因通路表达上调. 水生生物学报, 2015, 39(1):90—100]
[9]Yao S B, Ye Y T, Li J, et al. Changes of the oxidation indicators and fatty acid composition in the fish oil oxidation process [J]. Feed Research, 2012, (6): 74—76 [姚仕彬, 叶元土, 李洁, 等. 鱼油在氧化过程中氧化指标及其脂肪酸组成的变化. 饲料研究, 2012, (6): 74—76]
[10]Wang X, Wang X W, Wang L K, et al. A review on the processing and analysis of next-generation RNA-seq data [J]. Progress in Biochemistry and Biophysics, 2010,37(8): 834—846 [王曦, 汪小俄, 王立坤, 等. 新一代高通量RNA测序数据的处理与分析. 生物化学与生物物理进展, 2010, 37(8): 834—846]
[11]Qi Y X, Liu Y B, Rong W H. RNA-Seq and its applications: a new technology for transcriptomics [J]. Hereditas (Beijing), 2011, 33(11): 1191—1202 [祁云霞, 刘永斌,荣威恒. 转录组研究新技术: RNA-Seq 及其应用. 遗传,2011, 33(11): 1191—1202]
[12]Taguchi K, Motohashi H, Yamamoto M. Molecular mechanisms of the Keap1-Nrf2 pathway in stress response and cancer evolution [J]. Genes to Cells, 2011,16(2): 123—140
[13]Cui W, Ma H Y, Kong L. Research progress on Nrf2/ARE pathway and mechanism of antioxidation [J]. Journal of Jilin University (Medicine Edition), 2011,37(1): 187—190 [崔俣, 马海英, 孔力. Nrf2/ARE通路与机体抗氧化机制的研究进展. 吉林大学学报(医学版),2011, 37(1): 187—190]
[14]Cai W X, Zhang J, Hu D H. Defensive pathway of Nrf2/ARE involved in oxidative and chemical stress [J]. Chinese Journal of Biochemistry and Molecular Biology, 2009, 5(4): 297—303 [蔡维霞, 张军, 胡大海. 氧化和化学应激的防御性转导通路-Nrf2/ARE. 中国生物化学与分子生物学报, 2009, 5(4): 297—303]
[15]Armstrong R N. structure, catalytic mechanism, and evolution of the glutathione transferases [J]. Chemical Research in Toxicology, 1997, 10(1): 2—18
[16]Liao W Q, Liang X F, Wang L, et al. Molecular cloning and characterization of alpha-class glutathione S-transferase gene from the liver of silver carp, bighead carp,and other major Chinese freshwater fishes [J]. Journal of Biochemical and Molecular Toxicology, 2006, 20(3):114—126
[17]Slatter D A, Avery N C, Bailey A J. Identification of a new cross-link and unique histidine adduct from bovine serum albumin incubated with malondialdehyde [J]. Journal of Biological Chemistry, 2004, 279(1): 61—69
[18]Roberts R J, Agius C, Saliba C, et al. Heat shock proteins (chaperones) in fish and shellfish and their potential role in relation to fish health: a review [J]. Journal of Fish Diseases, 2010, (33): 789—801
[19]Yang Y L. The ubiquitylation system : targeting proteins for degradation and beyond [J]. Chinese Bulletin of Life Sciences, 2002, 14(5): 279—282 [杨义力. 蛋白质泛素化系统.生命科学, 2002, 14(5): 279—282]
[20]Yi X G, Zhao P. Components and functions of Ubiquitinproteasome pathway [J]. Progress in Physiological Sciences, 2006, 37(3): 255—258 [倪晓光, 赵平. 泛素-蛋白酶体途径的组成和功能.生理科学进展, 2006, 37(3):255—258]
EFFECTS OF OXIDIZED FISH OIL ON OXIDATIVE STRESS PATHWAYS OF INTESTINAL MUCOSA OF GRASS CARP (CTENOPHARYNGODON IDELLUS)
YE Yuan-Tu1, CAI Chun-Fang1, XU Fan1, LIN Xiu-Xiu1, HUANG Yu-Wei1,DONG Jiao-Jiao1, ZHANG Bao-Tong2and XIAO Pei-Zhen2
(1. Key Laboratory of Aquatic Animal Nutrition, School of Basic Medicine and Biological Science, Soochow University, Suzhou 215123, China; 2. Open Lab for Aquatic Animal Nutrition, Beijing Research Institute for Nutritional, Beijing 100000, China)
To evaluate effects of the oxidized fish oil on the antioxidative stress pathways of intestine, grass carp Ctenopharyngodon idellus were fed oxidized fish oil and normal fish oil for 7d before collecting intestinal mucosa for histology and RNA-seq. The gene differential expression, the gene annotation and IPA gene pathway were analyzed. Severe damage was observed in the intestine of grass carp by oxidized fish oil. The RAN-seq results indicated increased “Keap1-Nrf2-ARE” signal pathway and GSH/GSTs pathway by oxidized fish oil treatment. The heat shock proteins and ubiquitin - proteasome system genes were also significantly up-regulated. The activations of these three anti-oxidation pathway systems serve the main components to remove the damaged cells and decompose the harmful proteins,which play the essential roles to protect the intestinal mucosa tissue and its cells and to repair the intestinal mucosa response to the oxidation injury.
Grass carp Ctenopharyngodon idellus; Intestinal mucosa; Oxidized fish oil; RNA-seq; Nrf2; GSH/GSTs;Protein ubiquitination
S963.1
A
1000-3207(2016)04-0758-09
10.7541/2016.100
2015-07-06;
2015-12-10
国家自然基金(31172417)资助 [Supported by the National Natural Science Foundation of China (No. 31172417)]
叶元土, 教授; 研究方向为水产动物营养与饲料。E-mail: yeyt@suda.edu.cn, Tel./Fax:+86-0512-65880179

