彩色马铃薯“剑川红”和“转心乌”花色苷的抗氧化分析
肖继坪,杨晓艳,郭华春*(云南农业大学农学与生物技术学院,云南 昆明 650201)
彩色马铃薯“剑川红”和“转心乌”花色苷的抗氧化分析
肖继坪,杨晓艳,郭华春*
(云南农业大学农学与生物技术学院,云南 昆明 650201)
摘 要:彩色马铃薯“剑川红”和“转心乌”富含花色苷,为探明2 种马铃薯中花色苷的体外抗氧化活性差异及其组合效果,使这种价格低廉、取材方便的食材得到更好的开发和利用。本研究以抗坏血酸(VC)为对照,采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基法、2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基法、羟自由基(·OH)法、超氧阴离子自由基(O�·)法等4 种体外抗氧化模型评价了云南地方特色马铃薯品种 “剑川红”和“转心乌”花色苷的抗氧化活性。结果表明:“剑川红”和“转心乌”的花色苷具有很好的抗氧化活性,且与质量浓度成正相关,其清除自由基的能力是抗坏血酸的10.7~31.3 倍;“剑川红”和“转心乌”对4 种自由基的清除能力依次为ABTS+·>DPPH自由基>O·>·OH;“转心乌”花色苷对4 种自由基的清除效果比“剑川红”花色苷强;二者的花色苷之间没有拮抗作用,且有一定的协同或增效作用,协同或增效效果因自由基的不同而有所差异。
关键词:“剑川红”;“转心乌”;花色苷;抗氧化活性;自由基
引文格式:
肖继坪, 杨晓艳, 郭华春.彩色马铃薯“剑川红”和“转心乌”花色苷的抗氧化分析[J].食品科学, 2016, 37(13): 13-18.
XIAO Jiping, YANG Xiaoyan, GUO Huachun.Antioxidant activities of anthocyanins from ‘Jianchuanhong' and ‘Zhuanxinwu' pigmented potatoes[J].Food Science, 2016, 37(13): 13-18.(in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201613003. http://www.spkx.net.cn
彩色马铃薯(colored potato or pigmented potato)是普通栽培马铃薯的变种,其块茎的皮、肉呈现红、橙、紫、蓝、黑色[1]。云南具有丰富的彩色马铃薯品种资源[2],“剑川红”和“转心乌”是分属于红色、紫色色系的云南地方特色马铃薯品种。“剑川红”产于云南省大理州剑川县,表皮光滑呈红色,肉质白色带红色的环,口感细腻、香滑,淀粉含量较高。“转心乌”则产于云南省宣威市宝山镇,已有130多年的栽培历史,薯形扁圆,块茎周皮和木质部为紫黑色,木质部的紫色形成一个不规则的环向韧皮部蔓延,内外韧皮部和髓部均为淡黄色。两种马铃薯均富含花色苷,且色彩鲜艳,产量高成本低,是大众喜爱的蔬菜,甚至作为山区人民的主食,因此研究彩色马铃薯花色苷的功能对于深度开发利用彩色马铃薯和促进大众健康都具有重要意义。
花色苷是一类具有生物活性的类黄酮物质,它除了能赋予植物艳丽的色彩外[3],还具有抗氧化活性[4]。抗氧化性被视为花色苷的基础生物活性,清除自由基这一作用与花色苷抑制炎症反应[5]、预防心血管疾病、降血脂、保肝[6-7]、抑制肿瘤的发生等生理作用有关。花色苷是目前科学界发现的防治疾病、维护人类健康最直接、最有效、最安全的自由基清除剂之一,其清除自由基的能力是VC 的20 倍[8]。因此,研究彩色马铃薯花色苷的抗氧化活性是了解其他生物活性的基础。
花色苷的结构是其生物活性的基础[9],花色苷的抗氧化能力是由花色苷结构的3 个因素,即羟基化程度、酰基和糖苷基类型共同决定的。首先,自由羟基个数与抗氧化活性成正相关,这意味着矮牵牛色素较锦葵色素、芍药素和天竺葵色素具有更强的抗氧化能力[10-12]。其次,最常见的马铃薯花色苷酰化物是与香豆酸酰化的产物,酰化过程极大地增强了花色苷的抗氧化性[13]。此外,赋予彩色马铃薯抗氧化活性的糖苷基为芍药色素糖苷基、矮牵牛色素糖苷基和锦葵色素糖苷基等[10,14],“剑川红”色素主要为酰化天竺葵色素类花色苷,“转心乌”色素主要为矮牵牛色素,羟基化程度较高,糖苷基为矮牵牛色素糖苷基[15]。从结构上看,“转心乌”花色苷的抗氧化能力要优于“剑川红”,但目前此方面的研究很少。
因此,本实验用酸醇提取法提取“剑川红”和“转心乌”的花色苷,并用标准曲线法测定其含量,以抗坏血酸(VC)为对照,测定二者花色苷清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基、超氧阴离子自由基(O·)和羟自由基(·OH)的能力,探明彩色马铃薯“剑川红”和“转心乌”花色苷的体外抗氧化活性差异及其组合效果,为开发以彩色马铃薯为原料的天然抗氧化剂和保健食品及消费者的选择提供理论依据。
1 材料与方法
1.1 材料与试剂
“剑川红”和“转心乌”为云南地方特色马铃薯品种,均以相同的栽培条件种植于云南农业大学后山农场,成熟后收获块茎作为实验材料。
冰乙酸、无水乙醇、乙二胺四乙酸、硫酸亚铁、过硫酸钾、抗坏血酸 天津市风船化学试剂科技有限公司;甲醇 重庆川东化工(集团)有限公司;邻二氮菲西陇化工股份有限公司;十二水合磷酸氢二钠 广东光华科技股份有限公司;磷酸二氢钾 广东省化学试剂工程技术研究开发中心;双氧水 国药集团化学试剂有限公司;以上试剂均为分析纯。
Amberlite XAD-7大孔吸附树脂 美国Sigma公司;DPPH、ABTS 东京化成工业株式会社;L-蛋氨酸SabaseBio公司;核黄素 北京索莱宝科技有限公司;硝基氯化四氮唑蓝(nitrotetrazolium blue chloride,NBT)Biosharp公司。
1.2 仪器与设备
Heidolph LABOROTA 4000旋转蒸发仪、CHRIST ALPHA 1-2型冷冻干燥机、TU-1810紫外-可见光光度计北京普析通用仪器有限责任公司;AllegraTM64R离心机美国Beckman Coulter公司;LRH-250-G光照培养箱 韶关市泰宏医疗器械有限公司;SY3100DH超声波清洗机上海声源超声波仪器设备有限公司;HH-4智能数显恒温水浴锅 巩义市予华仪器限责任公司;THZ-C恒温振荡器 太仓市实验设备厂;AL104电子天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 花色苷提取纯化和含量测定
花色苷提取:将收获的新鲜马铃薯块茎洗净,阴凉处晾干,切成薄片。用体积分数为50%的乙酸-甲醇溶液密闭浸泡。24 h后倒出粗提液,再用等浓度的冰乙酸甲醇溶液浸提2 次。粗提液室温过夜,沉淀淀粉,取上清液棉塞过滤后抽滤。40 ℃减压浓缩后得粗提物浸膏,置于-20 ℃冰箱保存备用。
花色苷纯化:将粗提物浸膏用蒸馏水稀释后以每小时1 倍柱床体积的流速流过预处理好的XAD-7大孔吸附树脂柱,加蒸馏水冲洗除去糖、蛋白质、无机盐、有机酸等杂质,至流出液澄清,然后用2 倍柱床体积的体积分数为5%的乙酸甲醇溶液洗脱,收集乙酸甲醇洗脱液,于40 ℃减压浓缩得提取物浸膏[15],冷冻干燥成粉状备用。
花色苷含量测定:采用标准曲线法测定提取物的总花色苷含量[16],称取矢车菊素3-O-葡萄糖苷标样1 mg,加入提取液溶解配制成50 µg/mL的标样。分别吸取50 µg/mL的标样0.2、0.4、0.6、0.8、1.0 mL于5 mL离心管中,提取液稀释至4 mL,制成2.5、5.0、7.5、10.0、12.5 µg/mL的标样。在535 nm波长处测定标样的吸光度,以提取液为空白对照,绘制标准曲线,得线性回归方程:y=0.033 8x+0.001 9(R2=0.999 1)。把彩色马铃薯花色苷冻干粉配制成1 mg/mL的提取物溶液,在535 nm波长处测定花色苷提取物溶液的吸光度,以提取液为空白对照,带入回归方程计算花色苷提取物的总花色苷含量。
1.3.2 抗氧化活性分析
1.3.2.1 DPPH自由基清除能力的测定[17-18]
配制1 mmol/L的DPPH母液(准确称取0.197 2 g DPPH,溶于500 mL纯甲醇溶液中),放入-20 ℃冰箱中避光保存,使用前用甲醇稀释成0.1 mmol/L DPPH工作液。将花色苷冻干粉末/抗坏血酸溶于去离子水中,配制成不同质量浓度梯度的花色苷溶液(2、4、6、8、10、12、14、16 µg/mL)、抗坏血酸溶液(50、100、150、200、250、300、350、400 µg/mL)。取0.15 mL花色苷溶液/抗坏血酸溶液,与4.35 mL DPPH工作液充分混匀为样品组,以0.15 mL去离子水和4.35 mL DPPH为对照组,23 ℃避光反应30 min,在517 nm波长处测定吸光度,每个样品平行测3 次,计算DPPH自由基清除率及EC50值(concentration for 50% of maximal effect,EC50,即自由基清除率达到50%时所需要的样品质量浓度)。
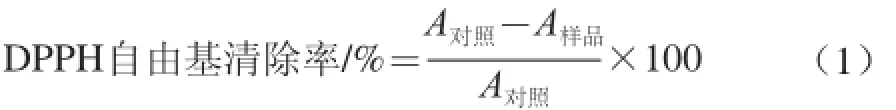
式中:A对照为DPPH自由基和溶剂的吸光度;A样品为样品与DPPH自由基反应后的吸光度。
1.3.2.2 ABTS+·清除能力的测定[17,19]
将7 mmol/L的ABTS溶液与2.45 mmol/L的过硫酸钾溶液等体积混合均匀,放置黑暗处过夜反应,成为ABTS储存液。使用前用体积分数为50%的乙醇溶液稀释ABTS储存液,在734 nm波长处检测,使其最终的吸光度达到0.700±0.002,成为ABTS工作液(稀释液大约是ABTS储存液的40 倍,稀释倍数随储存液贮存时间的增长而减小)。将花色苷冻干粉末/抗坏血酸溶于去离子水中,配制成不同质量浓度梯度的花色苷溶液(2、4、6、8、10、12、14、16 µg/mL)/抗坏血酸溶液(25、50、75、100、125、150、175、200 µg/mL)。取0.08 mL花色苷溶液/抗坏血酸溶液,与4 mL ABTS工作液充分混匀为样品组,以0.08 mL去离子水和4 mL ABTS工作液为对照组,30 ℃水浴避光反应6 min,在734 nm波长处测定吸光度,计算ABTS+·清除率及EC50值。
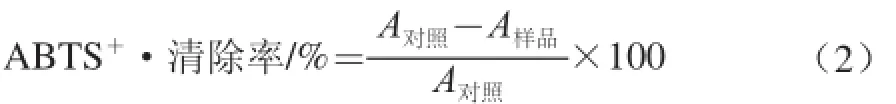
式中:A对照为ABTS+·和溶剂的吸光度;A样品为样品与ABTS+·反应后的吸光度。
1.3.2.3 ·OH清除能力的测定[20-21]
将等浓度(0.15 mol/L)的Na2HPO4·12H2O和KH2PO4溶液混合,调其pH 7.40,得到浓度为0.15 mol/L pH值为7.40的磷酸盐缓冲液(phosphate buffered saline,PBS),用去离子水配制0.75 mmol/L的邻二氮菲(先用适量的甲醇溶解后再用去离子水定容之所需体积)、0.75 mmol/L的硫酸亚铁、0.01%的双氧水。将花色苷冻干粉末/抗坏血酸溶于去离子水中,配制成不同质量浓度梯度的花色苷溶液(12、14、16、18、20、22、24、26、28、30 µg/mL)/抗坏血酸溶液(100、200、300、400、500、600、700、800 µg/mL)。样品组:1 mL PBS+1 mL邻二氮菲+ 1 mL硫酸亚铁+0.25 mL花色苷/抗坏血酸溶液,立即混匀后加入0.5 mL 0.01%双氧水。损伤组:1 mL PBS+1 mL邻二氮菲+1 mL硫酸亚铁+0.25 mL去离子水,立即混匀后加入0.5 mL 0.01%双氧水。未损伤组:1 mL PBS+ 1 mL邻二氮菲+1 mL硫酸亚铁+0.75 mL去离子水混合。37 ℃水浴避光反应60 min,在536 nm波长处测定吸光度,计算·OH清除率及EC50值。

式中:A样品为样品组的吸光度;A损伤为损伤组的吸光度;A未损伤为未损伤组的吸光度。
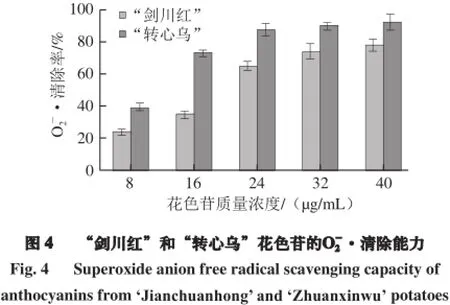
将等浓度(0.05 mol/L)的Na2HPO4·12H2O和KH2PO4混合,调其pH 7.80,得到浓度为0.05 mol/L pH值为7.80的PBS,用此PBS溶液配制65 mmol/L的L-蛋氨酸、100 μmol/L的核黄素、375 μmol/L的NBT、500 μmol/L的乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)溶液。将花色苷冻干粉末/抗坏血酸溶于去离子水中,配制成不同质量浓度梯度的花色苷溶液(8、16、24、32、40 µg/mL)/抗坏血酸溶液(200、400、600、800、1 000、1 200 µg/mL)。样品组:1 mL PBS+1 mL L-蛋氨酸+1 mL乙二胺四乙酸+ 1 mL NBT+1 mL核黄素+0.1 mL不同质量浓度的花色苷/抗坏血酸溶液。对照组:1 mL PBS+1 mL L-蛋氨酸+1 mL乙二胺四乙酸+1 mL NBT+1 mL核黄素+ 0.1 mL去离子水。在温度为25 ℃、光照强度为3 500 lx的光照培养箱中反应1 h。在560 nm波长处测定吸光度,计算O·清除率及EC50值。
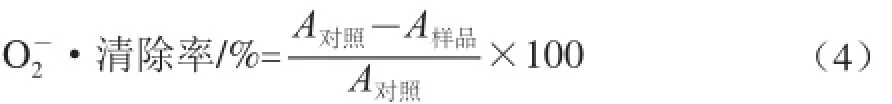
式中:A对照为对照组的吸光度;A样品为样品组的吸光度。
1.3.2.5 “剑川红”和“转心乌”花色苷混合后的抗氧化活性的测定
根据“剑川红”和“转心乌”花色苷清除自由基的EC50值的质量浓度配制花色苷溶液,2 个品种的花色苷溶液各取一半混合成样品溶液,用于4 种自由基清除能力测定。
1.4 数据处理
本实验数据采用Excel 2007软件进行处理,并计算EC50。
2 结果与分析
2.1 冻干粉中花色苷的含量
称取1 mg冻干粉溶于1 mL去离子水中,配制成1 mg/mL的花色苷溶液。根据标准曲线法计算得出1 mg/mL的“剑川红”和“转心乌”花色苷溶液中所含的纯花色苷质量浓度分别为7.9 µg/mL和4.5 µg/mL,即1 mg“剑川红”和“转心乌”冻干粉中含有纯花色苷分别为7.9 µg和4.5 µg。为了比较两种马铃薯中纯花色苷的抗氧化活性的强弱,在后续的抗氧化活性实验中,采用等质量浓度的冻干粉中所含的纯的花色苷质量浓度测定。
2.2 “剑川红”和“转心乌”的抗氧化活性
2.2.1 DPPH自由基的清除能力
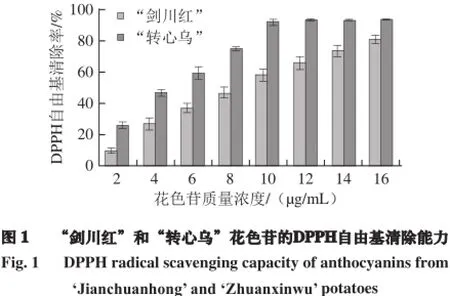
由图1可知,“剑川红”和“转心乌”花色苷的DPPH自由基清除率随花色苷质量浓度的增大而增大,当质量浓度达到16 µg/mL时,清除率分别高达81.0%和93.6%,且同质量浓度的“转心乌”花色苷的DPPH自由基清除率要高于“剑川红”花色苷。
同时,不同抗氧化剂的DPPH自由基清除能力强弱顺序为:“转心乌”花色苷(EC50=3.9 µg/mL)>“剑川红”花色苷(EC50=7.7 µg/mL)>VC (EC50= 84.4 µg/mL),且“转心乌”和“剑川红”花色苷的DPPH自由基清除能力分别是VC的21.6 倍和10.9 倍。说明彩色马铃薯花色苷具有很强的DPPH自由基清除能力,抗氧化效果优于VC。
2.2.2 ABTS+·的清除能力
由图2可知,“剑川红”和“转心乌”花色苷的ABTS+·清除率随花色苷质量浓度的增大而增大,当质量浓度达到16 µg/mL时,二者的ABTS+·清除率均高达99.7%,且同质量浓度的“转心乌”花色苷的ABTS+·清除率要高于“剑川红”花色苷。
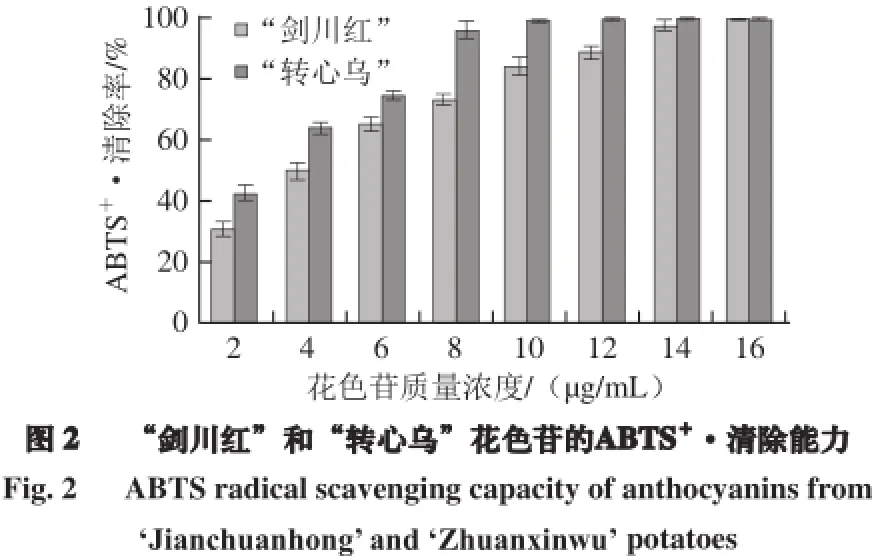
同时,不同抗氧化剂的ABTS+·清除能力强弱顺序为:“转心乌”花色苷(EC50=2.9 µg/mL)>“剑川红”花色苷(EC50=3.9 µg/mL) >VC(EC50=63.6 µg/mL),且“转心乌”和“剑川红”花色苷的ABTS+·清除能力是VC的22.1 倍和16.4 倍。说明彩色马铃薯花色苷具有很强的ABTS+·清除能力,抗氧化效果优于VC。
2.2.3 ·OH的清除能力
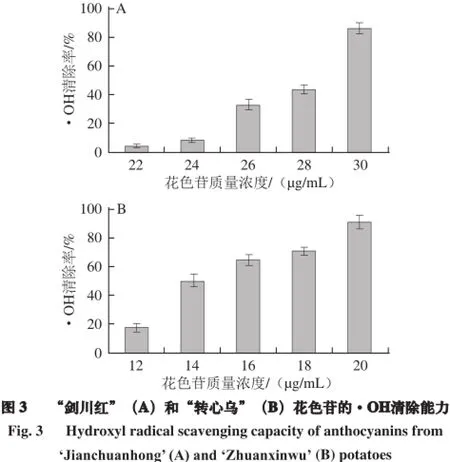
由图3可知,“转心乌”和“剑川红”花色苷的·OH清除率随花色苷质量浓度的增大而增大,当质量浓度分别达到20 µg/mL和30 µg/mL时,二者的·OH清除率分别高达91.3%和86.1%。当“转心乌”花色苷质量浓度为20 µg/mL时,·OH清除率已达91.3%,而此时“剑川红”花色苷的·OH清除率几乎没有。因此,“转心乌”花色苷的·OH清除率要远高于“剑川红”花色苷。
同时,不同抗氧化剂的·OH清除能力强弱顺序为:“转心乌”花色苷(EC50=14.7 µg/mL)>“剑川红”花色苷(EC50=27.5 µg/mL)>VC(EC50=295.3 µg/mL),且“转心乌”和“剑川红”花色苷的·OH清除能力是VC的20 倍和10.7 倍。说明彩色马铃薯花色苷具有很强的·OH清除能力,抗氧化效果优于VC。
2.3 “剑川红”和“转心乌”花色苷混合后抗氧化活性的变化
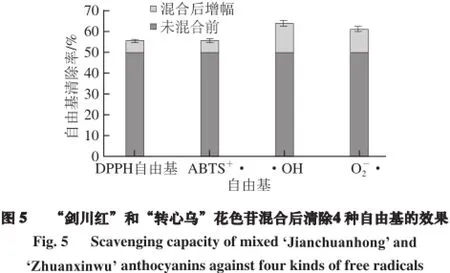
“剑川红”和“转心乌”花色苷分别以清除4 种自由基的EC50值等量混合,由图5可知,对DPPH自由基、ABTS+·、·OH和O·的清除率分别增加了5.34%、5.44%、14.06%和11.13%。说明“剑川红”和“转心乌”花色苷之间没有拮抗作用,且有一定的协同或增效作用,协同或增效效果因自由基的不同而有所差异。
3 结 论
“剑川红”和“转心乌”的花色苷具有很好的抗氧化活性,且与质量浓度成正相关;对4种自由基的清除能力:ABTS+·>DPPH自由基>O·>·OH。“转心乌”花色苷的抗氧化活性强于“剑川红”花色苷,这可能是由 “转心乌”和“剑川红”主要花色苷结构上的差异造成。同等质量分数的“剑川红”和“转心乌”色素冻干粉清除4 种自由基的能力不如VC,但是通过对冻干粉中花色苷含量的测定,将其换算成纯净的花色苷复合物后,花色苷复合物清除自由基的能力是等量VC的10.7~31.3 倍,说明“剑川红”和“转心乌”花色苷具有很强的抗氧化活性。杨大毅等[8]的研究也表明花色苷是很强的自由基清除剂,其清除自由基的能力是VC的20 倍。
“剑川红”和“转心乌”花色苷混合后没有拮抗作用,且有一定的协同或增效作用,协同或增效效果因自由基的不同而有所差异。本实验分离纯化得到的花色苷为混合物,虽然在前人研究基础上进一步纯化、定量,但具体的每个花色苷单体的作用机理及量效关系等还需进一步分离出纯净的单体后再进行研究。此外,马铃薯作为主粮和食品加工原料,其进一步的应用都需要加热,所以彩色马铃薯在高温高压等条件下的抗氧化能力的变化亦值得深入探讨。
Lachman等[24]对捷克和瑞士的15 个彩色马铃薯粗提液的花色苷含量进行了测定,在0.7~74.3 mg/100 g(以鲜质量计)之间。在自然界的天然植物中,彩色马铃薯花色苷的含量虽然不是最高的,但是彩色马铃薯具有适应性广、产量高、易于保存和运输、取材容易等特点,且彩色马铃薯所含花色苷多为酰化的花色苷,稳定性较高。因此,彩色马铃薯的花色苷可以应用于食品添加、化妆品、保健品等行业,具有广阔的市场前景。
参考文献:
[1] BROWN C R, WROLSTAD R, DURST R, et al.Breeding studies in potatoes containing high concentrations of anthocyanins[J].American Journal of Potato Research, 2003, 80(4): 241-250.DOI:10.1007/ BF02855360.
[2] 刘福翠, 谭学林, 郭华春.云南省马铃薯品种资源的RAPD分析[J].西南农业学报, 2004, 17(2): 200-204.DOI:10.3969/ j.issn.1001-4829.2004.02.017.
[3] ONSLOW M W.The anthocyanin pigments of plants[M].Cambridge: Cambridge University Press, 2014: 1-324.
[4] NEMŚ A, PĘKSA A, KUCHARSKA A Z, et al.Anthocyanin and antioxidant activity of snacks with coloured potato[J].Food Chemistry,2015, 172: 175-182.DOI:10.1016/j.foodchem.2014.09.033.
[5] KASPAR K L, PARK J S, BROWN C R, et al.Pigmented potato consumption alters oxidative stress and inflammatory damage in men[J].The Journal of Nutrition, 2011, 141(1): 108-111.DOI:10.3945/ jn.110.128074.
[6] CHOI J H, HWANG Y P, PARK B H, et al.Anthocyanins isolated from the purple-fleshed sweet potato attenuate the proliferation of hepatic stellate cells by blocking the PDGF receptor[J].Environmental Toxicology and Pharmacology, 2011, 31(1): 212-219.DOI:10.1016/ j.etap.2010.10.011.
[7] HWANG Y P, CHOI J H, CHOI J M, et al.Protective mechanisms of anthocyanins from purple sweet potato against tert-butyl hydroperoxide-induced hepatotoxicity[J].Food and Chemical Toxicology, 2011, 49(9): 2081-2089.DOI:10.1016/j.fct.2011.05.021.
[9] 周波, 李新华, 王晓红, 等.玉米紫色植株色素主要成分的结构鉴定[J].天然产物研究与开发, 2008, 20(5): 842-845.DOI:10.3969/ j.issn.1001-6880.2008.05.021.
[10] HAN K H, SEKIKAWA M, SHIMADA K, et al.Anthocyanin-rich purple potato flake extract has antioxidant capacity and improves antioxidant potential in rats[J].British Journal of Nutrition, 2006,96(6): 1125-1134.DOI:10.1017/BJN20061928.
[11] LACHMAN J, HAMOUZ K, ORSAK M, et al.Potato tubers as a significant source of antioxidants in human nutrition[J].Rostlinná Výroba, 2000, 46(5): 231-236.DOI:10.1016/S0925-5214(00)00076-4.
[12] WANG H, CAO G, PRIOR R L.Oxygen radical absorbing capacity of anthocyanins[J].Journal of Agricultural and Food Chemistry, 1997,45(2): 304-309.DOI:10.1021/jf960421t.
[13] de SOUZA R F V, de GIOVANI W F.Antioxidant properties of complexes of flavonoids with metal ions[J].Redox Report, 2004, 9(2): 97-104.DOI:10.1179/135100004225003897.
[14] BROWN C R, YANG C P, NAVARRE D, et al.Carotenoid and anthocyanin concentrations and associated antioxidant values in high pigment potatoes[J].American Journal of Potato Researches, 2004, 81: 48.
[15] 肖继坪, 郭华春.云南马铃薯地方彩色品种“剑川红”和“转心乌”的花色苷主成分分析[J].天然产物研究与开发, 2012, 24(4): 503-506.DOI:10.3969/j.issn.1001-6880.2012.04.019.
[16] 毛建霏, 付成平, 郭灵安, 等.可见分光光度法测定紫甘薯总花青素含量[J].食品与发酵科技, 2010, 46(2): 101-104.DOI:10.3969/ j.issn.1674-506X.2010.02-026.
[17] KIM D O, LEE K W, LEE H J, et al.Vitamin C equivalent antioxidant capacity (VCEAC) of phenolic phytochemicals[J].Journal of Agricultural and Food Chemistry, 2002, 50(13): 3713-3717.DOI:10.1021/jf020071c.
[18] KARAMAC M, KOSIÑSKA A, PEGG R B.Comparison of radicalscavenging activities for selected phenolic acids[J].Polish Journal of Food and Nutrition Sciences, 2005, 14(2): 165-170.DOI:10.1007/0-387-29455-4_25.
[19] DUDONNÉ S, VITRAC X, COUTIÈRE P, et al.Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH, ABTS, FRAP, SOD, and ORAC assays[J].Journal of Agricultural and Food Chemistry, 2009, 57(5): 1768-1774.DOI:10.4000/edc.2782.
[20] 金鸣, 蔡亚欣, 李金荣, 等.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理学进展, 1996, 23(6): 553-555.
[21] 张京芳, 王冬梅, 周丽, 等.香椿叶提取物不同极性部位体外抗氧化活性研究[J].中国食品学报, 2007, 7(5): 12-17.DOI:10.3969/ j.issn.1009-7848.2007.05.003.
[22] POPOVIĆ B M, ŠTAJNER D, SLAVKO K, et al.Antioxidant capacity of cornelian cherry (Cornus mas L.): comparison between permanganate reducing antioxidant capacity and other antioxidant methods[J].Food Chemistry, 2012, 134(2): 734-741.DOI:10.1016/ j.foodchem.2012.02.170.
[23] 刘安军, 杨永久, 张国蓉, 等.生、炒决明子抗氧化作用的研究与比较[J].食品科技, 2006, 31(12): 181-184.DOI:10.3969/ j.issn.1005-9989.2006.12.053.
[24] LACHMAN J, HAMOUZ K, MILOSLAY Š, et al.Cultivar differences of total anthocyanins and anthocyanidins in red and purple-fleshed potatoes and their relation to antioxidant activity[J].Food Chemistry,2009, 114(3): 836-843.DOI:10.1016/j.foodchem.2008.10.029.
DOI:10.7506/spkx1002-6630-201613003 10.7506/spkx1002-6630-201613003. http://www.spkx.net.cn [8] 杨大毅.紫薯发酵酒的生产工艺[J].酿酒, 2011, 38(1): 77-78.10.3969/j.issn.1002-8110.2011.01.028.
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2016)13-0013-06
收稿日期:2015-08-12
基金项目:国家自然科学基金青年科学基金项目(31401439);云南省教育厅科学研究基金项目(2013Y466);国家马铃薯产业技术体系项目(CARS-10-P21);云南省重大马铃薯种业专项(2013ZA007)
作者简介:肖继坪(1982—),女,讲师,博士,研究方向为彩色马铃薯花色苷。E-mail:xiaojiping82@126.com
*通信作者:郭华春(1962—),男,教授,博士,研究方向为马铃薯栽培及生理生化。E-mail:ynghc@126.com
Antioxidant Activities of Anthocyanins from ‘Jianchuanhong' and ‘Zhuanxinwu' Pigmented Potatoes
XIAO Jiping, YANG Xiaoyan, GUO Huachun*
(College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China)
Abstract:This study comparatively evaluated the antioxidant activities of individual and combined anthocyanins extracted from the tubers of the red-skinned and red-fleshed potato variety ‘Jianchuanhong' and the blue-skinned and blue-feshed potato variety ‘Zhuanxinwu', both of which are rich in anthocyanins as important natural antioxidants, with the aim of achieving better exploitation and utilization of these low-cost, easily available agricultural materials.The antioxidant activities were tested using four different in vitro models such as 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical,2,2'-azinobis-(3-ethylbenzthiazoline-6-sµlphonate) radical (ABTS+·), hydroxyl (·OH) and superoxide anion free radical (O·)scavenging assays with vitamin C (VC) as a control.The results showed that anthocyanins extracted from ‘Jianchuanhong' and ‘Zhuanxinwu' potatoes had strong antioxidant activity in a concentration dependent manner and revealed a significant free radical scavenging capacity 10.7-31.3 times higher than that of VC.For both pigmented potato varieties, the capacity for scavenging four kinds of free radical revealed the following order: ABTS+· > DPPH radical > O· > ·OH.The antioxidant activity of anthocyanins from ‘Zhuanxinwu' potato was better than that of ‘Jianchuanhong' potato.Anthocyanins from both varieties, in combination, were not antagonistic but were synergistic in scavenging free radicals, and the synergistic effects against different free radicals were different.
Key words:‘Jianchuanhong'; ‘Zhuanxinwu'; anthocyanins; antioxidant activities; free radical

