来曲唑构建湿热型多囊卵巢综合征大鼠模型及对卵巢StAR蛋白质因子的影响
郑慧颖,李庆端,蔡雪红,李丽娜(.漳州市中医院,福建 漳州 363000;2.湖北中医药大学,湖北 武汉 430065)
来曲唑构建湿热型多囊卵巢综合征大鼠模型及对卵巢StAR蛋白质因子的影响
郑慧颖1,2,李庆端1,蔡雪红1,李丽娜1
(1.漳州市中医院,福建 漳州 363000;2.湖北中医药大学,湖北 武汉 430065)
目的用来曲唑构建多囊卵巢综合征(PCOS)大鼠模型,研究其对StAR蛋白质因子的影响。方法将22只6周龄SPF级雌性SD大鼠随机分为空白组和模型组,空白组大鼠用1%羧甲基纤维素灌胃,模型组大鼠用1 mg/kg来曲唑加1%羧甲基纤维素灌胃,连续21 d,建立来曲唑诱导的PCOS大鼠模型,造模结束后观察大鼠体质量、阴道脱落细胞涂片、睾酮、空腹胰岛素、卵巢HE染色、StAR免疫组化病理涂片。结果模型组大鼠体质量增加,阴道脱落细胞涂片提示排卵障碍,睾酮升高,空腹胰岛素升高,卵巢呈多囊样改变,卵巢StAR表达活跃。结论来曲唑成功构建了PCOS大鼠模型,StAR表达的活跃度与高雄激素血症程度呈正相关。
来曲唑;多囊卵巢综合征;StAR蛋白质因子
多囊卵巢综合征 (polycystic ovarian syndrome,PCOS)是以持续性排卵障碍、高雄激素血症、卵巢多囊样变和胰岛素抵抗为特征的内分泌症候群,PCOS是一种复杂的内分泌和代谢疾病,发病原因不明,治疗较为棘手,是妇科领域的研究热点和难点。PCOS病因不明,至今无公认的最佳造模方法。因此,寻找一个更符合人类PCOS临床表现及病理特征的动物模型至关重要。近年来中医药治疗PCOS受到越来越多的学者认可,寻找具有中医特色的PCOS动物模型倍受关注。P450芳香化酶抑制剂来曲唑连续灌胃21 d诱导PCOS大鼠模型是Kafali等[1]创立的,来曲唑能阻止雄激素向雌激素转化,导致高雄激素血症。本实验采用来曲唑诱导PCOS大鼠模型,观察来曲唑是否能构建更符合人类PCOS的动物模型,观察其对卵巢STAR蛋白质因子的影响。
1材料与方法
1.1动物6周龄SD大鼠22只,SPF级,雌性,上海斯莱克实验动物有限责任公司提供,动物许可证号:SCXK(沪)2012-0002,合格证号:2013001805081。动物饲养及实验地点设在厦门大学实验动物中心。
1.2试剂来曲唑(江苏恒瑞医药股份有限公司,批号:15120958);大鼠胰岛素试剂盒(上海闳巨实业有限公司,批号:23029720);血睾酮试剂盒(雅培贸易(上海)有限公司,批号:10478UP00);StAR一抗试剂盒(美国Santa Cruz公司,批号:C0615)。
1.3仪器FZ-10002电子天平 (上海凡展衡器有限公司);DW-40L288超低温冰箱 (杭州硕联仪器有限公司);TDZ4-WS/TDZ4WS台式低速自动平衡离心机 (湖南湘仪离心机厂);I2000全自动化学发光仪(美国雅培公司);7600全自动生化分析仪(日本日立公司);BX951光学显微镜(奥林巴斯公司);HM525冷冻切片机(德国Microm公司);电热保温箱(上海阳光实验仪器有限公司);全封闭自动脱水机(MTM,SLEE);GHP-9270隔水式电热恒温培养箱(上海贺德实验设备有限公司);图像分析软件(Image J,NIH)。
1.4来曲唑诱导的PCOS大鼠模型构建6周龄SPF级雌性SD大鼠22只,喂以颗粒饲料,自由饮水,适应性喂养3 d。随机分为2组:空白组11只,模型组11只。空白组大鼠用1%羧甲基纤维素灌胃,模型组大鼠用1 mg/kg来曲唑加1%羧甲基纤维素灌胃,连续灌胃21 d。
1.5检测指标①大鼠体质量。大鼠造模前后各称重、记录1次。② 阴道脱落细胞涂片。大鼠自造模第11天开始阴道开口,阴道脱落细胞涂片检查2个性周期(1个性周期5 d),观察各组大鼠动情周期变化。③ 血清睾酮、空腹胰岛素。大鼠于抽血前1天晚20:00禁食不禁水,次日乙醚麻醉,眼眶静脉取血2mL送检,测血清睾酮、空腹胰岛素。④ 卵巢形态学。末次灌胃结束,取血完毕,将各组大鼠颈椎脱臼处死,剖腹,摘取双侧卵巢,将大鼠的卵巢组织放入10%富尔马林溶液中固定,脱水,石蜡包埋,制作HE染色病理片,光镜下组织学观察。⑤StAR蛋白检测。制作StAR蛋白因子的免疫组化病理片,光镜下观察,以卵泡膜细胞的细胞膜附近棕黄色颗粒为阳性结果,用Image J软件分析相应图片。
2结果
2.1大鼠一般情况造模期间空白组大鼠的一般情况良好,进食状况好,体态均匀,神态自如,精力旺盛,反应敏捷,不易抓取,被毛光泽贴身,小便清爽,垫料干爽。模型组大鼠在造模开始后1周即出现饮食饮水量增加,形体较臃肿,精神萎靡,懒于活动,反应迟钝,被毛松散无光泽,尿色黄,垫料粘腻,清洗时垫料偶有结块现象。
2.22组大鼠造模前后体质量比较见表1。

表1 2组大鼠造模前后体质量比较g
2.3血清睾酮、空腹胰岛素见表2。造模后模型组与空白组睾酮及空腹胰岛素比较有明显差异(P<0.01),说明来曲唑诱导的PCOS大鼠睾酮显著升高,存在高雄激素血症。同时说明模型大鼠空腹胰岛素也升高,存在胰岛素抵抗。

表2 2组大鼠造模后睾酮、空腹胰岛素比较
2.4阴道脱落细胞涂片观察见图1。
从图1可见:① 空白组大鼠阴道脱落细胞涂片可见到周期性变化,提示有排卵。图1-A为排卵前期,以基底层细胞为主,可见散在角化细胞,呈圆形或椭圆形,见深染的核,说明角化不完全,提示大鼠排卵即将开始。图1-B为排卵期,大鼠动情周期为5 d,与图1-A相隔5 d后阴道脱落细胞涂片见角化细胞满布整个视野,基本见不到基底层细胞,角化细胞形状不规则且见不到细胞核,说明角化完全,提示大鼠已进入排卵期。② 造模大鼠阴道脱落细胞涂片未见到周期性变化,提示无排卵。图1-C为早卵泡期,基底层细胞满布整个视野,可见散在的白细胞,见不到角化上皮,提示大鼠尚无优势卵泡发育。图1-D为早卵泡期,大鼠动情周期为5 d,与图1-C相隔5 d后阴道脱落细胞涂片仍未见角化上皮,提示排卵障碍。
2.5卵巢形态观察见图2。
图2-A为空白组:大鼠卵巢体积较小,存在不同发育阶段卵泡,可见排卵后的黄体,提示有排卵。图2-B为造模型组:大鼠卵巢体积较大,呈多囊样改变,无黄体,提示无排卵。
2.6StAR蛋白因子检测见图3。
图3-A为空白组,卵泡膜细胞层较薄,体积较小呈梭形。图3-B为模型组,卵泡膜细胞层增厚,体积明显增大,呈圆球形,且卵泡膜细胞靠近细胞膜附近呈褐色深染(S-P免疫组化法将目的蛋白StAR染为深褐色),提示PCOS大鼠卵泡膜细胞增生、功能亢进,StAR数量增多,功能活跃。
2.7卵巢StAR蛋白相对表达量见表3。
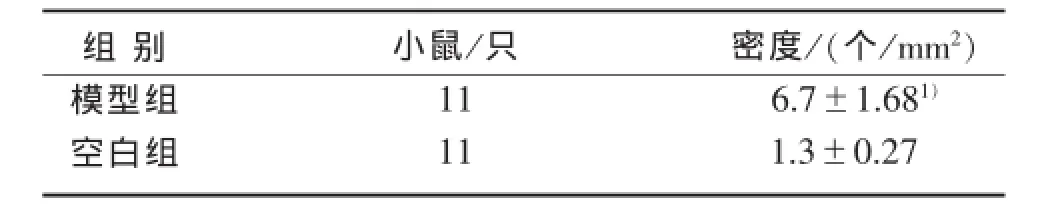
表3 2组卵泡膜细胞StAR表达比较
3讨论
3.1来曲唑构建PCOS大鼠模型的理论依据卵泡膜细胞产生的雄激素经过基底膜进入颗粒细胞,在颗粒细胞中FSH诱导P450芳香化酶活性,P450芳香化酶催化卵泡膜细胞转运来的雄激素生成雌酮,雌酮又在17β-羟甾脱氢酶的作用下转化为雌二醇。芳香化酶缺乏使雄激素无法转化为雌激素,血中雄激素水平升高。降低的雌激素对下丘脑和垂体的负反馈减弱,导致 Gn异常升高[2],卵巢出现PCO样变。另一方面,来曲唑在卵巢组织内阻断雄激素向雌激素的转化,引起卵泡发育微环境中雄激素积聚,雄激素在卵巢局部刺激胰岛素样生长因子等自分泌和/或旁分泌因子等的表达,改变卵泡发育微环境,促卵泡生长[3]。目前常用的芳香化酶抑制剂是来曲唑,文献报道采用来曲唑造模可使大鼠出现血清睾酮升高,胰岛素抵抗,卵巢多囊样变,大鼠病理生理特征接近人类PCOS特征,是研究该病较为理想的动物模型,且该造模方法与其它注射药物或皮下埋埴的方法比较,对大鼠创伤性更小,操作更简便[4-5]。
3.2根据PCOS鹿特丹诊断标准[6],本实验来曲唑造模大鼠出现典型的PCOS表现:①体质量增加;② 排卵障碍;③ 血清睾酮升高;④ 空腹胰岛素升高,提示存在胰岛素抵抗;⑤ 卵巢呈多囊样改变,说明本实验用来曲唑成功制作了PCOS大鼠模型,属湿热证;⑥ 体质量增加。朱丹溪在《格致余论》中说:“肥人湿多……”。清代章虚谷指出:“体丰者,本多痰湿。”古往今来中医学家对肥胖的论述甚多,但始终不离痰湿内盛的病机。病机分析:① 精神萎靡,懒于活动,反应迟钝。湿为阴邪,易阻遏气机,损伤阳气,清阳不升,神疲体倦。② 尿色黄,垫料粘腻,清洗时垫料偶有结块现象。湿性粘滞、重浊、趋下,故见小便粘腻,垫料结块,尿色黄属热。③ 高雄激素血症。雄属阳,雌属阴,雄激素升高则阳气亢盛,阳盛则热,可见高雄激素血症属热证。④ 胰岛素抵抗。孙刚等[7]检测了46名非痰湿体质者和35名痰湿体质患者的空腹胰岛素、血糖、血脂,计算胰岛素抵抗指数,发现非痰湿体质者的上述指标明显低于痰湿体质患者(P<0.05或 P<0.01)。⑤ 卵巢多囊样改变。夏桂成认为肾阴不足,天癸匮乏,卵子无以充养,发育停滞,痰湿蕴结于卵巢,使卵巢呈多囊样改变。
3.3StAR蛋白质因子甾体类生成快速调节蛋白(steroidogenetic acute regulatory protein,StAR)。人类的StAR是由285个氨基酸组成的蛋白质,存在于产生甾体激素细胞的线粒体外膜上,它促进胆固醇从线粒体外膜向内膜移动,这个重要过程建立了2层膜之间的联系位点,允许胆固醇流向低一级的浓度梯度中。在卵泡膜细胞内,胆固醇从线粒体外膜向甾醇相对较少的内膜转运,是甾体激素产生的关键步骤[8],决定了雄激素产生的速度和数量。本实验的免疫组化结果显示来曲唑诱导的PCOS大鼠卵泡膜细胞的细胞膜附近StAR密度明显升高,表达活跃。大量的StAR将更多胆固醇转运进卵泡膜细胞线粒体去合成雄激素,从而导致高雄激素血症。
3.4本实验发现雄激素合成过程中的关键蛋白StAR在来曲唑诱导的PCOS大鼠卵泡膜细胞内高表达,雄激素合成的原料胆固醇被大量转运入卵泡膜细胞线粒体内去合成雄激素,同时卵泡膜细胞增生、体积明显变大成圆球状,提示卵泡膜细胞功能亢进,而卵泡膜细胞是合成雄激素的场所,雄激素在这里被大量合成。说明来曲唑升高雄激素的机理是通过阻碍雄激素向雌激素转化使雄激素消耗减少,还通过激素间的反馈作用及细胞旁分泌等作用使雄激素合成增加。来曲唑使雌激素生成减少,降低的雌激素对下丘脑和垂体的负反馈减弱,导致LH异常升高。LH受体/cAMP/蛋白激酶A(PKA)信号通路可诱导雄激素生物合成通路中特定基因的表达,包括StAR基因、胆固醇侧链裂解酶基因等[9]。综上所述,来曲唑诱导PCOS大鼠模型,符合人类PCOS西医诊断标准、临床表现和病理特征,符合中医湿热证表现,来曲唑成功构建了湿热型PCOS大鼠模型。本实验StAR升高说明雄激素合成量增加,这一发现为研究PCOS治疗药物降低雄激素的机制提供了一个较新的研究指标。
[1]KAFALI H,IRIADAM M,OZARDAL I,et al.Letrozole-induced polycystic ovaries in the rat:a newmodel for cystic ovarian disease[J].Arch Med Res,2004,35(2):103-108.
[2]WALLACE KL,JOHNSON V,SOPELAK V,et al.Clomiphene cit-rate versus letrozole:molecular analysis of the endometri-um in women with polycystic ovary syndrome[J].FertilSteril,2011,96(4):1051-1056.
[3]林春莲.来曲唑促排卵的研究进展 [J].中国现代药物应用,2012,6(16):129-132.
[4]李进,胡平,段迎春,等.两种多囊卵巢综合征大鼠模型比较[J].湖北医药学院学报,2010,29(5):413-416.
[5]李明明,潘文,康开彪.不同造模方法对大鼠多囊卵巢综合征伴胰岛素抵抗模型的影响[J].西部中医药,2015,28(4):11-14.
[6]郁琦.妇科内分泌诊治指南[M].北京:人民卫生出版社,2013:93.
[7]孙刚,李晓玲.痰浊证型患者糖、脂等代谢指标检测及其临床意义[J].贵阳中医学院学报,1997,19(3):60.
[8]斯特劳斯.Yen&Jaffe生殖内分泌学[M].5版.北京:人民卫生出版社,2006:129-131.
[9]杨增明,孙青原,夏国良.生殖生物学[M].北京:科学出版社,2005:91.
R285.5
B
1000-338X(2016)03-0024-03
2016-05-12
漳州市科技局自然科学基金资助课题(ZZ2014J24)
郑慧颖(1980—),女,主治医师,2013级中西医结合妇科内分泌专业博士研究生,主要从事中医妇科基础与临床研究。

