橙皮素衍生物Y12抗炎活性评价
田远耀,李 俊,黄 成,孟晓明,程亚卉
◇药学研究◇
橙皮素衍生物Y12抗炎活性评价
田远耀,李 俊,黄 成,孟晓明,程亚卉
目的 筛选出具有较好抗炎活性的橙皮素衍生物Y12(HY-12)并对其抗炎活性进行评价。方法 脂多糖(LPS)刺激RAW262.7细胞株产生炎症因子,ELISA法测定细胞株分泌肿瘤坏死因子(TNF-α)和白细胞介素-6(IL-6)的水平,从而筛选出能抑制细胞因子TNF-α和IL-6生成、具有较好抗炎活性的HY-12;采用三种炎症模型:二甲苯致小鼠耳肿胀、角叉菜胶诱导小鼠足肿胀、弗氏完全佐剂所致小鼠佐剂性关节炎(AA),观察HY-12的抗炎活性。结果 筛选出HY-12具有较好的抗炎活性;HY-12(100、200、400 mg/ kg)对二甲苯致小鼠耳廓急性炎症有不同程度的抑制作用,HY-12(200、400 mg/kg)能显著抑制小鼠耳肿胀;HY-12(100 mg/kg)在3 h和5 h对小鼠足肿胀有明显的抑制作用,HY-12(200、400 mg/kg)于致炎后1 h开始产生疗效,在各个时间点均有明显的抑制作用;HY-12对小鼠AA模型的炎症反应也有一定的抑制作用,HY-12(400mg/kg)对AA小鼠的继发侧足肿胀、血清炎症因子、局部炎症浸润以及滑膜组织TNF-α、IL-6有一定的抑制作用。核转录因子-κB亚单位p65的磷酸化在炎症反应中起着重要的调控作用,结果显示加药组磷酸化p65表达水平低于模型组。结论 HY-12具有较强的抗炎活性,其抗炎作用可能与调控NF-κB通路活性有关。
HY-12;小鼠;耳肿胀;足肿胀;佐剂性关节炎
网络出版时间:2016-3-8 8:29:01 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.030.htm l
橙皮素是二氢黄酮的一种,其药理作用有:抗氧化[1]、抑制炎性介质[2]、降血脂、通过刺激某些线粒体酶(如琥珀酸脱氢酶等)保护内皮细胞组织的低氧、避免氧化等因素引起的基因突变导致的癌变[3]。虽然橙皮素具有很好的生物利用度,但由于其半衰期较短,口服给药后消除较快,需要通过频繁给药来维持血药浓度,这就限制了其在临床上的应用。为了克服这一缺点,本课题组通过化学合成的方法,合成了一系列的橙皮素衍生物并对其进行体外抗炎活性的筛选,希望以此得到具有更好抗炎活性且较母体药物橙皮素具有更长半衰期的新型药物单体。该研究选取小鼠腹腔巨噬细胞系RAW264.7,模拟体内巨噬细胞炎症反应,筛选出能较好抑制RAW264.7分泌炎症因子的橙皮素衍生物Y12(HY-12),并通过两种急性模型(二甲苯致小鼠耳肿胀、角叉菜胶诱导小鼠足肿胀)以及一种慢性模型[弗氏完全佐剂(Freund’s complete adjuvant,FCA)所致佐剂性关节炎(adjuvant-induced arthritis,AA)]初步评价其抗炎活性。
1 材料与方法
1.1 动物 普通级昆明种小鼠192只,雌雄各半,18~22 g,由安徽省实验动物中心提供。
1.2 主要试剂 HY-12和橙皮素(安徽医科大学药学院石静波博士合成并测定含量>99%);阿司匹林(华中药业股份有限公司);二甲苯(上海苏懿化学试剂公司,批号20120210);角叉菜胶(美国Sigma公司);小鼠腹腔巨噬细胞系RAW264.7(上海细胞库);DMEM培养基(美国Hyclone公司);胎牛血清(杭州四季青公司)置于-20℃冰箱保存,56℃水浴灭活30 min后使用;DMSO、FCA(美国Gibco公司);肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)ELISA试剂盒(上海拜力生物科技有限公司);TNF-α、IL-6、核转录因子-κB(nuclear transcription factor,NF-κB)亚单位p65磷酸化(p-p65)一抗(美国Cell Signaling公司);Western blot二抗(北京中杉金桥生物技术有限公司)。
1.3 主要仪器 足肿胀测量仪(荷兰雷勃公司);NAPCO-6100型细胞培养箱(美国SHELLAB公司);Western blot电泳仪(美国BIO-RAD公司)。
1.4 方法
1.4.1RAW264.7细胞的培养取冻存的RAW264.7细胞,37℃水浴快速解冻,加入含10%胎牛血清的DMEM完全培养基,将细胞放于37℃、5%CO2的培养箱中培养,6 h后更换培养基,细胞生长2 d后,按一定比例传代培养。
1.4.2 RAW264.7细胞培养液上清中TNF-α和IL-6的检测 取对数期生长的细胞以5×104/cm2接种于24孔板中,待细胞生长至80%,分别加入不同的药物刺激细胞,每组3个复孔。实验分组为正常组、模型组[脂多糖(lipopolysaccharide,LPS)1μg/ m l]、HY-12(12.5、25、50、100、200μmol/L)、橙皮素组(200μmol/L)和阳性药组(阿司匹林1 mg/ m l)。药物作用24 h后,取细胞上清液,1 000 r/min离心15 min,收集上清液,ELISA法测定上清液中炎症因子TNF-α和IL-6的含量。
1.4.3 二甲苯诱导小鼠耳肿胀模型的制备与检测[4]昆明种小鼠48只,雌雄各半,随机分为6组:正常组、模型组、HY-12(100、200、400 mg/kg)组、阳性药组(阿司匹林45 mg/kg)。灌胃给药,连续3 d [HY-12在使用前以0.5%羧甲基纤维素钠(CMCNa)混悬制备成相应浓度],正常组和模型组给予相应体积的CMC-Na。末次给药后1 h在小鼠左耳前后两面均匀涂抹二甲苯50μl(除正常组外),右耳作对照,1.5 h后处死小鼠,沿耳廓边剪下两耳,用9 mm的打孔器在两耳同一部位打下两圆耳片,用电子天平称重,计算肿胀度和抑制率。肿胀度以每鼠左右耳片重量差来表示,抑制率(%)=(模型组耳肿胀-给药组耳肿胀)/模型组耳肿胀×100%。
1.4.4 角叉菜胶诱导小鼠足肿胀模型的制备与检测 昆明小鼠48只,雌雄各半,随机分为6组:正常组、模型组、HY-12(100、200、400 mg/kg)组、阳性药组(阿司匹林45 mg/kg)。灌胃给药,连续3 d,正常组和模型组给予相应体积的CMC-Na。末次给药后,除正常组外每鼠右足趾皮下注射0.1 m l角叉菜胶(10 mg/m l),于致炎后1、3、5 h用足肿胀测量仪测量致炎侧足容积,肿胀度为各鼠足爪致炎前后容积差。
1.4.5 FCA所致小鼠AA模型的制备与检测[5]
昆明小鼠96只,雌雄各半,随机分为6组:正常组、模型组、HY-12(100、200、400 mg/kg)组、阳性药组(阿司匹林45 mg/kg)。除正常组外于每组小鼠左后足趾皮内注射0.02 m l FCA致炎,正常组小鼠注射同体积的生理盐水。
1.4.5.1 FCA所致小鼠AA足肿胀测量 在致炎前和致炎后第7、14、21、28天分别测定小鼠右侧足爪容积,肿胀度=致炎后容积-致炎前容积。致炎后第14天,小鼠继发性关节炎出现(肉眼观察改变以及肿胀度提示关节炎发生)。从第14天开始,除正常组和模型组外每只小鼠灌胃给予一定剂量药物,连续14 d,正常组和模型组给予等体积的CMCNa。
1.4.5.2 FCA所致小鼠AA血清炎症因子以及组织病理变化 检测第28天腹主动脉取血,1 500 r/ min离心15 min取血清,ELISA法测定TNF-α和IL-6含量。取小鼠膝关节,固定48 h后,EDTA脱钙处理30 d,HE染色,观察小鼠继发侧炎症浸润。
1.4.5.3 FCA所致小鼠AA滑膜组织炎症因子检测 第28天处死小鼠,取约100 mg膝关节滑膜组织,经液氮研磨提取组织蛋白,Western blot法检测组织TNF-α、IL-6和p-p65的表达。
1.5 统计学处理 采用SPSS 17.0软件进行分析,数据均以±s表示。组间比较采用 One-Way ANOVA检验。所有检验为双侧检验。
2 结果
2.1 HY-12对LPS刺激的RAW 264.7细胞炎症因子TNF-α和IL-6分泌的影响 与正常细胞比较,LPS刺激小鼠腹腔巨噬细胞分泌TNF-α和IL-6明显升高,见表1。加药组与模型组比较,阳性药组可以明显抑制LPS刺激的TNF-α和IL-6分泌,并且HY-12的高浓度组(100、200μmol/L)对LPS刺激的TNF-α和IL-6分泌也有明显的抑制作用,且与橙皮素组比较,效果更好。表明HY-12能抑制LPS刺激的RAW264.7细胞炎症因子TNF-α和IL-6的分泌,具有一定的抗炎活性。
表1 HY-12对LPS刺激的RAW 264.7细胞炎症因子分泌的影响(ng/L,±s)
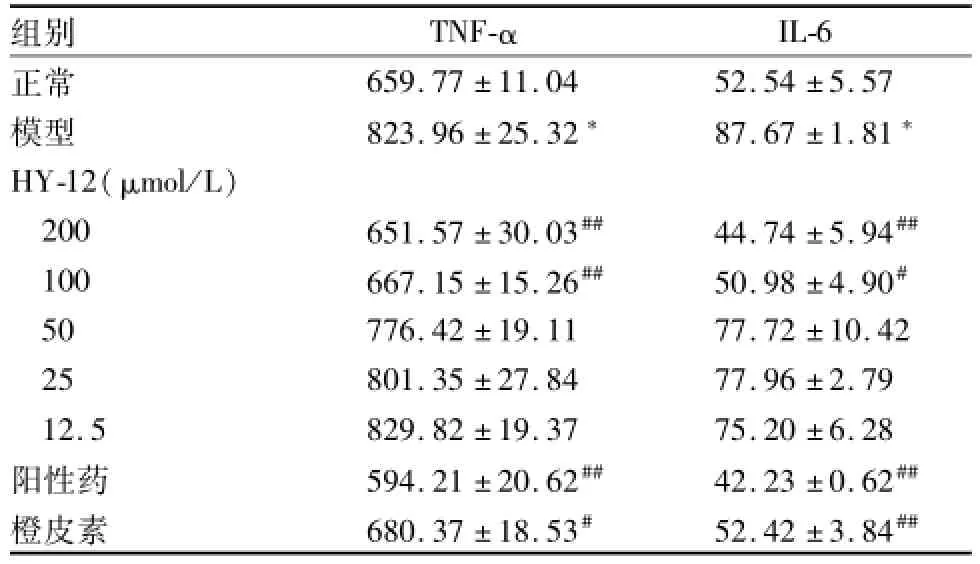
表1 HY-12对LPS刺激的RAW 264.7细胞炎症因子分泌的影响(ng/L,±s)
与正常组比较:*P<0.05;与模型组比较:#P<0.05,##P<0.01
组别 TNF-αIL-6正常659.77±11.04 52.54±5.57模型 823.96±25.32* 87.67±1.81*HY-12(μmol/L)200 651.57±30.03## 44.74±5.94##100 667.15±15.26## 50.98±4.90#50 776.42±19.11 77.72±10.42 25 801.35±27.84 77.96±2.79 12.5 829.82±19.37 75.20±6.28阳性药 594.21±20.62## 42.23±0.62##橙皮素 680.37±18.53# 52.42±3.84##
表2 HY-12对角叉菜胶诱导小鼠足肿胀的影响(ml,n=8,±s)
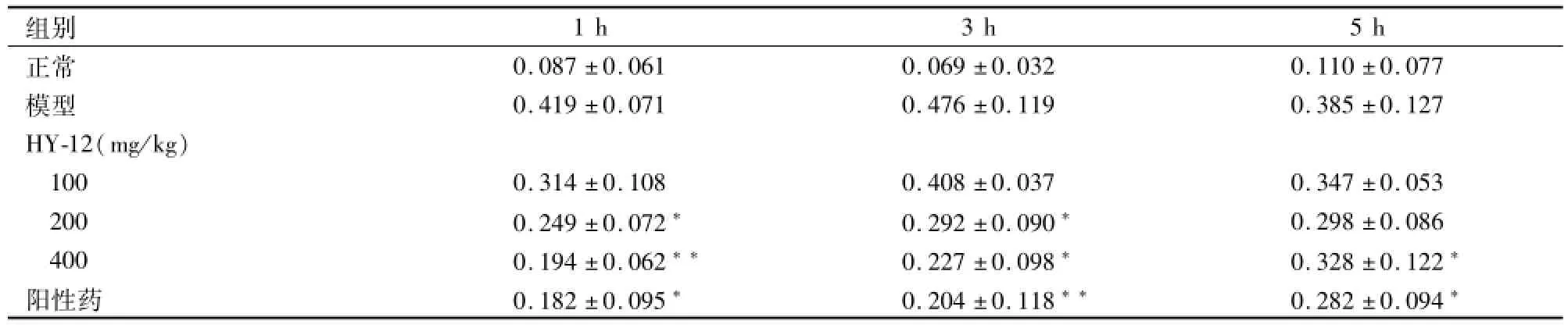
表2 HY-12对角叉菜胶诱导小鼠足肿胀的影响(ml,n=8,±s)
与模型组比较:*P<0.05,**P<0.01
组别1 h 3 h 5 h正常0.087±0.061 0.069±0.032 0.110±0.077模型 0.419±0.071 0.476±0.119 0.385±0.127 HY-12(mg/kg)100 0.314±0.108 0.408±0.037 0.347±0.053 200 0.249±0.072* 0.292±0.090* 0.298±0.086 400 0.194±0.062** 0.227±0.098* 0.328±0.122*阳性药 0.182±0.095* 0.204±0.118** 0.282±0.094*
2.2 HY-12对角叉菜胶诱导小鼠足肿胀的影响角叉菜胶致炎后1 h,小鼠足跖开始出现明显红、肿等变化,约3 h达高峰。HY-12(200、400 mg/kg)于致炎后1 h开始产生疗效,其中HY-12(400 mg/kg)在各个时间点均有明显的抑制作用。见表2。
2.3 HY-12对二甲苯诱导小鼠耳肿胀的抑制作用
HY-12(100、200、400 mg/kg)对二甲苯致小鼠耳廓急性炎症有不同程度的抑制作用,其中HY-12 (200、400 mg/kg)组与模型组比较差异有统计学意义。见表3。
表3 HY-12对二甲苯诱导小鼠耳肿胀的抑制作用(n=8,±s)
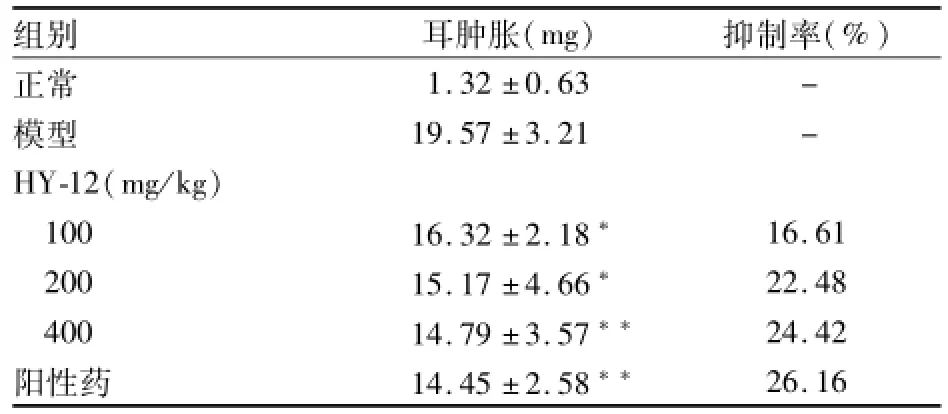
表3 HY-12对二甲苯诱导小鼠耳肿胀的抑制作用(n=8,±s)
与模型组比较:*P<0.05,**P<0.01
组别 耳肿胀(mg) 抑制率(%)1.32±0.63 -模型 19.57±3.21 -HY-12(mg/kg)100 16.32±2.18* 16.61 200 15.17±4.66* 22.48 400 14.79±3.57** 24.42阳性药 14.45±2.58**正常26.16
2.4 HY-12对FCA所致小鼠AA的影响
2.4.1 HY-12对FCA所致小鼠AA足肿胀的影响
模型组小鼠右后足肿胀在致炎后第14天开始出现继发肿胀。HY-12组小鼠从致炎后开始发挥作用,HY-12(400 mg/kg)可明显抑制致炎后第28天小鼠的继发性足肿胀。见表4。
2.4.2 HY-12对FCA所致小鼠AA血清TNF-α和 IL-6水平的影响 与正常组比较,模型组致炎后第28天小鼠血清TNF-α和IL-6明显升高。第14天给予小鼠HY-12(100、200、400 mg/kg),结果显示HY-12(200、400 mg/kg)组能明显抑制小鼠血清TNF-α 和IL-6的水平,以HY-12(400 mg/kg)组抑制作用最为明显。见表5。
2.4.3 HY-12对FCA所致小鼠AA膝关节病理改变的影响 模型组小鼠膝关节HE染色显示大量炎性细胞浸润,大量脂肪空泡,而且滑膜组织侵蚀到软骨及骨组织中,关节腔轮廓较不规则。HY-12组小鼠炎症浸润相对较少,关节腔轮廓相对较为清楚。其中HY-12(400 mg/kg)组炎症浸润明显少于模型组,与阳性药组基本相当。见图1。
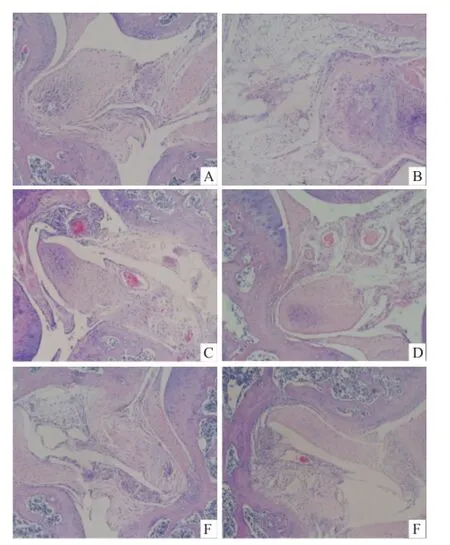
图1 小鼠膝关节 HE染色 ×40A:正常组;B:模型组;C:HY-12(100 mg/kg)组;D:HY-12(200 mg/kg)组;E:HY-12(400 mg/kg)组;F:阳性药组
2.4.4 HY-12对FCA所致小鼠AA组织炎症因子水平的影响 模型组小鼠滑膜组织TNF-α和IL-6的表达水平明显高于正常组,给予HY-12灌胃后,滑膜组织TNF-α和IL-6的表达水平下降,其中以HY-12(400 mg/kg)组最为明显。在HY-12组p-p65也较模型组表达降低。见图2。
3 讨论
该研究通过检测HY-12体外抑制LPS刺激的RAW264.7分泌TNF-α和IL-6的作用,筛选出具有较好抗炎活性的化合物HY-12。TNF-α是一种系统性炎症的细胞因子,同时也是引起急性反应的众多细胞因子中的一员,主要来自巨噬细胞分泌。其能够促使发热,引起细胞凋亡,诱导产生IL-1和IL-6从而引发炎症。TNF-α表达失调与许多人类疾病有关,包括阿尔茨海默病、癌症、重度抑郁障碍和肠炎[6]。IL-6是一种多效应炎症因子,主要由单核巨噬细胞、内皮细胞及淋巴样细胞分泌产生。IL-6在急性期反应、免疫应答、造血调节中发挥着重要作用,是造血源细胞、B细胞、T细胞、内皮细胞等的重要分化和生长因子[7]。然而过量表达IL-6往往与某些疾病密切相关,将造成组织损伤[8]。结果显示,HY-12高浓度组(100、200μmol/L)对于 LPS刺激的TNF-α和IL-6的分泌具有明显的抑制作用,且与母体药物橙皮素比较,效果更好。因此HY-12具有抑制LPS刺激的TNF-α和IL-6的分泌作用。
表4 HY-12对 FCA诱导小鼠AA足肿胀的影响(m l,n=8,±s)
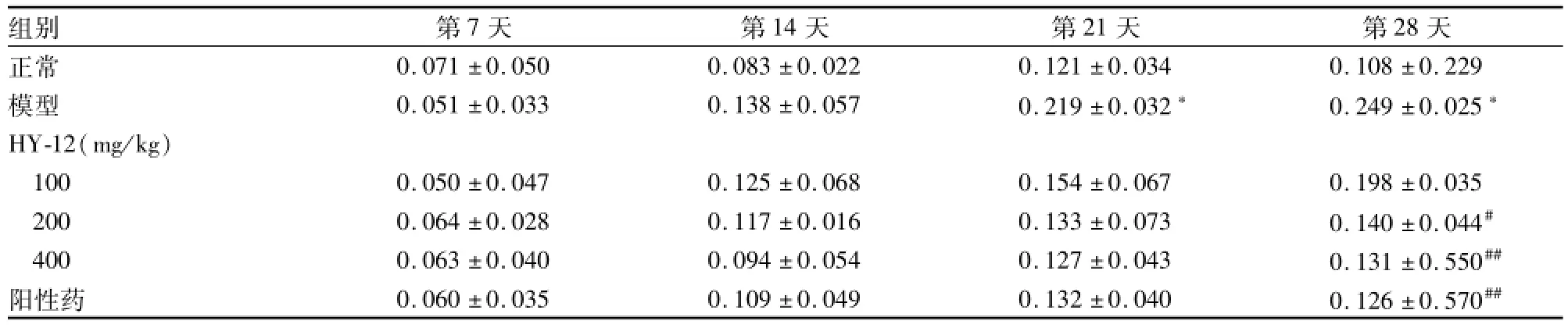
表4 HY-12对 FCA诱导小鼠AA足肿胀的影响(m l,n=8,±s)
与正常组比较:*P<0.05;与模型组比较:#P<0.05,##P<0.01
组别 第7天 第14天 第21天 第28天正常 0.071±0.050 0.083±0.022 0.121±0.034 0.108±0.229模型 0.051±0.033 0.138±0.057 0.219±0.032* 0.249±0.025*HY-12(mg/kg)100 0.050±0.047 0.125±0.068 0.154±0.067 0.198±0.035 200 0.064±0.028 0.117±0.016 0.133±0.073 0.140±0.044#400 0.063±0.040 0.094±0.054 0.127±0.043 0.131±0.550##阳性药 0.060±0.035 0.109±0.049 0.132±0.040 0.126±0.570##
表5 HY-12对 FCA诱导小鼠AA炎症因子的影响(ng/L,n=8,±s)
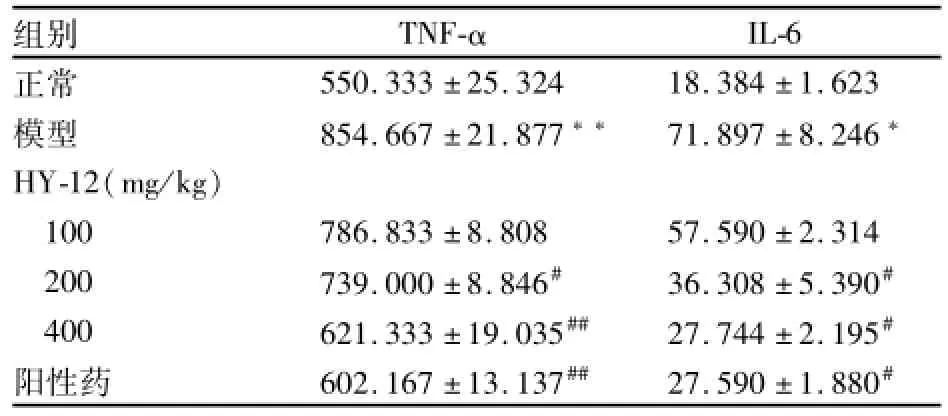
表5 HY-12对 FCA诱导小鼠AA炎症因子的影响(ng/L,n=8,±s)
与正常组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05;##P<0.01
组别 TNF-αIL-6正常550.333±25.324 18.384±1.623模型 854.667±21.877** 71.897±8.246*HY-12(mg/kg)100 786.833±8.808 57.590±2.314 200 739.000±8.846# 36.308±5.390#400 621.333±19.035## 27.744±2.195#阳性药 602.167±13.137## 27.590±1.880#


图2 小鼠膝关节滑膜组织 TNF-α、IL-6、p-p65蛋白表达水平A:正常组;B:模型组;C:HY-12(100 mg/kg)组;D:HY-12(200 mg/kg)组;E:HY-12(400 mg/kg)组;F:阳性药组;与正常组比较:*P <0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01
二甲苯致小鼠耳肿胀和角叉菜胶诱导小鼠足肿胀是两种常见急性非特异性炎症模型。二甲苯模型主要机制是致使某些炎症介质如组胺、激肽和纤维蛋白溶解释放,引起局部血管扩张,毛细血管通透性增加,炎症细胞浸润,造成耳部急性渗出性炎症水肿[9]。足肿胀模型是一个常用于评价或筛选药物抗炎作用的经典的急性炎症模型,当给小鼠足跖内注射角叉菜胶时能产生局部毛细血管扩张、血管通透性增高、渗出、水肿等反应。结果均表明,HY-12对二甲苯致小鼠耳肿胀和角叉菜胶诱导的小鼠足肿胀具有抑制作用,并且中、高两个剂量组的作用均有显著作用,其中高剂量组和阳性药作用相当。提示,HY-12具有较好的抗炎活性。
小鼠AA模型是一种免疫性炎症模型,继发性病变表现为多发性关节炎症,为筛选评价抗炎与免疫药物的常见模型。研究[10]表明,AA发病过程中存在细胞因子网络的失调,促炎因子(IL-1、IL-6、TNF-α)和抑炎因子(IL-10)的不平衡占有重要地位,其中TNF-α与AA疾病活动相关,参与多种病理过程,如增强内皮细胞黏附分子的表达;产生胶原酶,导致骨的破坏。此外,IL-6也是AA中主要的炎症介质,IL-6主要是诱导肝细胞分泌急性期蛋白并诱导其他炎症因子如IL-1和TNF-α的产生而发挥致病作用。在AA发生发展过程中,NF-κB是最为重要的炎症通路之一[11]。NF-κB通路的活化可以促进更多炎症因子表达水平以及发挥作用,包括促炎因子和抗炎因子[10]。结果均表明,HY-12能抑制AA小鼠的血清TNF-α、IL-6的水平。在局部膝关节,HY-12能抑制滑膜组织的炎症浸润,以及对滑膜组织增生,破坏软骨及骨组织也有一定的抑制作用。另外,Western blot结果也显示,HY-12组滑膜组织的TNF-α、IL-6水平也较模型组低。其中高剂量组TNF-α、IL-6水平明显低于模型组。HY-12抑制炎症因子TNF-α、IL-6的表达可能是通过调控NF-κB的活化实现的。
[1] Ren D Y,Xu T,Li R,et al.5,7,3′-Triacetyl hesperetin suppresses adjuvant-induced arthritis in rats through modulating JAK2 /STAT3 pathway[J].Am JChin Med,2013,41(3):601-14.
[2] 朱思明,于淑娟,杨连生,等.橙皮苷-铜(Ⅱ)配合物的配位模式和橙皮苷的抗氧化机理[J].天然产物研究与开发,2006,18(3):386-9.
[3] Nandakumar N,Rengarajan T,Balamurugan A,etal.Modulating effects of hesperidin on key carbohydrate-metabolizing enzymes,lipid profile,and membrane-bound adenosine triphosphatases against7,12-dimethylbenz(a)anthracene-induced breast carcinogenesis[J].Hum Exp Toxicol,2014,33(5):504-16.
[4] 彭 磊,张 茜,李 荣,等.橙皮苷衍生物抗炎活性的筛选研究[J].安徽医科大学学报,2011,46(1):36-9.
[5] 李 荣,李 俊,胡成穆,等.橙皮苷对大鼠佐剂性关节炎的治疗作用及机制[J].中国药理学通报,2008,24(4):494-8.
[6] 龙武彬,刘 建,董 巍,等.血清新蝶呤、IL-1、TNF-α联合检测对类风湿关节炎活动性诊断价值的探讨[J].现代预防医学,2010,37(13):2590-2.
[7] 张德忠,温建艳,季伟锋,等.类风湿性关节炎患者IL-6、IL-18 和CRP的水平变化及意义[J].放射免疫学杂志,2009,22 (2):155-7.
[8] 王 勇,滕义建,李前防.类风湿关节炎患者SAA、IL-6水平及意义[J].吉林医学,2010,31(35):6476.
[9] Wang SJ,Tong Y,Lu S,et al.Anti-inflammatory activity ofmyricetin isolated from Myrica rubra Sieb.et Zucc.leaves[J].Planta Med,2010,76(14):1492-6.
[10]Ledeboer A,Gamanos M,Lai W,et al.Involvement of spinal cord NF-κB activation in ratmodels of proinflammatory cytokinemediated pain facilitation[J].Eur J Neurosci,2005,22(8):1977-86.
[11]杨玉荣,佘锐萍,梁宏德.Toll-NF-kB信号途径及其介导的功能[J].细胞生物学杂志,2007,29(4):483-6.
The evaluation of hesperidin derivatives Y-12 anti-inflammatory activity
Tian Yuanyao,Li Jun,Huang Cheng,et al
(School of Pharmacy,Anhui Medical University,Anhui Provincial Laboratory on Bioactivity of Natural Products,Anhui Provincial Engineering Research Center on Active Components of Natural Products,Hefei230032)
Objective To screen out the derivativewith better anti-inflammatory activity of Hesperidin.And itsanti-inflammatory activity was also evaluated then.Methods We stimulated RAW 264.7 cell strainswith lipopolysaccharide(LPS)and then inflammation cytokines tumor necrosis factor alpha(TNF-α)and interleukin 6(IL-6)weremeasured by ELISA.And the anti-inflammatory activity was evaluated on three inflammationmodels(mice ear swelling induced by xylol,mice foot swelling induced by carrageen glue and mice adjuvant-induced arthritis.Resu lts Derivatives of hesperidin 12(HY-12)had better anti-inflammatory activity;HY-12(100,200,400 mg/ kg)on acute inflammation induced by xylene in mice auricle had different degree of inhibition,HY-12(200,400 mg/kg)dose group could significantly inhibit the ear swelling inmice;HY-12(100mg/kg)in 3 h,5 h had obviously inhibitory effectonmice foot swelling,HY-12(200,400 mg/kg)in inflammatory started producing curative effect after 1 h,at all time points itwas significantly inhibited.HY-12 also had certain inhibition to inflammation of rheumatoid arthritismousemodel.HY-12 400 mg/kg could significantly inhibit the secondary side paw swelling,serum inflammatory factors,local inflammatory infiltration and the expression of TNF-αand IL-6 in synovial tissues of adjuvant-induced arthritismice.And nuclear factor kappaB p65 played gets amajor role in regulation of inflammation response.Conclusion The above results show that HY-12 has strong anti-inflammatory activity through regulating the activation of NF-κB.
derivatives of hesperidin;mice;ear swelling;foot swelling;adjuvant-induced arthritis
R 285.25
A
1000-1492(2016)04-0526-05
2015-12-21接收
国家自然科学基金(编号:81473268、81273526);安徽省科技攻关计划项目(编号:1301042212);安徽省自然科学基金(编号:1308085MH145)
安徽医科大学药学院,安徽省天然药物活性研究重点实验室,安徽省天然药物活性成分工程技术研究中心,合肥230032
田远耀,男,硕士研究生;李 俊,男,教授,博士生导师,责任作者,E-mail:lijun@ ahmu.edu.cn

