共感染白纹伊蚊浓核病毒-3对登革2型病毒在蚊细胞内复制的影响研究
郭菁华 王衍海
·论著·
共感染白纹伊蚊浓核病毒-3对登革2型病毒在蚊细胞内复制的影响研究
郭菁华王衍海
273165 曲阜,山东省曲阜师范大学医院防疫科(郭菁华);100052 北京,中国疾病预防控制中心病毒病预防控制所(王衍海)
【摘要】目的研究病毒共感染白纹伊蚊C6/36 细胞后,白纹伊蚊浓核病毒-3(AalDV-3)对登革2型病毒(DENV-2)在细胞内的复制的影响。 方法C6/36 细胞感染AalDV-3后5 d,共感染DENV-2,设立单独感染AalDV-3与DENV-2为对照组。共感染后不同时间点,qPCR法检测病毒的拷贝数;共聚焦显微镜检测DENV-2感染率;共感染后37 ℃孵育24 h后,于1~2 d以流式细胞术检测细胞凋亡率。结果共感染后不同时间点,共感染组相对于DENV-2单独感染组,DENV-2基因拷贝数均明显下降(P<0.05),其中第8 d病毒滴度降低率达到最高的67%。共感染组DENV-2细胞阳性率均低于40%,明显低于DENV-2单独感染(>70%, P<0.05)。流式细胞术结果显示,共感染组1~2 d细胞凋亡率分别为23.43±1.02%和52.83±1.18%,明显低于DENV-2单独感染组凋亡率59.43±1.23%和96.21±1.87%(P<0.05)。结论病毒共感染白纹伊蚊C6/36 细胞后, AalDV-3可降低对DENV-2拷贝数,降低DENV-2细胞感染率,减少DENV-2诱导的细胞凋亡,AalDV-3具有防制蚊媒传染病的潜在价值。
【主题词】登革热病毒;伊蚊属;浓核病毒,蚊
蚊浓核病毒(Mosquito densoviruses,MDV)是一类蚊类特异性的细小病毒科(Parvoviridae),对蚊虫的病原作用较弱,属蚊虫共生微生物(Symbiotic microorganism),其广泛存在于自然界的蚊类种群中[1]。本研究以白纹伊蚊浓核病毒-3(Aedes albopictus densovirus-3,AalDV-3)与登革2型病毒(Dengue virus type 2,DENV-2)共感染我国登革热主要媒介白纹伊蚊(Aedesalbopictus)C6/36细胞系,探讨共感染AalDV-3对DENV-2在蚊细胞内复制的抑制作用与DENV-2对蚊细胞的感染率的影响,探寻登革防治的新策略。
1材料与方法
1.1细胞与病毒株白纹伊蚊C6/36 细胞系为本室保种;质粒pUCP与DENV-2病毒新几内亚株(New guinea-C, NGC)由南方医科大学病原生物学系顾金保教授惠赠。
1.2细胞培养与病毒的获得C6/36细胞使用10%胎牛血清的RPMI-1640(美国Life Tech公司)培养基28 ℃培养。 pUCP为包含AalDV-3全长基因组的感染性克隆,C6/36细胞融合度至70%以上时转染pUCP,转染后3 d反复冻融3次,1 200 r/min离心15 min,上清液经2 μm滤膜过滤即为AalDV-3原液-C6/36细胞传代后2 d接种DENV-2病毒,25 cm2细胞培养瓶入300 μl(TCID50=10-7/0.1 ml)病毒悬液,染后5 d,反复冻融后5 000 r/min离心30 min,上清为DENV-2悬液。
1.3病毒的定量AalDV-3:利用Omega Biotek(美国Omega 公司)提取病毒基因组为模板,使用Real Master Mix qPCR试剂盒(北京Tiangen公司),以引物DV-3F:5′-CAGGAGGAAACAGCACAAGA-3′、DV-3R:5′-GTTTCGATACCGTAACGGATGC-3′,线性化pUCP为标准品进行绝对定量分析。反应条件: 95 ℃ 5 min;之后95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共30个循环。DENV-2:使用TRIzol® Reagent(美国Life Tech公司)提取总RNA,TIANscript RT Kit(北京 Tiangen公司)进行cDNA第一链合成。DENV-2的 NS5 片段克隆入载体pLB线性化后作为标准品,以引物 DENV-2F: 5′-TCCCTTACAAATCGCAGCAAC-3′、DENV-2R: 5′-TGGTCTTTCCCAGCGTCAAT-3′进行绝对定量检测,反应条件:95 ℃ 3 min;之后95 ℃ 50 s,55 ℃ 50 s,共30个循环。
1.4病毒的共感染以浓度1×108拷贝/ml AalDV-3 100 μl于6孔板感染C6/36细胞,感染后5 d加入3×106拷贝/ml DENV-2 100 μl共感染,每两天对样品AalDV-3与DENV-2的基因拷贝与C6/36细胞感染率进行检测,共进行10 d。设立DENV-2与AalDV-3单独感染为对照。
1.5共聚焦显微镜检测C6/36细胞DENV-2感染率PBS漂洗细胞后4%多聚甲醛固定30 min, PBS再漂洗3次后加 0.5% TritonX-100室温孵育15 min。PBS漂洗后5%胎牛血清室温封闭30 min,加FITC标记抗DEV-2 E蛋白多克隆抗体(英国Biorbyt公司)(1∶200稀释),避光4 ℃ 孵育2 h。同时使用DAPI进行细胞核染色(瑞士Roche公司),荧光封片剂封片后激光共聚焦显微镜(德国 Zeiss 公司)拍照,每孔随机观察3个视野, 每视野观察100个细胞,计数绿色荧光的细胞百分率。
1.6流式细胞术检测C6/36细胞凋亡率共感染方法同上,共感染温度设为37 ℃ 24 h,以单独感染DENV-2与AalDV-3为对照,感染后置回27 ℃培养,分别于培养后1~2 d以预冷PBS洗涤后,加入300 μl的 1×binding buffer重悬细胞; 细胞悬液移至测量管,加入5 μl Annexin V-FITC(自美国 BioVision公司),室温避光放置 15 min,再加入5 μl PI行流式细胞仪检测。
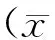
2结果
2.1共感染后AalDV-3对DENV-2的增殖影响为检测共感染后AalDV-3对DENV-2的增殖影响,于共感染后0、2、4、6、8、10 d对两种病毒的基因拷贝数进行了绝对定量分析。结果显示,共感染组在共感染后不同时间点AalDV-3的基因拷贝数逐渐增高,至感染后第6天达到顶峰,基因拷贝数增加了5倍左右,与单独感染AalDV-3组相比病毒基因拷贝数在各个时间点无统计学差异(P>0.05)(图1A)。感染组DENV-2基因拷贝数于共感染后缓慢增长,至第10 d增长约4倍左右,而单独感染DENV-2组病毒基因拷贝数随浓度迅速增高,在感染后第8d达到顶峰,基因拷贝数增长了10倍(图1B),共感染组与单独感染组相比较,DENV-2病毒基因拷贝数显著降低,证明共感染AalDV-3抑制了DENV-2在蚊C6/36细胞内的复制。
共感染组与单独感染组感染后不同时间点病毒基因拷贝数A:AalDV-3;B:DENV-2 图1 共感染AalDV-3对DENV-2在蚊C6/36细胞内增殖的影响Gene copy numbers of AalDV-3(A)and DENV-2(B)in single infection and coinfection group at different time points post infectionFig.1 Influence of growth of DENV-2 in mosquito C6/36 cells post-coinfected with AalDV-3

A 单感染组与共感染组共感染后不同时间点的C6/36细胞DENV-2阳性率;B 共感染4 d后免疫共聚焦显微镜显示绿色荧光的DENV-2抗原阳性C6/36细胞,蓝色显示DAPI染色细胞核图2 共感染AalDV-3后对C6/36细胞DENV-2感染率的影响A:Percentage of DENV-2 positive C6/36 cells in single infection and coinfection group at different time points post infection; B: Merged image of Confocal microscope photomicrographs of immunouorescence with DAPI stained nuclei from C6/36 cell of single infection and coinfection group at 4 d post coinfectionFig.2 Influence of percentage of DENV-2 positive C6/36 cells post-coinfected with AalDV-3
2.2共感染AalDV-3后降低细胞DENV-2感染率为了检测共感染后DENV-2对C6/36细胞的感染率的变化,我们于共感染后不同时间使用共聚焦显微镜,对C6/36细胞的DENV-2感染率进行了分析。结果显示,单独感染DENV-2组在不同时间点C6/36细胞的DENV-2感染率均达到70%以上;而共感染组,不同时间点C6/36细胞的DENV-2感染相对于对照组显著下降,最高不超过40%。图2B可见,在共感染后4 d,使用FITC标记的抗DENV-2 E蛋白抗体检测到的绿色荧光的DENV-2阳性细胞数要远远低于单独感染DENV-2对照组。
2.3共感染AalDV-3后降低C6/36细胞凋亡率通过三次重复实验,流式细胞术检测共感染后1 d与2 d各组C6/36细胞凋亡率分别为:共感染组(23.43±1.02%、52.83±1.18%),AalDV-3感染组(1.23±0.26、1.78±0.33%)和DENV-2感染组(59.43±1.23%、96.21±1.87%),空白对照组(1.10±0.32%、1.44±0.29%)。共感染组与单独感染DENV-2组比较,细胞凋亡率均明显降低,尤其在感染后2 d细胞凋亡率降低接近50%,差异有统计学意义(P<0.05)。证明共感染后AalDV-3有效地抑制了登革病毒诱导C6/36细胞凋亡的作用。而单独感染AalDV-3,细胞凋亡率与空白对照组无统计学差异(P>0.05),证实AalDV-3本身并不会对宿主细胞C6/36细胞有明显的诱导凋亡作用。
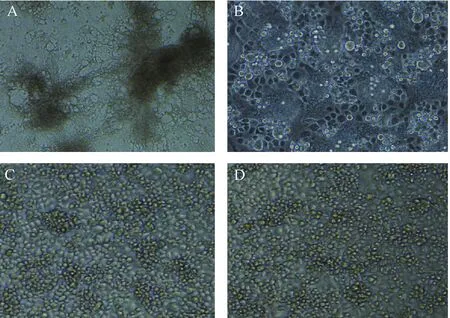
A DENV-2感染组; B 共感染组; C AalDV-3感染组; D 空白对照组图3 单感染与共感染组于共感染后2 d C6/36细胞形态A DENV-2 infected group; B co-infection group;C AalDV-3 infected group; D bank controlFig.3 Image of C6/36 cells of single infection and co-infection group at 2 d post co-infection
3讨论
蚊类体内有多种细菌、病毒和真菌等共生体,随着对这些共生体研究的深入,它们显示出蚊媒控制的潜在价值,例如沃尔巴克氏体(Wolbachia)具有影响蚊虫寿命、繁殖能力、性别分化等效应,已经初步应用于蚊虫的控制,并在我国广东地区进行了大规模的现场实验[2]。此外,蚊虫共生体可通过多种复杂的机制在蚊虫体内抑制某些病原体的感染、繁殖从而抑制某些蚊媒传染,比如沃尔巴克氏体可有效抑制登革病毒、基孔肯雅病毒(Chikungunya virus, CHIKV)、西尼罗病毒(West Nile Virus, WNV)等[3]的繁殖从而降低媒介能量,防制媒介传染病。MDV属于蚊虫特异的病毒共生体,生物安全性高,蚊种群中广泛分布,可水平传播、垂直传播在种群内扩散[4]。我们的研究结果证实,AalDV-3在蚊细胞内可以抑制DENV-2对蚊细胞的感染率,同时降低DENV-2拷贝数,这种多重感染后病毒的相互影响也见于恩湖米里姆病毒(Nhumirim virus,NHUV)对西尼罗病毒的抑制[5],辛德毕斯病毒(Sindbis virus,SINV)对DENV-4的抑制[6]。其主要机制可能是:首先建立感染的病毒利用了细胞内用于病毒复制、转录、翻译的资源,造成之后入侵的病毒缺少这些必要胞内的资源;其次这些病毒可能具有竞争细胞膜受体的情况,导致一种病毒拮抗另一种病毒入胞;此外首先入侵的病毒可能触发细胞的诸如RNA干扰(RNA interference,RNAi)等免疫进程,从而抑制其它病毒的再次定殖[7,8]。蚊作为媒介可以传播多种病毒性传染病,而蚊体内多种病毒之间的拮抗作用有可能成为一种我们控制病毒的策略[9]。我们的研究显示,AalDV-3具有在媒介细胞内拮抗登革病毒的能力,有助于我们发展其为抗登革病毒在媒介体内传播的生物防制工具。可通过在野外蚊虫孳生地播撒病毒,感染蚊虫种群,使其再感染登革病毒的几率降低或降低媒介能量。此外,由于病毒基因组已经克隆入质粒载体构建成传染性克隆[10],利于通过基因工程方法对其进行改造,使其表达针对登革病毒的抗原分子或小分子RNA,最终达到登革防制的目的。
4参考文献
[1]Carlson J, Suchman E, Buchatsky L. Densoviruses for control and genetic manipulation of mosquitoes[J]. Adv Virus Res, 2006, 68:361-392. doi:10.1016/S0065-3527(06)68010-X.
[2]Zhang D, Lees RS, Xi Z, et al. Combining the sterile insect technique with wolbachia-based approaches: II—a safer approach to aedes albopictus population suppression programmes, designed to minimize the consequences of inadvertent female release[J].PLoS One, 2015,10(8):e0135194. doi:10.1371/journal.pone.0135194.
[3]Johnson KN. The impact of wolbachia on virus infection in mosquitoes[J]. Viruses,2015,7(11):5705-5717.doi:10.3390/v7112903.
[4]Afanasiev B, Carlson J. Densovirinae as gene transfer vehicles[J].Contrib Microbiol,2000,4:33-58. doi:10.1159/000060330.[5]Goenaga S, Kenney JL, Duggal NK, et al. Potential for Co-Infection of a Mosquito-Specific Flavivirus, Nhumirim Virus, to Block West Nile Virus Transmission in Mosquitoes[J]. Viruses, 2015, 7(11):5801-5812. doi:10.3390/v7112911.
[6]Muturi EJ, Bara J. Sindbis virus interferes with dengue 4 virus replication and its potential transmission by Aedes albopictus[J]. Parasit Vectors, 2015,8:65. doi:10.1186/s13071-015-0667-y.[7]Olson KE, Blair CD. Arbovirus-mosquito interactions: RNAi pathway[J]. Curr Opin Virol, 2015, 15:119-126. doi: 10.1016/j.coviro.2015.10.001.
[8]Blair CD, Olson KE. The role of RNA interference (RNAi) in arbovirus-vector interactions[J]. Viruses, 2015, 7(2):820-843. doi: 10.3390/v7020820.
[9]O′Neal ST, Samuel GH, Adelman ZN, et al. Mosquito-borne viruses and suppressors of invertebrate antiviral RNA silencing[J]. Viruses, 2014,6(11):4314-4331. doi: 10.3390/v6114314.[10]Pham HT, Jousset FX, Perreault J, et al. Expression strategy of Aedes albopictus densovirus[J]. J Virol, 2013,87(17):9928-9932. doi: 10.1128/JVI.01259-1.
通信作者:郭菁华,Email:gonghui6785@163.com
DOI:10.3760/cma.j.issn.1003-9279.2016.03.004
(收稿日期:2016-04-06)
Co-infection of a mosquito- specific aedes albopictus densovirus-3 to influence dengue 2 virus replication in mosquito cell
GuoJinghua,WangYanhai
DepartmentofPreventionandHealthCare,HospitalofQufuNormalUniversity,Qufu273165,China(GuoJH);NationalInstituteforViralDiseaseControlandPrevention,Beijing102206,China(WangYH)Correspondingauthor:GuoJinghua,Email:gonghui6785@163.com
【Abstract】ObjectiveTo study co-infection of a mosquito-specific Aedes albopictus densovirus-3 (AalDV-3) to interfere dengue virus type 2 (DENV-2) replication in mosquito cell. MethodsCo-infected Ae.albopictus C6/36 cell with DENV-2 at 5 days post AalDV-3 infection, and DENV-2 and AalDV-3 single infected cell were used as control groups, respectively. The genome copy number of virus were quantified using real-time quantitative PCR (qPCR), percentage of DENV-2 positive C6/36 cells were determined by confocal microscope, apoptosis ratio of infected C6/36 cell were detected using flow cytometry at different time points post infection. ResultsThe genome copy number of DENV-2 in co-infection group was significantly lower than that of single DENV-2 infection group at different time points post infection, and reached highest inhibitory ratio (67%) at 8 days post co-infection. DENV-2 antigen positive C6/36 cells of co-infection displayed significant lower percentage (>40%) than that of single infection group (>70%, P<0.05) at different time points post infection. The apoptosis ratio of C6/36 cell in co-infection group were 23.43±1.02% and 52.83±1.18% at 1 and 2 day post infection, that were lower than that of single infection group (59.43±1.23% and 96.21±1.87%, P<0.05). ConclusionsCo-infected Aedes albopictus C6/36 cell with AalDV-3 can down regulate the gene copy number of DENV-2 in cell, infected cell ratio and apoptosis ratio, and AalDV-3 has the potential as a tool for dengue control.
【Key words】Dengue virus;Aedes; Densovirus, Mosquito

