2005
—2014年CHINET沙门菌属细菌耐药性监测
许云敏, 杜 艳, 单 斌, 王传清, 薛建昌, 张 泓, 王 春, 徐英春,张小江, 孙自镛, 简 翠, 汪 复, 朱德妹, 杨 青, 倪语星, 孙景勇,胡志东, 李 金, 卓 超0, 苏丹虹0, 张朝霞, 季 萍, 俞云松, 林 洁,魏莲花, 吴 玲, 徐元宏, 沈继录, 胡云建, 艾效曼, 褚云卓, 谢 轶,康 梅, 韩艳秋, 郭素芳, 贾 蓓, 黄文祥
2005
—2014年CHINET沙门菌属细菌耐药性监测
许云敏1, 杜 艳1, 单斌1, 王传清2, 薛建昌2, 张泓3, 王春3, 徐英春4,张小江4, 孙自镛5, 简翠5, 汪复6, 朱德妹6, 杨青7, 倪语星8, 孙景勇8,胡志东9, 李金9, 卓超10, 苏丹虹10, 张朝霞11, 季萍11, 俞云松12, 林洁12,魏莲花13, 吴玲13, 徐元宏14, 沈继录14, 胡云建15, 艾效曼15, 褚云卓16, 谢轶17,康梅17, 韩艳秋18, 郭素芳18, 贾蓓19, 黄文祥19
摘要:目的 了解2005年1月—2014年12月CHINET细菌耐药性监测网成员医院临床分离沙门菌属细菌的分布及耐药性。方法 对临床分离的沙门菌属细菌,按照统一方案,采用纸片扩散法或自动化仪器法进行药敏试验,结果按CLSI 2014年标准判读,数据统计用WHONET5.6进行分析。结果 10年间,沙门菌属细菌的检出率呈上升趋势:2005年为0.2%,2014年为0.7%。3 478株沙门菌属细菌中,鼠伤寒沙门菌954株(27.4 %),肠炎沙门菌849株(24.4 %)。药敏试验结果显示,沙门菌属细菌对氨苄西林耐药率最高(33.3 %~64.8 %),对头孢哌酮-舒巴坦、环丙沙星耐药率低,分别为0~5.3%、2.4%~14.3%。鼠伤寒沙门菌耐药率高于伤寒沙门菌、副伤寒沙门菌及肠炎沙门菌,对氨苄西林和甲氧苄啶-磺胺甲�唑耐药率高,分别为76.8 %和50.5 %。多重耐药沙门菌属细菌10年平均检出率为3.9 %,2005年检出率最高,为7.5 %,2013年检出率最低,为1.5 %。结论 我国流行的沙门菌属以鼠伤寒沙门菌和肠炎沙门菌为主。鼠伤寒沙门菌的耐药率较高,氨苄西林、甲氧苄啶-磺胺甲唑已不适于临床经验用药。沙门菌属对第三代头孢菌素及喹诺酮类抗菌药物仍维持较高的敏感率,对多重耐药沙门菌属仍需持续行耐药性监测。
关键词:沙门菌; 抗菌药物; 多重耐药; 细菌耐药性监测
沙门菌属是导致人类感染的常见病原菌。该菌主要通过污染食品和水源经口感染,可引起人类和动物的感染,主要分为伤寒和非伤寒沙门菌感染,
其中伤寒为血流感染的表现,而非伤寒沙门菌感染通常表现为肠道感染,可引起腹泻、发热和腹痛等。
非伤寒沙门菌感染是世界范围内的重要公共卫生问题之一[1],据报道,每年全世界有9 380万人因感染沙门菌引起胃肠炎症,15.5万人死于沙门菌感染[2]。在我国由沙门菌引起的食物中毒和食源性疾病一直排名前三[3]。现将2005—2014年CHINET
细菌耐药性监测网沙门菌属细菌耐药性监测结果报道如下。
1 材料与方法
1.1材料
1.1.1 菌株 收集2005年1月—2014年12月中国主要地区19所医院临床分离的沙门菌。剔除同一患者相同部位分离的重复菌株。
1.1.2 培养基和抗菌药物纸片 药敏试验用MH琼脂,抗菌药物纸片为英国OXOID公司或美国BBL公司。
1.2方法
1.2.1 药敏试验 按统一方案进行细菌对抗菌药的敏感性试验,采用CLSI 2014推荐的纸片扩散法或自动化仪器法进行药敏试验[4]。质控菌株为大肠埃希菌ATCC 25922和铜绿假单胞菌ATCC 27853。
1.2.2 多重耐药(MDR)定义 对3种及以上不同结构抗菌药物发生耐药者。本文中设定为:对氨苄西林、环丙沙星及甲氧苄啶-磺胺甲唑耐药者。
1.2.3 结果统计 采用WHONET 5.6分析细菌对抗菌药物的耐药性,SPSS 17.0进行χ2检验分析,P<0.05为差异有统计学意义。
2 结果
2.1菌种分布
2005年1月—2014年12月的10年间,沙门菌属细菌的检出率呈上升趋势:2005年为0.2%,2014年为0.7%,见表1。共收集3 478株沙门菌属细菌,其中门诊收集1 793株,占51.6 %,住院为1 685株,占48.4 %。标本中,粪便74.7 %,血液19.7 %,尿液1.0 %,骨髓0.6 %,脓液0.58 %,其他标本3.4 %。

表1 沙门菌属细菌在所有临床分离株中的检出率Table 1 Proportion of Salmonella isolates among all clinical isolates by year from 2005 to 2014
3 478株沙门菌共检测到55个血清型,有556株(16.0%)未分型。以鼠伤寒沙门菌(954株,27.4 %)、肠炎沙门菌(849株,24.4 %)为主,其他依次为甲型副伤寒沙门菌255株(6.8 %)、伤寒沙门菌224株(6.4 %)等,见表2。
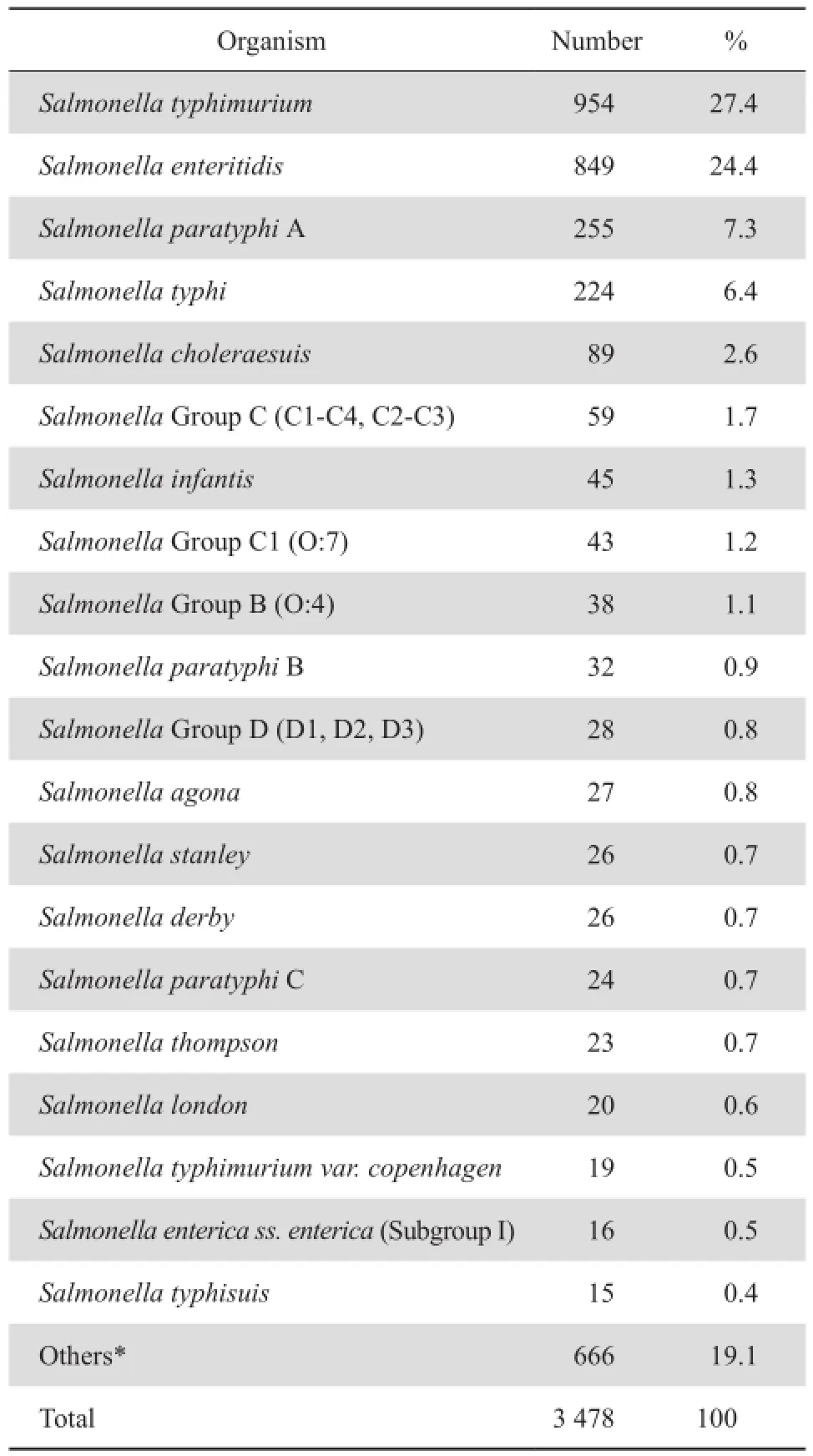
表2 2005—2014年沙门菌属细菌分布Table 2 Distribution of Salmonella species from 2005 to 2014
儿童分离株(2 413/3 478,69.4%)高于成人分离株(1 065/3 478,30.6%),且两者在标本来源及菌种间有差异。儿童标本主要分离自粪便标本(2 266/2 413,93.9 %),以鼠伤寒沙门菌(37.2 %)和肠炎沙门菌为主(32.4 %);分离自血液标本107株( 4.4 %),检出率依次为伤寒沙门菌(28.0%)、甲型副伤寒沙门菌(19.6 %)和猪霍乱沙门菌(12.1%)等。成人分离株以血液为主(541/1 065,50.8 %),检出率依次为甲型副伤寒沙门菌(37.5%)、伤寒沙门菌(19.6 %)和猪霍乱沙门菌(7.4 %)等;粪便标本检出率依次为鼠伤寒沙门菌(22.7 %),肠炎沙门菌(15.0 %)等,见表3。
2.2沙门菌对抗菌药物的耐药率和敏感率
2005—2014年沙门菌属细菌对抗菌药物的耐药率和敏感率无规律性改变,在所检测抗菌药物中对氨苄西林耐药率最高,为33.3 %~64.8 %,对头孢哌酮-舒巴坦,环丙沙星耐药率低,分别为0~5.3%,2.4 %~14.3 %,见表4。686株分离自血液的沙门菌属细菌,对氨苄西林耐药率最高,为32.8 %,对头孢哌酮-舒巴坦耐药率最低,为1.0%;而2 597株分离自粪便沙门菌属细菌同样对氨苄西林耐药率最高,对头孢哌酮-舒巴坦最低,分别为65.1 %和1.4 %。整体上粪便分离株对所检测抗菌药物的耐药率均高于血液分离株,见表5。
伤寒和副伤寒沙门菌对抗菌药物的耐药率(除环丙沙星、甲氧苄啶-磺胺甲唑外)低于其他沙门菌属细菌;鼠伤寒沙门菌耐药率普遍高于其他沙门菌属,见表6。伤寒和副伤寒沙门菌儿童分离株对氨苄西林、氨苄西林-舒巴坦、头孢曲松、甲氧苄啶-磺胺甲唑及氯霉素的耐药率高于成人株(P<0.05);而在其他沙门菌属中肠类沙门菌儿童株对氨苄西林、氯霉素耐药率高于成人株,对头孢哌酮-舒巴坦耐药率低于成人株;鼠伤寒沙门菌对氨苄西林-舒巴坦及氯霉素的耐药率儿童株低于成人株外,儿童分离株与成人分离株对抗菌药物耐药率差异大多无统计学意义(P>0.05)。除伤寒和副伤寒沙门菌住院分离株对氨苄西林耐药率低于门诊,肠炎沙门菌住院分离株对氨苄西林-舒巴坦、头孢哌酮-舒巴坦的耐药率高于门诊分离株;鼠伤寒沙门菌住院分离株对头孢曲松的耐药率(26.5 %)高于门诊分离株(14.2 %),差异有显著统计学意义(P<0.05)外,沙门菌属细菌住院分离株和门诊分离株对抗菌药物耐药率间差异无统计学意义(P>0.05),见表7、8。
2.3MDR沙门菌属
10年间,MDR沙门菌数量总体呈螺旋形下降,2005年和2009年检出率高,分别为7.5 %和7.2 %,2013年检出率最低,为1.2 %,平均检出率为3.9%。2014年(3.0 %)与2005年(7.5 %)相比下降明显。MDR菌株主要存在于鼠伤寒沙门菌(59.5 %,75/126),平均检出率为8.3 %,显著高于其他沙门菌属。见表9。

表3 成人和儿童分离的沙门菌属细菌在血液及粪便标本中的分布Table 3 Distribution of Salmonella species isolated from blood and stool of adults versus children
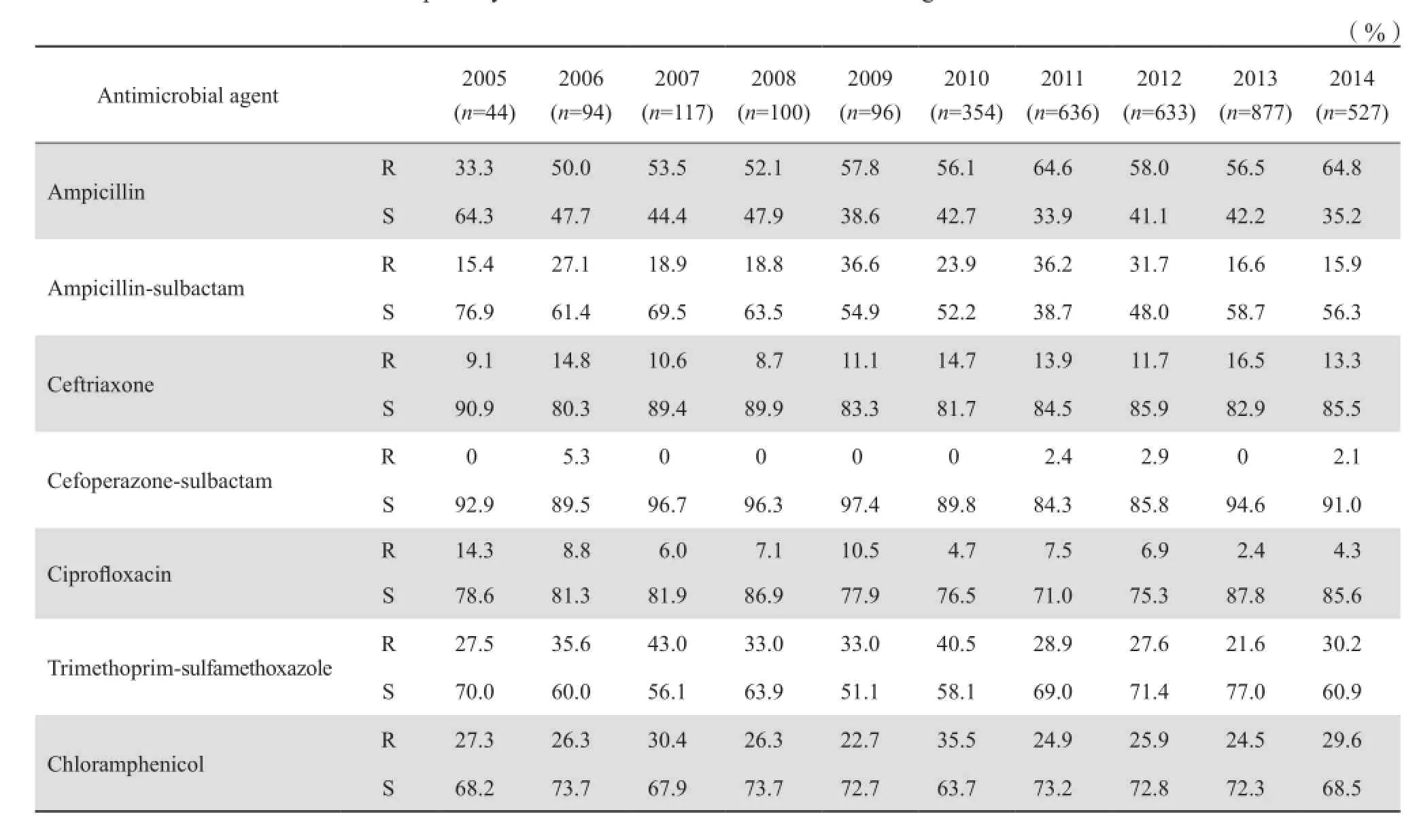
表4 2005—2014年沙门菌属细菌对抗菌药物的耐药率和敏感率Table 4 Susceptibility of Salmonella isolates to antimicrobial agents from 2005 to 2014

表5 血液和粪便标本分离沙门菌属细菌对抗菌药物的耐药率和敏感率Table 5 Susceptibility of Salmonella isolates from blood and stool to antimicrobial agents

表6 伤寒和副伤寒沙门菌、肠炎沙门菌和鼠伤寒沙门菌对抗菌药物耐药率和敏感率Table 6 Susceptibility of S. typhi and S. paratyphi, S. enteritidis and S. typhimurium to antimicrobial agents from 2005 to 2014

表7 成人及儿童患者沙门菌属细菌对抗菌药物的耐药率和敏感率Table 7 Susceptibility of the Salmonella isolates from children and adults to antimicrobial agents
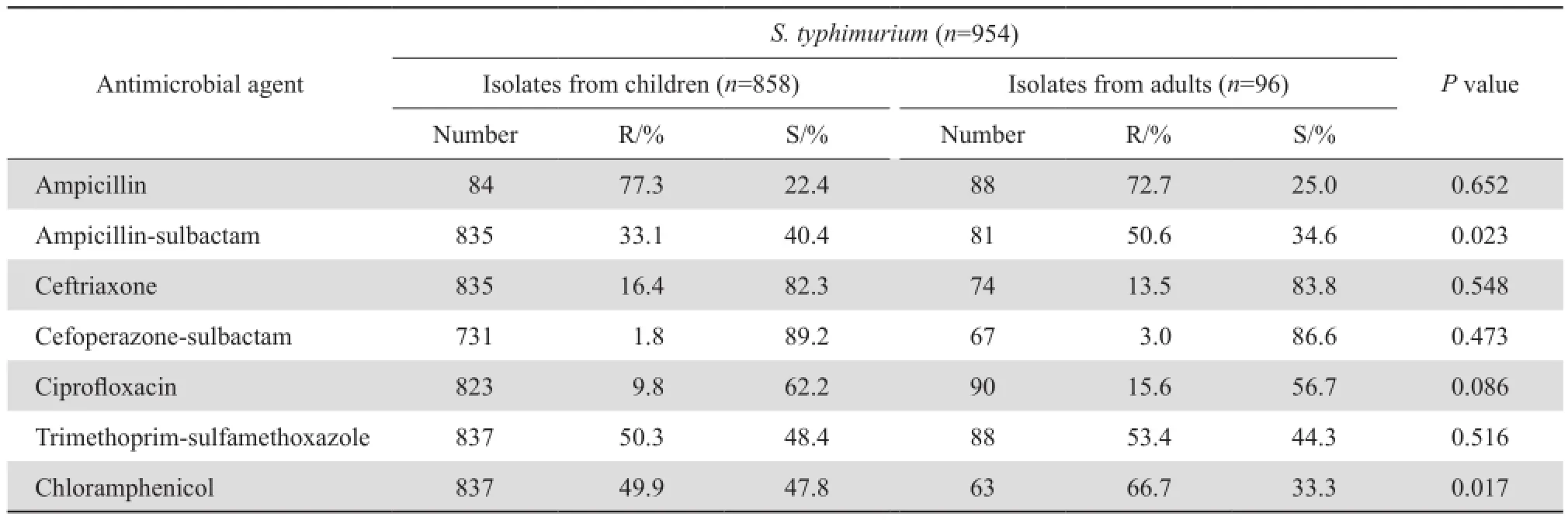
表7(续)Table 7 (continued)

表8 门诊与住院患者沙门菌属细菌对抗菌药物的耐药率和敏感率Table 8 Susceptibility of the Salmonella isolates from outpatients and inpatients to antimicrobial agents
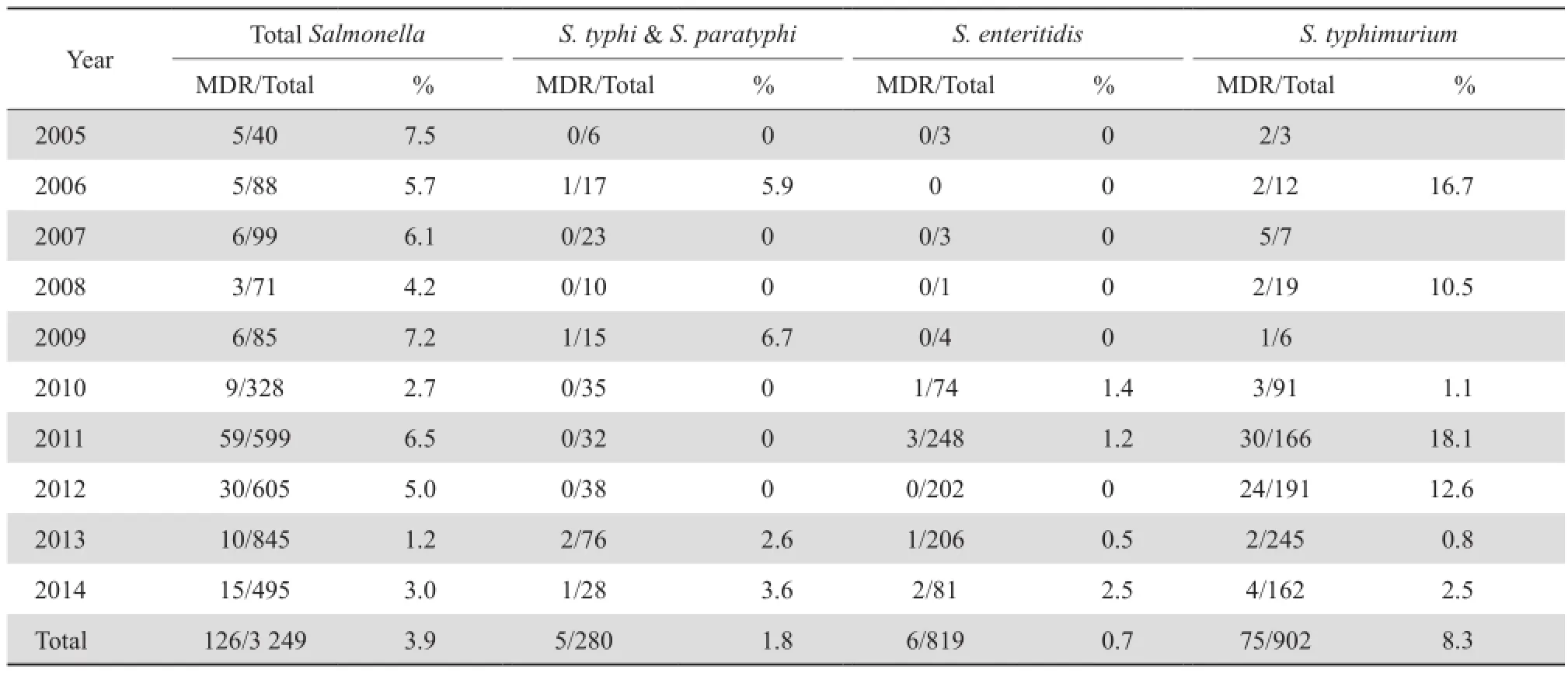
表9 2005—2014年多重耐药沙门菌的检出率Table 9 Prevalence of multidrug-resistant Salmonella isolates from 2005 to 2014
3 讨论
沙门菌属是肠杆菌科的一个菌属,可从人和动物中分离得到,根据抗原结构,有2 500多个血清型,其致病性具有种系特异性,例如人是伤寒、副伤寒A、B、C沙门菌的天然宿主;有些专对动物致病,也有些菌种对人和动物都能致病。沙门菌主要通过污染食品和水源经口感染,引起人类和动物的沙门菌病,出现相应的临床症状或亚临床感染,主要分为伤寒和非伤寒沙门菌感染,其中伤寒沙门菌为血流感染的表现,非伤寒沙门菌通常表现为肠道感染,引起患者腹泻、发热和腹痛,少数引起肠道外感染,可致血流感染、泌尿道感染和中耳炎,常发生在免疫低下患者。
在分离的3 478株沙门菌中,检出率最高的是鼠伤寒沙门菌,检出率为27.4 %,其次为肠炎沙门菌,检出率为24.4 %,二者占51.8 %,显示我国流行的沙门菌属以鼠伤寒沙门菌和肠炎沙门菌为主。在所分离的沙门菌属细菌中,成人标本来源以血液为主,占50.8 %;儿童以粪便为主,占93.9 %。成人血液标本中的沙门菌检出最高的为甲型副伤寒(37.5%),粪便标本检出最高的为鼠伤寒沙门菌(22.7 %);儿童血液标本中检出最高的为伤寒沙门菌,占28.0 %,粪便标本中以鼠伤寒沙门菌(37.2 %)和肠炎沙门菌(32.4 %)为主,监测结果显示,沙门菌属在不同的标本来源,构成有所不同。沙门菌属感染,成人以甲型副伤寒感染为主,伤寒为主要临床症状;儿童因其免疫力较低,胃肠道抵抗力弱,较成人易感,感染以非伤寒沙门菌为主,腹泻为其主要临床症状。鼠伤寒沙门菌和肠炎沙门菌为主要病原菌与国内研究相似[5]。
监测资料表明,尽管10年间伤寒沙门菌属细菌的耐药性变化不大,但不同血清型的沙门菌对抗菌药物耐药率有所差异。鼠伤寒沙门菌的耐药率普遍高于其他沙门菌,其对氨苄西林的耐药率为76.8 %,对甲氧苄啶-磺胺甲唑的耐药率亦达50.6 %,对头孢曲松耐药率为16.2 %,对环丙沙星呈低度耐药,为10.3 %,对头孢哌酮-舒巴坦仍高度敏感。CLSI 2014推荐[4],对于分离于肠道内和肠道外的伤寒沙门菌,以及A群至C群的沙门菌临床只需常规测试并报告氨苄西林、一种氟喹诺酮类和甲氧苄啶-磺胺甲唑。从本次监测的药敏结果来看对鼠伤寒沙门菌临床使用氨苄西林和甲氧苄啶-磺胺甲唑的临床治疗失败可能性较大,已不适于在临床推广使用。
在我国长期以来,畜牧业为治疗或预防疾病,抗菌药物被广泛添加到动物饲料中,致使沙门菌耐药不断上升,而沙门菌感染是人畜共患病,其耐药性可在沙门菌间相互传播。MDR的沙门菌已成为许多国家临床医学和兽医医学所面临的主要问题[6]。MDR的沙门菌的传播较为复杂,可通过污染的肉类食品传播[7],导致人致病,其耐药性可通过质粒等可移动原件在细菌间进行水平传播[8]。有研究显示,在被沙门菌污染的食品中分离到的沙门菌MDR率较高[1,9],因此,尽管本监测中临床分离株的MDR率较低(1.2 %~7.5 %),但对其耐药性的监测仍有必要。加强细菌耐药性监测和流行病学调查,加强临床用药的科学性和严谨性,将对预防和控制沙门菌感染的发生、延长抗菌药物的使用寿命和减少耐药菌的发生和发展起到重要作用。
参考文献:
[1]ASGHARPOUR F, RAJABNIA R, FERDOSI SHAHANDASHTI E, et al. Investigation of class I integron in Salmonella infantis and its association with drug resistance[J]. Jundishapur J Microbiol, 2014, 7(5): e10019.
[2]MAJOWICZ SE, MUSTO J, SCALLAN E, et al. The global burden of nontyphoidal Salmonella gastroenteritis[J]. Clin Infect Dis, 2010, 50(6):882-889.
[3]许学斌,顾宝柯,金汇明,等. 上海市沙门菌血清型流行特征[J].中国人兽共患病学报,2009,25(2):156-158.
[4]Clinical and Laboratory Standards Institute. Performance standardsfor antimicrobial susceptibility testing[S].Tweentyfourth formational supplement, 2014, M100-S24.
[5]陈强,余晓君,李俏俏,等.引起儿童腹泻的沙门菌属临床分离株的耐药特点及分子流行病学研究[J].中华检验医学杂志,2011,3(34):249-253.
[6]RAHMANI M, PEIGHAMBARI SM, SVENDSEN CA, et al. Molecular clonality and antimicrobial resistance in Salmonella enterica serovars Enteritidis and Infantis from broilers in three Northern regions of Iran[J]. BMC Vet Res, 2013:9:66.
[7]NÓGRÁDY N, TÓTH A, KOSTYÁK A, et al. Emergence of multidrug-resistant clones of Salmonella Infantis in broiler chickens and humans in Hungary[J]. J Antimicrob Chemother,2007, 60(3):645-648.
[8]叶金艳,祝建军,李英龙,等.多重耐药志贺菌临床分离株耐药基因检测及指标聚类分析[J].中国人兽共患病学报,2013,29(9):929-933.
[9]ÁLVAREZ-FERNÁNDEZ E, ALONSO-CALLEJA C,GARCÍA-FERNÁNDEZ C, et al. Prevalence and antimicrobial resistance of Salmonella serotypes isolated from poultryin Spain:comparison between 1993 and 2006[J]. Int J Food Microbiol,2012, 153(3):281-287.
2.复旦大学附属儿科医院;
3.上海交通大学附属儿童医院;
4.北京协和医院;
5.华中科技大学同济医学院附属同济医院;
6.复旦大学附属华山医院;7.浙江大学附属第一医院;
8.上海交通大学医学院附属瑞金医院;
9.天津医科大学总医院;
10.广州医科大学附属第一医院;
11.新疆医科大学第一附属医院;
12.浙江大学医学院附属邵逸夫医院;
13.甘肃省人民医院;
14.安徽医科大学第一附属医院;
15.北京医院;
16.中国医科大学附属第一医院;
17.四川大学华西医院;
18.内蒙古医科大学附属医院;
19.重庆医科大学附属第一医院。
中图分类号:R378.22
文献标识码:A
文章编号:1009-7708(2016)03-0294-08
DOI:10.16718/j.1009-7708.2016.03.009
收稿日期:2015-03-26 修回日期:2015-11-22
作者单位:1.昆明医科大学第一附属医院检验科,昆明 650032;
作者简介:许云敏(1979—),女,硕士,主管检验师,主要从事临床微生物学检验和细菌耐药性监测工作。
通信作者:单斌,E-mail:shanbin6@139.com。
Resistance profile of Salmonella isolates in hospital across China: results from CHINET Antimicrobial Resistance Surveillance Program,2005-2014
XU Yunmin, DU Yan, SHAN Bin, WANG Chuanqing,XUE Jianchang, ZHANG Hong, WANG Chun, XU Yingchun, ZHANG Xiaojiang, SUN Ziyong, JIAN Cui, WANG FU, ZHU Demei, YANG Qing, NI Yuxing,SUN Jingyong, HU Zhidong, LI Jin, ZHUO Chao,SU Danhong, ZHANG Zhaoxia, JI Ping, YU Yunsong,LIN Jie, WEI Lianhua, WU Ling, XU Yuanhong,SHEN Jilu, HU Yunjian, AI Xiaoman, CHU Yunzhuo,XIE Yi, KANG Mei, HAN Yanqiu, GUO Sufang, JIA Bei, HUANG Wenxiang. (Department of Laboratory Medicine, First Affiliated Hospital of Kunming Medical University, Kunming 650032, China)
Abstract:Objective To investigate the distribution and changing resistance profle of Salmonella isolates in hospitals across China during the period from January 2005 to December 2014. Methods Seventeen general hospitals and two children's hospitals were involved in this program. Antimicrobial susceptibility testing was carried out by means of a unified protocol using Kirby-Bauer method or MIC determination. The results were analyzed according to CLSI 2014 breakpoints. Results The proportion of Salmonella isolates increased with time from 0.2% in 2005 to 0.7% in 2014. A total of 3 478 Salmonella strains were collected from 19 hospitals. The proportion of Salmonella typhimurium and Salmonella enteritidis was 27.4% and 24.4%, respectively. During the 10-year period, the Salmonella strains showed highest resistance rate to ampicillin (33.3%-64.8%), but low resistance to cefoperazone-sulbactam (0-5.3%) and ciprofloxacin (2.4%-14.3%). S. typhimurium showed higher resistance rate than S. typhi, S. paratyphi and S. enteritidis. About 76.8% and 50.5% of S. typhimurium were resistant to ampicillin and trimethoprimsulfamethoxazole. The average prevalence of multi-drug resistant Salmonella was 3.9% in the ten-year period, the highest (7.5%)was in 2005, the lowest (1.5%) in 2013. Conclusions During the period from 2004 to 2015, majority of the Salmonella isolates in hospitals across China was S. typhimurium and S. enteritidis. Ampicillin and trimethoprim-sulfamethoxazole are no longer appropriate for empirical treatment of S. typhimurium infection due to high resistance rate. Salmonella isolates are relatively more susceptible to third-generation cephalosporins and quinolones. Ongoing monitoring is necessary to identify multi-drug resistant strains of Salmonella.
Key words:Salmonella; antimicrobial agent; multidrug-resistant; bacterial resistance surveillance

