灵芝孢子粉破壁工艺优化及其抗肿瘤作用
刘春延,张国财*,程方志,张国珍*,赵 博,林连男(东北林业大学林学院,黑龙江 哈尔滨 150040)
灵芝孢子粉破壁工艺优化及其抗肿瘤作用
刘春延,张国财*,程方志,张国珍*,赵 博,林连男
(东北林业大学林学院,黑龙江 哈尔滨 150040)
以灵芝孢子粉为原料,采用高压均质法破壁灵芝孢子,研究灵芝孢子粉破壁优化工艺及破壁孢子粉抗肿瘤作用。选取水为破壁溶剂,以均质压力、均质次数、料液比为试验因素,以灵芝孢子破壁率为试验指标,通过单因素试验及正交试验对灵芝孢子破壁工艺进行优化。通过建立S180荷瘤小鼠模型,对破壁灵芝孢子粉的抗肿瘤作用进行研究。结果表明,最佳破壁工艺条件为均质压力150 MPa、均质次数3、料液比1∶100(g/mL),破壁率为94.35%。抗肿瘤实验表明,破壁灵芝孢子对小鼠S180肉瘤的抑制率为43.37%~57.59%,且肝体比和肺体比变化稳定,并可显著提高小鼠的胸腺指数和脾指数。因此,破壁灵芝孢子粉具有良好的抗肿瘤作用。
灵芝孢子;破壁;高压均质法;抗肿瘤作用
灵芝孢子粉(Ganoderma lucidum spores,GLS)是灵芝在生长成熟期从灵芝菌褶中弹射出来的极其微小的卵形生殖细胞,具有灵芝的全部遗传物质[1]。药理研究表明,GLS具有抗肿瘤、增加免疫调节、保护肝脏、治疗神经性疾病等多种药理作用[2-8]。但由于GLS为双壁结构,质地坚硬,由几丁质和纤维素等高分子物质构成,限制了机体对孢内有效物质的消化吸收。为了充分利用灵芝孢内有效物质,破壁处理是必要的,且破壁处理可以提高GLS的生物活性[9-10]。
目前,国内外关于GLS破壁方法有超声波处理法、酶水解处理法、离心剪切粉碎法和CO2超临界处理法[11-13]等,但这些方法普遍存在效率低、破壁率较低的缺点,关于高压均质法破壁GLS的工艺亦有报道,本实验系统研究了高压均质法GLS破壁工艺优化,并对破壁后灵芝孢子粉(broken Ganoderma lucidum spores,BGLS)的抗肿瘤作用进行了研究。
1 材料与方法
1.1 材料与试剂
GLS由吉林白石山林业局培养并提供,品种为“韩芝1号”。抗肿瘤实验中BGLS是用高压均质机在最佳破壁工艺条件下获得。
清洁级昆明种小鼠(雄雌各半,体质量(20±2)g)黑龙江省中医药大学。
小鼠实体移植肉瘤180(S180)由东北林业大学食品科学实验室提供,液氮冻存。无水硫酸锌、无水乙醇国药集团化学试剂有限公司;注射用环磷酰胺(批号:20140942,200 mg/支) 江苏恒瑞医药股份有限公司。
1.2 仪器与设备
血球计数板(25 mm×16 mm) 哈尔滨赛拓生化试剂仪器公司;TH-500BQ型超声波仪 济宁天华超声电子仪器有限公司;QL901型涡旋混合器 江苏海门其林贝尔公司;BH-2型普通光学显微镜 奥林巴斯公司;AH100B型高压均质机 上海市ATS工业系统有限公司。
1.3 方法
1.3.1 GLS破壁工艺
GLS→过80 目筛→冲洗数次→抽干→烘干(60 ℃)→预处理GLS→制成悬浊液→超声处理(1 h)[14]→振荡(1 次/10 min数次)→高压均质机破壁→BGLS悬浊液→减压浓缩→BGLS
1.3.2 破壁率的测定
参考倪伟锋[15]方法对BGLS采用血球计数板计数,并绘制标准曲线y=8 069.2x+1.694 4(y为孢子粉平均数,x为孢子粉质量,R2=0.999 5),按照(1)式计算破壁率:

式中:X为破壁率/%;Nl为从标准曲线查到的与待测样品相同质量的未破壁GLS数目;N2为计数得到的BGLS样品中未破壁的GLS数目。
1.3.3 单因素试验设计
以水为破壁工艺溶剂,按照1.3.1节中的工艺对GLS进行破壁处理,通过单因素试验考察料液比、均质压力、均质次数对GLS破壁率的影响,单因素试验设计见表1,固定条件为:料液比1∶100(g/mL)、均质压力130 MPa、均质次数1。
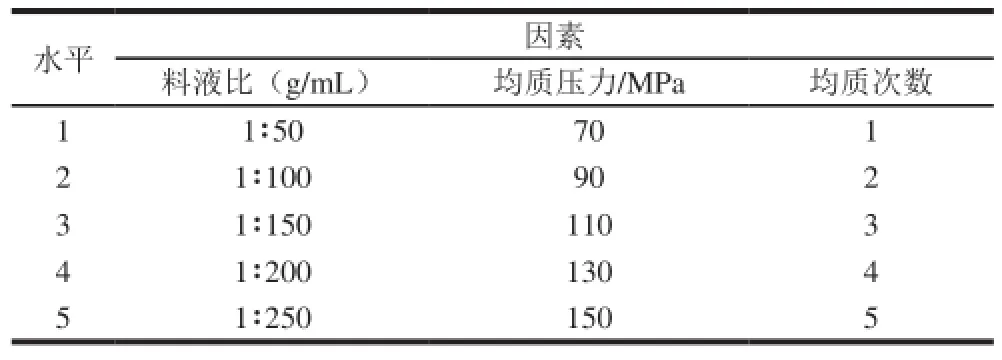
表1 单因素试验因素及水平设计Table 1 Factors and t heirl evels used for o ne-factor-at-a-time experiments
1.3.4 正交试验设计
以料液比、均质压力、均质次数为试验因素,以破壁率为指标采用正交试验设计法[16]对破壁工艺进行优化,正交试验因素与水平设计见表2。

表2 GLS破壁工艺正交试验因素与水平Table 2 Factors and t heir levelsu sed for orthog on ala rray experiments
1.3.5 BGLS抗肿瘤作用
1.3.5.1 荷瘤造模
复苏S180肿瘤细胞,腹腔接种,传代3 次后用于实验。无菌抽取传代7 d、生长良好的S180荷瘤小鼠的腹水,加入生理盐水调节肿瘤细胞分子数量浓度至1×107/mL。
小鼠60 只,雌雄各半,喂养1 周。造模时每鼠右腋皮肤消毒,于右腋皮下接种瘤细胞悬液,每只小鼠接种0.2 mL[17]。
1.3.5.2 分组给药
接种24 h后,将小鼠随机分为8 组,即模型对照(等容食用油)、GLS(0.5、1、2 g/kg)、环磷酰胺(75 mg/kg)和BGLS(0.5、1、2 g/kg)组。灌胃给药,每天1 次,连续10 d[18-20]。
1.3.5.3 BGLS对S180荷瘤小鼠模型的影响
停药次日称质量并处死小鼠,分别称取小鼠肿瘤质量、肝脏、肺、胸腺和脾脏质量,计算抑瘤率[21]、肝体比、肺体比、胸腺指数和脾指数[22]等,如式(2)~(6)所示:


2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对破壁率的影响
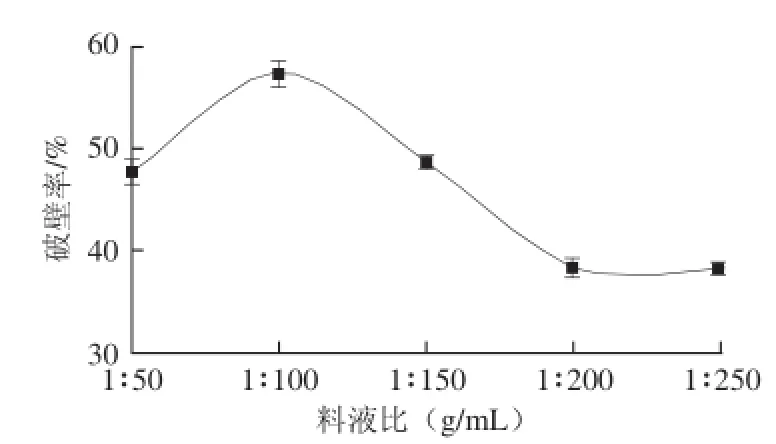
图1 料液比对破壁率的影响Fig.1 Effects of solid-to-liquid ratio on the percentage of broken spores
由图1可知,料液比在1∶50~1∶100(g/mL)范围内,GLS破壁率随着溶剂用量的增加而提高,当料液比为1∶100(g/mL)时,破壁率最大,达57.24%。当溶剂用量继续增加时破壁率反而下降。然而高压均质机处理GLS时,强大的机械力使GLS相互碰撞达到破壁的目的,当溶剂用量较小时,GLS之间碰撞距离较短,撞击力较低,导致破壁率较低,随着溶剂用量的增大,GLS之间的碰撞距离随之增大,破壁率会因撞击力变大而提高,但当溶剂用量增大到一定程度时GLS破壁率会因碰撞几率减小而下降。故选料液比1∶100(g/mL)为最佳。2.1.2 均质压力对破壁率的影响
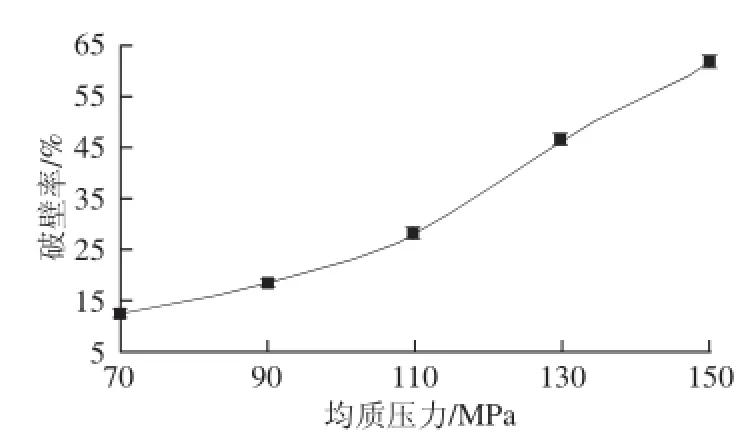
图2 均质压力对破壁率的影响Fig.2 Effects of homogenization pressure on the percentage of broken spores
由图2可知,GLS破壁率随着均质压力的增大而升高,当均质压力在70~110 MPa时,破壁率较低且缓慢升高,当均质压力达到110 MPa时,破壁率显著升高,当达到高压均质机最大均质压力150 MPa时,破壁率达到57.38%。结果表明,利用高压均质机对GLS破壁处理,均质压力越大,提供的机械能越大,GLS破壁率越高。考虑到本实验高压均质机最大使用均质压力为150 MPa,因此,均质压力选择130 MPa。
2.1.3 均质次数对破壁率的影响
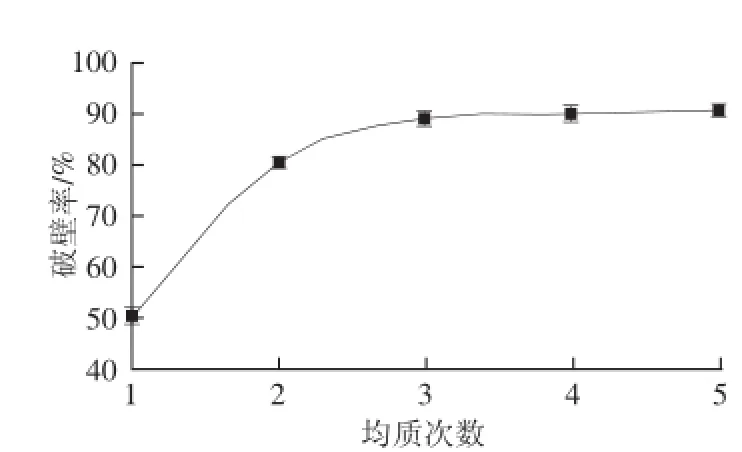
图3 均质次数对破壁率的影响Fig.3 Effects of the number of homogenization cycles on the percentage of broken spores
由图3可知,GLS破壁率随着均质次数增加而升高,当均质3 次时,破壁率达到89.33%,均质次数继续增加,破壁率趋于平稳。因此,选择均质次数3。
2.2 正交试验结果
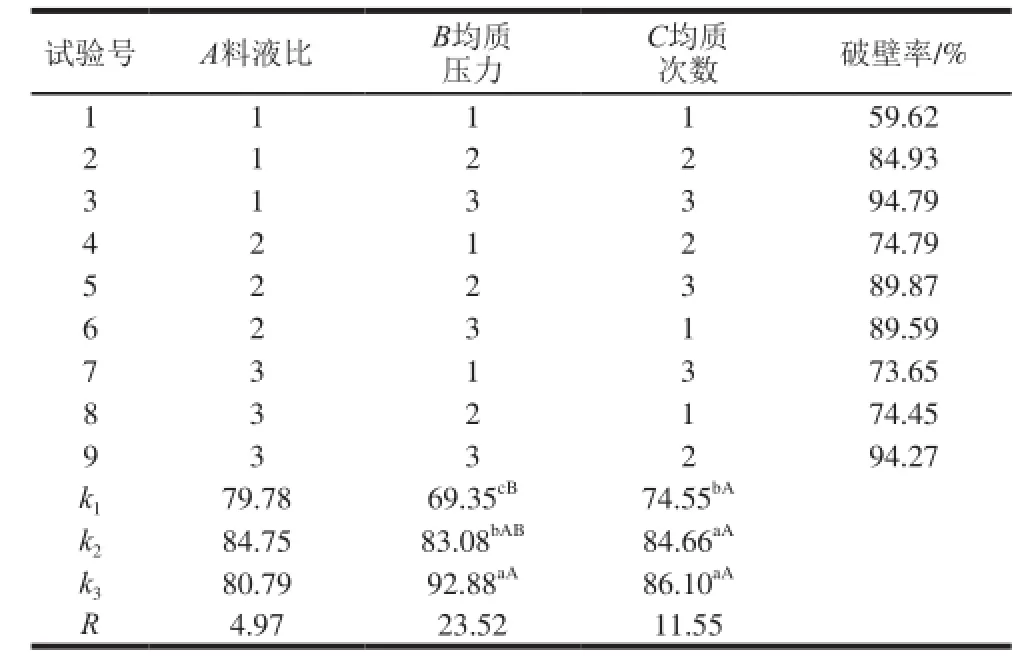
表3 GLS破壁工艺优化正交试验设计与结果Table3 Orthog on alarray designlayout withexperimental results for pe rc en tag e disru pti on of G.luc idum s pores
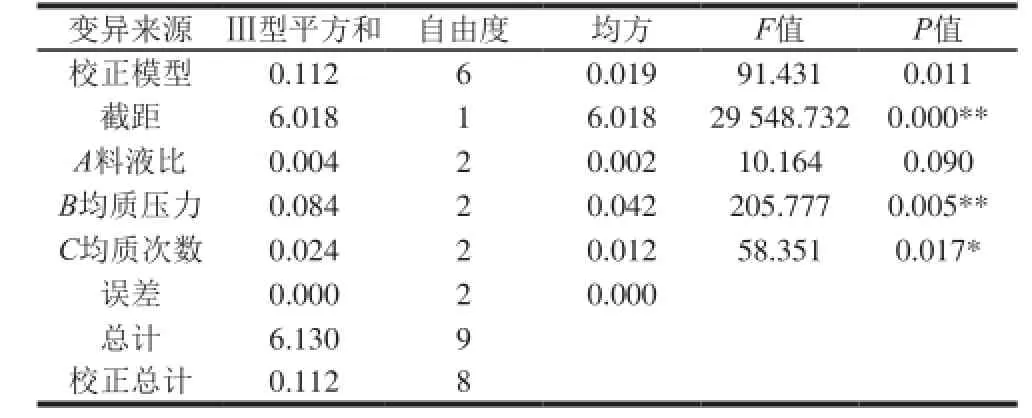
表4 正交 试验 结果 方差 分析Table4 Analysis of variance of theresults o for thog on alarray experiments
表4方差分析结果表明:3 个因素的主次顺序为均质压力(B)>均质次数(C)>料液比(A),即均质压力对GLS破壁率具有极显著的影响(P<0.01),均质次数对破壁率影响显著(P<0.05),而料液比对破壁率的影响不显著。
由表3、4可知,在正交试验设计中,对于B因素,GLS破壁率在各水平间的差异显著,B3和B1破壁率差异极显著,以B3为最佳。对于C因素,GLS破壁率C1水平分别与C2、C3水平差异显著,但C2水平和C3水平间无显著差异,实践中选取C2为最佳。对于A因素,GLS破壁率在各水平间无显著差异,在A2水平上破壁率最大,因此,实践中选取A2为最佳。综合考量得出:GLS破壁工艺最优条件为B3C2A2,即均质压力150 MPa、均质次数3、料液比1∶100(g/mL)。
2.3 验证实验
按照最佳破壁工艺B3C2A2采用高压均质法对GLS进行3 次平行破壁处理,破壁率的平均值达94.35%,与正交试验中的结果相吻合,进一步验证了该破壁工艺的可行性。其中,GLS和BLGS的显微结构见图4,未破壁GLS视野范围内孢子完整,而BGLS视野范围内大部分孢子已被破壁,两者差异明显。

图4 GLS (a)和BGLS (b)显微镜图(×400)Fig.4 Optical microscope photographs of intact (a) and broken (b)G.lucidum spores (×400)
2.4 BGLS抗肿瘤功能
2.4.1 BGLS对S180荷瘤小鼠肿瘤质量的影响
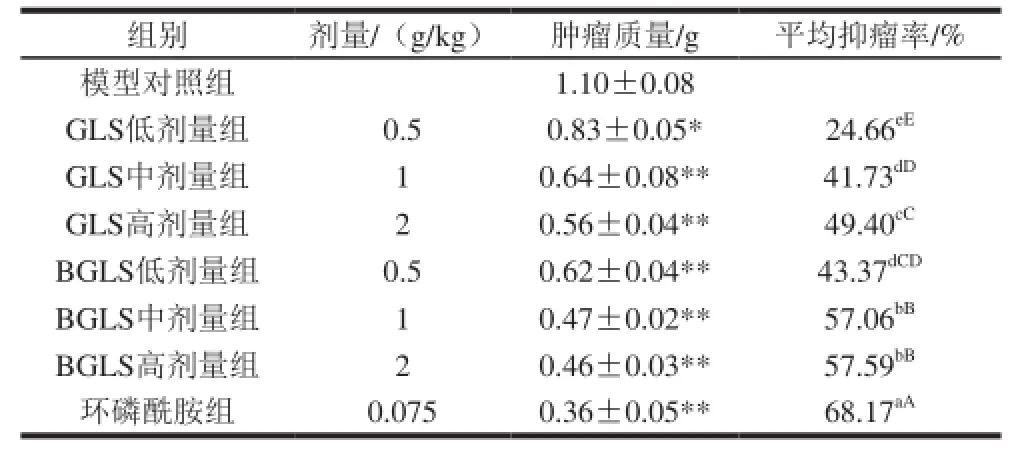
表5 BGLS 对S180荷瘤小鼠肿瘤质量及抑瘤率的影响(x±s,n=6)Table 5 Inhibitory effects of broken G.luc idum sporeso nt umor gr ow th in S18 0 tum or-be ar in g mice (x± s,n=6)
由表5可知,给药10 d后处死小鼠,剥离肿瘤后,各组肿瘤质量均低于模型对照组,且抑瘤率与给药剂量呈一定正相关关系,当GLS给药剂量相同时,BGLS剂量组抑瘤率均高于GLS剂量组,其中BGLS高剂量组肿瘤质量最小,抑瘤率最高,为57.59%,相比环磷酰胺组低了10.58%,相比BGLS中剂量组仅提高了0.53%。方差分析表明,GLS剂量组肿瘤质量与模型对照组差异显著,证明GLS对S180有明显的抑制作用,同时,BGLS剂量组与GLS剂量组差异显著,BGLS高剂量组与BGLS中剂量组肿瘤抑制率无显著差异,结果表明BGLS剂量组抑瘤率优于GLS剂量组。综合考量,选BGLS中剂量组为最佳。
2.4.2 GLS对S180荷瘤小鼠肺体比、肝体比、胸腺指数和脾脏指数的影响
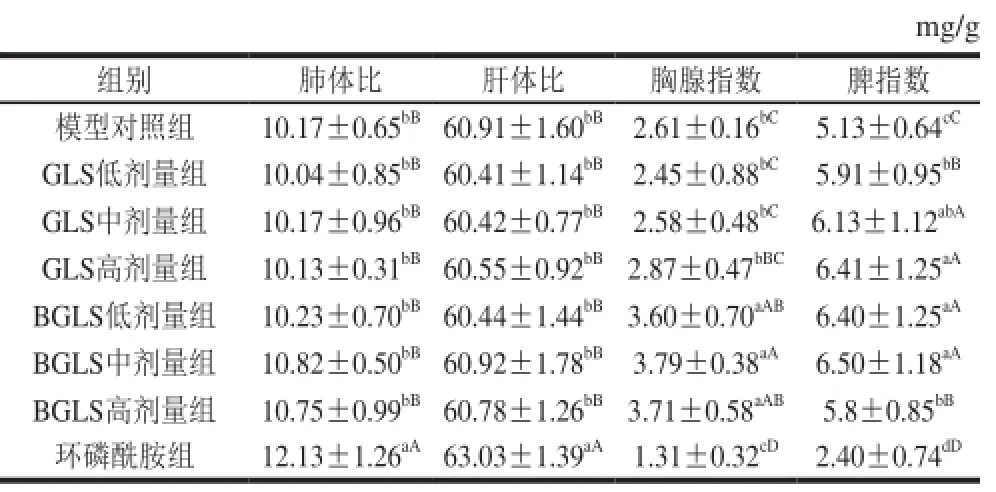
表6 BGLS对S180荷瘤小鼠肺体比、肝体比、胸腺指数、脾指 数的 影响 (x±s,n=6)Table 6 Effects of broken G.lucidum sporeso nl ung in dex, liver in dex,ch estg l and in d ex , and spleen in d ex in S1 80 tum or-be ar in g m ice (x± s,n=6)
由表6可知,不同处理组肺体比和肝体比中,不同剂量组与模型对照组相比变化不大,且差异不显著,表明GLS对小鼠肝肺影响较小;但环磷酰胺组肺体比和肝体比均高于其他处理组,且与其他处理组均有显著差异。不同处理组胸腺指数中,BGLS剂量组胸腺指数均高于其他处理组,以BGLS中剂量组为最高,方差分析表明,BGLS剂量组胸腺指数与其他各处理组差异显著;GLS剂量组胸腺指数与模型对照组相比变化不大且无显著差异,环磷酰胺组胸腺指数比模型对照组下降了49.81%。分析结果表明,BGLS可以提高小鼠胸腺指数,GLS对小鼠胸腺指数无影响而环磷酰胺可以对使小鼠胸腺指数大大下降。不同处理组脾指数中,随着GLS剂量组剂量的增加,脾指数呈上升趋势,但BGLS高剂量组脾指数低于BGLS中剂量组,同时,BGLS中剂量组脾指数高于GLS剂量组,此外,环磷酰胺组胸腺指数与模型对照组相比下降了53.21%。方差分析表明,GLS和BGLS剂量组脾指数与模型对照组具有显著差异,与环磷酰胺处理组差异极显著,分析结果表明,GLS可以提高小鼠脾指数,且以BGLS中剂量组为最佳,环磷酰胺可以对使小鼠脾指数下降。
3 讨论与结论
通过单因素试验和正交试验优化法探讨高压均质法破壁GLS工艺条件,确定最佳破壁工艺参数为:均质压力150 MPa、均质次数3、料液比1∶100(g/mL)。高压均质机与传统工艺相比,高压均质机操作简单,更易于实现工业化生产。本研究发现,GLS平均破壁率与均质压力呈正相关,由于受实验装置的构造所限不可能无限地增大均质压力,故本实验选择最大均质压力为150 MPa。
抗肿瘤实验表明,GLS剂量组与模型对照组相比具有明显的抗肿瘤作用,环磷酰胺组对S180荷瘤小鼠的平均抑瘤率虽然最高,但其会大大降低S180荷瘤小鼠胸腺指数、脾脏指数,出现肺体比增大和肝体比增大等现象,对免疫器官的损伤,极大降低了机体的抵抗力,同时,GLS剂量组中S180荷瘤小鼠肺体比和肝体比比较稳定,且胸腺指数和脾指数与模型对照组相比有上升趋势,这表明GLS对小鼠不但有抑制肿瘤生长的作用,同时还可以增强小鼠的免疫功能,这与李洁[23]的白花蛇舌草对S180小鼠的抗肿瘤研究的结果相符。此外,通过比较BGLS与GLS的抗肿瘤效果,结果发现,BGLS可以更显著提高S180小鼠的抗肿瘤活性及免疫功能,这与Liu Xin[2]、吴学谦[24]等的研究结果相符,并且肿瘤抑制率与给药剂量的呈正相关,这与马晶晶[25]的研究结果相符,但BGLS的抗肿瘤效果中,BGLS中剂量组作用最明显,因此,BGLS使用时并不是剂量越大越好,而是存在最适剂量,这与林庶茹等[26]的研究结果相符。故在抗肿瘤实验中选用BGLS中剂量组为最佳,为1 g/kg。本研究为BGLS的抗氧化、改善细胞呼吸、抑制凋亡、肠道菌群调节和刺激细胞因子等生物活性的深入研究提供了参考。
[1] 姜余梅, 杨艳, 陈晓姗, 等.灵芝孢子和抗性淀粉对糖尿病大鼠糖脂代谢及氧化应激的协同干预[J].食品科学, 2014, 35(23): 288-291.DOI:10.7506/spkx1002-6630-201423056.
[2] LIU Xin, YUAN Jianping, CHUNG C K, et al.Antitumor activity of the sporoderm-broken germinating spores of Ganoderma lucidum[J].Cancer Lett, 2002, 182(2): 155-161.DOI:10.1016/S0304-3835(02)00080-0.
[3] GUO Liang, XIE Jianhui, RUAN Yuanyuan, et al.Characterization and immunostimulatory activity of a polysaccharide from the spores of Ganoderma lucidum[J].International Immunopharmacology, 2009,9(10): 1175-1182.DOI:10.1016/j.intimp.2009.06.005.
[4] JIN Hai, JIN Feng, JIN Jiaxing, et al.Protective effects of Ganoderma lucidum spore on cadmium hepatotoxicity in mice[J].Food and Chemical Toxicology, 2013, 52(1): 171-175.DOI:10.1016/ j.fct.2012.05.040.
[5] ZHOU Yan, QUA Zeqiang, ZENG Yuanshan, et al.Neuroprotective effect of preadministration with Ganoderma lucidum spore on rat hippocampus[J].Experimental and Toxicologic Pathology, 2012,64(7/8): 673-680.DOI:10.1016/j.etp.2010.12.011.
[6] 王淑秋, 李晓捷, 姜志梅, 等.灵芝孢子粉对癫痫大鼠脑组织细胞色素C、线粒体钙、HSP70和BDNF的影响[J].中国病理生理杂志,2011, 27(6): 1053-1058.DOI:10.3969 /j.issn.1000-4718.2011.06.003.
[7] WANG Quanxi, HUANG Yifan, WU Baocheng, et al.Inhibitive effect on apoptosis in splenic lymphocytes of mice pretreated with Lingzhi (Ganoderma lucidum) spores[J].Journal of Traditional Chinese Medicine,2014, 34(2): 173-177.DOI:10.1016/S0254-6272(14)60074-1.
[8] 唐柳, 张志军, 魏雪生, 等.灵芝孢子粉药理作用研究进展[J].天津农业科学, 2011, 17(3): 25-28.DOI:10.3969/ j.issn.1006-6500.2011.03.008.
[9] 黄晓兰, 吴惠勤, 黄芳, 等.破壁与不破壁灵芝孢子粉多糖的分析[J].中草药, 2006, 37(6): 813-816.
[10] SANODIYA B S, THAKUR R K, BAGHEL G B, et al.Ganoderma lucidum: a potent pharmacological macrofungus[J].Current Pharmaceutical Biotechnology, 2009, 10(8): 717-742.DOI:10.2174/138920109789978757.
[11] ZHU H S, YANG X L, WANG L B, et al.Effects of extracts from sporoderm-broken spores of Ganoderma lucidum on HeLa cells[J].Cell Biology and Toxicology, 2000, 16(3): 201-206.DOI:10.1023/ A:1007663006548.
[12] FU Yujie, LIU Wie, ZU Yugang, et al.Breaking the spores of the fungus Ganoderma lucidum by supercritical CO2[J].Food Chemistry,2009, 112(1): 71-76.DOI:10.1016/j.foodchem.2008.05.044.
[13] 赵洁胜, 魏联, 虞燕萍, 等.灵芝孢子粉破壁率的检验方法研究进展[J].中国医药指南, 2013, 11(5): 431-434.DOI:10.15912/j.cnki.gocm.2013.05.071.
[14] 朱俊洁, 张守勤, 王长征, 等.破壁提取综合法提取灵芝孢子多糖的研究[J].农业机械学报, 2004, 35(3): 184-185.
[15] 倪伟锋.灵芝破壁孢子粉破壁率测定技术和质量安全评价的研究[D].福州: 福建农林大学, 2008.
[16] 焦艳丽, 温升南, 杜冰, 等.挤压处理灵芝孢子粉提取灵芝多糖[J].食品科学, 2011, 32(16): 67-70.
[17] 张秀娟, 刘斌, 孙宇婷, 等.大豆多糖对S-(180)荷瘤小鼠抗肿瘤作用的免疫机制研究[J].食品工业科技, 2012, 33(2): 389-392.DOI:10.13386/j.issn1002-0306.2012.02.010.
[18] 张艳, 叶克难.虫草灵芝孢子粉复合物对小鼠免疫功能的影响[J].食品科学, 2012, 33(17): 269-273.
[19] 杨丽丽, 邓志钦, 黄维渊, 等.灵芝孢子粉对抗亚急性酒精性肝损伤的实验研究[J].时珍国医国药, 2013, 24(3): 513-514.DOI:10.3969/ j.issn.1008-0805.2013.03.001.
[20] 张荣标, 陈润, 陈冠敏, 等.破壁灵芝孢子粉对小鼠免疫功能影响的研究[J].预防医学论坛, 2013, 19(12): 936-938; 954.
[21] 金玲, 刘菊妍, 孙升云, 等.灵芝孢子油软胶囊对H22肝癌小鼠抑瘤作用及免疫功能的影响[J].中华中医药杂志, 2011, 26(4): 715-718.
[22] 蒋丽, 黄远英, 殷光玲.灵芝孢子油免疫调节作用的研究[J].现代食品科技, 2013, 29(3): 531-533; 542.
[23] 李洁.白花蛇舌草对S-(180)荷瘤小鼠抑瘤作用的实验研究[J].中医研究, 2008, 21(5): 11-13.
[24] 吴学谦, 吴学良, 楼利明, 等.原木灵芝破壁孢子粉对小鼠免疫功能的影响[J].中国食用菌, 2014, 33(1): 51-54.DOI:10.13629/ j.cnki.53-1054.2014.01.017.
[25] 马晶晶.高速离心剪切粉碎对灵芝孢子粉破壁及特性的影响[D].武汉: 武汉理工大学, 2006.
[26] 林庶茹, 杜松, 郑洪新, 等.灵芝破壁孢子粉对LEWIS荷瘤小鼠细胞免疫干预作用[J].中国中医基础医学杂志, 2005, 11(6): 428-430; 433.
Optimization of Disruption of Ganoderma lucidum Spores and Antitumor Effect of the Broken Spores
LIU Chunyan, ZHANG Guocai*, CHENG Fangzhi, ZHANG Guozhen*, ZHAO Bo, LIN Liannan
(College of Forestry, Northeast Forestry University, Harbin 150040, China)
The purpose of this study was to investigate the optimum conditions for breaking Ganoderma lucidum spores by high-pressure homogenization using water as the solvent and to evaluate the antitumor effect of the broken spores.The optimization of three process variables including solid-to-liquid ratio, homogenization pressure, and the number of homogenization cycles for improved percentage of broken spores was conducted through one-factor-at-a-time and orthogonal array experiments.S180 tumor-bearing mice models were established for evaluation of the antitumor effect of the broken G.lucidum spores.The results showed that the optimal conditions for breaking G.lucidum spores were obtained as follows: homogenization pressure, 150 MPa; homogenization cycles, 3 times; and solid-to-liquid ratio, 1:100 (g/mL).Under these conditions, the percentage of broken spores could be up to 94.35%.Antitumor tests showed that the percentage inhibition of tumor growth in S180 tumor-bearing mice by the broken spores was 43.37%-57.59%, and the liver index and lung index were little affected while the thymus index and spleen index were significantly enhanced.Therefore, broken G.lucidum spores possessed good antitumor effect.
Ganoderma lucidum spores; spore disruption; high pressure homogenization method; antitumor effect
10.7506/spkx1002-6630-201614009
R285.5
A
1002-6630(2016)14-0051-05
刘春延, 张国财, 程方志, 等.灵芝孢子粉破壁工艺优化及其抗肿瘤作用[J].食品科学, 2016, 37(14): 51-55.
DOI:10.7506/spkx1002-6630-201614009. http://www.spkx.net.cn
LIU Chunyan, ZHANG Guocai, CHENG Fangzhi, et al.Optimization of disruption of Ganoderma lucidum spores and antitumor effect of the broken spores[J].Food Science, 2016, 37(14): 51-55.(in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201614009. http://www.spkx.net.cn
2015-11-19
哈尔滨市科技局科技项目(2014FF6CJ002);中央高校基本科研业务费专项(2572014AA08)
刘春延(1993—),女,硕士研究生,研究方向为食用菌活性成分。E-mail:Lcy7621@126.com
*通信作者:张国财(1964—),男,教授,博士,研究方向为森林资源保护及利用。E-mail:Zhang640308@126.com
张国珍(1964—),女,高级工程师,博士,研究方向为森林培育资源。E-mail:Zhangguozhen60@126.com

