小蓬竹光合作用对CO2的响应特征1)
李丽霞 刘济明 廖小锋 熊雪 骆畅 柳嘉佳
(贵州大学,贵阳,550025) (贵州科学院贵州省山地资源研究所) (贵州大学)
小蓬竹光合作用对CO2的响应特征1)
李丽霞刘济明廖小锋熊雪骆畅柳嘉佳
(贵州大学,贵阳,550025)(贵州科学院贵州省山地资源研究所)(贵州大学)
摘要为加强小蓬竹(Drepanostachyum luodianense (Yi et R. S. Wang))的保护利用及光合生理研究,以移栽和野生的2年生小蓬竹植株作为对比实验材料,利用Li-6400便携式光合作用测定系统对小蓬竹的CO2响应特性进行了研究。结果表明:小蓬竹CO2响应研究最适宜的数理模型为直角双曲线的修正模型,在控制条件为叶温28 ℃、叶面空气湿度75%、光合有效辐射1 700 μmol·m-2·s-1时,小蓬竹胞间CO2摩尔分数随着叶室内CO2摩尔分数的升高而近乎同步直线上升,移栽小蓬竹与野生小蓬竹的胞间CO2摩尔分数和叶室内CO2摩尔分数值分别稳定在0.44、0.59;气孔导度随着胞间CO2摩尔分数的升高总体上逐步下降,移栽小蓬竹气孔导度水平略低于野生小蓬竹;蒸腾速率随着胞间CO2摩尔分数的升高及气孔导度的下降而逐步下降,最后趋于平稳,移栽小蓬竹与野生小蓬竹蒸腾速率表现出与气孔导度较为一致的差异。因此,移栽小蓬竹最大净光合速率与野生小蓬竹总体上无明显差异。
关键词小蓬竹;CO2响应;光合作用与CO2的响应曲线
光合作用是植物生长发育的基础,CO2是光合作用的物质来源[1-2]。目前,人类活动加剧了温室气体的排放,大气中的CO2摩尔分数逐年升高,CO2的增多造成全球气候变化,直接影响植物代谢和生长发育。光合作用对CO2的响应特征是植物生理生化和生态特性研究的重要内容之一,光合作用与CO2的响应曲线(Pn-Ci曲线)的测定和模拟是主要的研究手段[3-4]。
竹类植物是我国重要的森林资源,竹林具有良好的生态、经济和社会效益,倍受生产、科研人员重视[5-6]。目前关于竹类植物对CO2的响应曲线研究较少,仅见对缺苞箭竹(Fargesia denudata)、毛竹(Phyllostachys pubescens)等少数几个竹种的相关研究。在以往研究中,CO2响应模型有Pn-Ci曲线的直角双曲线模型、Pn-Ci曲线的非直角双曲线模型、Pn-Ci曲线的直角双曲线的修正模型(Pn/Ci模型)及二次多项式模型等。杨理艳应用针对CO2响应曲线的修正直角双曲线模型研究了缺苞箭竹[7];胡元斌等采用直线回归拟合低CO2摩尔分数阶段(≤200μmol·mol-1)的CO2响应曲线来研究毛竹表观羧化效率、CO2补偿点,再利用二次多项式模型拟合其它CO2摩尔分数下的曲线部分,得到毛竹CO2饱和点[8]。张蕾等用PhotosynAssistant软件(基于非直角双曲线模型)研究黄槽绿皮罗汉竹(P. aureacv. luteosulcata)、绿槽黄皮罗汉竹(P. aureacv. viridisulcata)、金镶玉竹(P. aureosulcata ‘Spectabilis’)、紫竹(P. nigra)的羧化效率及CO2补偿点[9]。但到目前为止,有关我国喀斯特竹种,即小蓬竹(Drepanostachyum luodianense (YietR.S.Wang)Kengf.)对CO2响应特征的研究较少。
小蓬竹(Drepanostachyum luodianense (YietR.S.Wang))作为中国特有种,对生境破碎化与异质性程度较高、土壤稀薄的西南喀斯特山地具有较高的适应性,有良好的生态效益、经济效益及社会效益。但是,近年来的滥砍滥伐导致小蓬竹无性系种群严重退化,种群数量急剧减少,现已被列为极危物种[10-12]。研究移栽小蓬竹和野生小蓬竹的光合作用对CO2摩尔分数的响应,不仅有助于明确两种生长环境下小蓬竹的光合机制,预测气候变化对小蓬竹的影响,同时也可为西南喀斯特石漠化生态环境的恢复与治理以及小蓬竹的保护与利用提供科学的理论依据。
1试验地概况
野外研究地位于小蓬竹典型自然分布地之一的贵州罗甸县董架乡董架村。该区域的地层以三叠系的纯质石灰岩为主,为典型喀斯特丘陵地貌景观,石灰岩基岩大面积裸露。气候属典型的南亚热带季风气候,年均气温18.6 ℃,雨量充沛,年降水量在1 200mm左右。试验地平均海拔925m,坡向为东北坡,坡位为中坡位,地理位置为东经106°54′20″、北纬25°37′17″。土壤为典型的喀斯特石灰土,肥力较高。
小蓬竹移栽试验地位于贵阳市贵州大学南校区林学院苗圃内,海拔约1 020m。年平均气温15.3 ℃,年极端最高温度35.1 ℃,年极端最低温度-7.3 ℃,最热月(7月下旬)平均气温24 ℃,最冷月(1月上旬)平均气温4.6 ℃。年平均相对湿度77%,年平均总降水量1 129.5mm,年平均阴天时间235.1d,年平均日照时间1 148.3h,降雪时间年平均11.3d。试验地土壤及盆栽用土由石灰岩发育而来,呈微碱性,肥力中等。
2材料与方法
移栽小蓬竹:于2009年7月中旬从小蓬竹原生地贵州罗甸县董架乡将长势较为一致的野生小蓬竹竹丛截杆(地上部分保留0.8m)后移栽至贵州大学林学院苗圃。于2010年12月份将成活的长势较为一致的小蓬竹竹丛进行分蔸繁殖。选取根系较为一致的分蔸后的小蓬竹植株,种植于规格一致的聚丙烯花盆内(底部内径24cm,盆口内径29cm,盆高22cm),土壤统一采用经多菌灵消毒后的喀斯特石灰土,而后进行常规的统一的水肥管理。盆栽苗于2011年3月份长出新枝叶。
选取上述长势良好、较为一致的无病虫害小蓬竹盆栽苗3盆,每盆选取3片处于植株上部的当年生叶色饱满、水分状况良好的向阳成熟功能叶,标记以备测定。
野生小蓬竹:试验材料为小蓬竹典型群落林中生长的2年生小蓬竹植株,龄级划分参照陈洪、谢元贵等的方法[13-14]。在林中生境选择3丛生长良好的小蓬竹,每丛选择1株2年生植株,每株选取3片处于林冠上层的植株上部当年生叶色饱满、水分状况良好的向阳成熟功能叶,标记以备测定。
数据测定:于2011年7月下旬(苗圃地)和8月初(野外)利用美国Li-cor公司生产的Li-6400便携式光合作用测定系统进行测定。在控制条件下(叶温28 ℃、叶面空气湿度75%、光合有效辐射1 700μmol·m-2·s-1),对Li-6400的外源CO2注入系统进行设置,使叶室CO2摩尔分数(Ca)从1 600μmol·mol-1逐渐降低到50μmol·mol-1(设置值分别为1 800、1 600、1 400、1 200、800、600、400、200、150、120、100、80、60、50μmol·mol-1),仪器自动记录净光合速率(Pn)、气孔导度(Gs)、胞间CO2摩尔分数(Ci)、蒸腾速率(Tr)等参数,最终取平均值。
从民族自强到民族自信,还差一个富强的中国。“天行健,君子以自强不息”,中华民族是一个蕴藏着巨大生命力的民族,在落后于人的情况下,从未停止抗争和追赶。新民主主义革命的胜利,完成了民族独立和解放的任务,中国人民站起来了、腰杆挺起来了。但是,新中国的贫穷与落后,与西方发达资本主义国家的巨大差距,无法让国人真正自信起来。从民族自强到民族自信,还差一个富强的中国、一个兴盛的中华民族。改革开放后,我国社会出现的盲目推崇西方价值、西方理论、西方生活方式的现象,暴露了国人当中民族自卑心理依然存在,重振民族自信仍是一个重大的现实问题。
数据处理:将小蓬竹CO2响应曲线统计均值应用直角双曲线模型、非直角双曲线模型和直角双曲线修正模型等3种模型分别进行拟合,确定最适模型。拟合采用SPSS17.0统计分析软件进行,采用非线性最小二乘法的Marquardt迭代原理求各模型参数。
3结果与分析
3.1净光合速率对胞间CO2摩尔分数变化的响应及拟合
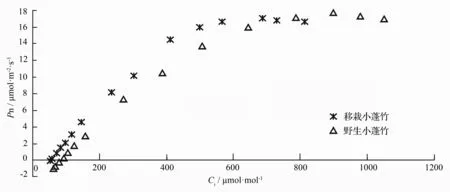
由图1可知,小蓬竹叶片净光合速率在低胞间CO2摩尔分数阶段(≤200μmol·mol-1)上升速度较快,上升趋势近似直线。之后随着胞间CO2摩尔分数的升高,净光合速率上升速度逐渐减缓,在一定的胞间CO2摩尔分数下净光合速率达到最大值,之后有所下降。其中,移栽小蓬竹的胞间CO2摩尔分数大致在700μmol·mol-1左右,而野生小蓬竹的胞间CO2摩尔分数大致在900μmol·mol-1左右。
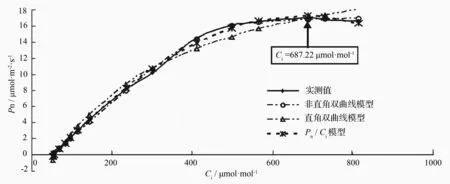
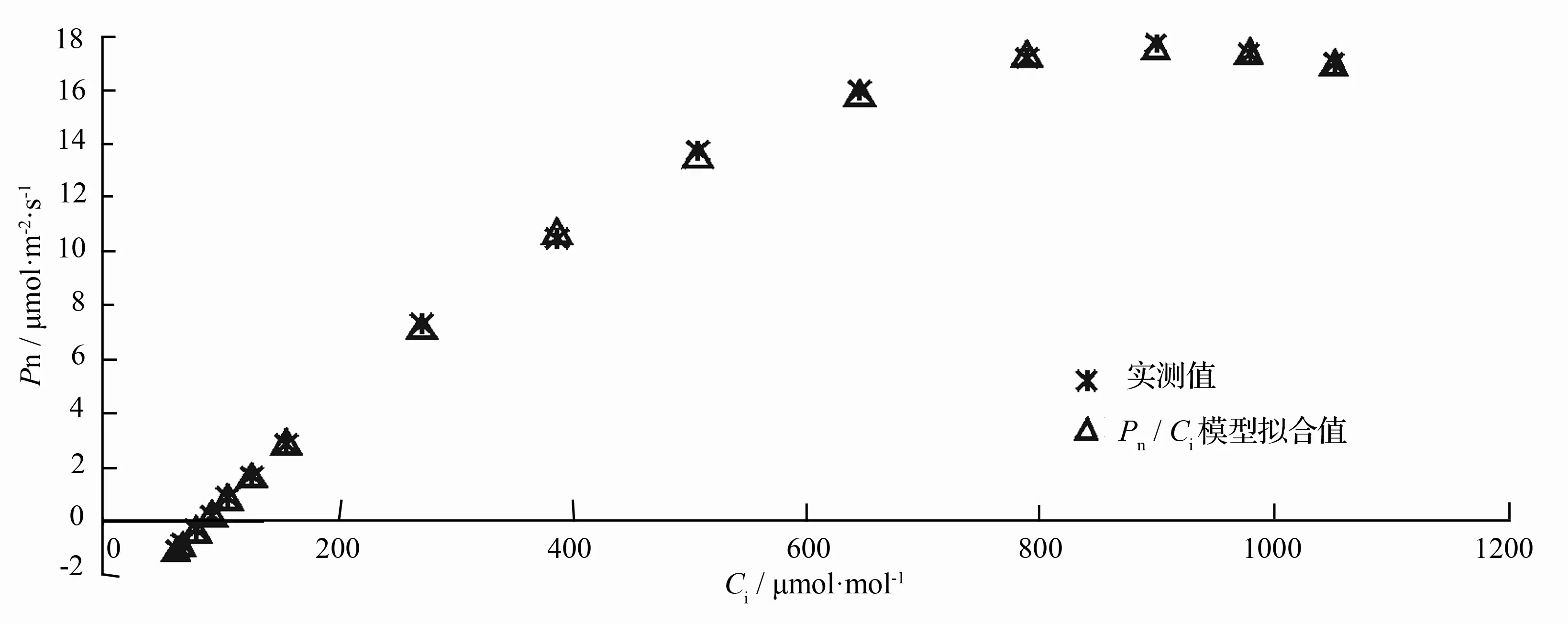
为了更为准确地了解小蓬竹光合作用的CO2限制水平,以及其它与CO2摩尔分数相关的光合参数,笔者对小蓬竹Pn-Ci曲线进行了数学模型的拟合解析。图2显示的是以移栽小蓬竹Pn-Ci曲线为例的经3种经验模型处理的拟合值。可以看出,除直角双曲线模型拟合值与实测值相差较大外,非直角双曲线与Pn/Ci模型在各个数据点下的拟合值与实测值都较为接近,但只有Pn/Ci模型能很好地处理移栽小蓬竹净光合速率在胞间CO2摩尔分数达到700μmol·mol-1左右后开始略微下降的问题。
叶温28 ℃;叶面空气湿度75%;光合有效辐射1 700 μmol·m-2·s-1。
叶温28 ℃;叶面空气湿度75%;光合有效辐射1 700 μmol·m-2·s-1。
用Pn-Ci曲线的直角双曲线模型、非直角双曲线模型及Pn/Ci模型分别拟合图1中移栽小蓬竹Pn-Ci曲线得到的光合参数(见表1)。可知,通过直角双曲线模型拟合得到的最大净光合速率(Pmax)为32.15μmol·m-2·s-1,远大于实测值,虽然通过其给出的相关参数求取的胞间CO2饱和点(Cisat)和胞间CO2补偿点(Cic)与实测值较为接近,但偏差还是略大;非直角双曲线拟合求取的胞间CO2补偿点与实测值很接近,但通过其求取的胞间CO2饱和点远低于实测值,最大净光合速率则超出实测值较多。Pn/Ci模型拟合得到的最大净光合速率为17.31μmol·m-2·s-1,通过其给出的相关参数求取的胞间CO2饱和点和胞间CO2补偿点均最接近实测值。可以看出,Pn/Ci模型克服了直角双曲线以及非直角双曲线模型的上述困难,通过其拟合求取的最大净光合速率、胞间CO2饱和点、胞间CO2补偿点与实测值粗略估计值非常接近,且其拟合系数R2达到了0.999,表明拟合可靠性很高。因此,采用Pn/Ci模型对于拟合移栽小蓬竹光合作用CO2响应曲线最为适宜。
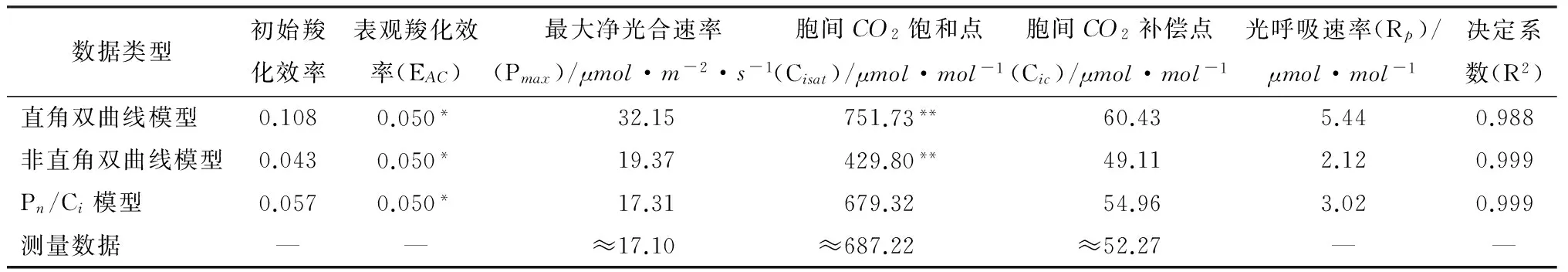
表1 3种模型拟合得到的移栽小蓬竹光合参数及其测量数据
注:*表示低胞间CO2部分(≤200μmol·mol-1)拟合直线的斜率;** 表示用线性方程Pmax=EAC×Cisat-Rp求得的饱和胞间CO2摩尔分数。
根据以上分析可知,野生小蓬竹的净光合速率的CO2响应曲线也完全可以采用修正的直角双曲线模型直接拟合,图3为拟合值与实测值的对比,表2为修正的直角双曲线模型求取的CO2响应曲线相关光合参数。从图3可以看出,拟合值与实测值能够较好地吻合,也解决了野生小蓬竹净光合速率在胞间CO2摩尔分数达到900μmol·mol-1左右后逐渐下降的问题。
叶温28 ℃;叶面空气湿度75%;光合有效辐射1 700 μmol·m-2·s-1。
表2中求取的最大净光合速率、胞间CO2饱和点、胞间CO2补偿点与从实测值得出的估计值都较为接近,同时决定系数高达0.999,表明拟合过程及求取的相关光合参数是可靠的。Pn/Ci模型给出的移栽小蓬竹与野生小蓬竹净光合速率对胞间CO2摩尔分数的响应模型分别为如式(1)与式(2)所示。

(1)

(2)
可以看出,在饱和光合有效辐射下,小蓬竹光合速率主要受CO2供应的限制,在叶温为28 ℃、湿度为75%的控制条件下,当光合有效辐射为近饱和光合有效辐射1 700μmol·m-2·s-1,并且CO2充足供应,小蓬竹最大净光合速率在17~18μmol·m-2·s-1。这个光合速率水平基本代表了小蓬竹在该特定条件下的最大净光合速率。
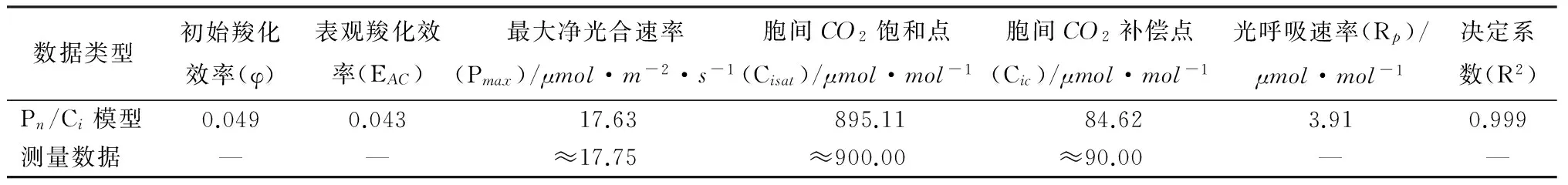
表2 Pn/Ci模型拟合得到的野生小蓬竹光合参数及其测量数据
3.2胞间CO2摩尔分数对大气CO2摩尔分数变化的响应
在叶片气孔开放的情况下,胞间CO2摩尔分数随外界环境CO2摩尔分数的变化而变化。这是由于气孔在光下开放状态较高,外界CO2摩尔分数升高且高于细胞间隙CO2摩尔分数时,根据气体扩散原理可知,外界CO2会从气孔逸进细胞间隙[15]。图4显示,小蓬竹胞间CO2摩尔分数随光合仪叶室内CO2摩尔分数(Ca)的升高而升高。野生小蓬竹与移栽小蓬竹的变化趋势一致,且反应都比较灵敏,基本呈同步直线上升趋势;但移栽小蓬竹胞间CO2摩尔分数几乎始终比野生小蓬竹要低,且差距逐步增大,到叶室内CO2摩尔分数为1 800μmol·mol-1时差距已达到200μmol·mol-1以上。
3.3气孔导度对胞间CO2摩尔分数变化的响应
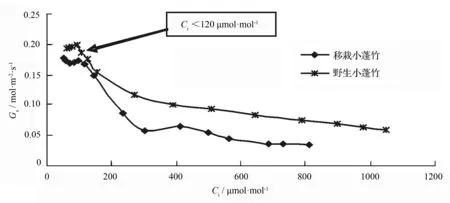
图5显示,在近饱和光合有效辐射下小蓬竹叶片气孔导度总体上随着CO2摩尔分数的升高表现出先迅速下降、再缓慢下降的趋势,但低胞间CO2摩尔分数阶段有一定波动。CO2摩尔分数的增加可以对气孔开放产生抑制作用,这可能涉及到胞间CO2摩尔分数大小、苹果酸水平以及保卫细胞Ca2+摩尔分数等[16],但是并不会像在正常CO2摩尔分数下对光合作用产生气孔限制[17],因此,小蓬竹净光合速率并没有因为气孔导度下降而迅速下降(图1)。低胞间CO2摩尔分数阶段,小蓬竹进行光合作用的CO2原料供应严重不足,这个阶段光呼吸较强[18],气孔导度的波动可能由光呼吸和同化作用的共同调节所致。移栽小蓬竹气孔导度始终比野生小蓬竹略低,这应该与小蓬竹对两地具体环境的适应性差异有关。

叶温28 ℃;叶面空气湿度75%;光合有效辐射1 700 μmol·m-2·s-1。
叶温28 ℃;叶面空气湿度75%;光合有效辐射1 700 μmol·m-2·s-1。
3.4蒸腾速率对胞间CO2摩尔分数变化的响应
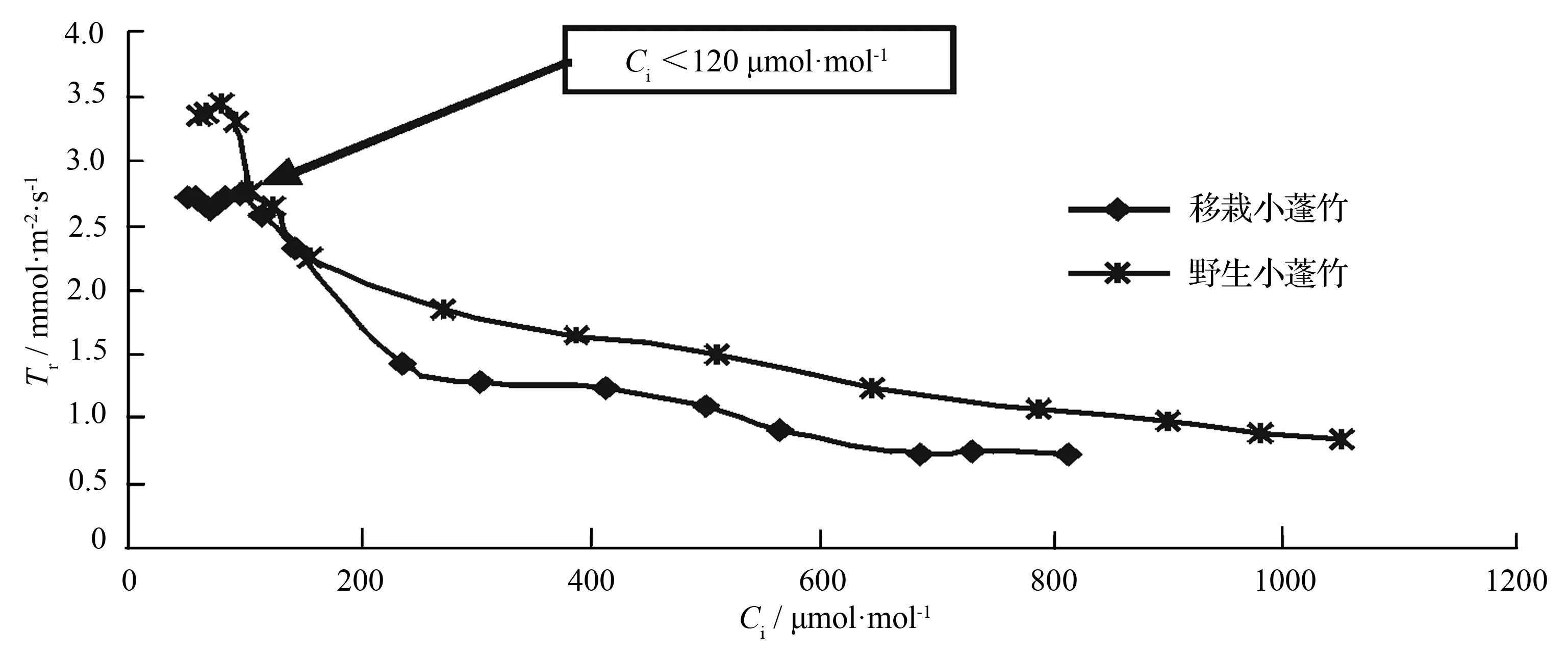
近饱和光合有效辐射、低CO2摩尔分数下,小蓬竹蒸腾速率处于较高水平,但略有波动。而之后随着CO2摩尔分数的升高(图5),蒸腾速率逐渐下降,最后趋于平稳(图6)。初始阶段,气孔开放程度处于高水平,这段时间叶片同化作用受CO2供应不足的影响而较低,同时光呼吸较强。这3个因素共同作用导致小蓬竹蒸腾速率较高,也因为这3个因素的协调作用导致蒸腾速率与气孔导度出现一致的波动。胞间CO2摩尔分数逐渐升高后,气孔导度下降,气孔水蒸气逸出,气孔阻力加大,蒸腾速率也表现出逐渐降低的趋势。移栽小蓬竹蒸腾速率和野生小蓬竹相比也有与气孔导度类似的差异,移栽小蓬竹蒸腾速率始终略低于野生小蓬竹,这可能是气孔导度上的差异造成的。
叶温28 ℃;叶面空气湿度75%;光合有效辐射1 700 μmol·m-2·s-1。
4结论与讨论
CO2是植物进行光合作用的原料,在高光强下甚至是光合作用的主要限制因子。CO2摩尔分数升高能在两方面提升植物光合作用,一方面是CO2摩尔分数升高增加了CO2对Rubisco酶结合位点的竞争,提高了Rubisco酶结合位点羧化速度;另一方面高CO2摩尔分数抑制了呼吸作用,因此,叶片净光合速率随CO2摩尔分数的升高而升高[19-22]。当CO2摩尔分数提高到一定程度后,净光合速率增大的趋势会逐渐减弱,直至达到CO2饱和状态,而此时叶片的最大净光合速率受核酮糖-1,5-二磷酸(RuBP)的再生速率的影响[23]。文献表明:淀粉及果糖合成过程中,如果CO2摩尔分数高于700μmol·mol-1,则磷酸三碳糖的消耗能力及光合磷酸化过程中磷酸根的再生能力成为光合过程中对CO2利用的限制因素[24-25]。小蓬竹在高胞间CO2摩尔分数阶段,其净光合速率有所下降可能与此有关。
从初始羧化效率来看,非直角双曲线以及Pn/Ci模型相差较小,且与表观羧化效率接近,但直角双曲线拟合值却达到了表观羧化效率的两倍。光呼吸速率表示的是植物在光照下没有CO2供应无法启动光合作用而只进行呼吸作用,消耗掉叶片上接收到的光能,是植物的一种自我保护机制。由于实测中无法达到光合仪叶室内CO2摩尔分数为零的控制水平,因此,这个参数也无法与实测估计值比较,但可看出非直角双曲线和Pn/Ci模型的拟合值较为接近,而两者与直角双曲线模型的拟合值差距较大。因此,采用Pn/Ci模型对于拟合移栽小蓬竹光合作用CO2响应曲线最为适宜。野生与移栽小蓬竹胞间CO2摩尔分数与叶室内CO2摩尔分数基本保持在比较恒定的比值,但这个比值是存在差异的,这与许多实验得出的同一种植物气孔内外CO2摩尔分数之比为定值的结果不完全一致[26],与两者气孔开放程度的差异有关。在饱和光合有效辐射下,小蓬竹光合速率主要受CO2供应的限制,这与邹琦等对大豆和董志新等对苜蓿的研究结论一致[21,27]。在饱和光合有效辐射且CO2供应充足的情况下,净光合速率的最大值基本代表了植物的最大净光合速率大小[21]。小蓬竹在高CO2摩尔分数下蒸腾速率整体上比低CO2摩尔分数下低,这与周玉梅等对红松(Pinus koraiensis)的研究一致[28]。Bloom等指出在漫长的进化过程中植物已经形成一种自我调节机制,即尽可能使所有资源对生长的限制处于同一个水平[29]。大气CO2摩尔分数的上升使CO2可利用率增加,为了保证自身对增加的CO2的可利用性,植物必须降低气孔导度,以减少水分损失。可以说气孔导度对大气CO2摩尔分数升高的响应实质是植物对水资源利用的调整,也是植物水分生理的一个改变过程[30]。Drake及Jarvis也认为气孔导度下降通常会引起蒸腾速率的下降[17,31]。这正好解释了小蓬竹气孔导度与蒸腾速率在胞间CO2摩尔分数升高的情况下出现协同下降趋势的原因。众多研究均发现植物在高CO2摩尔分数下的气孔导度比常态摩尔分数下低,它们在CO2摩尔分数达到倍增摩尔分数或更高时气孔导度比常态CO2摩尔分数时下降10%~36%[32-33]。小蓬竹在短时间内气孔导度在高摩尔分数CO2时下降幅度也大致在这个范围,王建林对9种木本及草本植物的研究和张强对12种牧草的研究也发现了这一点[34-35]。综合研究表明移栽小蓬竹光合作用并未完全稳定,但与野生小蓬竹的相关参数进行对比表明,移栽小蓬竹光合作用能力与野生小蓬竹总体上无明显差异。
参考文献
[1]吴芹,张光灿,裴斌,等.不同土壤水分下山杏光合作用CO2响应过程及其模拟[J].应用生态学报,2013,24(6):1517-1524.
[2]张淑勇,夏江宝,张光灿,等.黄河三角洲贝壳堤岛叶底珠叶片光合作用对CO2浓度及土壤水分的响应[J].生态学报,2014,34(8):1937-1945.
[3]叶子飘.光合作用对光和CO2响应模型的研究进展[J].植物生态学报,2010,34(6):727-740.
[4]周洪华,陈亚宁,李卫红,等.干旱区胡杨光合作用对高温和CO2浓度的响应[J].生态学报,2009,29(6):2797-2810.
[5]高健,刘颖丽,李岚,等.竹子光合作用研究进展[J].世界竹藤通讯,2006,4(3):13-16.
[6]刘国华,王福升,丁雨龙,等.4种地被竹光合作用日变化及光合光响应曲线[J].福建林学院学报2009,29(3):258-263.
[7]杨理艳.缺苞箭竹(Fargesia benudata)的光合生理特性对CO2浓度和温度升高的响应[D].雅安:四川农业大学,2011.
[8]胡元斌,金爱武,金晓春,等.施肥对毛竹林幼竹生长期光合特性的影响[J].江西农业学报2010,22(9):75-78.
[9]张蕾,金松恒,方伟.4种珍稀观赏竹光合作用特性研究[J].浙江大学学报(农业与生命科学版),2009,35(2):165-172.
[10]李永康,蓝开敏.贵州植物志[M].成都:四川民族出版社,1988:271-272.
[11]蒙朝阳,谢元贵,刘济明,等.小蓬竹水土保持效应的研究[J].安徽农业科学,2008,36(4):1431-1433.
[12]刘济明.贵州喀斯特地区小蓬竹生态特性研究[D].北京:北京林业大学,2010.
[13]陈洪.喀斯特植物小蓬竹无性系种群生态学研究[D].贵阳:贵州大学,2007.
[14]谢元贵,刘济明,陈洪,等.不同喀斯特生境小蓬竹无性系构件研究[J].西南大学学报(自然科学版),2009,31(6):46-50.
[15]叶子飘,于强.植物气孔导度的机理模型[J].植物生态学报,2009,33(4):772-782.
[16]WHEELERRM,MACKOWIAKCL,YORIONC,etal.EffectsofCO2onstomatalconductance:DostomataopenatveryhighCO2concentration[J].AnnalsofBotany,1999,83(3):243-251.
[17]DRAKEBG,GONZLEZ-MELERMA.Moreefficientplants:aconsequenceofrisingatmosphericCO2[J].AnnualReviewPlantPhysiology,1997,48(6):609-639.
[18]CAISQ,XUDQ.RelationshipbetweentheCO2compensationpointandphotorespirationinsoybeanleaves[J].ActaPhytophysiologicaSinica,2000,26:545-550.
[19]WONGSC.ElevatedatmosphericpartialpressureofCO2andplantgrowth:I.InteractionsofnitrogennutritionandphotosyntheticcapacityinC3andC4plants[J].Oecologia(Berl.),1979,44:68-74.
[20]XUHL.EffectsofaMicrobialInoculantandOrganicFertilizersontheGrowth,PhotosynthesisandYieldofSweetCorn[J].JournalofCropProduction,2001,3(1):183-214.
[21]董志新.不同苜蓿(Medicago sativaL.)品种光合速率对光和CO2浓度的响应特征[J].生态学报,2007,27(6):2272-2278.
[22]JAVAIDA,MAHMOODN.Growthnodulationandyieldresponseofsoybeantobiofertilizersandorganicmanures[J].PJBot,2010,42(2):863-871.
[23]孙彩霞,郝健均,王杰,等.两个品种转基因抗虫棉光合生理的CO2响应[J].生态学报,2010,20(2):504-510.
[24]VONCAEMMERERS,FARQUHARGD.Somerelationshipsbetweenthebiochemistryofphotosynthesisandthegasexchangeofleaves[J].Planta,1981,153:376-387.
[25]FARQUHARGD,SHARKEYTD.Stomatalconductanceandphotosynthesis[J].AnnualReviewsofPlantPhysiology,2003,33(4):317-345.
[26]傅伟,王天铎.对一个气孔经验模型的电学类比分析和模拟检验[J].植物生理学报,1996,22(2):145-151.
[27]邹琦,孙广玉,程炳嵩,等.小粒大豆与普通大豆光合对光、温度、CO2响应特性的比较研究[J].山东农业大学学报,1991,22(4):311-316.
[28]周玉梅,韩士杰,胡艳玲,等.高浓度CO2对红松(Pinus koraiensis)针叶光合生理参数的影响[J].生态学报,2008,28(1):423-429.
[29]BLOOMAJ,MOONEYHA.Resourcelimitationinplants-aneconomicanalogy[J].AnnualReviewofEcologyandSystematics,2003,16(1):363-392.
[30]郑凤英,彭少麟.不同尺度上植物叶气孔导度对升高CO2的响应[J].生态学杂志,2003,22(1):26-30.
[31]JARVISAJ,MANSFIELDTA,DAVIESWJ.Stomatalbehaviour,photosynthesisandtranspirationunderrisingCO2[J].Plant,CellandEnvironment,1999,22(6):639-648.
[32]REYA,JARVISPG.Long-termphotosyntheticacclimationtoincreasedatmosphericCO2concentrationinyoungbirch(Betulapendula)trees[J].TreePhysiol,1998,18(7):441-450.
[33]GARCIARL,LONGSP,WALLGW,etal.Photosynthesisandconductanceofspring-wheatleaves:fieldresponsetocontinuousfree-airatmosphericCO2enrichment[J].Plant,CellandEnvironment,1998,21(7):659-669.
[34]王建林,温学发.气孔导度对CO2浓度变化的模拟及其生理机制[J].生态学报,2010,30(17):4815-4820.
[35]张强.不同牧草品种适应性与光强和CO2响应研究[D].杨凌:西北农林科技大学,2008.
第一作者简介:李丽霞,女,1992年9月生,贵州大学林学院,硕士研究生。E-mail:18798006671@163.com。 通信作者:刘济明,贵州大学林学院,教授。E-mail:karst0623@163.com。
收稿日期:2016年5月11日。
分类号S795.9
EffectofDrepanostachyum luodianensePhotosynthesisonCharacteristicofResponsetoCO2//
LiLixia,LiuJiming
(GuizhouUniversity,Guiyang550025,P.R.China);LiaoXiaofeng(InstituteofMountainResources,GuizhouAcademyofSciences);XiongXue,LuoChang,LiuJiajia(GuizhouUniversity)//JournalofNortheastForestryUniversity,2016,44(8):18-23,54.
WestudiedthecharacteristicofresponsesonphotosynthesistoCO2ofDrepanostachyum luodianense (YietR.S.Wang)toenhancetheprotection,utilizationandphotosyntheticphysiologicalofD. luodianensebyLi-6400portablephotosynthesissystem.ThemostsuitablemathematicalmodelofresponsesonphotosynthesistoCO2ofD. luodianenseisthefixedrectangularhyperbolamodel.Undercontrolledconditionsoftheleaftemperatureof28 ℃,thevaneairhumidityof75%,andphotosyntheticallyactiveradiationof1 700μmol·m-2·s-1,intercellularCO2concentrationofD. luodianenseisgoingupwiththerisingofCO2concentrationinthehamuro.IntercellularCO2concentrationandindoorCO2concentrationoftransplantingD. luodianenseisstableon0.44,andthewildoneisstableat0.59.StomatalconductanceisgoingdownwiththerisingofintercellularCO2concentration.ThestomatalconductanceoftransplantingD. luodianenseisslightlylowerthanthatofwildone.TranspirationrateisgoingdownwiththerisingofintercellularCO2concentrationandthedecreasingStomatalconductance,andgoingtoastablelevel.ThetranspirationrateoftransplantingD. luodianenseisslightlylowerthanthatofwildone.Therefore,thereisnosignificantdifferencebetweentransplantingandwildD. luodianense.
KeywordsDrepanostachyum luodianense; Responses on photosynthesis to CO2; Photosynthesis and CO2 response curve
1)贵州省林业科研课题(黔林科合[2010]重大04号)。
责任编辑:戴芳天。

