局灶性脑缺血再灌注大鼠脑损伤与半暗带锌离子水平的关系研究*
郭淑娟,王琮民
(1.邯郸市中心医院老年病科,河北邯郸 056001;2.河北工程大学附属医院神经内科,河北邯郸 056001)
局灶性脑缺血再灌注大鼠脑损伤与半暗带锌离子水平的关系研究*
郭淑娟1,王琮民2
(1.邯郸市中心医院老年病科,河北邯郸 056001;2.河北工程大学附属医院神经内科,河北邯郸 056001)
[摘要]目的检测局灶性脑缺血大鼠在再灌注不同时间窗脑梗死体积及皮质半暗带区锌离子(Zn2+)的水平,分析讨论Zn2+对缺血性脑卒中大鼠脑组织损伤的影响及机制。方法健康雄性SD大鼠120只分为假手术组(SHAM组,n=40)、大脑中动脉栓塞组(MCAO组,n=40)、Zn2+螯合剂+MCAO组(TPEN+MCAO组,n=40)。线栓法制备大鼠脑缺血再灌注模型,于灌注后0、3、12、24 h将大鼠断头取脑,冷冻切片,行2,3,5-三苯基氯化四氮唑(TTC)染色、LOZEX-F图像扫描确定脑梗死体积;采用新型荧光探针FLOUZin-3检测缺血后再灌注不同时间点时大鼠脑内皮质半暗带区Zn2+的阳性细胞数及荧光强度;采用Pearson法分析Zn2+水平与脑梗死体积间的相关性。结果(1) SHAM组大鼠未出现脑梗死,MCAO组大鼠脑梗死体积随再灌注时间的增加而增大,与MCAO组大鼠相比,TPEN+MCAO组的脑梗死体积显著减少(P<0.05);(2) FLOUZin-3染色显示,SHAM组大鼠皮质半暗带区未出现Zn2+染色阳性细胞,MCAO组皮质半暗带区Zn2+阳性细胞数随再灌注时间的增加而增多,与MCAO组大鼠相比,TPEN+MCAO组的Zn2+染色阳性细胞显著减少(P<0.05)。(2)Pearson相关分析显示,MCAO组大鼠皮质半暗带区FLOUZin-3染色阳性细胞数与脑梗死体积之间呈高度正相关(r=0.921,P<0.05)。结论较高浓度Zn2+可能为内源神经毒物在缺血性脑卒中脑损伤过程中发挥了重要作用。
[关键词]脑缺血;创伤和损伤;锌;再灌注;脑损伤;半暗带;锌离子螯合剂
缺血性脑卒中亦称脑梗死,一般指由于脑动脉粥样硬化而引起的血管内腔狭窄或完全闭塞而形成的一种脑血管意外性疾病,致残和病死率比较高,且治疗技术一直没有重大突破[1-2]。锌在人体内的含量仅次于铁,游离态锌离子(Zn2+)聚集在中枢神经的突触小泡中,常与酶和转录因子结合,对人体的正常生长发育、蛋白质代谢、免疫等过程发挥重要作用[3]。有研究指出,神经系统受损时,Zn2+会从突触前神经元轴突末端大量涌入突触后神经元[4-5]。也有报道指出,Zn2+在脑缺血介导的脑神经元死亡过程中作用突出[6]。这些研究主要集中在海马CA1区,本实验采用线栓法制作大鼠中动脉栓塞缺血(MCAO)再灌注模型,并在MCAO前30 min腹腔注射Zn2+螯合剂(TPEN,20 mg/kg)。用2,3,5-三苯基氯化四氮唑(TTC)染色法测定再灌注不同时间点的脑梗死体积,并用新型荧光探针FLOUZin-3检测缺血后再灌注不同时间点时大鼠脑内皮质半暗带区Zn2+的水平和荧光强度,探讨Zn2+对缺血性脑卒中脑损伤的影响及其作用机制,为寻找临床治疗脑卒中的新策略提供实验依据。
1材料与方法
1.1材料TPEN(sigma公司,美国)、FLOUZin-3(sigma公司,美国)、TTC(上海恒远生物科技有限公司)、手术显微镜(MOELLER-WEDEL公司,德国)、TDA-8301H 温度显示调节仪(Olympus 公司,日本)、OCT包埋剂(SAKURA公司,美国)、手动台式冷冻切片机MTC(SLEE公司,德国)、BH-2 显微镜(Phillip公司日本),大鼠呼吸机(美国CWE公司)。

表1 不同时间点脑梗死体积比较±s,%)
a:P<0.05、b:P<0.01,与再灌注0 h比较;c:P<0.01,与再灌注3 h比较;d:P<0.05,与再灌注12 h比较。
1.2方法
1.2.1实验动物分组及模型制备健康雄性SD大鼠120只,体质量250~300 g,实验动物许可证号SYXK(冀)2014-0038,清洁级。采用抽签方法分为3组:假手术组(SHAM组,n=40)、MCAO组(n=40)、TPEN+MCAO组(n=40)。TPEN+MCAO组于MCAO前30 min腹腔注射TPEN,其他两组注射等量的生理盐水。大鼠于缺血90 min后行再灌注术,分为4个时间点:0、3、12、24 h,每次10只。本实验采用线栓法制备MCAO模型[7],试验中特别注意了插入深度和栓线的粗细,保证既要阻断血流,又不能刺破血管。MCAO过程检测大鼠的肛温、动脉压、心率,使3项生理指标保持正常。
1.2.2脑梗死体积计算缺血90 min再灌注不同时间点时大鼠用水合氯醛(10%)麻醉处死,立即断头取脑,生理盐水冲洗干净,放于蜡槽中,在-24 ℃冰箱中冷冻全脑30 min,从额极至枕极把大脑切成2 mm厚度的冠状切片6个,将切片快速置于2%TTC染色液中,在37 ℃条件下,避光孵育20 min。除第5个切片,其他切片顺序摆放在蓝色背景平板上,拍照。照片输入Imageplus5.0系统,分析计算脑梗死体积。脑梗死体积百分比为(A-B)/A×100%。其中,A:健侧大脑半球体积=(A1+A2+...+A6)×h,B:梗死侧非梗死区大脑半球体积=(B1+B2+...+B6)×h。Ai为第i片切片健侧脑组织面积,Bi代表第i片梗死侧非梗死区脑组织面积梗死体积,h表示切片厚度[8-9]。
1.2.3FLOUZin-3染色分析取上步各大鼠第5片冠状切片进行连续冷冻,进一步切为20 μm 10片,加入FLOUZin-3进行染色,终浓度为10 mol/L。37 ℃环境,避光孵育30 min,磷酸盐缓冲液(PBS)冲洗3遍,在荧光显微镜下观察脑切片内缺血半暗带区Zn2+水平(半暗带区范围为病灶旁5 mm区域)。每张切片随机选取4个不同角度,在同等放大倍数和参数下拍照,用专业图像分析软件NIS Element确定皮质半暗带区FLOUZin-3 Zn2+阳性细胞数和平均荧光强度,荧光强度平均值为总荧光强度值和FLOUZin-3阳性细胞数比值[10-11]。
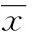
2结果
2.1不同时间点各组大鼠脑梗死体积比较经TTC染色,SHAM组大鼠未见脑梗死,MCAO组大鼠再灌注不同时间点均现梗死灶,随再灌注时间增加,梗死体积也显著增加(P<0.05)。单因素方差分析显示,再灌注各不同时间点TPEN+MCAO组的脑梗死体积显著小于MCAO组(P<0.05),见表1、图1。图中红色为正常组织,白色为病变组织。

图1 再灌注不同时间点TTC染色结果(×500)
2.2FLOUZin-3染色分析SHAM组大鼠缺血再灌注各时间点未现FLOUZin-3染色Zn2+阳性细胞,但MCAO组大鼠在再灌注的个时间点皮层半暗带均出现FLOUZin-3染色Zn2+阳性细胞,高倍镜下胞体现绿色荧光,突起清晰,再灌注0 h到3 h,12 h到24 h,FLOUZin-3染色Zn2+阳性细胞数显著增加(P<0.05),但从再灌注后3 h到12 h,FLOUZin-3染色Zn2+阳性细胞数差异无统计学意义(P>0.05)。单因素方差分析显示,再灌注各不同时间点TPEN+MCAO组的FLOUZin-3染色Zn2+阳性细胞数显著小于MCAO组(P<0.05)。各时间点之间的平均荧光强度值相差无统计学意义,见表2、图2。
2.3脑梗死体积与Zn2+水平的相关性分析MATLAB进行Pearson分析,结果显示,MCAO组大鼠缺血半暗带区的FLOUZin-3染色阳性细胞和不同时间点的脑梗死体积之间呈高度正相关(r=0.921,P<0.05),见图3。

表2 不同时间点FLOUZin-3染色Zn2+阳性细胞数比较
a:P<0.05、b:P<0.01,与再灌注0 h比较;c:P<0.01,与再灌注3 h比较;d:P<0.05,与再灌注12 h比较。

图2再灌注不同时间点FLOUZin-3染色结果(×500)

图3 Zn2+和梗死体积的相关性分析
3讨论
锌在人体内的水平仅次于铁,是脑神经生长发育的必需元素,Zn2+在中枢神经细胞内聚集在突触小泡内,生理浓度的Zn2+对神经元有保护作用,但Zn2+在体内浓度过高或过低会对身体造成伤害[1]。在接受刺激尤其是脑缺血时,大脑皮层中的Zn2+会从突触小泡和神经元内大量释放并涌入突触后神经元。有报道指出,大鼠全脑缺血24 h后,海马CA1区的锥体细胞会出现延迟性神经元死亡,而且锥体细胞内Zn2+水平逐渐增加,但如果大鼠在缺血后用Zn2+阻断剂处理,则锥体细胞内Zn2+水平降低,而且海马CA1区的锥体细胞的神经元损伤减轻,说明高浓度的Zn2+可能参与了神经元的死亡过程[12]。以上的研究主要观察了海马CA1区神经元的Zn2+浓度和脑损伤的关系,未关注缺血半暗带区Zn2+的变化情况,缺血半暗带区已成为急性缺血性脑卒中治疗的新靶点。
FLOUZin-3是一种新型的Zn2+荧光探针,发光强度大,波动性小,抗其他金属离子干扰性强,可检测聚集到突触后神经元的Zn2+流[13]。本实验在MCAO过程中检测了大鼠的肛温、动脉压和心率指标,3组大鼠的生理参数都在正常范围,据此可以忽略手术过程对实验过程的影响。由实验结果可知,脑缺血诱导了Zn2+在突触后神经元的集聚。但如用Zn2+螯合剂进行预处理,则半暗带区的FLOUZin-3 Zn2+阳性染色细胞明显减少,各个时间点大鼠的脑梗死体积也明显降低。有文献[16]指出,在动物脑缺血模型中用TPEN预处理,可以降低大鼠的病死率[14]。有文献提示,大鼠在脑缺血再灌注1 h时,脑梗死区域未现凋亡神经元,但在再灌注3~24 h内,凋亡神经元进行性增多[15]。这些发现说明Zn2+的集聚可能是引起脑组织损伤的1个重要因素,移除多余的Zn2+可以对脑缺血再灌注损伤起到保护作用。实验结果表明,再灌注0 h时,脑梗死体积约8%,梗死体积较小,FLOUZin-3染色阳性细胞数也较少,提示Zn2+从再灌注开始便参与了脑组织的损伤过程,但Zn2+参与大鼠脑缺血再灌注损伤的生理机制还没有完全搞清。文献[16]指出,Zn2+大量聚集可能会影响线粒体功能,抑制线粒体腺嘌呤核苷三磷酸(ATP)生成,刺激活性氧(ROS)生成。并且,细胞内Zn2+聚集会放大凋亡通路,增加细胞的凋亡率。本实验和这个结论基本相似,故推测高浓度的Zn2+会作为内源性毒素作用于脑组织,诱发脑组织神经元损伤或死亡。
本实验结果表明,缺血再灌注不同时间窗的荧光强度值差异不明显,这可能是因为单个细胞内结合状态的Zn2+迅速释放使细胞内的游离态Zn2+快速饱和,致使荧光强度增加不明显。本实验发现,Zn2+和脑梗死体积之间呈高度正相关,这也进一步表明了Zn2+参与了脑缺血损伤并发挥着重要作用。
综上所述,脑缺血再灌注大鼠脑内Zn2+水平随灌注时间进行性增加,且与脑梗死体积显著正相关,故推测较高浓度的Zn2+可能会作为内源性毒素参与脑损伤过程,为临床研究缺血性脑病的治疗技术提供新依据。
参考文献
[1]陈于祥,陈于兰,瞿伦学,等.老年人脑梗死复发的相关危险因素分析[J].重庆医学,2013,42(24):2839-2841.
[2]潘红,孙芳玲,王文,等.缺血性脑卒中的治疗药物及其有效治疗时间窗的研究进展[J].中国康复理论与实践,2013,19(3):201-203.
[3]张德辉,杨锦青,鞠培新,等.锌离子螯合剂DEDTC对小鼠脑缺血再灌注损伤保护作用[J].解剖科学进展,2012,18(4):366-369.
[4]Lee SJ,Koh JY.Roles of Zinc and metallothionein-3 in oxidative stress-induced lysosomal dysfunction,cell death,and autophagy in neurons and astrocytes[J].Mol Brain,2010,3(1):30.
[5]Pan R,Chen C,Liu WL,et al.Zinc promotes the death of hypoxic astrocytes by upregulating hypoxia-induced hypoxia-inducible factor-1alpha expression via poly(ADP-ribose) polymerase-1[J].CNS Neurosci Ther,2013,19(7):511-520.
[6]张亚敏,徐虹,孙华,等.线栓法制作大鼠局灶性脑缺血再灌注模型的研究及体会[J].医学研究杂志,2014,43(1):27-30.
[7]Shuttleworth CW,Weiss JH.Zinc:new clues to diverse roles in brain ischemia[J].Trends Pharmacol Sci,2011,32(8):480-486.
[8]王荣亮,刘小蒙,张营,等.大鼠局灶性脑缺血后神经功能评分与脑梗死体积相关性分析[J].首都医科大学学报,2013,34(1):69-74.
[9]闫峰,刘向荣,赵海苹,等.不同性别大鼠局灶性脑缺血脑血流及梗死体积的变化[J].首都医科大学学报,2013,34(1):64-68.
[10]Stork CJ,Li YV.Rising Zinc:a significant cause of ischemic neuronal death in the CA1 region of rat hippocampus[J].J Cereb Blood Flow Metab,2009,29(8):1399-1408.
[11]李芳,刘向荣,闫峰,等.局部亚低温对大鼠脑缺血再灌注基质金属蛋白酶9及细胞外基质蛋白表达的影响[J].首都医科大学学报,2013,34(1):58-63.
[12]Aguilar-Alonso P,Martinez-Fong D,Pazos-Salazar NG,et al.The increase in Zinc levels and upregulation of Zinc transporters are mediated by nitric oxide in the cerebral cortex after transient ischemia in the rat[J].Brain Res,2008,1200(1):89-98.
[13]Zhang X,Deguchi K,Yamashita T,et al.Temporal and spatial differences of multiple protein expression in the ischemic penumbra after transient MCAO in rats[J].Brain Res,2010,1343(3):143-152.
[14]Shuttleworth CW,Weiss JH.Zinc:new clues to diverse roles in brain ischemia[J].Trends Pharmacol Sci,2011,32(8):480-486.
[15]Yun YJ,Li SH,Cho YS,et al.Survivin mediates prostate cell protection by HIF-1 alpha against Zinc toxicity[J].Prostate,2010,70(11):1179-1188.
[16]Zhao Y,Pan R,Li S,et al.Chelating intracellularly accumulated Zinc decreased ischemic brain injury through reducing neuronal apoptotic death[J].Stroke,2014,45(4):1139-1147.
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.15.008
*基金项目:国家自然科学基金资助项目(81400934)。
作者简介:郭淑娟(1979-),主任医师,博士,主要从事神经病学研究。
[中图分类号]R741.02
[文献标识码]A
[文章编号]1671-8348(2016)15-2055-03
(收稿日期:2015-11-15修回日期:2016-02-16)
Relationship between focal cerebral ischemia reperfusion injury of rats and level of Zinc ions in penumbra*
Guo Shujuan1,Wang Congmin2
(1.DepartmentofGeriatrics,HandanCentralHospital,Handan,Hebei056001,China;2.DepartmentofNeurology,HebeiEngineeringUniversity,Handan,Hebei,056001,China)
[Abstract]ObjectiveTo detect the cerebral infarct volume and the contents of Zinc ions in the penumbra of rats with focal cerebral ischemia and reperfusion in different time,and to analyse the effect of Zinc ions on brain tissue damage in rats with ischemic stroke.MethodsA total of 120 healthy male SD rats were divided into SHAM operation group (SHAM group,n=40),middle cerebral artery occlusion group (MCAO group,n=40) and TPEN+MCAO group(n=40).Through drawing method,rat cerebral ischemia reperfusion model was established by suture method.After perfusion 0 h,3 h,12 h and 24 h,the brain were removed and stained by TTC to determine the volume of cerebral infarction by LOZEX-F image scanning;the positive Zinc ions cell number and fluorescence intensity were detected by fluorescent probes FLOUZin-3.Results(1) Cerebral infarction were not found in SHAM group;the volume of cerebral infarction in MCAO group was increased with reperfusion time extension;compared with MCAO group,TPEN+MCAO group significantly reduced cerebral infarction volume(P<0.05).(2)FLOUZin-3 cells were not found in SHAM group;a drastic increase of FLOUZin-3 cells was observable in the penumbra of MCAO group;compared with group MCAO group,TPEN+MCAO group significantly reduced FLOUZin-3 cells(P<0.05).(3)There was positive correlation between the FLOUZin-3 positive cell numbers and the volume of cerebral infarction in MCAO group(r=0.921,P<0.05).ConclusionHigher concentrations of Zinc ions as endogenous nerve poison might play an important role in the process of brain injury in ischemic stroke.
[Key words]cerebral ischemia;wounds and injuries;Zinc;reperfusion;brain tissue damage;penumbra;Zn2+chelation

