肺腺癌患者胸水中肿瘤耐药相关基因蛋白的表达及临床意义
马秦榕 郑锦花 钟玲玲 胡 洁 陈 颢
(桂林医学院附属医院病理科,广西 桂林 541001)
·肿瘤·
肺腺癌患者胸水中肿瘤耐药相关基因蛋白的表达及临床意义
马秦榕郑锦花钟玲玲胡洁陈颢
(桂林医学院附属医院病理科,广西桂林541001)
〔摘要〕目的检测P-糖蛋白(P-gp)、肺癌耐药蛋白(LRP)、多药耐药相关蛋白(MRP)在肺腺癌及恶性间皮瘤患者胸水沉渣包埋组织中的表达及临床意义。方法采用S-P免疫组化方法,对63例未做放化疗的肺腺癌或恶性间皮瘤患者进行检测,记录其胸水沉渣包埋组织中P-gp、LRP、MRP的表达水平。结果肺腺癌患者胸水沉渣包埋组织中P-gp、LRP、MRP的阳性率均高于非肿瘤性胸水患者(P<0.05);恶性间皮瘤患者胸水沉渣包埋组织中P-gp、LRP的阳性率均高于非肿瘤性胸水患者(P<0.05),但两者MRP阴性率无显著差异(P>0.05)。P-gp、LRP、MRP与肺腺癌患者年龄、组织分化程度及淋巴结转移无密切相关(P>0.05)。结论肺腺癌及恶性间皮瘤肿瘤细胞对转运蛋白类耐药基因有较强的耐药性,检测P-gp、LRP、MRP的阳性表达对指导临床化疗方案的实施有重要意义。
〔关键词〕沉渣包埋;耐药相关基因蛋白;免疫组化;化学治疗
肺腺癌和恶性间皮瘤常导致胸腔积液,化疗中也常常会出现耐药问题影响其疗效。胸水沉渣石蜡包埋技术是通过多次离心胸水后将沉渣包埋制片,具有组织块优势,可连续切片并可用于免疫组化染色,有利于胸水的确诊并指导临床治疗。本文拟探讨耐药基因蛋白在肺腺癌及恶性间皮瘤患者胸水沉渣组织中的表达及临床意义。
1资料与方法
1.1一般资料63例恶性胸腔积液的沉渣包埋组织均来桂林医学院附属医院2011年1月~2014年6月住院患者,均在抽取胸腔积液之前未经过放、化疗,收治的均经病理活检确诊,其中肺腺癌53例,恶性间皮瘤10例。肺腺癌中男23例,女30例,年龄39~80岁,平均65岁;恶性间皮瘤中男6例,女4例,年龄38~77岁,平均66岁。另设60例非肿瘤性胸水(结核性胸水)作为对照。
1.2方法采用S-P免疫组化方法,主要检测试剂盒由北京中杉生物技术有限公司提供,取肺腺癌、恶性间皮瘤和非肿瘤性胸水沉渣标本用4%中性甲醛固定,常规石蜡包埋,4 μm连续切片,严格按照试剂盒说明书进行免疫组化染色,检测P-糖蛋白(P-gp)、肺癌耐药蛋白(LRP)、多药耐药相关蛋白(MRP)在胸水沉渣包埋组织中的表达,用已知切片作阳性对照,用磷酸盐缓冲液(PBS)代替一抗做阴性对照,DAB显色,苏木素复染,胸水沉渣包埋切片的免疫组化结果与组织病理免疫组化结果一致。
1.3结果判定标准P-gp和MRP的阳性表达部位在胞膜/胞质,LRP阳性表达部位在胞质。根据染色强度评分〔1〕:染成淡黄色计1分,黄色计2分,棕黄色计3分;再根据阳性细胞的百分比评分:<25%计1分,25%~50%计2分,51%~75%计3分,>75%计4分,将每例两项得分相乘计入总分,若总分为0~3分判为-,4~8分判为+,9~12分判为。
1.4统计学方法采用SPSS13.0软件进行χ2检验。
2结果
2.1P-gp、LRP和MRP在肺腺癌及恶性间皮瘤患者胸水沉渣包埋组织中的表达肺腺癌患者胸水中P-gp、LRP、MRP阳性表达率均显著高于非肿瘤性胸水(P<0.05);恶性间皮瘤患者的胸水中P-gp和LRP阳性表达率高于非肿瘤性胸水(P<0.05),但两者MRP表达无显著差异(P>0.05)。见表1。染色阳性部位主要位于细胞膜或细胞质,呈黄色或棕黄色颗粒强于背景着色(图1)。
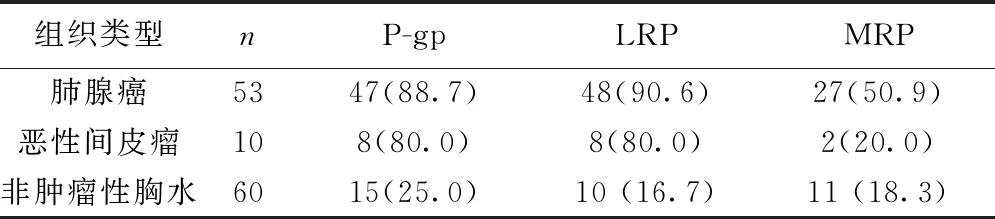
表1 耐药基因蛋白在肺腺癌及恶性间皮瘤胸水沉渣包埋组织中的表达〔n(%)〕
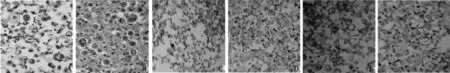
A:腺癌细胞环状排列,核大深染,胞质空泡状或含黏液(HE,×400);B:恶性间皮瘤细胞呈散在排列并可见核仁(HE,×400);C:P-gp阳性表达位于肺腺癌细胞的胞膜及胞质(S-P法,×400);D:LRP阳性表达位于肺腺癌细胞的胞质及胞膜(S-P法,×400);E:P-gp阳性表达位于恶性间皮瘤细胞的胞膜及胞质(S-P法,×400);F:LRP阳性表达位于恶性间皮瘤细胞的胞质及胞膜(S-P法,×400)图1 P-gp、LRP在肺腺癌、恶性间皮瘤中的表达
2.2P-gp、LRP、MRP的协同表达关系三种耐药基因相关蛋白在肺腺癌及恶性间皮瘤患者胸水中协同表达,肺腺癌患者胸水中三种耐药基因蛋白协同表达为18例(33.96%),其中P-gp和LRP协同表达为42例(79.25%),而恶性间皮瘤患者三种耐药基因蛋白协同表达仅为1例(10.0%),P-gp和LRP协同表达则高达7例(70.0%),可见P-gp和LRP的协同表达率较高。
2.3胸水沉渣包埋组织中耐药基因蛋白的表达与肺腺癌患者临床病理特征的关系P-gp、LRP、MRP的表达与肺腺癌组织分化程度、淋巴结转移及患者年龄无密切关系(P>0.05)。见表2。

表2 胸水中P-gp、LRP、MRP的表达与肺腺癌临床病理特征的关系〔n(%),n=53〕
3讨论
近年来我国肺癌的发病率逐年快速上升,死亡率较高,约占18.2%〔2〕,其中肺腺癌是常见的组织学分型,属于非小细胞肺癌,因其早期确诊率低,所以很多肺腺癌患者就诊时已为中晚期,患者常伴有胸腔积液,而肿瘤细胞对多种化疗药物产生交叉耐药性,因此常导致肿瘤化疗失败〔3〕。
P-gp基因分子量为170 kD,是一种能量依赖性药物泵,当细胞膜上的P-gp合成增加时,可将细胞内药物泵出细胞外,降低许多化疗药物在细胞内有效浓度,削弱其杀伤作用而导致耐药的发生〔4〕。P-gp阳性表达使阿霉素(ADM)、柔红霉素、长春花碱、长春新碱(VCR)、足叶乙甙(VP16)、紫杉醇等对肿瘤抑制率降低〔5,6〕。MRP基因位于染色体16号P13区1带,分子量190 kD。该蛋白表达位于细胞膜上,如果MRP的基因转染给正常细胞则使该细胞对VP16、ADM、VCR、柔红霉素等发生耐药。MRP可以促使细胞排出药物而致胞内药物浓度降低,或将药物吸入囊泡而改变药物分布,最终均导致耐药。LRP 基因位于16号染色体P13区1带与P11区2带间,分子量为110 kD,是与聚泡相关联的细胞微粒体。LRP使胞质中的药物吸入运输囊泡,通过胞吐方式排出细胞外,从而导致细胞内药物浓度下降。LRP导致耐药的另一机制是将药物从细胞核转移至细胞质,从而降低细胞核内靶点药物浓度〔7〕。LRP介导的耐药底物有蒽环类抗肿瘤抗生素、长春碱类等,还包括顺铂、卡铂、烷化剂等。由于这些药物主要作用于DNA,提示核屏蔽作用可能是LRP特有的作用机制。通过对肿瘤细胞株的研究中发现,高度耐药的肿瘤细胞株中大多数存在LRP和MRP的共同表达,这些结果表明这两种基因在定位功能表达中存在某种关联。
本研究结果表明,肺腺癌患者胸水沉渣包埋组织中P-gp、LRP、MRP较非肿瘤性胸水沉渣包埋组织均有过度表达其阳性率与参考文献〔8〕相似。Mahond等〔9〕实验表明,用药后P-gp表达阳性的病例死亡危险率大于P-gp阴性病例3倍,因此认为P-gp阳性表达与预后不良明显相关。周庚寅等〔10〕报道P-gp阳性患者3年生存率明显低于P-gp阴性患者,提示P-gp表达阳性患者对化疗药物不敏感,有明显的耐药性,从而治疗效果及预后差。因此P-gp、LRP、MRP在肺腺癌化疗过程中起到的药物减毒作用,可导致肺腺癌化疗失败〔11〕。本研究结果提示肺腺癌对化疗不敏感,与临床化疗随访结果相符,可见胸水沉渣包埋组织中耐药基因蛋白的阳性表达率可以为肺腺癌患者选择化疗方案提供参考依据。另有作者报道,肿瘤耐药相关基因表达与肿瘤淋巴结转移相关,认为其过度表达也是癌细胞生物学行为的恶性标志〔12〕。本研究结果表明,肺腺癌病理分化程度、淋巴结转移及患者年龄,不宜作为判断肺腺癌恶性程度和预后的指标。另外P-gp和LRP两种耐药基因蛋白可以作为临床选择化疗方案的参考依据,但因为患者例数较少,还需要进一步研究。
4参考文献
1Tormanen-Napankangas U,Soini Y,Kahlos K,etal.Expression of caspases-3,-6 and-8 and their relation to apoptosis in nonsmall cell lung carcinoma〔J〕.Int J Cancer,2001;93(2):192-8.
2Ferlay J,Shin HR,Bray F,etal.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008〔J〕.Int J Cancer,2010;127(12):2893-917.
3窦红漫,程平,吴赛青,等.多药耐药蛋白P-gP,Topo-II与p53蛋白在胃癌组织中的表达及意义〔J〕.安徽医药,2010;14(11):1294-6.
4Kim EH,Min HY,Chung HJ,etal.Anti-proliferative activity and suppression of P-glycoprotein by (-)-antofine,a natural phenanthroindolizidine alkaloid,in paclitaxel-resistant human lung cancer cells〔J〕.Food Chem Toxicol,2012;50(3/4):1060-5.
5Ruiz Gomez MJ,Souviron RA,Martineg MM.P-glycopro-tein,a membrane pump that represents a barrier to chemo-therapy in cancer patients〔J〕.An Med Interna,2002;19(9):477-85.
6Anthony V,Skach WR.Molecular mechanism of P-glyco-protein assembly into cellular membrances〔J〕.Curr Protein Pept Sci,2002;3(5):485-501.
7Wang J,Zhang J,Zhang L,etal.Expression of P-gp,MRP,LRP,GST-π and TopoⅡα and intrinsic resistance in human lung cancer cell lines〔J〕.Oncol Rep,2011;26(5):1081-9.
8Filpits M,Stranzl T,Pohl G,etal.Drug resistance factors in acute myeloidleukemia,a comparatiue analysis〔J〕.Leukemia,2000;14(1):68-76.
9Mahond A,Ahmed A,Roben SM,etal.P-glycoprotein as a prognosticindicator in per and post chemotheraphy ovarian adenocarcinoma〔J〕.Inter J GynePathd,1997;16(1):69-75.
10周庚寅,王利,郭玲玲,等.肺癌的化疗与多耐药的研究〔J〕.中国肺癌杂志,2001;4(3):178-20.
11韩宝惠,聊美琳,苏建中,等.非小细胞肺癌肿瘤药敏与耐药基因表达的相关性研究〔J〕.中华结核和呼吸杂志,2002;25(12):727-31.
12李英杰,于长海,张文.COX-2 与 LRP 在非小细胞肺癌中的表达与肺癌预后的关系〔J〕.临床肺科杂志,2010;15(12):1797-8.
〔2016-02-18修回〕
(编辑滕欣航)
基金项目:广西区卫计委自筹课题(Z2015414)
通讯作者:郑锦花(1970-),女,博士,主任医师,主要从事胸部肿瘤发病机制、鉴别诊断及综合治疗研究。
〔中图分类号〕R734.2
〔文献标识码〕A
〔文章编号〕1005-9202(2016)13-3193-03;
doi:10.3969/j.issn.1005-9202.2016.13.047
第一作者:马秦榕(1991-),女,在读硕士,主要从事胸部肿瘤发病机制、鉴别诊断及综合治疗研究。

