钙敏感受体对内皮祖细胞数量及功能的影响
张凤香 贺成业 李晨光 孙大鹏
(辽宁医学院附属第一医院心外科,辽宁 锦州 121001)
钙敏感受体对内皮祖细胞数量及功能的影响
张凤香贺成业李晨光孙大鹏
(辽宁医学院附属第一医院心外科,辽宁锦州121001)
〔摘要〕目的观察钙敏感受体(CaSR)对人外周血内皮祖细胞(EPCs)数量及功能的影响。方法培养并鉴定EPCs;RT-PCR和Western 印迹检测EPCs中CaSR的表达情况;MTT法观察CaSR对EPCs增殖能力的影响;Tube形成和迁移实验评价CaSR对EPCs血管新生能力和迁移能力的影响;Western 印迹检测CaSR对EPCs中血管内皮生长因子(VEGF)蛋白表达的影响。结果RT-PCR和Western 印迹结果显示在EPCs中有CaSR的表达;MTT法、Tube形成和迁移实验检测结果显示与正常对照组相比较,CaSR激动剂组EPCs增殖、迁移能力和血管形成能力明显增强(P<0.05),而CaSR抑制剂组EPCs增殖、迁移能力和血管形成能力明显降低 (P<0.05);Western 印迹检测发现与正常对照组相比较,CaSR激动剂组VEGF和CaSR表达明显增强,而CaSR抑制剂组VEGF和CaSR表达明显降低。结论EPCs中有CaSR的表达,并且CaSR可以影响EPCs的数量、迁徙和血管形成能力。
〔关键词〕钙敏感受体;内皮祖细胞;血管内皮生长因子
动脉粥样硬化(AS)是引起人类心脑血管疾病的重要原因之一,其发病机制十分复杂。目前研究发现〔1〕,血管内皮细胞的损伤和激活可以影响AS的发生,从而影响心脑血管系统的稳定。因此,血管内皮功能的恢复和局部微循环的形成是防治AS的重要手段〔2〕。内皮祖细胞(EPCs)是一种起源于骨髓的原始细胞,除骨髓外,脐带血和成人外周血中均存在 EPCs。近年来,人们发现EPCs可以提高血管内皮功能和促进新生血管的形成,进而恢复缺血组织的功能以达到预防AS形成的作用〔3〕。钙敏感受体(CaSR)是G蛋白耦联受体超家族中C家族的一员。CaSR广泛存在于心脑血管系统中,并通过在巨噬细胞和平滑肌等细胞中的表达来参与AS的形成过程〔4〕。但CaSR是否在EPCs中存在表达尚不得而知。本实验主要探讨CaSR在EPCs中是否存在表达以及CaSR是否对EPCs的增殖、迁徙及血管形成产生影响,进而影响AS的形成。
1材料和方法
1.1材料CaSR激动剂GdCl3、CaSR 抑制剂NPS2390(上海生工);淋巴细胞分离液(天津灏洋生物制品公司);DMEM培养基、胎牛血清(Hyclone公司);胰 蛋 白 酶、噻唑蓝(MTT)、二甲基亚砜(DMSO,Sigma公司);血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、表皮细胞生长因子(EGF)、胰岛素样生长因子-1(IGF-1,Cytolab公司);人纤维连接蛋白(Haematologic Technologic公司);兔抗人CaSR抗体、兔抗人VEGF抗体、HRP 标记羊抗兔二抗、兔抗β-actin 单克隆抗体 (北京中杉金桥公司)。
1.2EPCs的培养及分组取健康成人空腹外周血,通过密度梯度离心(Ficoll-Paque,1.077,Amersham Bioscience)收集获得外周血单个核细胞,将3×106/ml单个核细胞铺在包被有人纤维连接蛋白的24孔培养板。加入M199完全培养基0.5 ml,5% CO2、37℃孵育箱中培养3 d,用PBS洗掉非贴壁细胞,换培养液继续培养至7 d,然后用PBS洗掉非贴壁细胞,贴壁细胞供实验使用。实验分为正常对照组、GdCl3组及NPS2390组。
1.3EPCs的鉴定贴壁细胞弃上清,37℃与含Dil-ac-LDL (2.4 mg/ml)的 M199培养液孵育1 h,PBS浸洗,用2%多聚甲醛固定10 min,再加入FITC-UEA-I (10 mg/ml), 37℃孵育1 h,PBS 浸洗。激光共聚焦显微镜鉴定,FITC-UEA-I和Dil-ac-LDL双染色阳性细胞为早期EPCs。
1.4EPCs增殖能力检测将等量EPCs接种到96孔培养板培养24 h。实验分为正常对照组、GdCl3组及NPS2390组,分别培养培养24、48、72 h。检测时各组每孔加入5 mg/ml MTT 20 μl,培养4 h,弃上清液,然后每孔加入150 μl DSMO,微量振荡器上振荡10 min,室温孵育30 min后放入酶标仪,波长490 nm处测吸光度值。
1.5EPCs迁移能力检测用0.25%胰蛋白酶(含0.02%EDTA)消化收集贴壁细胞,用含10%胎牛血清的DMEM培养基制成单个细胞悬液,以5×104/孔的细胞数加入孔径为0.8 μm的Transwell小室的上室,每孔体积100 μl。37℃培养48 h后取出滤膜,棉签拭去上室滤膜外表面残存细胞,对迁移至滤膜内表面的细胞用20 g/L多聚甲醛固定,PBS洗涤,苏木素染色风干后在吸收波长530 nm,发射波长590 nm处测荧光值,以百分率表示。
1.6EPCs血管形成能力检测Matrigel胶4℃过夜后以1∶2 稀释后平铺在 24 孔板,置于 37℃培养箱 1 h。加入GdCl3或NPS2390,然后加入胰酶收集细胞,置于 37℃培养箱 48 h,Tube 的形成定义为形成管状结构,长为宽的 4倍,通过倒置显微镜(×100)随机选择 6 个视野观察,用 Adobe Photoshop 分析每个视野总的 Tube 视野的管腔结构数后取其均值。
1.7Western 印迹检测CaSR和VEGF表达情况收集各组细胞以冷PBS洗2次,以裂解缓冲液提取细胞总蛋白,蛋白浓度参照BCA试剂盒测定。煮沸变性的蛋白以每孔40 μg的含量加样,经浓缩胶6%,分离胶10%的SDS-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离。通过电转仪将凝胶上的蛋白样品转至PVDF膜上,5%脱脂奶粉在37℃封闭2 h。分别与1∶1 000兔抗人VEGF抗体和1∶600兔抗人CaSR抗体4℃孵育过夜。TBST洗膜3次,每次10 min,后加入辣根过氧化物酶标记的羊抗兔IgG(1∶500),4℃孵育2 h。洗膜3次,每次10 min。ECL发光试剂盒发光显影,凝胶成像。
1.8RT-PCR检测CaSR mRNA表达培养48 h后收集并计数各组细胞,用RNA提取试剂盒提取细胞总RNA,经紫外分光光度计检测RNA浓度,参照反转录试剂盒说明书进行发转录反应。反转录PCR法检测:CaR:正义链5′-TTCGGCATCAGCTTTGTG-3′ ;反义链5′-TGAAGATGATTTCGTCTTCC-3′;β-actin:正义链5′-TTGTAACCAACTGGGACGATATGG-3′;反义链5′-GATCTTGATCTTCATGGTGCTAGG-3′。扩增条件:95℃ 15 min;94℃ 30 s,55℃ 30 s,72℃ 2 min,共30个循环。取10 μl PCR产物进行琼脂糖凝胶电泳分析。
1.9统计学方法采用SPSS13.0统计软件,计量资料组间比较进行t检验。
2结果
2.1EPCs的鉴定分离获得的单个核细胞培养7 d后呈梭形样改变。Dil-acLDL和FITC-UEA-1对细胞染色后通过共聚焦显微镜鉴定,双染色阳性细胞被认为是正在分化的EPCs。见图1。
2.2EPCs中CaSR的表达检测结果显示,阴性对照组未加入CaSR抗体无任何条带出现,而CaSR抗体组则可见明显条带出现, 研究提示CaSR在EPCs中存在表达。见图2。
2.3CaSR对EPCs增殖能力的影响MTT检测结果显示:作用细胞24、48和72 h后,与正常对照组比较GdCl3组明显促进EPCs增殖,当作用至48 h这种促进作用达到高峰(P<0.05);而NPS2390组与正常对照组比较明显抑制EPCs增殖,当作用至48 h这种抑制作用达到高峰(P<0.05)。见表1。

A:FITC-UEA-I标记阳性细胞呈绿色荧光; B:DiI-acLDL标记阳性细胞呈红色荧光;C:双重染色阳性的细胞呈黄色荧光 图1 共聚焦显微镜鉴定EPCs(×200)

1:阴性对照组 2:CaSR抗体组图2 EPCs中鉴定CaSR的表达
2.4CaSR对EPCs迁移能力的影响作用细胞24、48和72 h后,与正常对照组比较GdCl3组明显增强EPCs的迁移能力,当作用至48 h这种增强作用达到高峰(P<0.05);而NPS2390组与正常对照组比较明显抑制EPCs的迁移能力,当作用至48 h这种抑制作用达到高峰(P<0.05)。见表2。
2.5CaSR对EPCs管腔形成能力的影响作用细胞24、48和72 h后,与正常对照组比较GdCl3组明显增强EPCs的管腔形成能力,当作用至48 h这种增强作用达到高峰(P<0.05);而NPS2390组与正常对照组比较明显抑制EPCs的管腔形成能力,当作用至48 h这种抑制作用达到高峰(P<0.05)。见表3。
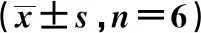
表1 CaSR对EPCs体外增殖能力的影响
与正常对照组比较:1)P<0.05,下表同
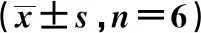
表2 CaSR对EPCs迁移能力的影响
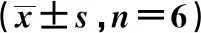
表3 CaSR对EPCs管腔形成能力的影响
2.6CaSR对EPCs内VEGF和CaSR蛋白表达的影响作用48 h后,Western 印迹检测结果显示:与正常对照组相比,GdCl3组VEGF和CaSR蛋白表达明显增强,而NPS2390组VEGF和CaSR蛋白表达明显减弱。见图3。

1:正常对照组;2:NPS2390组;3:GdCl3组 图3 Western 印迹鉴定VEGF和CaSR蛋白的表达
3讨论
AS是造成人体心、脑血管疾病的主要原因之一,对AS发病机制和防治方法的研究正成为人们关注的热点。研究发现〔1〕,血管内皮细胞在AS的形成过程中起到十分重要的作用,是 AS发生的始动环节。EPCs是一种可分化成血管内皮细胞的前体细胞,它可以参与血管内皮损伤后的再生与修复,从而影响AS的形成〔5,6〕。近年来研究发现,在很多组织细胞中均有CaSR的表达,如心肌组织、主动脉内皮细胞、肺动脉平滑肌细胞、颈动脉平滑肌细胞〔7~9〕。但CaSR是否在EPCs中存在表达尚不清楚。本实验结果说明CaSR在EPCs中存在表达,增强CaSR的表达能够明显增加EPCs的数量、促进外周血EPCs的迁移;而抑制CaSR的表达能够明显降低EPCs的数量、减少外周血EPCs的迁移。VEGF是血管生成的关键因子之一。VEGF不但可以促进EPCs的迁移和新血管的生长和形成,还可以通过提高EPCs分裂和增生能力,对其生长发育及功能进行调节〔10~12〕。本研究结果说明CaSR能够对EPCs血管的生成产生影响,这种影响可能与 VEGF的表达变化有关,但其具体机制尚需进一步研究。综上所述,EPCs中有CaSR的表达,并且CaSR可以影响EPCs的数量、迁徙和血管形成能力,这种促进作用可能是通过调节VEGF的表达来实现的。
4参考文献
1Vanhoutte PM.Endothelial dysfunction and atherosclerosis〔J〕.Eur Heart,1997;18:19-29.
2Moreno PR,Prushothaman KR,Sirol M,etal.Neo-vascularization in human atherosclerosis〔J〕.Circulation,2006;113:2245-52.
3Hristow M,Eel W,Weber PC.Endothelial progenitor cells:mobilization,differentitation and homing〔J〕.Thromb Vasc Biol,2003;23:1185-9.
4郭津,徐长庆,李鸿珠,等.动脉粥样硬化对大鼠心肌钙敏感受体的表达和细胞凋亡的影响〔J〕.中华心血管病杂志,2008;36(12):1101-5.
5Lev EI,Leshem-Lev D,Mager A,etal.Circulating endothelial progenitor cell levels and function in patients who experienced late coronary stent thrombosis〔J〕.Eur Heart J,2010;31(21):2625-32.
6Wang HY,Gao PJ,Ji KD,etal.Circulating endothelial progenitor cells,C-reactive protein and severity of coronary stenosis in Chinese patients with coronary artery diseases〔J〕.Hypert Res,2007;30(2):133-41.
7李光伟,邢文婧,郝静辉,等.钙敏感受体在缺氧诱导的大鼠肺动脉平滑肌细胞增殖中的作用〔J〕.中国病理生理杂志,2010;26(12):2433-7.
8Li GW,Wang QS,Hao JH,etal.The functional expression of extracellular calcium-sensing receptor in rat pulmonary artery smooth muscle cells〔J〕.J Biomed Sci,2011;18:16.
9李辛,贺成业,罗俊生,等.钙敏感受体在颈动脉平滑肌细胞增殖和迁移中的作用〔J〕.解放军医学院学报,2013;8:125-9.
10Alonci A,Allegra A,Bellomo G,etal.Evaluation of circulation endothelial cells,VEGF and VEGFR2 serum levels in patients with chronic myeloproliferative diseases〔J〕.Hematol Oncol,2008;26(2):235-9.
11Yi C,Xia W,Zheng L,etal.Transplantation of endothelial pro-genitor cells transferred by vascular endothelial growth factor gene for vascular regeneration of ischemic flaps〔J〕.J Surg Res,2006;135(1):100-6.
12Valarmathi WT,Davis J,Yost MT,etal.A three-dimensional model of vasculogensis 〔J〕.Biomaterials,2009;30(7):1098-112.
〔2014-12-09修回〕
(编辑曹梦园)
基金项目:国家自然科学基金(81541099);辽宁省自然科学基金(2013022010);辽宁医学院校长基金项目 (XZJJ 20130246)
通讯作者:孙大鹏(1978-),男,副教授,博士后,主要从事生物治疗研究。
〔中图分类号〕R39
〔文献标识码〕A
〔文章编号〕1005-9202(2016)13-3098-03;
doi:10.3969/j.issn.1005-9202.2016.13.004
Effect of calcium-sensing receptor on the number and function of endothelial progenitor cells
ZHANG Feng-Xiang,HE Cheng-Ye,LI Chen-Guang,et al.
Department of Cardiac Surgery,the First Affiliated Hospital of Liaoning Medical College,Jinzhou 121001,Liaoning,China
【Abstract】ObjectiveTo investigate the effect of calcium-sensing receptor (CaSR) on the number and function of endothelial progenitor cells (EPCs).MethodsThe EPCs were cultured and identified.Realtime-PCR and Western blot were used to detect the expression of CaSR in EPCs.MTT was used to detect the effect of CaSR on the proliferation of EPCs.Tube formation and migration test were used to measure the effect of CaSR on the angiogenesis and migration of EPCs.Western blot was used to detect the expression of vessel endothelial growth factor (VEGF).ResultsRT-PCR and Western blot analysis showed there was CaSR expression in EPCs.MTT method ,Tube formation and migration assay showed,compared with normal control group,EPCs proliferation,migration and angiogenesis were markedly enhanced in CaSR agonist group (P<0.05),while EPCs proliferation,migration and angiogenesis were markedly reduced in CaSR inhibitor group (P<0.05).Western blot showed that,compared with the control group ,VEGF and CaSR expression were significantly increased in CaSR agonist group,while were significantly reduced in CaSR inhibitor group (P<0.05).ConclusionsCaSR could express in EPCs,CaSR not only could affect the number of EPCs but also the migration and angiogenesis capabilities of EPCs.
【Key words】Calcium-sensing receptor; Endothelial progenitor cells; Vascular endothelial growth factor
第一作者:张凤香(1978-),女,博士,副教授,副主任医师,主要从事动脉粥样硬化研究。

