模拟失重雌雄大鼠骨密度、骨代谢指标与骨折风险的相关性
张 恒,任宁涛,刘 宁,李 洁,王 征,毛克亚,崔 赓
模拟失重雌雄大鼠骨密度、骨代谢指标与骨折风险的相关性
张恒1,任宁涛1,刘宁2,李洁3,王征1,毛克亚1,崔赓1
100853北京,解放军总医院:1.骨科,3.妇产科;2.710032西安,第四军医大学西京医院骨科
【摘要】目的分析模拟失重雌、雄性大鼠模型骨密度及骨代谢生化指标和生物力学之间的相关性,与骨折风险建立联系,探讨航天医疗基础工作。方法3个月龄雌、雄性SD大鼠各20只,按照性别及是否失重分为4组。采用尾部悬吊模拟失重方法,实验4周后处死SD大鼠,双能X线吸收法(dual-energy X-ray absorption, DEXA)测定L4椎体、股骨髁部骨密度,骨组织切片染色,ELISA法检测骨代谢生化标志物:骨碱性磷酸酶(bone alkaline phosphatase,BALP)、抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP),生物力学测试骨强度。结果悬吊组大鼠较对照组大鼠BMD均显著下降,雌性悬吊组较雄性组下降明显;组织切片悬吊组较对照组骨组织及骨细胞间隙明显增宽,细胞肿胀;BALP、TRAP雄性悬吊组分别较对照组升高3.09和1.72倍,雌性悬吊组分别较对照组升高3.43和2.14倍;悬吊组椎体的最大压缩载荷(N)、最大压缩压力(MPa)、股骨最大抗弯曲载荷(N)悬吊组较对照组显著下降。骨密度(bone mineral density,BMD)、BALP、TRAP与椎体最大力学强度Fmax相关性系数r值,雄性组分别为0.985、-0.949、-0.970,雌性组分别为0.908、-0.858、-0.921。结论失重4周后大鼠出现明显的骨质疏松、骨小梁结构破坏、力学强度显著下降。雌性大鼠骨质疏松较雄性组明显加重。最大力学强度Fmax与骨密度成正相关,与BALP、TRAP成负相关,未来精准、便捷的骨代谢指标可能成为航天医学预测骨折风险的手段之一。
【关键词】模拟失重;骨质疏松;骨生化标记物; 生物力学;相关性
失重状态下导致的骨质疏松、肌肉萎缩、心血管功能紊乱、泌尿系结石等成为近年来航天医学研究的重点[1, 2]。美国国家航空航天局(National Aeronautics and Space Administration, NASA)提出一项新的研究领域:空间生命科学,旨在解决人类离开地球后生理功能的病理性改变[3]。因航天员的数量有限及人体试验的伦理等约束,目前针对航天员的在体实验很难开展。NASA研究员不断探索实验模型,Morey-Holton教授提出的大鼠尾部悬吊模型(tail suspended, TS)得到与有限的太空实验相似的实验结果,并被公认为目前最合理的活体失重模型[4-8]。失重引起的骨质疏松从骨密度、骨小梁三维微观结构、细胞通路方面已得到相关验证[9, 10]。在太空或空间实验室条件下,由于空间及目前技术所限,缺乏地面上大型骨密度测量仪器,如何精确地预测航天员的骨折风险是航天医学的重点和难点,目前国内外研究较少。本研究设计通过骨代谢生化标记物与骨密度及力学性能的相关性,与骨折风险建立联系,进而对航天员的航天医疗工作提供理论依据。
1材料与方法
1.1实验动物成年健康3个月龄Sprague Dawley(SD)大鼠40只,体重(220±16)g,此生长发育阶段的SD大鼠处于骨密度峰值期(peak bone mineral density, PBMD)[11],减少发育期骨密度的增长产生的误差。按性别比及试验处理分为4组,雄性对照组、雄性悬吊组、雌性对照组、雌性悬吊组,每组10只。
1.2主要仪器XJ828生物力学试验机(MTS 858 bionix,美国),双能X线吸收骨密度仪及配套的小动物分析软件(DEXAHOLOGIC公司,美国),Leica-LA 2500轮转式硬组织切片机(LEICA公司,德国),Leica-LA全自动显微镜(Olympus CX31,日本),大鼠TRAP ELISA试剂盒、大鼠BALP ELISA试剂盒(Groundwork Biotechnology Diagnosticate Ltd,美国),Du7HS型紫外分光光度计(Beckman公司,美国)。
1.3实验方法
1.3.1失重大鼠模型的建立按照Morey-Holton教授提出的尾部悬吊模型制造模拟失重模型[4]。试验组后肢悬垂脱离水平面,与头部约成30°夹角,大鼠可自由饮食和旋转活动,光照黑暗时间各12 h。设置相同饮食和光照的对照组。
1.3.2取材与骨密度分析于第4周后处死,取L4椎体、股骨行骨密度,扫描精度1%,ACF= 1.037,BCF=1.024,扫描类型:hHi-Res,扫描模式:Discovery Wi(S/N 83860),应用小动物测量专用分析软件。
1.3.3组织切片观察L5椎体打磨表面软组织后,经10%的甲醛溶液固定2周,乙醇逐次脱水后,于塑料液内包埋并固化成块,并切成50~100 μm切片。根据改良的丽春红染色方法染色后,制成不脱钙切片,显微镜下观察骨组织情况。
1.3.4血清骨代谢生化标记物检测实验到期后利用2%戊巴比妥钠(40 mg/kg)对SD大鼠腹腔注射麻醉,心脏取血4~5 ml,静置20 min后,于高速离心机内4500 r/min,离心6 min,取上层血清,-80 ℃低温冰箱冻存,待检测。检测前提前12 h常温解冻,ELISA法检测血清BALP、TRAP的含量(大鼠TRAP ELISA试剂盒Groundwork Biotechnology Diagnosticate Ltd.美国;大鼠BALP ELISA试剂盒Groundwork Biotechnology Diagnosticate Ltd.美国;Du7HS型紫外分光光度计 Beckman公司,美国),绘制LOGIT-LOG曲线图,并计算其含量。
1.3.5生物力学测试在万能材料试验机上(MTS858 systeminc,minneapolis,USA),采用轴向加压测试椎体松质骨的力学强度(单位:N、MPa)。采用三点预弯试验测量皮质骨的力学强度(单位:N)。测量时 ,切除椎体椎弓及附件,砂纸磨除椎体上下表面,使平面相互平行,卡尺测量椎体高度,根据阿基米德原理计算其体积,计算椎体横断面积。椎体加载速度1 mm/min,股骨支点跨距16 mm,加压点为中点,加载速度1 mm/min,加载至骨折,计算机记录载荷-位移曲线。计算出最大抗压缩载荷及应力。
1.3.6观察指标悬吊结束后密切观察大鼠的饮食、粪便、体重、毛发等一般指标,骨密度,骨组织切片、骨代谢生化标记物BALP、TRAP含量,生物力学最大压缩应力、最大压缩载荷、股骨三点弯曲强度。
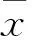
2结果
2.1一般指标SD大鼠在试验过程中饮食、排便及一般活动正常,体重增加与空白对照组间差异不明显,各组均无脱毛、断尾及死亡现象发生(表1)。
2.2骨密度各组间骨密度的基线值组间差异可能无统计意义。失重实验后,不同性别悬吊组大鼠均较空白对照组骨密度下降(P<0.01),其中雄、雌性组失重后骨密度分别降低18.4%和29.1%。同时,雌性悬吊组较雄性悬吊组骨密度下降明显(P<0.05,表2),差异有统计学意义。
2.3组织学L5椎体改良丽春红染色后组织形态学观察(图1)。50倍显微镜下观察到悬吊组SD大鼠的骨小梁组织结构表现为明显的“蜂窝样”改变,提示悬吊组出现明显的骨质疏松,骨小梁结构从组织、细胞水平遭到破坏,雌性组较雄性组上述改变更明显。
2.4骨代谢标记物表3示血清BALP、TRAP的含量的统计结果。失重实验结束后,雌雄性空白对照组间血清BALP、TRAP含量统计无差异,不同性别间悬吊组均较空白对照组血清BALP、TRAP升高(P<0.05),雄性悬吊组分别较对照组升高3.09和1.72倍,雌性悬吊组分别较对照组升高3.43和2.14倍。雌性悬吊组较雄性悬吊组血清BALP、TRAP升高更明显(P<0.05),差异有统计学意义。
2.5生物力学实验见表4。两对照组间力学测试结果无统计差异,不同性别悬吊组大鼠的腰椎的最大压缩载荷、最大压缩应力、股骨的最大抗弯曲载荷均较空白对照组显著下降(P<0.05),雄性悬吊组分别较对照组下降27.6%、26.4%、24.7%,雌性悬吊组分别较对照组下降36.6%、33.1%、34%,力学强度显著下降。雌性失重大鼠较雄性失重大鼠力学强度下降更明显,差异有统计学意义(P<0.05)。
2.6力学强度与骨密度、血清BALP、TRAP含量参数的相关系数预测骨折风险结果表5示雄、雌性大鼠椎体Fmax与骨密度、骨生化标志物的线性相关分析结果。骨密度与椎体最大力学强度在雄性组和雌性组均成明显正相关(P<0.05),血清BALP、TRAP与椎体最大力学强度在雄性组和雌性组均成明显的负相关(P<0.05),且两组间有较好的一致性。

表1 两组大鼠实验建模4周后观察指标比较 (n=10;±s)
注:均能正常活动,无脱毛、断尾和死亡
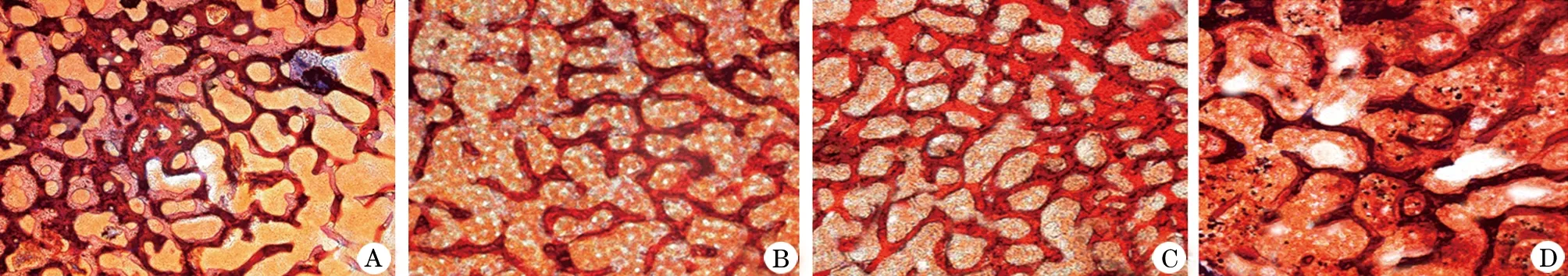
图1 L5椎体形显微镜下形态学观察(改良丽春红染色,×50)
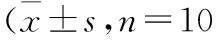
;g/cm2)
注:与对照组比较,①P<0.05;与雄性悬吊组比较,②P<0.05

表3 ELISA法检测不同性别SD大鼠模拟失重后骨代谢生化标记物BALP、TRAP含量 (n=10;
注:与对照组比较,①P<0.05;与雄性悬吊组比较,②P<0.05

表4 实验大鼠模拟失重后椎体最大压缩载荷、最大压缩压力及股骨最大抗弯曲载荷指标比较 (n=10;±s)
注:与对照组比较,①P<0.05;与雄性悬吊组比较,②P<0.05

表5 雄、雌性大鼠模拟失重后椎体Fmax与BMD、骨生化标志物的线性相关分析
3讨论
3.1失重与骨质疏松失重性骨质丢失主要发生在脊柱、骨盆及股骨等承重骨,且以松质骨分布区域的骨量丢失为主,而颅骨、颞骨等变化不明显[12]。其机制:成骨细胞的活性降低,破骨细胞的活性增强,骨形成与骨吸收代谢失平衡,导致骨密度降低,骨小梁的三维立体结构破坏,正常的H形结构变细、疏松,力学性能明显下降[3, 13]。尾部悬吊大鼠后肢处于人工失重状态,体液头像分布,NASA 在太空飞行实验中进行的动物实验与地面尾部悬吊实验数据进行比较,该模型与太空飞行时大鼠或宇航员处于的失重状态相似,该模型引起的应激程度轻微,大鼠体质量增长与正常大鼠接近,可用来对长期失重生理影响及其机制进行研究[14, 15]。
3.2失重与骨骼骨密度改变太空中承重骨骼以每月1.6%的速率丢失,宇航员返回地球后普遍出现立位耐力不良,腰背部、关节肌肉疼痛等症状,甚至出现骨质疏松性骨折[16]。Pecaut等[17]发现,失重导致肌肉和骨骼应力刺激减少,易导致骨密度降低,肌肉萎缩,运动功能较低。俄、美联合研究表明:在长达14.5个月的微重力环境下,宇航员下肢骨密度下降明显,股骨下降(8.17±1.24)%,骨盆下降(11.99±1.22)%[16]。徐丛等[18]研究骨密度与极限应力成明显的正相关(r=0.765)。Ebbesen等[19]发现,最大生物力学强度与骨密度成明显正相关(r=0.88)。本研究与国内外研究结果有较好一致性。失重后雌雄性大鼠骨密度较对照组明显降低,镜下观察骨形态结构改变,悬吊组雌、雄大鼠椎体骨质疏松样改变明显,骨小梁不连续、变细、间隙增大明显。雌性大鼠骨密度及显微镜下图像分析结果较雄性组骨质疏松严重,这可能是性别不同、生理结构差异,以及激素水平差异所致,后期笔者将对此进行进一步探索。
3.3失重与骨代谢标记物失重和模拟失重导致的骨丢失主要以骨形成受抑制为主,成骨细胞的分化下降,细胞内代谢紊乱抑制了成骨细胞的成骨能力[20]。Aguirre等[21]发现,尾吊模型中破骨细胞数量增加且活性增强。Nakamura等[22]证实,失重状态下BALP下降,TRAP增加。尿羟脯氨酸(HOP)为经典的骨吸收标记物,但易受饮食影响,且悬吊大鼠尿液采集存在困难。本实验以TRAP代替HOP,实验灵敏度、准确性均较高。BLAP、TRAP分别从成骨细胞、破骨细胞水平间接反映骨形成与骨吸收,较好地体现了骨重建与骨转换。Kapitonova等[23]指出,实际太空飞行实验后,BALP表达及活性增高,这可能是细胞的一种代偿反应,仅有BALP活性增高可使成骨细胞分化,但无法使其矿化,这可能是BALP 升高未使骨丢失改善的原因。本研究中,BLAP、TRAP均升高,与Nakamura等[22]的实验结果有偏差,与Kapitonova等[23]研究一致。经分析认为,BLAP、TRAP均增高主要是因为SD大鼠模拟失重状态下骨转换率增强,骨矿化功能障碍,骨吸收大于骨沉积,造成了骨代谢的负平衡,也是引起骨量丢失的主要原因。
3.4失重与生物力学生物力学作为骨质疏松应力性骨折的检测手段,通过直观的最大应力数值验证模拟失重状态下骨密度及骨小梁结构改变带来的力学强度降低。骨代谢标记物与生物力学相关性研究已成为当前研究热点之一[24]。在太空条件下,由于缺乏地面的大型骨密度测量仪器,笔者认为通过目前实验研究测定骨生化标记物、骨密度与骨折风险建立理论相关性联系,后期的深入研究可根据骨生化代谢指标预测骨折风险。本实验中雌、雄性SD大鼠椎体最大力学强度Fmax与骨密度成显著正相关,与BLAP、TRAP成负相关。精准、简便的骨代谢指标与骨折风险相联系,将可能是未来航天医学的研究热点。此外,随着研究的深入,骨代谢标记物用于航天员骨质疏松筛查或流行病学的研究也将成为可能。
本研究论证了模拟失重状态骨密度、BLAP、TRAP的变化与生物力学的相关性,未来精准、便捷地检测骨代谢指标可能成为航天医学预测骨折风险的手段之一。
【参考文献】
[1]White R J, Averner M. Humans in space[J]. Nature, 2001,409(6823):1115-1118.
[2]Roberge E. The gravity of it all: from osteoporosis to immunosuppression, exploring disease in a microgravity environment holds promise for better treatments on Earth[J]. IEEE Pulse, 2014,5(4):35-41.
[3]Sibonga J D. Space flight-induced bone loss: is there an osteoporosis risk?[J]. Curr Osteoporos Rep, 2013,11(2):92-98.
[4]Morey-Holton E, Globus R K, Kaplansky A,etal. The hindlimb unloading rat model: literature overview, technique update and comparison with space flight data[J]. Adv Space Biol Med, 2005,10:7-40.
[5]Zhong N, Garman R A, Squire M E,etal. Gene expression patterns in bone after 4 days of hind-limb unloading in two inbred strains of mice[J]. Aviat Space Environ Med, 2005,76(6):530-535.
[6]Ziambaras K, Civitelli R, Papavasiliou S S. Weightlessness and skeleton homeostasis[J]. Hormones (Athens), 2005,4(1):18-27.
[7]Shahnazari M, Kurimoto P, Boudignon B M,etal. Simulated spaceflight produces a rapid and sustained loss of osteoprogenitors and an acute but transitory rise of osteoclast precursors in two genetic strains of mice[J]. Am J Physiol Endocrinol Metab, 2012,303(11):E1354-362.
[8]任宁涛,张恒,李洁,等.模拟失重对雌性大鼠背根神经节的影响[J]. 武警医学, 2015,26(7):653-655.
[9]Nakamura H, Aoki K, Masuda W,etal. Disruption of NF-kappa B1 prevents bone loss caused by mechanical unloading[J]. J Bone Miner Res, 2013,28(6):1457-1467.
[10]张恒,任宁涛,李洁,等.模拟失重状态下雌性大鼠骨质疏松模型骨结构及性能变化研究[J].中国骨与关节杂志, 2015,4(1):61-66.
[11]成魁,葛宝丰,甄平,等.口服淫羊藿苷可提高大鼠的峰值骨密度和骨质量[J].中国骨质疏松杂志, 2014,20(2):120-124.
[12]Zhu B, Guo H, Hao X J,etal. Mechanism of weightlessness osteoporosis and preventive and therapeutic effect of traditional Chinese medicine[J]. Zhongguo Gu Shang, 2012,25(7):611-616.
[13]徐沁,张丽君,王永春,等.失重或模拟失重对骨形成影响的研究进展[J]. 解放军医学院学报, 2015,36(3):291-293.
[14]陈杰,马进,丁兆平,等.一种模拟长期失重影响的大鼠尾部悬吊模型[J]. 空间科学学报, 1993,4(2):159-162.
[15]陶飞飞,吴继功.机械振动防治失重性骨质疏松的研究进展[J]. 中国骨质疏松杂志, 2014,20(6):683-686.
[16]Administration NAAS.A little shake upforhealthy bones. Office of biological and physical research[EB/OL].http://spaceresearch.nasa.gov,2003.
[17]Pecaut M J, Nelson G A, Peters L L,etal. Genetic models in applied physiology: selected contribution: effects of spaceflight on immunity in the C57BL/6 mouse. I. Immune population distributions[J]. J Appl Physiol, 2003,94(5):2085-2094.
[18]徐丛,徐世田,汪宏斌,等.DEXA测量松质骨BMD与其生物力学相关性[J].中国骨质疏松杂志, 2014,3(3):152-157.
[19]Ebbesen E N, Thomsen J S, Beck-Nielsen H,etal. Lumbar vertebral body compressive strength evaluated by dual-energy X-ray absorptiometry, quantitative computed tomography, and ashing[J]. Bone, 1999,25(6):713-724.
[20]Bucaro M A, Zahm A M, Risbud M V,etal. The effect of simulated microgravity on osteoblasts is independent of the induction of apoptosis[J]. J Cell Biochem, 2007,102(2):483-495.
[21]Aguirre J I, Plotkin L I, Stewart S A,etal. Osteocyte apoptosis is induced by weightlessness in mice and precedes osteoclast recruitment and bone loss[J]. J Bone Miner Res, 2006,21(4):605-615.
[22]Nakamura H, Kumei Y, Morita S,etal. Antagonism between apoptotic (Bax/Bcl-2) and anti-apoptotic (IAP) signals in human osteoblastic cells under vector-averaged gravity condition[J]. Ann N Y Acad Sci, 2003,1010:143-147.
[23]Kapitonova M Y, Salim N, Othman S,etal. Alteration of cell cytoskeleton and functions of cell recovery of normal human osteoblast cells caused by factors associated with real space flight[J]. Malays J Pathol, 2013,35(2):153-163.
[24]Bonnick SL, Shulman L. Monitoring osteoporosis therapy: bone mineral density, bone turnover markers, or both?[J]. Am J Med, 2006,119(4 Suppl 1):S25-31.
(2015-11-03收稿2016-03-15修回)
(责任编辑岳建华)
基金项目:1.全军武器预研基金(9140A7040109JB1003);2.航天医学基础与应用国家重点实验室开放基金(SMFA15K03)
作者简介:张恒,硕士研究生,医师。 通讯作者:崔赓,E-mail:cuigeng@aliyun.com
【中国图书分类号】R852.22
The relationship between BMD, biochemical marker parameters and fracture risk for simulated weightlessness in male and female rats
ZHANG Heng1, REN Ningtao1, LIU Ning2, LI Jie3, WANG Zheng1, MAO Keya1, and CUI Geng1.
1.Department of Orthopaedic, 3. Department of Obstetrics and Gynecology, General Hospital of PLA, Beijing 100853, China;2. Department of Orthopaedics, Xijing Hospital, Fourth Military Medical University, Xi’an 710032, China
【Abstract】ObjectiveTo analyze the changes of BMD, biochemical marker parameters, mechanical properties in male and female rat osteoporosis models in simulated weightlessness comparatively to establish relationship and predict fracture risk.Methods40 3-months-old SD rats were selected, 20 males and 20 females. According to the gender, they were divided into 4 groups at random: experimental group and reference group. The t Tail suspended models (TS) were measured. After 4 weeks, the rats were killed, the BMD of L4 and femoral condyle by dual-energy X-ray absorptiometry (DEXA) were measured, the osteal tissue slices were stained by the way of poncean, the marks of bone biochemical metabolism in serum were detected by ELISA and the biomechanics was tested by biomechanical testing machine.ResultsThe BMD of L4 lumbar vertebrae and femoral condyle in the experimental groups are obviously lower than the reference groups. The bone metabolic biochemical markers (BLAP & TRAP) in TS groups were remarkably higher than in the reference groups. The correlation coefficient R values between Fmax and BMD, BLAP, TRAP in male groups were 0.985, -0.949, -0.970, and in female group were 0.908, -0.858, -0.921.ConclusionsFor 4 weeks simulated weightlessness, obvious osteoporosis, destruction of the microstructure, decrease of the mechanical strength are manifested. Fmax is positively correlated with BMD, and negative correlation for BLAP, TRAP. It is a precise and convenient bone metabolism index to predict fracture risk in space medicine and is a feasible, precise and convenient bone metabolism index to predict fracture risk in space medicine.
【Key words】simulated weightlessness;osteoporosis; biochemical marker;biomechanics;correlation

