五味子甲素在小鼠体内组织的分布特点及其靶向疗效研究
赵振宇,姜晓慧,王春梅,李 贺,孙晶波,陈建光,张成义
(北华大学 药学院,吉林 吉林 132013)
五味子甲素在小鼠体内组织的分布特点及其靶向疗效研究
赵振宇,姜晓慧,王春梅,李贺,孙晶波,陈建光,张成义
(北华大学 药学院,吉林 吉林 132013)
[摘要]【目的】 建立小鼠组织中五味子甲素的质量浓度测定方法,并研究五味子甲素在小鼠体内的组织分布及其靶向治疗效果。【方法】 将五味子甲素按25 mg/kg一次灌胃ICR雄性小鼠,于给药后0.5,1,2,3和4 h分别取小鼠心、肝、肾、脑,用生理盐水洗净后制成0.25 g/mL组织匀浆,以睾丸酮为内标物,采用高效液相色谱法(HPLC)测定五味子甲素在小鼠心、肝、肾、脑中的质量浓度,并对HPLC方法的专属性、回收率、精密度和稳定性进行考察。依据五味子甲素在各组织中的峰值及各时间段的质量浓度,确定其分布最高的组织,对质量浓度分布最高的组织进行相关的药理学评价。【结果】 小鼠心、肝、肾、脑组织中五味子甲素质量浓度为0.625~20 μg/mL时,其质量浓度与五味子甲素/内标峰面积线性关系良好(r≥0.999 0)。HPLC法的专属性良好;日内精密度为(3.15±0.82)%~(4.77±0.57)%,日间精密度为(5.51±1.82)%~(8.46±2.93)%;稳定性试验的RSD<10%;绝对回收率为(89.04±3.82)%~(91.37±3.77)%,相对回收率为(95.65±5.76)%~(106.07±8.29)%。五味子甲素1次灌胃给药(剂量25 mg/kg)后在小鼠体内心、肝、肾、脑组织中均有分布,给药1 h后五味子甲素在小鼠心脏、脑组织中质量浓度达到峰值,给药2 h后在小鼠肝脏和肾脏中质量浓度达到峰值。整个分布情况显示,给药后1,2,3 h五味子甲素在小鼠肝脏组织中的质量浓度均高于其他组织,且达峰值时其质量浓度也显著高于心脏、肾脏、脑(P<0.05);其次是肾脏,五味子甲素质量浓度较低的为心脏和脑。五味子甲素对CCl4所致的小鼠急性肝损伤确有一定的保护作用。【结论】 该测定方法简便、快速、稳定,可用于小鼠内脏组织中五味子甲素质量浓度的测定;小鼠灌胃给药后五味子甲素在小鼠体内心、肝、肾、脑组织中均有分布,且达峰值时以肝脏中质量浓度最高,其次是肾脏,心脏与脑中较低;五味子甲素对CCl4所致的小鼠急性肝损伤有一定保护作用。
[关键词]五味子甲素;小鼠组织;靶向疗效
现代药理学研究证实,五味子对肝脏、中枢神经系统均具有较好的调节作用[1-4],其降脂保肝作用对现代人多发的高血脂、脂肪肝等具有较好的防治效果。木脂素是五味子重要的活性成分,其中五味子甲素的药效学活性较为明显[5-6]。五味子甲素被吸收进入体内后,经由循环系统运送到各组织脏器,其组织分布特点同自身理化性质、组织亲和力等因素密切相关[7]。因此,了解五味子甲素的组织分布特点对相关新药和保健品的开发具有重要意义。目前,国内外关于五味子甲素的组织分布研究仍较为少见。本研究参考之前确证的五味子木脂素主要生物活性[8],采用高效液相色谱法(HPLC)测定了五味子甲素在小鼠体内主要脏器(心、肝、肾、脑)组织的分布情况,并对五味子甲素质量浓度较高的靶器官进行相关生物活性研究,以期为五味子甲素的肝靶向制剂研究奠定基础。
1材料与方法
1.1材料及仪器
健康清洁级ICR雄性小鼠,体质量16~20 g/只,购于长春市亿斯试验动物技术有限责任公司,合格证号为SCXK(吉):2011-0004;五味子甲素标准品,HPLC纯度≥98%,购于四川维克奇生物科技有限公司;D-半乳糖、甲醇(色谱纯)、聚乙二醇400、睾丸酮标准品均购于北京鼎国昌盛生物技术有限责任公司;联苯双酯片,批号:1420073069,购于江苏鹏鹞药业有限公司。
日本岛津 LC-20A 高效液相色谱仪(包括自动进样器、LC solu-tion色谱工作站等);瑞士METTLER-TOLEDO AL204电子天平;艾本德Eppendorf 5418R高速离心机;S10手提式高速分散器(宁波新芝生物科技有限公司)。
1.2五味子甲素的组织分布研究
1.2.1色谱条件Agilent TC-C18柱(250 mm×4.6 mm,5 μm);预柱:C18保护柱(4.0 mm×3.0 mm,5 μm);流动相:甲醇-水(V(甲醇)∶V(水)=70∶30);流速:1.0 mL/min;检测波长:254 nm;进样量20 μL;柱温:40 ℃。
1.2.2五味子甲素标准溶液和睾丸酮内标溶液的配制精密称取五味子甲素标准品10 mg,置于20 mL的容量瓶中,甲醇溶解并定容,制得0.5 mg/mL的五味子甲素储备液。精密吸取上述储备液适量,用甲醇-水稀释成质量浓度为0.5,1.0,5.0,10.0,15.0和20.0 μg/mL的系列标准溶液,置于4 ℃冰箱中保存备用。
取睾丸酮0.5 g,置于50 mL容量瓶中,用甲醇-水配制成质量浓度为10 mg/mL的内标溶液。
1.2.3给药方案及样品的采集取ICR雄性小鼠15只,随机分为5组,每组3只,给药前禁食12 h,自由饮水。五味子甲素用体积分数20%聚乙二醇400水溶液分散,按照25 mg/kg剂量灌胃给药,分别于给药后0.5,1,2,3和4 h各处死一组小鼠,分离心、肝、肾、脑,用生理盐水洗净,滤纸吸干后称质量,加入适量体积的生理盐水制成0.25 g/mL的组织匀浆。
1.2.4组织样品的处理取1 mL组织匀浆液置于2 mL离心管中,5 000 r/min离心10 min,取上清200 μL,置于2 mL离心管中,加入甲醇-水60 μL,涡旋30 s,加10 mg/mL睾丸酮40 μL,涡旋30 s,加入乙腈400 μL,涡旋2 min,14 000 r/min离心10 min,吸取上清液,待测。同法制备未给五味子甲素的小鼠空白组织匀浆液,备用。
1.2.5方法学考察(1)方法的专属性:取五味子甲素和内标混合标准溶液、空白肝组织匀浆液、空白肝组织匀浆液加一定质量浓度混合标准溶液及给药2 h后的肝组织匀浆液,分别按1.2.1节色谱条件进行HPLC分析。
(2)标准曲线的制备:取各空白组织匀浆200 μL,加入五味子甲素系列标准溶液各100 μL,配制成五味子甲素质量浓度为0.625,1.25,2.5,5.0,10.0和20.0 μg/mL的样品,按1.2.4节方法处理后进行HPLC分析。对五味子甲素/内标峰面积(y)与五味子甲素质量浓度(x)进行线性回归,得到相应的回归方程。
(3)回收率的测定:①绝对回收率。按1.2.2节五味子甲素标准溶液配制方法,配制五味子甲素在肝组织样品中质量浓度为60,300和600 μg/mL的质量控制样品,进行HPLC分析,记录峰面积,与相同质量浓度的五味子甲素标准品溶液直接进样测定的峰面积相比即得绝对回收率。②相对回收率。将上述HPLC分析所得峰面积代入标准曲线,计算五味子甲素质量浓度,即测定质量浓度,其与实际质量浓度的比值即为相对回收率。
(4)精密度的测定:在相同条件下日内测定上述样品的相对回收率5次,计算日内精密度;连续测定7 d,计算日间精密度。
(5)稳定性的测定:取上述五味子甲素60,300和600 μg/mL的质量控制样品,在室温条件下放置24 h后进行HPLC分析,每种样品重复5次,计算测定结果的RSD值。
1.3五味子甲素对小鼠CCl4所致急性肝损伤的影响
1.3.1动物分组与处理取ICR雄性小鼠20只适应性喂养1周后,随机分为4组,分别为对照组、模型组、阳性药物(联苯双酯)组和五味子甲素组。阳性药物组小鼠灌胃给予联苯双酯片150 mg/kg;五味子甲素组小鼠灌胃给予五味子甲素分散溶液(质量浓度0.6 mg/mL),剂量为300 mg/kg;对照组和模型组均灌胃给予同等剂量的蒸馏水。各组小鼠每日灌胃1次,连续15 d,期间常规饲料喂养,自由饮水。末次给药1 h后,模型组、阳性药物组和五味子甲素组小鼠均腹腔注射体积分数10% CCl4橄榄油注射液2.0 mL/kg,对照组同法给予等剂量橄榄油,6 h后取样,期间各组小鼠均禁食、不禁水。
1.3.2肝脏病理检测小鼠造模6 h后断髓处死,取出肝脏,在生理盐水中将血液洗净,置入体积分数10%甲醛溶液中固定后,0.01 mol/L PBS浸泡过夜,常规梯度酒精脱水,石蜡包埋,制成4 μm石蜡切片,HE染色,最后滴加中性树胶封片,置于显微镜下观察、拍照。
1.4统计学分析
2结果与分析
2.1五味子甲素的组织分布
2.1.1系统的专属性分析由图1可知,五味子甲素、内标物睾丸酮峰形良好,无杂质峰干扰,保留时间分别为16.4 min (五味子甲素)和11.0 min(内标物睾丸酮)左右,与相邻色谱峰的分离度均大于 1.5。
2.1.2标准曲线绘制五味子甲素在小鼠心、肝、肾、脑中分布的标准曲线见表1。由表1可知,五味子甲素质量浓度在0.625~20 μg/mL时与五味子甲素/内标峰面积线性关系良好。
2.1.3回收率试验方法对60,300和600 μg/mL五味子甲素溶液的绝对回收率分别为(90.14±4.79)%,(91.37±3.77)%和(89.04±3.82)%;相对回收率分别为(106.07±8.29)%,(95.65±5.76)%和(100.35±4.62)%。结果表明,本试验所用的五味子甲素质量浓度测定方法具有良好的回收率。
2.1.4精密度及稳定性试验方法对60,300和600 μg/mL五味子甲素溶液的日内精密度分别为(4.65±0.73)%,(4.77±0.57)%和(3.15±0.82)%,日间精密度分别为((8.46±2.93)%,5.59±1.69)%和(5.51±1.82)%,结果表明,该方法精密度良好。3个质量浓度的五味子甲素样品稳定性测试RSD值均小于10%,表明五味子甲素在室温条件下放置24 h表现稳定。

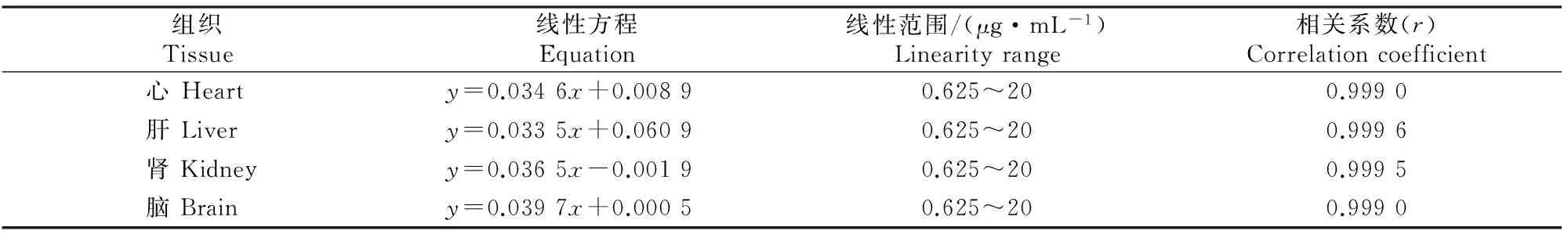
图 1 内标睾丸酮和五味子甲素生物样品的HPLC分析 A.内标睾丸酮和五味子甲素混合标准溶液; B.小鼠空白肝组织;C.小鼠空白肝组织加内标睾丸酮和 五味子甲素混合标准液;D.五味子甲素给药2 h后小鼠肝组织样品;a.内标睾丸酮,b.五味子甲素 Fig.1 HPLC chromatogram of internal standard and Schisandrin A A.Standard solution of internal standard and Schisandrin A;B.Blank liver tissue of mice; C.Blank liver tissue of mice,internal standard,and Schisandrin A;D.Mice liver tissue samples 2 h after administration; a.Testosterone is internal standard,b.Schisandrin A表 1 五味子甲素在小鼠组织中分布的标准曲线Table 1 Distribution of Schisandrin A in mice tissues
注:y为甲素与内标峰面积比,x为甲素质量浓度(μg/mL)。
Note:yis the peak area ratio of Schisandrin A to dihydrotestosterone,xis the concentration of Schisandrin A.
2.1.5五味子甲素的组织分布在给药后5个时间点分别处死一组小鼠,测定组织样品五味子甲素/内标峰面积,代入相应的标准曲线方程,计算得到样品中五味子甲素的质量浓度,结果如表2所示。

表 2 给药后不同时间五味子甲素在小鼠各组织中的分布Table 2 Distribution of Schisandrin A in mice tissues at different times after administration
由表2可知,给药1 h五味子甲素在小鼠心脏、脑组织中质量浓度达到峰值,给药2 h五味子甲素在肝脏和肾脏中质量浓度达到峰值。五味子甲素在肝脏中质量浓度峰值显著高于心脏、肾脏、脑(P<0.05);心脏、肾脏、脑中五味子甲素质量浓度峰值差异均无统计学意义(P>0.05)。
2.2小鼠CCl4急性肝损伤病理形态学观察
将制作好的小鼠CCl4急性肝损伤病理切片置于显微镜下观察,结果(图2)显示,正常对照组小鼠肝小叶结构清晰,肝索呈放射状且排列规则,汇管区和肝中央静脉清晰可见,肝细胞形态呈球状,核位于中央,细胞浆分染(图2-A);模型组小鼠肝小叶结构不佳,肝中央静脉和肝窦扩张,肝细胞呈不同程度的胞浆淡染,排列紊乱,多数体积增大,有明显的小灶性坏死,伴炎性细胞浸润,坏死区周围的肝细胞存在不同程度的嗜酸性变性(图2-B);联苯双酯阳性药物组小鼠肝细胞结构基本正常(图2-C);五味子甲素给药组小鼠肝细胞形态明显好转,肝细胞嗜酸性变性明显改善,中央静脉周围肝细胞形态基本恢复正常(图2-D)。

图 2 五味子甲素对CCl4所致小鼠肝损伤的保护效果 (HE,×100) A.正常对照组;B.模型组;C.联苯双酯阳性药物组;D.五味子甲素组Fig.2 Protective effect of Schisandrin A on CCl4 induced liver injury in mice (HE,×100) A.Control group;B.Model group;C.Positive drug group (bifendate);D.Schisandrin A group
3讨论
药物吸收进入机体后会随循环系统运送至各组织中,由于药物的理化性质以及体内各组织的生理特征存在差异,造成药物体内分布存在差异性,进而会直接影响到药物的治疗效果、蓄积、毒副反应[9-10],因此研究其组织分布特点,有利于相关制剂的开发和改进,使药物最大限度地作用于靶器官。对天然药物相关组分的组织分布进行研究,不仅具有上述作用,还能够为天然药物归属理论提供现代理论支持。五味子具有收敛固涩、益气生津、补肾宁心的功效,对肝脏、中枢神经系统、心血管系统、呼吸系统、免疫功能等均具有较好的药效学活性[11]。对其主要活性成分木脂素中的甲素在哺乳动物组织的分布特征进行研究,有助于进一步阐明五味子归经的实质,同时还可为相关药品和保健品的开发提供理论参考。
组织中药物的含量通常会由于质量浓度过低而较难测出,本研究在预试验基础上,以HPLC法为主要手段,通过对各项检测条件的优化来满足脏器中分布药物含量的测定。在流动相的选择方面,对乙腈-水、甲醇-水等多种流动相体系进行了对比,结果显示在甲醇-水流动相体系下,检测成分均有较好的响应,待测组织中的内源性物质对被测组分无明显干扰,各峰之间分离度较好;进一步考察甲醇和水的配比,发现当甲醇比例增大时,可使色谱峰的出峰时间提前,但组织中的内源性杂质干扰增加,当甲醇和水体积比为70∶30时,内源性杂质减少,出峰时间较为适中,峰型较好,因此本研究选择该流动相配比。在内标法的选择方面,本试验曾经参考周渊等[12]的方法,选用外标法进行检测,但由于组织中的内源性物质对五味子甲素的干扰较多,无法准确评价其药物质量浓度,因此本研究选取睾丸酮为内标物质,并考察发现其受待测组织内源性物质的影响较小,稳定性较高。
本试验在预试验基础上对五味子甲素灌胃给药后4 h内的5个时间点的组织分布情况进行了研究,代表了组织分组的吸收相(0.5~1 h,各组织中五味子甲素含量逐渐增加)、平衡相(1~2 h,除肝、肾组织中的质量浓度达峰值外,其他所测组织中五味子甲素质量浓度基本处于平衡状态)、消除相(2 h后五味子甲素质量浓度呈现逐渐下降的趋势)。给药后甲素在小鼠心、肝、肾、脑组织中均有分布,且呈动态。达峰值时间上,脑组织和心组织均在给药1 h达到最高质量浓度,肝组织和肾组织均在给药2 h达到峰值。随着给药时间的延长,以上组织中药物含量也出现相应变化,其中口服五味子甲素在肝脏中的质量浓度最高,提示其主要通过肝脏代谢,此结果也与中医理论中五味子归肝经[13]相符;其次为肾脏中五味子甲素达峰时质量浓度高于心脏和脑,提示肾脏可能为五味子甲素的主要排泄器官,同时也可能由于肝脏和肾脏的血流量大,循环好,促使五味子甲素的转运量相对较大;分布较少的为心脏和脑,可能由于五味子甲素与心脏和脑组织的亲和力较小有关。
上述结果已证实肝脏为五味子甲素的靶向作用器官,而目前防治各种有害因素引发的肝损伤仍是一个全球性的难题[14-17]。因此,本研究设计了CCl4致急性肝损伤这一经典的试验性肝损伤动物模型来探讨五味子甲素保肝的活性。CCl4所致肝损伤主要表现为血清中转氨酶活性增加,肝细胞脂质过氧化或坏死,在形态学和病理生理学的某些表现与人的肝病较为相似[18-21]。本试验病理检查结果显示,五味子甲素给药组小鼠肝细胞形态明显好转,与CCl4肝损伤模型组比较,中央静脉周围肝细胞形态基本恢复正常,说明五味子甲素对肝损伤具有保护作用,且其对肝脏保护作用与其在肝脏组织中的分布特点具有密切相关性。
[参考文献]
[1]Yang J M,Ip S P,Yeung H J,et al.HPLC-MS analysis ofSch-isandralignans and their metabolites in Caco-2 cell monolayer and rat everted gut sac models and in rat plasma [J].Acta Pharm Sin B,2011,1(1):46.
[2]Tilg H, Day C.Management strategies in alcoholic liver disease [J].Nature Clinical Practice Gastroenterology & Hepatology,2007,4(1):24-34.
[3]Wang B,Hu J,Tan W,et al.Simultaneous quantification of four activeSchisandralignans from a traditional Chinese medicineSchisandrachinensis(Wuweizi) in rat plasma using liquid chromatography mass spectrometry [J].J Chromatogr B,2008,865(1):14.
[4]赵红霞,鞠大宏,刘梅洁,等.五味子有效成分药理学研究进展 [J].中国医药导刊,2014,14(10):1334-1336.
Zhao H X,Ju D H,Liu M J,et al.Progress in pharmacological research ofSchisandrachinensiseffective components [J].Chinese Med,2014,14(10):1334-1336.
[5]应国清,俞志明,单剑峰,等.五味子有效组分的研究进展 [J].河南中医,2005,25(6):84-87.
Ying G Q,Yu Z M,Shan J F,et al.Research progress on the effective components ofSchisandra[J].Henan Journal of Traditional Chinese Medicine,2005,25(6):84-87.
[6]Assimopoulou A N,Papageorgiou V P.Radical scavenging activity of alkanna tinctoria root extracts and their main constituents,hydroxynaphthoquinones [J].Physiother Res,2005,19(2):141-147.
[7]于洋,严子玲,赖巧,等.五味子配伍对吴茱萸主成分在大鼠肠道吸收中的影响研究 [J].中国药师,2014,17(3):349-352.
Yu Y,Yan Z L,Lai Q,et al.Study on the effect of intestinal absorption in rats ofSchisandraturczfructusevodiae principal component [J].China Pharmacist,2014,17(3):349-352.
[8]王春梅,李贺,李生,等.北五味子木脂素对小鼠酒精性肝损伤的保护作用 [J].食品科学,2014,35(13):262-265.
Wang C M,Li H,Li S,et al.Protective effect ofFructuschinensison alcohol induced liver injury in mice [J].Journal of Food Science,2014,35(13):262-265.
[9]Ko K M,Ip S P,Poon M K,et al.Effect of a lignan-enriched fructusSchisandraeextract on hepatic glutathione status in rats:protection against carbon tetrachloride toxicity [J].Planta Medica,1995,61(2):134-137.
[10]Sid B,Verrax J,Calderol P B.Role of oxidative stress in the pathogenesis of alcohol-induced liver disease [J].Free Radical Research,2013,47(11):894-904.
[11]Wu D,Cederbaum A I.Alcohol,oxidative stress,and free radical damage [J].Alcohol Research&Health,2003,27(4):277-284.
[12]周渊,毛春芹,胡俊扬,等.液-质联用研究五味子醇甲、五味子甲素和五味子乙素在大鼠体内的组织分布 [J].药物分析杂志,2013,33(7):1121-1126.
Zhou Y,Mao C Q,Hu J Y,et al.Tissue distribution of Schisandrin,deoxyschisandrin and Schisandrin B in rat determined by HPLC-MS [J].Chin J Pharm Anal,2013,33(7):1121-1126.
[13]王明媚,周亮,张鑫,等.药物性肝损伤的诊断和防治研究进展 [J].中国药业,2014,23(7):94-96.
Wang M M,Zhou L,Zhang X,et al.Research progress of diagnosis and treatment of drug-induced liver injury [J].Chinese Pharmaceutical,2014,23(7):94-96.
[14]Wang B L,Hu J P,Tan W,et al.Simultaneous quantification of four activeSchisandralignans from a traditional Chinese medicineSchisandrachinensis(Wuweizi) in rat plasma using liquid chromatography/mass spectrometry [J].Journal of Chromatography B:Analytical Technologies in the Biomedical and Life Sciences,2008,865(1/2):114-120.
[15]郑春英,李宏涛,吴桐,等.HPLC法同时测定五味子不同部位中三种木脂素成分含量 [J].食品科学,2007,28(7):376-379.
Zheng C Y,Li H T,Wu T,et al.Simultaneous determination of three kinds of different parts ofSchisandralignans content with HPLC method [J].Food Science,2007,28(7):376-379.
[16]陈宝芝,李生,吴金滢,等.五味子粗多糖对四氯化碳致小鼠急性肝损伤的保护作用及其机制 [J].吉林大学学报(医学版),2014,40(1):92-96.
Chen B Z,Li S,Wu J Y,et al.Protective effect ofSchisandraon acute liver injury induced by CCl4in mice and its mechanism [J].Journal of Jilin University (Medical Science Edition),2014,40(1):92-96.
[17]Cederbaum A I,Lu Y,Wu D.Role of oxidative stress in alcohol-induced liver injury [J].Archives Toxicology,2009,83(6):519-548.
[18]Miranda M A,Luqo B A,Armendariz B J.Molecular basis and current treatment for alcoholic liver disease [J].International Journal of Environmental Research and Public Health,2010,7(5):1872-1888.
[19]Hwang I S,Kin J E,Lee Y J,et al.Protective effects of gomisin A isolated fromSchisandrachinensisagainst CCl4-induced hepatic and renal injury [J].International Journal of Molecular Medicine,2013,31(4):8884-8898.
[20]Minin E A,Buchwalow I B,Wellner M,et al.L-Arginine-NO-cGMP signaling following acute liver injury in the rat [J].Experimental and Toxicologic Pathology,2005,57(2):161-171.
[21]Deya,Cederbaumai.Alcohol and oxidative liver injury [J].Hepatology,2006,43(2):63-74.
DOI:网络出版时间:2016-06-0816:2110.13207/j.cnki.jnwafu.2016.07.009
[收稿日期]2014-12-15
[基金项目]吉林省科技发展计划项目(20130206036YY);吉林省发改委科研平台资助项目(2013G020)
[作者简介]赵振宇(1989-),男,河南鹤壁人,在读硕士,主要从事天然药物体内分布代谢研究。 E-mail:longyuxiang0118@163.com [通信作者]张成义(1966-),男,吉林吉林人,教授,博士,硕士生导师,主要从事天然药物药理学研究。 E-mail:zhchyjL@163.com
[中图分类号]
[文献标志码]A
[文章编号]1671-9387(2016)07-0057-07
Distribution characteristics of Schisandrin A in mice tissues and its targeting therapeutic effect
ZHAO Zhenyu,JIANG Xiaohui,WANG Chunmei,LI He,SUN Jingbo,CHEN Jianguang,ZHANG Chengyi
(CollegeofPharmacy,BeihuaUniversity,Jilin,Jilin132013,China)
Abstract:【Objective】 This study established a method to detect the concentration of Schisandrin A in mice,investigated its distribution characteristics and examined its targeting therapeutic effect. 【Method】 Schisandrin A at concentration of 25 mg/kg was administered orally to ICR mice and the concentrations in heart,brain,kidney and liver were measured using HPLC with testosterone as internal standard 0.5,1,2,3,and 4 h after administration.The specificity,recovery,accuracy and stability of HPLC method were also studied.The tissue with highest Schisandrin A contribution was determined and the biological activities were evaluated.【Result】 The concentrations of Schisandrin A distribution in mice heart,liver,kidney,and brain tissues were 0.625 to 20 μg/mL,having a good linear relationship with the internal standard peak area ratio (r≥0.999 0).HPLC had a good specificity,with within-day precision of (3.15±0.82)%-(4.77±0.57)% and between-day precision of (5.51±1.82)%-(8.46±2.93)%.The RSD of stability test was <10%,the absolute recovery was (89.04±3.82)%-(91.37±3.77)%,and the relative recovery was (95.65±5.76)%-(106.07±8.29)%.Schisandrin A was distributed in heart,liver,kidney and brain,and the times needed to reach peak concentration were 1 hour in heart and brain,and 2 hours in liver,and 3 hours in kidney.The concentration of Schisandrin A in liver was significantly higher than in kidney,heart and brain (P<0.05).Schisandrin A had protective effect on CCl4 induced acute liver injury in mice.【Conclusion】 The established method was simple,rapid,stable,and can be used for determination of Schisandrin A in internal tissues of mice.After oral administration,peak and every time concentrations of Schisandrin A were highest in liver,and it can protect acute liver injury.
Key words:Schisandrin A;mice tissue;distribution;targeting therapeutic effect
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160608.1621.018.html

