新城疫病毒HN蛋白酵母双杂交诱饵载体的构建及鉴定
胡湘云,高小龙,付向晶,王燕平,刘丹丹,常旭东,刘 蓬,杜恩岐,王兴龙,党如意,杨增岐
(西北农林科技大学 动物医学院,陕西 杨凌712100)
新城疫病毒HN蛋白酵母双杂交诱饵载体的构建及鉴定
胡湘云,高小龙,付向晶,王燕平,刘丹丹,常旭东,刘蓬,杜恩岐,王兴龙,党如意,杨增岐
(西北农林科技大学 动物医学院,陕西 杨凌712100)
[摘要]【目的】 应用酵母双杂交技术构建新城疫病毒的血凝素-神经氨酸酶(HN)蛋白线性中和表位区的诱饵载体pGBKT7-HN-neu,为筛选靶向新城疫病毒HN蛋白的中和性纳米抗体奠定基础。【方法】 合成HN蛋白的线性中和表位区HN-neu,将其克隆至酵母双杂交系统诱饵载体pGBKT7中,构建诱饵载体pGBKT7-HN-neu,经酶切鉴定和测序验证正确后,将pGBKT7-HN-neu转化酵母菌Y2H Gold,检测其在酵母细胞中的毒性和自激活作用。【结果】 成功合成了HN-neu,构建的pGBKT7-HN-neu在酵母细胞Y2H Gold中无毒性和自激活能力。【结论】 成功构建了诱饵载体pGBKT7-HN-neu。
[关键词]新城疫病毒;HN蛋白;酵母双杂交系统;诱饵载体
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的一种禽类急性、高度接触性、致死性传染病,在世界范围内广泛流行,是危害养禽业的主要传染病之一[1]。NDV 属于副粘病毒科禽腮腺炎病毒属,为单股负链 RNA 病毒[2]。NDV基因组包含 6个开放阅读框架(ORF),编码6种结构蛋白,分别为核衣壳蛋白(NP)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、血凝素-神经氨酸酶(HN)和大蛋白(L),其编码基因排列顺序是 3′-NP-P-M-F-HN-L-5′,其中HN是位于NDV病毒粒子表面囊膜上的一种纤突蛋白,是病毒进入宿主细胞的必需成分之一[3]。HN具有血凝素和神经氨酸酶2种活性,能诱导机体产生中和性抗体,在机体抗感染免疫中起着重要作用,尤其是其中和表位是免疫保护作用的核心靶点,是研究和控制新城疫的最佳切入点[4]。相关研究显示,新城疫病毒HN结构蛋白的一个潜在线性中和表位区为346-353aa(DEQDYQIR)[5-8],其氨基酸序列在一级结构上是连续的,可以在体外模拟。
近年来,随着基因工程技术的迅速发展,一种新型抗体——重链抗体重链可变区(Variable domain of heavy chain of heavy chain antibody,VHH)的出现逐渐引起科研工作者的关注[9],其抗原结合位点仅由重链的可变区VHH单结构域形成,且高度仅为4.8 nm左右,直径仅为2.2 nm左右,故又被称为纳米抗体(Nanobodies,Nbs)。由于纳米抗体的单域性质使其较普通抗体具有一些独特的性质,如易于表达、高水溶性和稳定性、能识别独特的构造表位、具有较高的亲和力、免疫原性低等,因此成为抗体研究的热点[10]。目前主要利用噬菌体表面展示技术、酵母双杂交技术和核糖体展示技术进行纳米抗体的研究。酵母双杂交技术作为验证蛋白互作的主流技术,也可用来鉴定抗原抗体的反应。本实验室应用酵母双杂交技术已成功构建双峰驼免疫酵母双杂交纳米抗体文库,并筛选出靶向圆环病毒的纳米抗体[11]。
本研究以新城疫病毒HN蛋白的线性中和表位区为研究对象,将其与酵母转录因子GAL4的DNA结合功能域(DNA binding domain,DNA-BD)重组在一起构建酵母双杂交诱饵载体pGBKT7-HN-neu,并对构建的诱饵载体进行毒性和自激活活性检测,以期从新城疫酵母双杂交纳米抗体文库中筛选靶向HN蛋白的纳米抗体。
1材料与方法
1.1材料
1.1.1试剂SD/-Trp、DDO(-Trp-Leu)、QDO(-Trp-Leu-His-Ade)选择性培养基、YPDA培养基、50% PEG 3350、10×TE、10×LiAC、9 g/L NaCl溶液、Yeastmaker Carrier DNA、3 mol/L醋酸钠溶液、X-α-Gal及Aureobasidin A等试剂均购自Clontech;二甲基亚砜(DMSO)购自Sigma;琼脂糖购自Invitrogen;EcoRⅠ、SalⅠ核酸限制性内切酶购自Fermentas;2K plus DNA Marker购自北京全式金生物技术有限公司;质粒提取试剂盒购自OMEGA;凝胶回收试剂盒购自TIANGEN。其他试剂为国产分析纯。
1.1.2菌株、毒株、载体及文库Y2H Gold酵母菌及pGADT7-T、pGBKT7、pGBKT7-Lam、pGBKT7-53载体均购自Clontech公司。DH5α感受态细胞、双峰驼新城疫病毒酵母双杂交纳米抗体文库均由本实验室构建与保存。
1.2方法
1.2.1线性中和表位区的合成根据GenBank数据库中公布的NDV LaSota株 HN基因序列,并参考文献[5-8]报道的HN潜在线性中和表位(epitope)的氨基酸序列(DEQDYQIR),设计一段由linker(GGGS)串联的线性中和表位片段,命名为HN-neu,在该片段首端、末端分别引入EcoRⅠ、SalⅠ 酶切位点,片段序列为:5′-GAATTCGGTGGTGGTTCCGATGA ACAGGATTACCAAATCC-GTGGTGGTGGTTCCGATGAACAGGATTACC-AAATCCGTGGTGGTGGTTCCGATGAACAGG-ATTACCAAATCCGTTAAGTCGAC-3′,5′和3′端下划线部分分别为EcoRⅠ、SalⅠ酶切位点。片段由苏州金唯智生物科技有限公司合成。
1.2.2诱饵载体pGBKT7-HN-neu的构建将合成的带中和表位区的质粒HN-neu和pGBKT7载体分别用EcoRⅠ、SalⅠ进行双酶切,用胶回收试剂盒回收切出的目的条带,用 T4连接酶于16 ℃连接过夜。连接产物使用YC法转化大肠杆菌DH5α感受态细胞中,涂布于LB固体平板(含100 mg/mL卡那霉素)培养,直到有菌落出现,挑单菌落接种于LB液体培养基(含100 mg/mL卡那霉素)中,于37 ℃、220 r/min振荡培养12 h,按质粒提取试剂盒操作步骤说明提取质粒,进行EcoRⅠ、SalⅠ双酶切鉴定,将鉴定呈阳性的质粒送南京金斯瑞公司进行测序,测序正确的质粒即为诱饵载体,命名为pGBKT7-HN-neu。
1.2.3诱饵载体对Y2H Gold 酵母菌的转化用PEG/LiAC方法制备酵母感受态细胞,将冻存的Y2H Gold酵母菌划线接种至YPDA平板,于30 ℃倒置培养3 d,挑取直径为2~3 mm的单菌落于3 mL YPDA液体培养基中,30 ℃、220 r/min振荡培养8~12 d,取20 μL接种于50 mL YPDA培养基中进行扩大培养,30 ℃、220 r/min振荡培养16~20 h。当OD600为0.15~0.30时,700g离心5 min,弃上清,沉淀重悬于100 mL YPDA中,30 ℃孵化3~5 h直到OD600为0.40~0.50。 将上述100 mL培养液分装至2个50 mL无菌锥形瓶,室温700g离心5 min,弃上清,每管用30 mL灭菌蒸馏水重悬,室温700g离心5 min,弃上清,每管用1.5 mL 1.1×TE/LiAC重悬,转移细胞悬液到2个1.5 mL EP管中,12 000 r/min离心15 s,弃去上清,每管用600 μL 1×TE/LiAC重悬细胞,即得酵母感受态细胞。
将100 ng诱饵载体pGBKT7-HN-neu、5 μL Yeastmaker Carrier DNA(10 μg/μL,沸水加热10 min后置于冰上备用)、50 μL酵母感受态细胞和500 μL PEG/LiAC溶液混合在一起,同时设空载体pGBKT7对照。混合后涡旋振荡10 s,30 ℃培养箱中孵育45 min,每隔15 min混匀1次,加入160 μL DMSO混匀,42 ℃热激20 min,每隔10 min混匀1次,室温700g离心5 min,弃去上清,收集菌体。用100 μL 0.9%氯化钠溶液重悬菌体,涂布SD/-Trp营养选择性固体平板,30 ℃倒置培养3~5 d。
1.2.4诱饵载体的自激活作用检测吸取100 μL上述转化pGBKT7-HN-neu的Y2H Gold酵母菌液3份,分别均匀涂布SD/-Trp平板、SD/-Trp/X-α-Gal 平板和SD/-Trp/AbA/X-α-Gal平板,30 ℃培养3~5 d。观察酵母菌生长情况,直到有菌落长出,检测诱饵蛋白是否具有自激活作用。试验同时设空载体pGBKT7对照(培养基为SD/-Trp)、阳性载体pGBKT7-53+pGADT7-T对照(培养基为DDO/-Trp-Leu/AbA/X-α-Gal)和阴性载体pGBKT7-lam+pGADT7-T对照(培养基为DDO/-Trp-Leu/AbA/X-α-Gal)。
1.2.5诱饵载体的毒性检测从SD/-Trp平板上分别挑取已转化成功的pGBKT7-HN-neu和空载体pGBKT7的Y2H Gold单克隆接种于5 mL SD/-Trp(含50 μg/mL卡那霉素)液体培养基中,30 ℃下220 r/min振荡培养16~20 h,分别于0,4,8,12,16和20 h取样,用紫外光分光光度计测其在600 nm波长下的吸光度(OD600)值,检验诱饵蛋白是否有毒性。若OD600<0.8,说明重组诱饵载体pGBKT7-HN-neu对Y2H Gold酵母细胞可能有毒性,反之则没有毒性。
2结果与分析
2.1诱饵质粒pGBKT7-HN-neu的鉴定
重组诱饵质粒pGBKT7-HN-neu用EcoRⅠ 和SalⅠ限制性内切酶双酶切后进行琼脂糖凝胶电泳分析,得到123 bp的目的条带(图1),与预期结果一致。DNA序列分析结果与设计的序列完全一致,表明诱饵重组质粒构建正确,可用于后续试验。
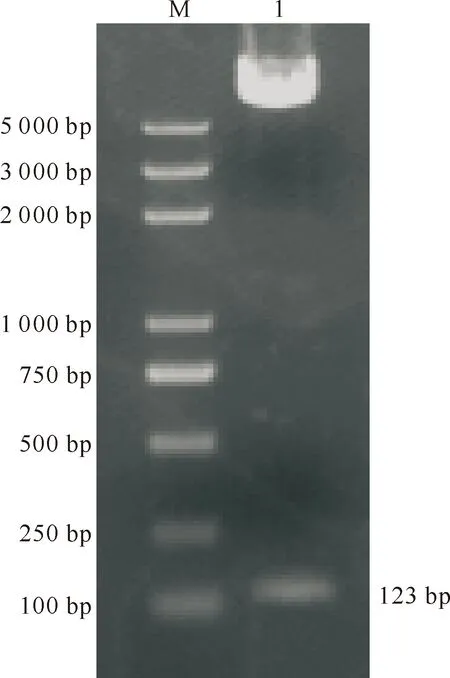
图 1 诱饵载体pGBKT7-HN-neu的酶切鉴定 M.2K plus DNA相对分子质量标准; 1. 诱饵载体pGBKT7-HN-neu 酶切产物Fig.1 Identification of pGBKT7-HN-neu by restriction enzyme digestion M.2K plus DNA Marker;1.Product from pGBKT7-HN-neu digested with EcoRⅠ and SalⅠ
2.2诱饵质粒转化Y2H Gold 酵母菌
将转有pGBKT7-HN-neu诱饵质粒的Y2H Gold菌涂布于SD/-Trp营养选择性固体平板,3~5 d后有白色菌落生长,说明诱饵质粒已成功转化到Y2H Gold酵母中。
2.3诱饵载体的自激活作用
诱饵载体的自激活作用检测结果见表1。由表1可知,转化pGBKT7-HN-neu的Y2H Gold在SD/-Trp平板和SD/-Trp/X-α-Gal 平板上长出白色菌落,在SD/-Trp/AbA/X-α-Gal平板上无菌落生长;空载体pGBKT7对照平板上长出白色菌落,阳性载体pGBKT7-53+pGADT7-T对照平板上长出蓝色菌落,而阴性载体pGBKT7-lam+pGADT7-T对照平板无菌落生长,对照组结果成立。上述结果表明,诱饵质粒pGBKT7-HN-neu在Y2H Gold酵母细胞中对报告基因Ade、His、Leu和LacZ无自激活活性,可用于后续酵母双杂交的筛选试验。
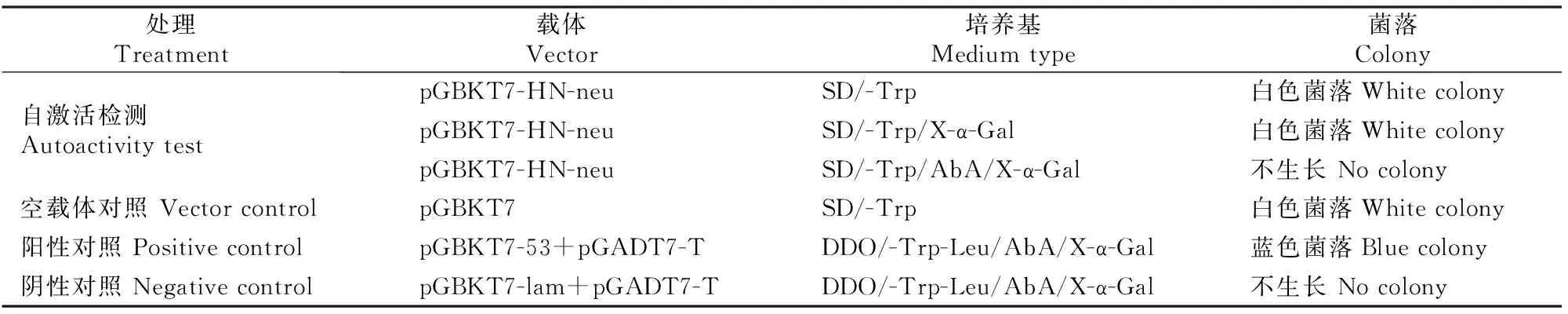
表 1 诱饵载体pGBKT7-HN-neu对报告基因的自激活检测Table 1 Autoactivity test of bait vector pGBKT7-HN-neu to the reporter genes
2.4诱饵载体的毒性检测
由图2可知,诱饵载体pGBKT7-HN-neu和空载体pGBKT7处理的OD600值相近,振荡培养16 h时,诱饵载体pGBKT7-HN-neu和空载体pGBKT7处理的OD600分别为1.303和1.357,均大于0.8。结果表明,诱饵载体pGBKT7-HN-neu表达的DNA-BD融合蛋白对酵母菌Y2H Gold的生长无毒性。
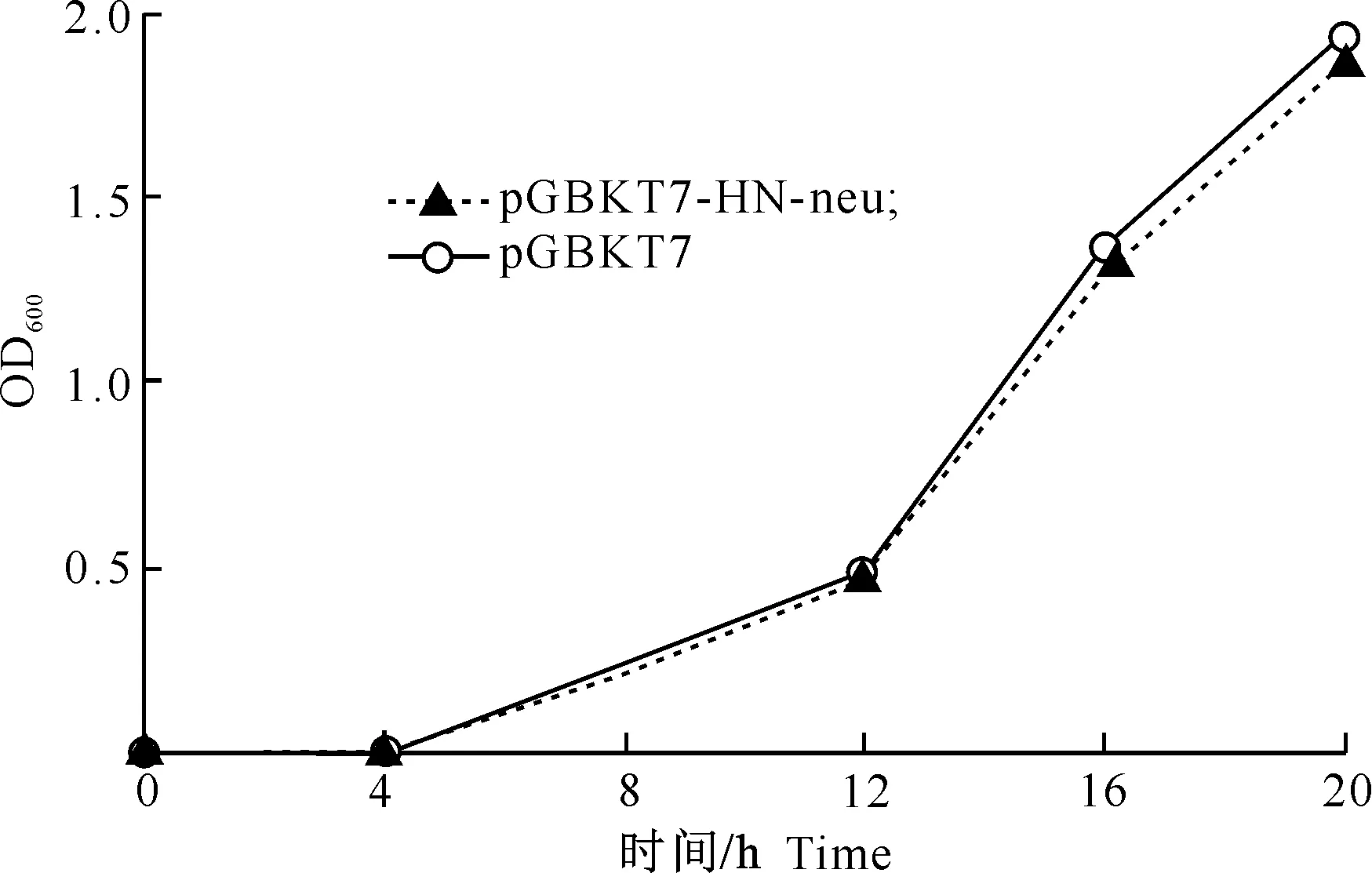
图 2 诱饵载体pGBKT7-HN-neu对酵母细胞 Y2H Gold的毒性检测Fig.2 Toxicity of pGBKT7-HN-neu to Y2H Gold yeast cell
3讨论
新城疫病毒的血凝素-神经氨酸酶(HN)蛋白在病毒侵染过程中能识别细胞受体并介导病毒吸附细胞膜,此外,它还参与影响病毒毒力[12]。HN蛋白是NDV的重要保护性抗原,试验证明其单克隆抗体能中和NDV的感染[13]。由于单克隆抗体制备过程对技术人员的细胞操作技术要求高,且在实际生产中大量高浓度抗体的制备难度大、成本高。近年来,随着基因工程技术发展,相继开展了NDV新型基因工程抗体的研究。王斌等[14]通过构建HN-scFV原核表达载体在大肠杆菌中表达获得具有生物活性的HN蛋白单链抗体。但目前尚未见到关于HN蛋白中和性基因工程抗体的报道。纳米抗体是基于骆驼体内天然存在的重链抗体获得的具有亲本抗体抗原结合活性的一种基因工程抗体;由于VHH分子量小、稳定、易制备、免疫原性小以及能识别独特的表位等优点,使其在抗病毒中的研究成为热点,如VHH已用于人类免疫缺陷病毒等多种病毒性疾病的诊断和治疗[15],因此,研制靶向NDV HN蛋白的中和性纳米抗体为今后控制和治疗新城疫提供了一个崭新的方向。
酵母双杂交技术是建立在真核表达基础上验证蛋白互作的一个有力工具,也可用于目标蛋白抗体的筛选。相对于噬菌体展示技术,利用酵母双杂交技术筛选特定抗原的VHH时,在筛选过程中,抗原不需要表达和纯化,可在核酸水平操作。本试验直接选取HN蛋白的潜在线性中和表位(DEQDYQ-IR)作为抗原,通过酶切连接构建用于酵母双杂交筛选的诱饵载体pGBKT7-HN-neu。通过将转化诱饵载体的酵母细胞在不同营养缺陷型平板上进行培养,观察其生长情况和颜色变化,在SD/-Trp和SD/-Trp/X-α-Gal平板上为白色菌落,在SD/-Trp/AbA/X-α-Gal平板上无菌落生长,直观地判断诱饵载体对报告基因无自激活作用,从而排除假阳性。同时转化诱饵载体的酵母细胞在SD/-Trp液体培养基中能大量增殖,OD600值大于0.8,说明表达的诱饵蛋白对酵母菌无毒性作用。上述试验结果表明,本研究成功构建了HN蛋白的诱饵载体pGBKT7-HN-neu,且所构建的诱饵载体在酵母系统中无自激活和毒性作用,为利用酵母双杂交系统筛选靶向NDV HN蛋白的中和性纳米抗体奠定了基础。
[参考文献]
[1]Alexander D J.Newcastle disease and other avian paramyxoviruses [J].Rev Sci Tech,2000,19:443-462.
[2]Mayo M A.A summary of taxonomic changes recently approv-ed by ICTV [J].Arch Virol,2002,147:1655-1663.
[3]Gravel K A,Morrison T G.Interacting domains of the HN and F proteins of newcastle disease virus [J].J Virol,2003,77(20):110402-110409.
[4]Corey E A,Mirza A M,Levandowsky E.Fusion deficiency induced by mutations at the dimer interface in the newcastle disease virus hemagglutinin-neuraminidase is due to a temperature-dependent defect in receptor binding [J].J Virol,2003,77(12):6913-6922.
[5]Chambers P.Location of a neutralizing epitope for the haemagglutinin-neuraminidase glycol protein of newcastle disease virus [J].J Gen Virol,1988,69:2115-2122.
[6]Iorio R M,Bratt M A.Monoclonal antibodies to newcastle disease virus:delineation of four epitopes on the HN glycoprotein [J].Journal of Virology,1983,48(2):440-450.
[7]Iorio R M,Syddall R J,Sheehan J P,et al.Neutralization map of the hemagglutinin-neuraminidase glycoprotein of NDV:domains recognized by monoclonal antibodies that prevent receptor recognition [J].J Virol,1991,65(9):4999-5006.
[8]Liu Y,Meng C,Liu X F.Identification of a variable epitope on the newcastle disease virus hemagglutinin-neuraminidase protein [J].Vet Microbiol,2010,140(1/2):92-97.
[9]Hamerscasterman T,Atarhouch S,Muyldermans G,et al.Naturally occurring antibodies devoid of light-chains [J].Nature,1993,363(6428):446-448.
[10]Harmsen M M,De Haard H J.Properties,production and applications of camelid single-domain antibody fragments [J].Appl Microbial Biotechnol,2007,77(1):13-22.
[11]Fu X J,Gao X L,He S F,et al.Design and selection of a camelid single-chain antibody yeast two-hybrid library produced de novo for the cap protein of porcine circoviru type 2 (PCV2) [J].PLoS One,2013,8(3):1-10.
[12]Tan L T,Xu H Y,Wang Y L,et al.Molecular characterization of three new virulent newcastle disease virus variants isolated in China [J].Journal of Clinical Microbiology,2008,46(2):750-753.
[13]Kamiya N,Niikura M,Kai C,et al.Protective effect of individual glycoprotein of newcastle disease virus expressed in insect cell:the fusion protein derived from an avirulent strain had lower protective efficacy [J].Virus Res,1994,32:373-379.
[14]王斌,刘培欣,李涛,等.抗新城疫病毒HN蛋白单链抗体的原核表达及功能鉴定 [J].中国预防兽医学报,2014,36(5):383-386.
Wang B,Liu P X,Li T,et al.Prokaryotic expression and functional analysis of the single-chain antibody against the HN protein of newcastle disease virus [J].Chinese Journal of Preventive Veterinary Medicine,2014,36(5):383-386.
[15]Forsman A,Beirnaert E,Aasa-Chapman M M,et al.Llama antibody fragments with cross-subtype human immunodeficiency virus type 1 (HIV-1)-neutralizing properties and high affinity for HIV-1 gp120 [J].J Virol,2008,82(24):12069-12081.
DOI:网络出版时间:2016-06-0816:2110.13207/j.cnki.jnwafu.2016.07.007
[收稿日期]2014-11-26
[基金项目]国家自然科学基金项目(31272578)
[作者简介]胡湘云(1990-),女,广西南宁人,在读硕士,主要从事动物传染病学及基因工程抗体研究。 E-mail:821995274@163.com [通信作者]杨增岐(1964-),男,陕西岐山人,教授,博士生导师,主要从事动物传染病学研究。E-mail:yzq8162@163.com
[中图分类号]S852.65
[文献标志码]A
[文章编号]1671-9387(2016)07-0045-05
Construction and identification of HN bait vector of newcastle disease virus in yeast two-hybrid system
HU Xiangyun,GAO Xiaolong, FU Xiangjing,WANG Yanping,LIU Dandan,CHANG Xudong,LIU Peng,DU Enqi,WANG Xinglong,DANG Ruyi,YANG Zengqi
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Abstract:【Objective】 The recombinant bait vector pGBKT7-HN-neu was constructed by yeast two-hybrid system to select variable domain of heavy chain antibody(VHH)against newcastle disease virus (NDV) HN protein.【Method】 The neutralizing epitope of NDV HN protein was synthetized and cloned into bait vector pGBKT7 of yeast two-hybrid system. After being verified by enzyme digestion and sequencing,pGBKT7-HN-neu was transformed into yeast cells Y2H Gold.Then,self-activation and toxic action of the bait vector pGBKT7-HN-neu were tested. 【Result】 HN-neu was successfully synthetized and the recombination bait vector pGBKT7-HN-neu was proven to be no self-activation and not toxic to the host yeast cell.【Conclusion】 The bait vector pGBKT7-HN-neu was successfully constructed.
Key words:newcastle disease virus (NDV);hemagglutinin-neuraminidase (HN);yeast two-hybrid system;bait vector
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160608.1621.014.html

