一株纤维素降解菌的鉴定及其对饲料粗纤维的降解效果
王尧悦,曹平华,陈玉林,杨明明,杨雨鑫
(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
一株纤维素降解菌的鉴定及其对饲料粗纤维的降解效果
王尧悦,曹平华,陈玉林,杨明明,杨雨鑫
(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
[摘要]【目的】 对本课题组分离的一株纤维素降解菌进行鉴定,优化其产酶条件并检测其对饲料粗纤维的降解效果,以期为该菌在饲料粗纤维降解中的应用提供理论依据。【方法】 通过菌株形态特征和16S rDNA 序列分析鉴定了实验室分离保存的一株纤维降解菌;研究该菌所产纤维素酶的部分酶学性质和酶谱,并优化其产纤维素酶的条件;利用体外发酵和尼龙袋法测定菌株N3所产粗酶液对3种饲料(麸皮、麦草、燕麦)粗纤维的降解率;利用RB亮蓝脱色试验检测该菌的木质素降解能力。【结果】 经鉴定,该菌株为枯草芽孢杆菌,命名为Bacillus subtilis N3;N3菌株不产生漆酶,主要向胞外分泌分子质量70 ku以上的纤维素酶组分;N3菌株所产纤维素酶的最适反应温度和pH分别为60 ℃和5.5;N3菌株以体积比1∶50接种至最适发酵培养基(碳源为麸皮、氮源为蛋白胨,初始pH为5),37 ℃培养24 h时,所产纤维素酶活性最高,可达3.50 U/mL;菌株N3所产粗酶液对麸皮的粗纤维降解率最高,对麦草秸秆的粗纤维降解率最低。【结论】 分离到的纤维降解菌Bacillus subtilis N3主要分泌分子质量70 ku 以上、耐热的纤维素酶,对饲料粗纤维具有较强的降解能力。
[关键词]枯草芽孢杆菌;纤维素酶;酶学性质;纤维素降解;酶谱分析
全世界每年生成的植物性有机物质中,约50%为纤维素物质[1]。纤维素作为一种丰富的、可再生资源,已经成为饲料工业、食品工业、造纸业、洗涤工业和纺织品工业的潜在原料。但这些纤维素物质只有一小部分得到了应用,绝大多数被浪费,甚至成为环境污染物[2-3]。因此,如何有效降解纤维素,已成为当前国际研究的重要课题之一。生物法降解纤维素因具有对设备要求低,分解后的产物易回收利用,对环境污染较小等特点而逐渐受到关注。目前生物降解法主要是利用纤维素酶降解纤维素,纤维素酶大部分产生于具有纤维素水解系统的微生物,主要包括真菌、细菌和放线菌。在不同种类的纤维素酶中,大多数胞外单一酶由好氧菌产生,而胞外的多酶复合物则由厌氧菌产生。连接的非催化结构蛋白(脚手架蛋白)能够在纤维素晶体结构的作用下激发纤维素酶的活力。
在饲料工业中添加纤维素酶有助于提高饲料转化率,增加动物对谷物类饲料的消化率,消除抗营养因子,促进动物的生长,拓宽饲料来源。但由于酶活力易受温度、酸碱度、产酶量等因素的影响[4-5],因此,筛选产酶活力高、稳定性好的纤维素降解菌是提高纤维素有效利用率的前提。
本研究对实验室前期保存的一株纤维素降解菌进行种属鉴定、酶学特性分析、产酶条件优化和酶谱分析,并研究其所产粗酶液对3种饲料(麸皮、麦草秸秆、燕麦秸秆)粗纤维的降解效果,以期为该菌在饲料粗纤维降解中的应用提供理论依据。
1材料与方法
1.1材料
1.1.1菌株试验所用菌株N3为西北农林科技大学动物科技学院绒毛用羊科研创新团队实验室前期筛选保存的菌株。
1.1.2引物16S rDNA扩增引物(通用引物)由南京金斯瑞公司合成,名称和序列如下:16S-F:5′-AGAGTT TGATCCTGGCTCAG-3′,16S-R:5′-GGTTACCTTGTTACGACTT-3′。
1.1.3主要试剂和仪器羟甲基纤维素钠(CMC-Na)、3,5-二硝基水杨酸、葡萄糖、NaCl、NaOH、H2SO4、刚果红、酚酞,均购自西安沃尔森公司;甲基红,购自杨凌三利化玻仪器公司;细菌基因组DNA提取试剂盒,购自OMEGA公司;Taq酶,购自Takara公司;酵母提取物、蛋白胨,购自OXOID公司。
Thermo循环水浴锅Tech320, HITACH紫外可见分光光度计U-3900, Bio-rad PCR仪C1000,酸式、碱式滴定管,数码相机等。用孔径为50 μm尼龙布(购于杨凌新三力化玻)制成9 cm×6 cm的尼龙袋。
1.1.4主要培养基(1) LB液体培养基:取10.0 g蛋白胨、5.0 g酵母提取物、5.0 g氯化钠,溶于1 L蒸馏水,121 ℃灭菌30 min。
(2) LB固体培养基:LB液体培养基中添加1.5%琼脂,121 ℃灭菌30 min。
(3) LC固体培养基:含10 g/L羧甲基纤维素钠(CMC-Na)的LB固体培养基,121 ℃高压灭菌30 min。
(4) 基础产酶培养基(BM培养基):含10 g/L 羧甲基纤维素钠(CMC-Na)的LB液体培养基,调节pH值至7.0,121 ℃高压灭菌30 min。
1.2方法
1.2.1菌株的活化与鉴定将保存的菌株划线接种至LC固体培养基平板,于37 ℃恒温过夜培养,观察平板上菌落生长状况。挑取形态正常的单菌落,接种至5 mL LB液体培养基中,混匀后,于37 ℃、220 r/min恒温培养箱过夜培养,获得种子液;在挑过菌的LC固体培养基中加入适量的刚果红染色液,染色30 min后,用1 mol/L NaCl溶液脱色15 min,观察水解圈大小,选择水解圈最大的作为接种菌。
菌株的形态鉴定[6-7]:将活化后的菌株接种于LC固体培养基平板,37 ℃培养24 h后,观察其菌落与菌体形态,并进行刚果红染色观察和革兰氏染色镜检。
菌株的16S rDNA扩增:提取N3菌株的基因组DNA,以之为模板,用16S rDNA通用引物扩增其16S rDNA片段,送桑尼公司测序,应用NCBI Blast 在线分析工具对测序结果进行同源性比对。
1.2.2纤维素酶活力测定采用DNS法[8-9]测定纤维素酶活力。取3支规格为25 mL比色管,加入2 mL 10 g/L 的CMC-Na,分别置于37 ℃下预热2 min,之后迅速加入0.1 mL粗酶液,精准计时5 min后,立即加入2.5 mL DNS,煮沸5 min后冷却,定容至10 mL,混匀,备检。对照组加入沸水中煮沸30 min灭活的粗酶液,其余操作同前。用紫外可见分光光度计(用对照组试液调0)于540 nm波长比色,然后根据葡萄糖标准曲线计算纤维素酶活力。
酶活单位:按照以上测定方法,在1 min内将羧甲基纤维素分解成1 μmol葡萄糖所需的纤维素酶量为一个单位酶活,单位为U/mL。
1.2.3葡萄糖标准曲线的绘制分别吸取1 g/L标准葡萄糖溶液0,0.5,1.0,2.0,4.0 mL于10 mL容量瓶中,用蒸馏水定容。(以含有0 mL标准葡萄糖溶液的试液作为对照组)。再分别吸取上述溶液各2 mL于比色管中,分别加入2.5 mL 3,5-二硝基水杨酸显色液(DNS),煮沸5 min。冷却后,加水稀释至10 mL。用HITACH紫外分光光度计U-3900在540 nm波长下比色(用对照组试液调0),以标准葡萄糖溶液的质量浓度为横坐标、对应的光密度值为纵坐标,绘制标准曲线,拟合回归方程。
1.2.4纤维素酶的部分酶学性质分析将供试菌株种子液接种于LB液体培养基,于37 ℃、220 r/min 培养24 h,然后4 ℃ 、10 000 r/min离心15 min,取上清液即为粗酶液。
酶促反应的最适温度:在含10 g/L CMC-Na的50 mmol/L乙酸钠缓冲液(pH 5.0)中加入适量粗酶液,分别于30,35,40,45,50,55,60,65,70,75,80,85和90 ℃下反应5 min,DNS法测定纤维素酶活性。每个处理设3个重复。
酶促反应的最适pH:将10 g/L CMC-Na分别溶于pH 3.5~11.0的缓冲液,即乙酸-乙酸钠缓冲液(pH为 3.5,4.0,4.5,5.0,5.5,6.0,6.5),Tris-HCl缓冲液(pH为7.0,7.5,8.0,8.5)和甘氨酸-氢氧化钠缓冲液(pH为 9.0,9.5,10.0,10.5,11.0)。加入0.1 mL粗酶液,于最适温度下反应5 min,DNS法测定CMC酶活性。每个处理设3个重复。
1.2.5酶谱分析利用含有10 g/L CMC的10%分离胶对供试菌株所产内切纤维素酶进行SDS-PAGE检测[10]。将粗酶液样品与上样缓冲液(0.6 mol/L Tris-HCl pH 6.8、体积分数60%甘油、60 g/L SDS、0.6 g/L溴酚蓝)按体积比4∶1混合,冰浴2 h备用;同时,将标准蛋白冰浴2 h备用。将已经前期处理的备用粗酶液和标准蛋白分别上样,80 V电泳2 h。电泳后,将胶条在含1 g/L Triton X-100的50 mmol/L醋酸缓冲液(pH 5.5)中洗涤30 min除去SDS。将含有标准蛋白的胶条切下,经考马斯亮蓝染色、脱色备用;其余含有样品的胶条置于50 mmol/L醋酸钠缓冲液(pH 5.5)中,于37 ℃过夜孵育,经10 g/L刚果红染色30 min后,用1 mol/L NaCl洗脱显示透明带。
1.2.6产酶条件优化[11-12](1)单因子试验。利用单因子试验筛选该菌株产酶的最佳培养时间和培养基的最佳碳源、氮源,每个处理设3个重复。
培养时间:将菌株N3的种子液按照1∶50的体积比接种于30 mL基础产酶培养基中,分别于37 ℃、220 r/min条件下培养12,24,36,48和60 h,测定纤维素酶活力。
碳源: 取30 mL LB液体培养基3份,向其中分别加入麸皮、麦草、燕麦各2.0 g,121 ℃灭菌25 min, 即得不同碳源培养基,备用。将菌株N3的种子液按体积比1∶50接种不同碳源培养基,在最佳培养时间下进行发酵产酶,测定菌株在不同碳源下所产纤维素酶的活力。
氮源:以筛选的碳源配制基础培养基,分别用10 g/L蛋白胨、硫酸铵和硝酸钾作为氮源制备发酵培养基。将N3菌株种子液按照1∶50的体积比接种至不同氮源的发酵培养基,在最佳培养时间下培养,测定菌株在不同氮源下所产纤维素酶活力。
(2)正交试验。采用正交试验优化供试菌株的培养温度(A)、培养基初始pH(B)及接种比例(C),每个因素 3个水平,L9(34)正交表如表 1所示,其他的培养基成分与制备的发酵培养基成分相同,每组试验重复3次,结果取平均值。
1.2.7粗纤维降解率的测定在最优产酶条件下,制备粗酶液。将10 mL粗酶液和含2.0 g饲料(麸皮/麦草/燕麦),于最适反应温度下220 r/min分别培养12,24,36,48,60 h,将残渣转入已做恒质量处理的尼龙袋中。每个处理设3个重复,结果取平均值。利用尼龙袋法[13]测定饲料及菌株N3降解后残渣中的粗纤维含量,并计算粗纤维降解率。

表 1 菌株N3产酶培养条件优化的L9(34)正交试验因素水平表Table 1 Optimized culturing conditions of Bacillus subtillis N3 for enzyme production
1.2.8供试菌株对木质素的降解能力分析利用RB亮蓝脱色试验[14]检测菌株对木质素的降解能力。将10.0 mg RB 亮蓝加入至100 mL BM 培养基中,使其充分溶解,铺平板后接种菌株N3,于30 ℃静置培养,每天观察记录平板脱色情况,根据菌落周围是否产生脱色圈判断有无木质素降解酶(如:漆酶)分泌。
1.3数据分析
用SPSS 11.5进行统计差异性分析,以P<0.05作为检验各项数据的差异显著性水平。
2结果与分析
2.1N3菌株的鉴定
2.1.1形态鉴定将该菌株接种于LC平板上培养24 h后,可观察到菌落成椭圆形、灰白色;刚果红染色发现菌体周围有明显的水解圈(图1-A);革兰氏染色发现该菌株呈杆状,颜色为蓝紫色(图1-B),说明该菌为革兰氏阳性菌,命名为N3。

图 1 菌株N3的形态学鉴定 A.刚果红染色;B.革兰氏染色Fig.1 Morphological identification of N3 A.Congo red staining;B.Gram staining
2.1.216S rDNA序列分析以菌株N3的基因组DNA为模板,用16S rDNA通用引物扩增获得该菌株16S rDNA片段,长度约为1 400 bp(图2)。测序后,应用NCBI Blast 在线分析工具对测序结果进行同源性比对,发现该菌株的16S rDNA序列与枯草芽孢杆菌属细菌Bacillussubtilissubsp.subtilis str.168的16S rDNA序列(登录号:NC_000964.2)具有100%的相似度,结合菌株的形态鉴定,初步确定该菌株为枯草芽孢杆菌属,并命名为BacillussubtilisN3。
2.2葡萄糖标准曲线绘制
用不同质量浓度的葡萄糖标准溶液与3,5-二硝基水杨酸(DNS)反应,在540 nm波长下测得相应的吸光度值。利用Excel软件制作散点图得到标准曲线(图3),其拟合方程为y=14.323x-0.124 3,R2=0.999 5,线性良好。
2.3菌株N3所产内切纤维素酶的部分酶学性质
2.3.1酶促反应的最适温度由图4可知,菌株N3 所产纤维素酶的最适反应温度为60 ℃,在该温度下,酶活性可达到为2.51 U/mL;在30~60 ℃时,纤维素酶活性随温度的升高不断增强;60 ℃之后,纤维素酶活性随温度的升高呈下降趋势,但在60~75 ℃时,纤维素酶仍有较高的酶活性。
2.3.2酶促反应的最适pH由图5可知,当pH为 4.5~8.5时,菌株N3所产酶的活力较高,其中,当pH为 5.5时,纤维素酶活性最强,达到3.04 U/mL。该结果表明,该菌所产纤维素酶具有较宽的pH范围,尤其是对偏酸性环境的适应性较强。
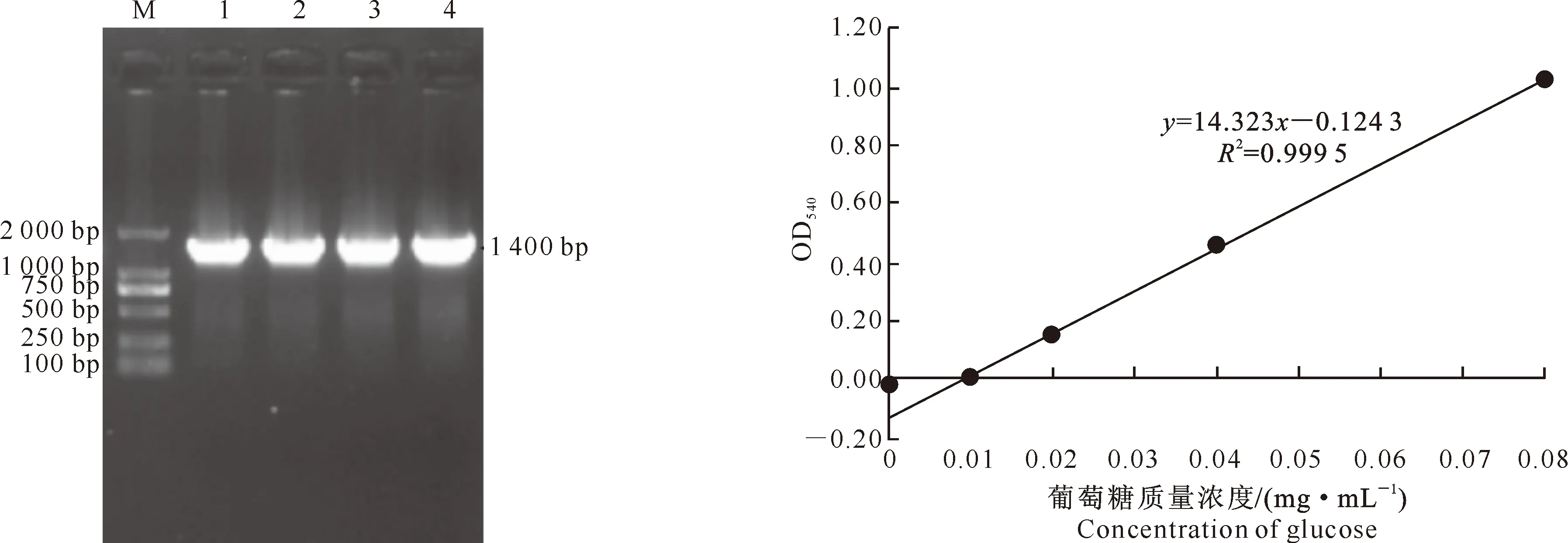
图 2菌株N3的16S rDNA的扩增结果
M.DL2000 DNA Marker;1~4.为扩增片段
Fig.2Amplification of N3 16s rDNA
M.DL2000 DNA Marker;1-4.Products of 16S rDNA PCR
图 3葡萄糖标准曲线
Fig.3Standard curve of glucose

图 4 反应温度对纤维素酶酶活性的影响Fig.4 Cellulase activities under different reaction temperatures

图 5 pH值对纤维素酶酶活性的影响Fig.5 Cellulase activities under different pH values
2.4酶谱分析
利用SDS-PAGE和刚果红染色法分析菌株N3所产内切纤维素酶的分子质量。结果发现,经刚果红染色再脱色后,胶条上分子质量大于70 ku的部分颜色较分子质量小于70 ku的部分浅(图6, 胶条1),证明N3菌株所产分子质量为70 ku以上的纤维素酶降解了羧甲基纤维素底物。

图 6 菌株N3所产纤维素酶的酶谱分析 M.Blue plus II protein Marker;1.菌株N3所产纤维素酶Fig.6 Zymogram analysis of cellulase from N3 M.Blue plus II protein Marker;1.Cellulase from N3
2.5菌株N3产酶条件的优化
2.5.1不同培养时间对酶活力的影响由图7可以看出,菌株N3的纤维素酶活力曲线与其生长曲线的变化规律相似,随着培养时间的延长均呈现先上升后下降趋势;培养24 h时,菌体所产酶活力最高,而在培养48 h后,培养时间对酶活力的影响变小。
2.5.2不同碳源对酶活力的影响分别以麦草、麸皮和燕麦作为碳源(2.0 g/30 mL),其他成分不变进行最适碳源的筛选,在37 ℃,220 r/min条件下培养 24 h后测定纤维素酶活力,结果如图 8所示。由图8可以看出,不同碳源对菌体产酶活力有显著影响(P<0.05),其中以麸皮作为发酵培养基的碳源时,菌体接种其中所产纤维素酶的活性最高,为3.24 U/mL。因此,以麸皮为菌株N3产纤维素酶的碳源进行后续试验。

图 8 不同碳源对N3所产纤维素酶活力的影响 图注上标不同小写字母表示差异显著(P<0.05)。图9同Fig.8 Enzyme production of N3 with different carbon origins Different letters indicate significant difference atP<0.05.The same for figure 9
2.5.3不同氮源对酶活力的影响由图9可知,以蛋白胨为氮源培养时,N3所产纤维素酶活性最高,为2.93 U/mL,显著高于以硫酸铵和硝酸钾为氮源时的纤维素酶活性(P<0.05)。因此,以蛋白胨为氮源进行后续试验。
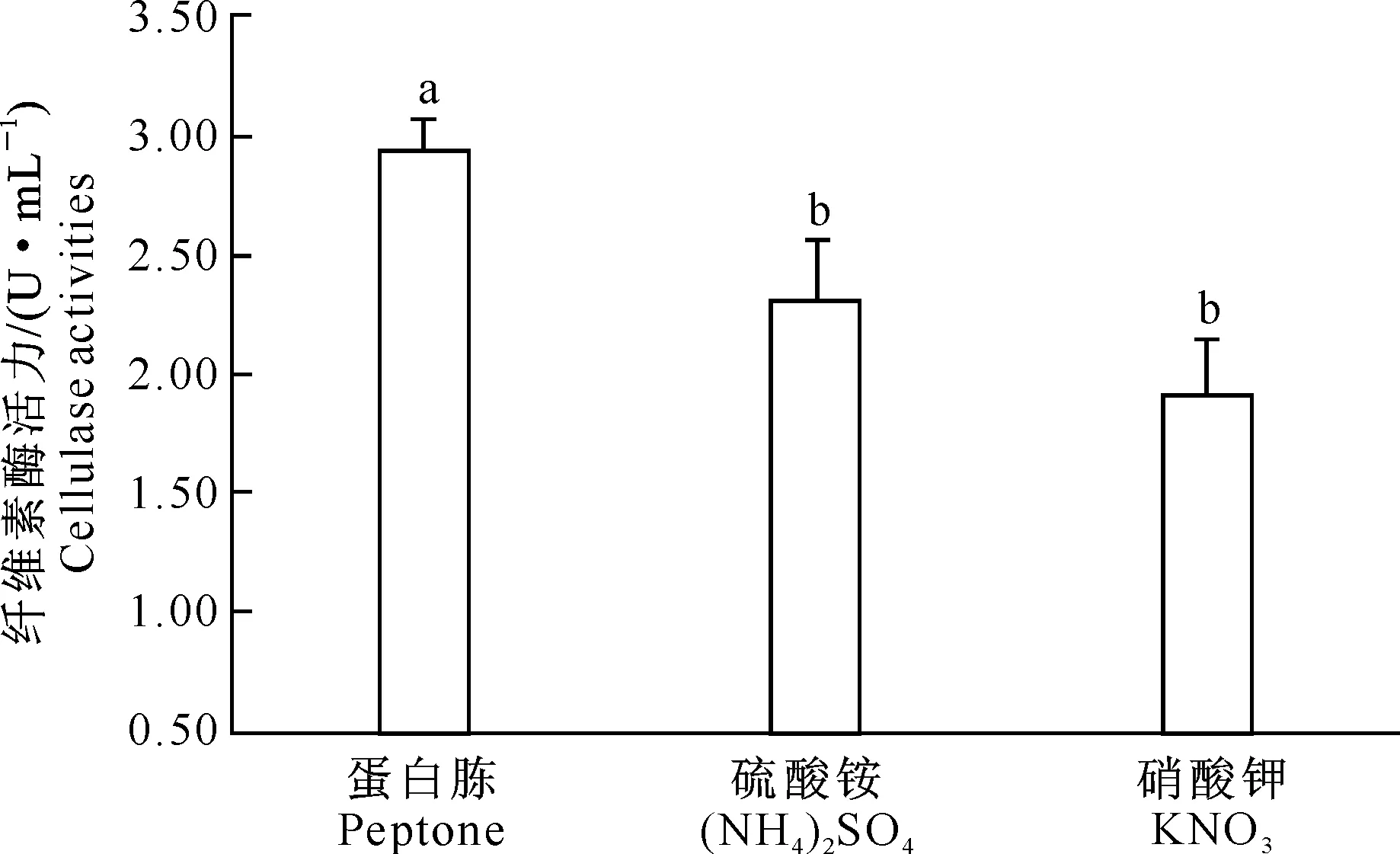
图 9不同氮源对N3所产纤维素酶活力的影响
Fig.9Enzyme production of N3 with different nitrogen origins
2.5.4培养温度、培养基初始pH及接种比例对酶活力的影响为提高菌株产酶能力,在最适氮源、碳源和发酵时间下,应用正交试验进一步优化菌株N3发酵产酶的条件。为此,选取培养温度(A)、培养基初始pH(B)和接种比例(C)进行L9(34)正交试验,每个因素选3个水平,每个试验做3次平行。结果表明(见表2),培养温度(A)对菌株N3产纤维素酶的影响最为显著,菌株N3产纤维素酶的最优条件A2B1C2,即当菌株N3以1∶50比例接种至pH为5的产酶培养基,于37 ℃发酵培养24 h时,菌株所产酶的活力最强,可达到3.50 U/mL。

表 2 不同培养温度、初始pH、接种比例下该菌株产纤维素酶活力的比较Table 2 Cellulase activities of Bacillus subtilis N3 at different temperature,initial pH and ratio of inoculation
2.6菌株N3对粗纤维降解率的测定
由图10可知,菌株N3所产纤维素酶对麸皮粗纤维的降解率最高,对麦草秸秆粗纤维的降解效果最差。

图 10 菌株N3对饲料粗纤维的降解效果Fig.10 Degradation rates of crude fiber under different culture times
2.7菌株N3对木质素降解能力的测定
结果(图11)发现,菌株N3经过4 d的脱色反应,菌体周围仍无脱色圈产生,表明N3不分泌木质素降解酶(漆酶)。

图 11 菌株N3对木质素降解能力的测定 A.脱色第1天,未发现脱色现象;B.脱色第4天,未发现脱色现象Fig.11 Determination of lignin decomposing capacity of N3 A.Decolorizating in day 1,no decolonization phenomenon was observed;B.Decolorizating in day 4,no decolorization phenomenon was observed
3讨论
在微生物发酵产酶过程中,微生物的产酶量与其所处生长阶段有关。通常微生物在对数生长期时产酶活性迅速上升,进入生长稳定期时产酶活性达到最高,之后逐渐下降。这主要是因为在生长的稳定期后,营养物质逐渐耗尽和有毒代谢产物的逐渐积累,细菌死亡速率大于增殖速率,从而使菌株在培养稳定期后产酶活力逐渐下降[15-17]。本试验中,菌株N3对数生长期为0~24 h,菌株N3产酶活力在此时段迅速上升;在培养24 h左右,细菌N3进入生长稳定期,此时具有最高的纤维素酶活性,说明菌株N3在此期间产酶能力最强;发酵24 h后,细菌发酵液的酶活开始缓慢下降,说明酶的分解速度已大于产生的速度,所以菌株N3的最适发酵培养时间为24 h。碳源和氮源是微生物发酵产酶的重要影响因素,本试验所选取的3种碳源中,以麸皮作为发酵培养基的碳源时,菌株N3所产酶的活性最高,这是因为麸皮的营养物质最为丰富,尤其是植物性蛋白质的含量高达14%左右[18],这为菌株产酶提供了丰富的营养,从而获得较高的纤维素酶活力;在以蛋白胨为氮源时,N3所产酶活性最高,这可能是因为蛋白胨能够提供有机氮,而硫酸铵和硝酸钾只能够提供无机氮元素;以硝酸钾为氮源的培养基所产酶活最低,这可能与灭菌前培养基发生反硝化反应,造成氮元素的挥发和流失有关[19]。相比较而言,在大规模发酵产酶时,考虑到成本,选择硫酸铵为氮源更经济。
细菌性纤维素降解菌一般不具备完整的纤维素酶系,通常只能分泌1~3种组分[20-23]。本试验通过酶谱分析,观察到一条清晰的水解条带,说明该菌株可能主要分泌一种胞外内切纤维素酶组分。这为今后该酶基因的克隆、构建酶高效表达系统、进一步深入研究其酶学性质提供了重要依据[24]。
纤维素酶在具体应用过程中,需耐受一定的高温,而且纤维素物质的分解都是在少氧或缺氧环境中进行[25],因此筛选纤维素酶活高的厌氧及兼性厌氧细菌具有更广泛的应用价值,而高耐热的细菌源纤维素酶也更利于实际操作和工业生产。许多细菌源纤维素酶的最适温度在50 ℃左右[24]。本试验中,菌株N3所产纤维素酶的最适温度为60 ℃,且在60~75 ℃时仍具有较高的酶活性,表明N3所产的纤维素酶具有较强的耐热性,这为今后克隆其耐热纤维素酶基因或纯化耐热纤维素酶直接应用于动物饲料提供了理论依据[26]。
本试验在研究菌株N3所产粗酶液对饲料粗纤维降解率时,应用了尼龙袋法,该方法虽不能完全模拟动物体内的消化环境,但可以在一定程度上反映饲料中粗纤维在动物体内的总体消化情况[20],这有利于生产中该酶制剂的科学添加。
木质素是自然界第2位最丰富的有机物,木质素的降解主要依赖木质素过氧化物酶、锰过氧化物酶和漆酶共同作用来完成,而目前研究最多的是漆酶,且近年来的研究发现,漆酶对环境污染问题的治理起着重要的作用[14]。研究证实,许多枯草芽孢杆菌能分泌漆酶[27-28]。本试验利用RB亮蓝脱色反应定性检测了菌株N3分泌漆酶的能力,发现菌株N3周围均无脱色圈产生,表明该菌株不产生能够降解木质素的漆酶。
4结论
经鉴定,供试纤维素降解菌为枯草芽孢杆菌属,命名为BacillussubtilisN3。菌株N3不分泌木质素降解酶(漆酶),主要分泌分子质量约为70 ku以上的内切纤维素酶组分。N3所产酶具有较强的耐热性,最适温度为60 ℃,最适pH为5.5,对饲料粗纤维具有较强的降解能力。菌株N3的最佳产酶条件为:接种量为1∶50(体积比),分别以麸皮和蛋白胨为碳源和氮源,发酵培养基初始pH为5, 37 ℃培养时间24 h,在上述条件下,N3菌株所产纤维素酶的活力最高,约为3.50 U/mL。
[参考文献]
[1]李燕红,赵辅昆.纤维素酶的研究进展 [J].生命科学,2005,17(5):392-397.
Li Y H, Zhao F K.Advances in cellulase research [J].Chinese Bulletin of Life Sciences,2005,17(5):392-397.
[2]张立静,李术娜,朱宝成.高效纤维素降解菌短小芽孢杆菌(Bacilluspumilus)T-7的筛选、鉴定及降解能力的研究 [J].中国农学通报,2011,27(7):112-118.
Zhang L J,Li S N,Zhu B C.Screening,identification and degradation conditions of cellulose decomposing bacterialBacilluspumilusT-7 [J].Chinese Agricultural Science Bulletin,2011,27(7):112-118.
[3]Wilson D B.Cellulases and biofuels [J].Current Opinion in Biotechnology,2009,20(3):295-299.
[4]李淑彬,陆广欣,林如妹.嗜热菌-工业用酶的新来源 [J].中国生物工程杂志,2003,23(7):67-71.
Li S B,Lu G X,Lin R M.Thermophilic bacteria-the new source of industrial enzyme [J].China Biotechnology,2003,23(7):67-71.
[5]Ibrahim A S S,El-diwany A I.Isolation and identification of new cellulases producing thermophilic bacteria from an Egyptian hot spring and some properties of the crude enzyme [J].Australian Journal of Basic and Applied Sciences,2007,1(4):473-478.
[6]胡国全,邓宇,徐恒,等.极端嗜热厌氧纤维素菌的分离鉴定,系统发育分析及其酶学性质的研究 [J].应用与环境生物学报,2004,10(2):197-201.
Hu G Q,Deng Y,Xu H,et al.Isolation of a thermophilic cellulolytic anaerobic bacterium and its biological characteristic [J].Chin J Appl Environ Biol,2004,10(2):197-201.
[7]曹月青,殷幼平,董亚敏,等.桑粒肩天牛肠道纤维素分解细菌的分离和鉴定 [J].微生物学通报,2001,28(1):9-11.
Cao Y Q,Yin Y P,Dong Y M,et al.Isolation and identification of the cellulose-utilizing bacteria from the gut ofAprionagermari(Hope) [J].Microbiology China,2001,28(1):9-11.
[8]刘德海,杨玉华,安明理,等.纤维素酶酶活的测定 [J].中国饲料,2002(17):27-28.
Liu D H,Yang Y H,An M L,et al.Assay method on the activity of feed cellulase [J].China Feed,2002(17):27-28.
[9]管斌,丁友昉,谢来苏,等.还原糖测定方法的规范 [J].无锡轻工大学学报,1999,18(3):74-79.
Guan B,Ding Y F,Xie L S,et al.Standardized measurement method of reducing sugar [J].Journal of Wuxi University of Light Industry,1999,18(3):74-79.
[10]Yamada K,Toyohara H.Function of meiobenthos and microorganisms in cellulose breakdown in sediments of wetlands with different origins in Hokkaido [J].Fisheries Science,2012,78(3):699-706.
[11]孟婷,储卫华,刘海峡,等.产纤维素酶细菌的分离及产酶条件研究 [J].江苏农业科学,2012,40(8):354-355.
Meng T,Chu W H,Liu H X,et al.Isolation of cellulose-utilizing bacteria and conditions of producing cellulase [J].Jiangsu Agricultural Sciences,2012,40(8):354-355.
[12]黄玉兰,李征,张杰,等.一株耐低温纤维素酶高产菌株的筛选、鉴定和产酶的初步试验 [J].微生物学通报,2010,37(5):637-644.
Huang Y L,Li Z,Zhang J,et al.Screening and identification of a cold-adapted cellulose-producing bacteria [J].Microbiology China,2010,37(5):637-644.
[13]吴秋珏,张晓庆,郝正里.用尼龙袋测定饲料中粗纤维的试验研究 [J].饲料工业,2005,26(1):55-56.
Wu Q J,Zhang X Q,Hao Z L.Experimental study on the determination of crude fiber with nylon bag [J].Feed Industry,2005,26(1):55-56.
[14]康从宝,刘巧,李清心.白腐菌产漆酶的纯化及部分酶学性质 [J].中国生物化学与分子生物学报,2002,18(5):638-642.
Kang C B,Liu Q,Li Q X.Purification and properties of laccase produced from a White Rot Fungus (W-1) [J].Chinese Journal of Biochemistry and Molecular Biology,2002,18(5):638-642.
[15]钱林,郑巧利,柳建设,等.一株高产纤维素降解菌株的分离鉴定及其酶学性质 [J].微生物学通报,2010,37(4):524-528.
Qian L,Zheng Q L,Liu J S,et al.Isolation and identification of a cellulose degrading bacterium and its cellulase characterization [J].Microbiology China,2010,37(4):524-528.
[16]叶云峰,黎起秦,袁高庆,等.枯草芽孢杆菌B47菌株高产抗菌物质的培养基及发酵条件优化 [J].微生物学通报,2011,38(9):1339-1346.
Ye Y F,Li Q Q,Yuan G Q,et al.Optimization of culture medium and fermentation conditions for high production of antimicrobial substance byBacillussubtilisstrain B47 [J].Microbiology China,2011,38(9):1339-1346.
[17]胡艳平,王磊,曹平华,等.纤维素酶产生菌的筛选,其酶学性质及对饲料粗纤维降解效果的研究 [J].饲料工业,2013,34(8):21-27.
Hu Y P,Wang L,Cao P H,et al.Study of screening of a strain producing cellulase,its enzymatic properties and the degradation rate of crude fiber in the feed [J].Feed Industry,2013,34(8):21-27.
[18]林琳.小麦麸皮的营养成分及其开发利用 [J].农业科技与装备,2010(3):41-42.
Lin L.Nutritional ingredient of wheat bran and its utilization [J].Agriculture Science & Technology and Equipment,2010(3):41-42.
[19]杨宣华.不同氮源对北冬虫夏草生长影响的研究 [J].佛山科学技术学院学报(自然科学版),2008,26(3):52-58.
Yang X H.Effects of different nitrogen sources on the growth of cordyceps militaris link [J].Journal of Foshan University(Natural Science Edition),2008,26(3):52-58.
[20]Singh J,Batra N,Sobti R C.Purification and characterization of alkaline cellulase produced by a novel isolate,BacillussphaeritesJS1 [J].Journal of Industrial Microbiology and Biotechnology,2004,31(2):51-56.
[21]Zeng R,Xiong P,Wen J.Characterization and gene cloning of a cold-active cellulase from a deep-sea psychrotrophic bacteriumPseudoalteromonassp.DY3 [J].Extremophiles,2006,10(1):79-82.
[22]Snoek P A,Von den Hoff J W.Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors [J].Bio Techniques,2005,38(1):73-83.
[23]Rezg R,Mornagui B,El-Arbi M,et al.Effect of subchronic exposure to malathion on glycogen phosphorylase and hexokinase activities in rat liver using native PAGE [J].Toxicology,2006,223(1):9-14.
[24]李旺,杨明明,陈玉林.产纤维素酶枯草杆菌B.subtilisDR的鉴定与酶特性研究 [J].饲料研究,2012(1):33-35.
Li W,Yang M M,Chen Y L.Identification and enzymatic characteristics of cellulose producing-strainsB.subtilisDR [J].Feed Research,2012(1):33-35.
[25]刘艳.嗜热厌氧梭菌降解纤维素及产氢特性研究 [D].山东济南:山东大学,2008.
Liu Y.Studies on cellulose degradation and hydrogen production characteristics of thermophilic anaerobicClostridium[D].Jinan,Shandong:Shandong University,2008.
[26]李旺.纤维素酶基因重组野生乳酸杆菌表达系统的构建 [D].陕西杨凌:西北农林科技大学,2010.
Li W.Construction of wild type lactobacillus expression system integrated with cellulose genes [D].Yangling,Shaanxi:Northwest A&F University,2010.
[27]Guan Z B,Zhang N,Song C M,et al.Molecular cloning,characterization,and dye-decolorizing ability of a temperature-and pH-stable laccase fromBacillussubtilisX1 [J].Applied Biochemistry and Biotechnology,2014,172(3):1147-1157.
[28]Brander S,Mikkelsen J D,Kepp K P.Characterization of an alkali-and halide-resistant laccase expressed inE.coli:CotA fromBacillusclausii[J].PLoS One,2014,9(6):e99402.
DOI:网络出版时间:2016-06-0816:2010.13207/j.cnki.jnwafu.2016.07.003
[收稿日期]2014-11-13
[基金项目]国家自然科学基金项目(31072060;31372343);国家绒毛用羊产业技术体系项目(CARS-40-13);国家公益性行业(农业)专项(20130305905)
[作者简介]王尧悦(1992-),女,陕西临潼人,在读硕士,主要从事动物营养与饲料科学研究。E-mail:18792629437@163.com [通信作者]杨雨鑫(1977-),男,河南信阳人,副教授,博士,主要从事动物营养与饲料科学研究。 E-mail:yxyang@nwsuaf.edu.cn
[中图分类号]S821.5
[文献标志码]A
[文章编号]1671-9387(2016)07-0016-09
Identification of a cellulose-decomposing strain and its application for degrading different cellulosic materials
WANG Yaoyue,CAO Pinghua,CHEN Yulin,YANG Mingming,YANG Yuxin
(CollegeofAnimalScience&Technology,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Abstract:【Objective】 A cellulose-decomposing strain was identified,its optimal cultivating conditions for cellulase production were determined and the crude fiber utilization rate was tested to provide basis for its application.【Method】 A cellulosic decomposing bacterium was identified by morphology and 16S rDNA gene sequences.Then,the enzymatic properties of Bacillus subtilis N3 were studied and cultivation conditions for cellulase production were optimized.Degradation of three feedstuffs (wheat bran,wheat straw,oat straw) by cellulose from the strain N3 was conducted.The lignin decomposing capacity of the strain was also tested using brilliant blue RB method.【Result】 The strain was identified and named Bacillus subtilis N3.The optimal temperature and pH for the CMCase activity of the crude enzyme were 60 ℃ and 5.5,respectively.Zymogram analysis showed that one CMCase with molecular weight of 70 ku was primary secreted by Bacillus subtilis N3.The optimal conditions of producing cellulase were 24 h,37 ℃,wheat bran,peptone,initial pH 5.0 and 1∶50 for initial inoculums.The average activity of CMCase activity reached 3.5 U/mL.The highest degradation rate of crude fiber was observed for wheat bran,while the lowest degradation rate was for wheat straw.In addition,Bacillus subtilis N3 failed to produce laccase and could not degrade lignin.【Conclusion】 Cellulose-decomposing strain Bacillus subtilis N3 mainly secreted a cellulase with molecular weight of 70 ku and its degradability of crude fiber was strong.
Key words:Bacillus subtilis;cellulase;enzymatic property;cellulose degradation;zymographic analysis
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160608.1620.006.html

