来航鸡FOXL2基因的真核表达及纯化
刘 静,韩 丽,李任峰,徐 萍,鲁 毅,杨 猛,王三虎
(河南科技学院 动物科学学院,河南 新乡 453003)
来航鸡FOXL2基因的真核表达及纯化
刘静,韩丽,李任峰,徐萍,鲁毅,杨猛,王三虎
(河南科技学院 动物科学学院,河南 新乡 453003)
[摘要]【目的】 对来航鸡FOXL2基因进行真核表达及纯化,为其生物学功能研究奠定基础。【方法】 根据GenBank已发表的来航鸡FOXL2基因序列(GenBank登录号:JF_708868.1)设计引物,以来航鸡全血DNA为模板,PCR扩增FOXL2基因,经EcoRⅠ和XbaⅠ双酶切后定向克隆于pPICZαA 中,获得pPICZαA-FOXL2真核表达载体。将pPICZαA-FOXL2转化毕赤酵母菌GS115,用甲醇进行诱导表达,对表达产物进行SDS-PAGE和Western blotting检测。【结果】 克隆了918 bp的FOXL2基因;成功构建了pPICZαA-FOXL2真核表达载体;实现了FOXL2基因在毕赤酵母菌GS115中的融合表达,获得了分子质量约为37 ku的重组蛋白FOXL2,经Western blotting 检测其具有较好的生物学活性。【结论】 成功地在毕赤酵母中表达了来航鸡FOXL2基因。
[关键词]来航鸡;FOXL2基因;真核表达
叉头框转录因子L2基因(Winged helix forkhead transcription factor gene 2,FOXL2)存在于细胞核内,是一个长度为2.7 kb的单外显子基因,位于3q23(3号染色体2区3带)区域,包含一个特有的forkhead DNA结构域(该结构域含有101个氨基酸,位于第54-148残基区域之间)和一个多聚丙氨酸肽段,但该肽段的功能尚不确定。许多人类发育性、免疫性疾病及肿瘤的发生均与个体的基因突变有关,这些基因突变可引起循环系统、免疫系统和骨骼系统的缺陷。此外,FOXL2是最早被发现的一个在人类卵巢功能维持方面起重要作用的常染色体基因,也是在脊椎动物中首先被认定作为卵巢分化的性别二态性标记物[1]。FOXL2是单外显子转录因子,位于常染色体上,是卵巢分化过程中最早的影响因子,在不同性别决定机制的脊柱动物中呈现高度保守性和高表达性[2]。鸡FOXL2基因位于9号常染色体上,包含1 130个碱基,可编码305个氨基酸,是早期卵泡发育的调控因子。在鸡胚胎发育早期,FOXL2可与芳香化酶共同影响其卵巢髓质的发育,且FOXL2的表达先于芳香化酶,但芳香化酶可抑制FOXL2的表达[3]。FOXL2可能参与调节芳香化酶的合成,对雌激素分泌进行间接调节,且与卵巢上的启动子2共同激活CYP19基因的表达,从而影响雌性性腺的分化[4]。另外,FOXL2可能具有抗卵泡衰亡的作用,FOXL2表达量低可使卵泡衰亡加快,进而导致卵巢内卵泡数目的减少,卵巢储备功能下降[5-7]。综上可知,FOXL2很可能与鸡的卵巢发育及产蛋性能有重要关系。
来航鸡是一种世界闻名的高产蛋鸡品种,也是我国养鸡业中重要蛋鸡品种,多年来为养殖业带来了巨大的经济效益。本研究对来航鸡FOXL2基因进行了克隆,并在毕赤酵母中进行了真核融合表达,以期为进一步分析来航鸡FOXL2基因的生物学功能奠定基础。
1材料与方法
1.1材料
1.1.1血样、细菌菌株及载体纯系SPF来航鸡(Leghorn),购自北京梅里亚维通试验动物技术有限公司;大肠杆菌DH5α感受态细胞,购自北京全式金生物技术有限公司;毕赤酵母菌GS115,购自Invitrogen公司;质粒载体pMD18-T、pPICZαA均为河南科技学院中心实验室保存。
1.1.2主要试剂和仪器血液/细胞/组织基因组DNA提取试剂盒,购自OMEGA公司;普通琼脂糖凝胶回收纯化试剂盒和质粒提取试剂盒,均购自TaKaRa公司;2×TaqMaster Mix,购自康为世纪公司;氨苄青霉素(Amp)、博来霉素(ZeocinTM)、β-半乳糖苷酶(X-gal)、甲醇、山梨醇和琼脂糖,均购自Sigma公司;T4 DNA连接酶及EcoRⅠ、XbaⅠ和ScaⅠ限制性内切酶,均为Fermentas公司产品;一抗His-Tag(2AS)Mouse mAb,购自Abmart公司; 二抗辣根过氧化物酶标记的山羊抗小鼠IgG,购自中杉金桥公司;酵母粉和蛋白胨均购自OXOID公司;电穿孔仪购自美国Bio-Rad公司。
1.2引物的设计与合成
根据GenBank已发表的来航鸡FOXL2基因序列(GenBank登录号:JF_708868.1)以及真核表达载体pPICZαA序列上的多克隆酶切位点,用Primer 5.0软件设计引物:
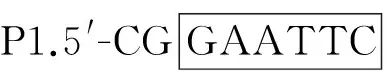

1.3FOXL2基因的克隆及序列测定
1.3.1基因组DNA的提取采集来航鸡血液样品,按照OMEGA公司的血液/细胞/组织基因组DNA提取试剂盒操作步骤提取基因组DNA。
1.3.2基因扩增及纯化以来航鸡基因组DNA为模板,P1和P2 分别作为上、下游引物,对FOXL2基因进行PCR扩增。PCR 扩增反应体系为:2×TaqMaster Mix 25 μL,P1 2 μL,P2 2 μL,ddH2O 19 μL,模板DNA 2 μL。PCR反应条件:94 ℃ 10 min;94 ℃ 1 min,61.5 ℃ 1 min,72 ℃ 90 s,30个循环;72℃ 10 min,4 ℃保存。PCR产物经1%琼脂糖凝胶电泳检测后,用普通琼脂糖凝胶回收纯化试剂盒回收纯化PCR产物,并再次进行电泳检测。
1.3.3重组质粒pMD18-T-FOXL2的构建将回收纯化的FOXL2基因和pMD18-T 载体分别用EcoRⅠ和XbaⅠ进行双酶切后,用T4 DNA连接酶进行连接,构建重组质粒pMD18-T-FOXL2。将连接产物转化大肠杆菌DH5α。挑取转化平板上生长的5个单菌落分别进行过夜培养,取过夜培养菌液各1 μL作为模板,PCR扩增FOXL2基因,对扩增产物进行1.0%琼脂糖凝胶电泳检测。用碱裂解法小量提取PCR检测阳性菌重组质粒pMD18-T-FOXL2,进行EcoRⅠ 和XbaⅠ双酶切鉴定,筛选含FOXL2基因的阳性重组质粒,试验同时设经同样双酶切的空载体pMD18-T对照;并将重组质粒pMD18-T-FOXL2送北京英骏生物技术有限公司测序。
1.4FOXL2基因在毕赤酵母中的表达
1.4.1真核表达载体pPICZαA-FOXL2的构建FOXL2基因重组真核表达载体的构建策略如图1所示。通过EcoRⅠ和XbaⅠ2个限制性酶切位点,将正向连接的重组质粒pMD18-T-FOXL2中的FOXL2亚克隆到表达载体pPICZαA中,构建真核表达载体pPICZαA-FOXL2。连接产物转化大肠杆菌DH5α,扩大培养后提取pPICZαA-FOXL2,进行PCR鉴定及EcoRⅠ、XbaⅠ双酶切鉴定,试验同时设经同样双酶切的空载体pPICZαA对照。将初步鉴定正确的阳性菌种送北京英骏生物技术有限公司测序,并进行序列分析。
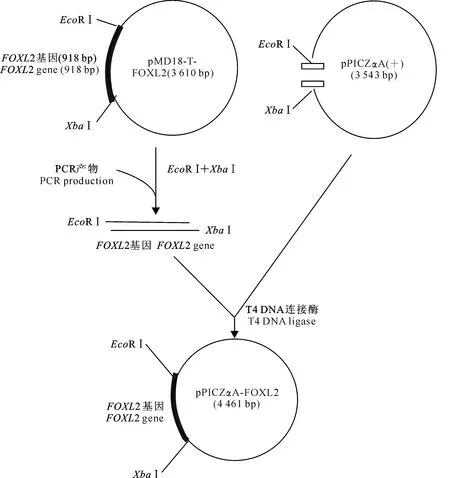
图 1 重组真核表达载体pPICZαA-FOXL2的构建示意图Fig.1 Establishment of recombinant eukaryotic expression vector pPICZαA-FOXL2
1.4.2真核表达载体pPICZαA-FOXL2的线性化将测序正确的阳性大肠杆菌DH5α按体积分数1%的量接种至100 mL含ZeocinTM(25 μg/mL)的LLB液体培养基中,37 ℃下180 r/min振荡培养过夜,大量提取pPICZαA-FOXL2真核表达载体,用SacⅠ单酶切使其线性化。
1.4.3酵母重组子的制备与诱导表达参照Invitrogen公司提供的试剂说明书制备毕赤酵母GS115感受态细胞,备用。将pPICZαA-FOXL2真核表达载体转化至自制的毕赤酵母菌 GS115感受态细胞,挑取饱满湿润的菌落接种于10 mL含100 μg/mL ZeocinTM的YPDS液体培养基中,28 ℃下250 r/min剧烈振荡培养过夜,第2天再以体积分数1%的量接种于20 mL BMGY培养液中,28 ℃下250 r/min振荡培养使菌液的OD600为2~7,于 4 000 r/min 离心5 min,收集菌体,将菌体用100 mL BMMY培养液重悬使其OD600为1时,加甲醇至其体积分数为0.5%~1%,28 ℃下250 r/min诱导培养8 d,期间每隔24 h补加甲醇使其最终体积分数达0.5%~1%,分别取未诱导样品及诱导72 h后的样品,4 ℃下12 000 r/min离心10 min,取上清液,于-20 ℃冻存,备检。
1.4.4表达产物的SDS-PAGE及Western blotting检测将1.4.3节所获得的酵母重组子重悬于25 μL 2×SDS凝胶加样缓冲液中,煮沸10 min后以12%分离胶、5%浓缩胶进行SDS-PAGE 检测,同时以pPICZαA空载体转化的毕赤酵母GS115在相同条件下诱导表达的产物作为对照。用电转移法将蛋白质转移到硝酸纤维膜上,用50 g/L脱脂奶粉封闭纤维膜;加入均按1∶2 500体积比稀释的鼠抗His-Tag单克隆抗体(一抗)和羊抗鼠IgG(二抗);加入显色液,观察结果。
2结果与分析
2.1FOXL2基因的PCR扩增
PCR产物经1%琼脂糖凝胶电泳后,在918 bp 处有1条特异性DNA条带(图2),其长度与目的基因片段长度相一致。

图 2 来航鸡FOXL2基因的PCR扩增 M.DNA Marker DL 2000;1~4.PCR产物Fig.2 PCR amplification of leghorn FOXL2 gene M.DNA Marker DL 2000;1-4.PCR products
2.2重组质粒 PMD18-T-FOXL2的鉴定
PCR扩增产物经1.0%琼脂糖凝胶电泳检测,在918 bp 处有1条特异性DNA条带,可以初步判断相对应的转化子为阳性重组子。克隆质粒 PMD18-T-FOXL2经双酶切,结果(图3)出现了2条带,一条长度约为2.7 kb,与载体长度(2 692 bp)相近;另一条长度约为1.0 kb,与外源目的基因长度(918 bp)相符。重组质粒 PMD18-T-FOXL2经测序证实获得了正向插入、无突变表达质粒pPICZαA-FOXL2。
2.3重组真核表达载体 pPICZαA-FOXL2的鉴定
PCR扩增检测结果显示,在918 bp 处有1条特异性DNA条带,可以初步判断相对应的转化子为阳性重组子。真核表达载体pPICZαA-FOXL2经双酶切,结果(图4)出现了2条带,一条长度约为3.6 kb,与载体长度(3.6 kb)相近;另一条长度约为1.0 kb,与外源目的基因长度(918 bp)相符。
测序结果显示,重组表达载体pPICZαA-FOXL2中正向插入了完整的来航鸡FOXL2基因开放式阅读框,其长度为918 bp,编码305个氨基酸,该序列与GenBank中来航鸡FOXL2基因编码区核苷酸序列(GenBank登录号:JF_708868.1)同源性为99.99%,推导的氨基酸序列同源性为 99.9%。

图 3 重组质粒pMD18-T-FOXL2的EcoRⅠ和XbaⅠ双酶切鉴定 M.DNA Marker DL 5000 ;1.重组质粒pMD18-T-FOXL2的 双酶切产物;2.空载体pMD18-T的双酶切产物Fig.3 Identification of recombinant plasmid pMD18-T-FOXL2 with EcoRⅠand XbaⅠdigestion M. DNA Marker DL 5000;1.Recombinant plasmid pMD18-T-FOXL2 with EcoRⅠand XbaⅠdigestion; 2 .Empty carrier pMD18-T with EcoRⅠand XbaⅠdigestion图 4 真核表达载体pPICZαA-FOXL2的EcoRⅠ和XbaⅠ双酶切鉴定 M.DNA Marker DL 5000;1.重组质粒pPICZαA-FOXL2的 双酶切产物;2.空载体pPICZαA的双酶切产物Fig.4 Identification of eukaryotic expression vector pPICZαA-FOXL2 with EcoRⅠand XbaⅠdigestion M.DNA Marker DL 5000;1.Recombinant plasmid pPICZαA with EcoRⅠand XbaⅠdigestion; 2.Empty carrier pPICZαA with EcoRⅠand XbaⅠdigestion
2.4真核表达产物的检测
2.4.1SDS-PAGE电泳对经甲醇诱导72 h的样品进行SDS-PAGE电泳,结果见图5。从图5可以看出,与空载体pPICZαA对照相比,经过甲醇诱导72 h的样品出现了1条约37 ku的蛋白条带,与预期蛋白分子质量大小相一致。
2.4.2Western blotting检测Western blotting 检测结果见图6。从图6可以看出,被检测的样品只出现1条特异的条带,其大小与预期结果相一致,说明了重组真核表达载体成功诱导表达出目的蛋白。

图 6 重组蛋白FOXL2的Western blotting检测 M.蛋白质分子量标准;1~3.重组蛋白FOXL2Fig.6 Western blotting detection of recombinant protein FOXL2 M.Protein Marker;1-3.Recombinant protein FOXL2
3讨论
FOXL2基因是近年来发现的一种转录因子,属翼状螺旋/叉头转录因子超家族成员,其在眼睑、胚胎及成体卵巢颗粒细胞中呈现特异性的表达,与性别决定、卵巢早衰、不孕不育、肿瘤以及小眼睑裂综合征等有关。翼状螺旋/叉头转录因子家族是一种转录调节核蛋白,内含一个特定的forkhead DNA结合域,它们在早期胚胎谱系决定,特别是胚外胎膜的形成、内胚层和侧板中胚层的发育及随后器官的形成中起重要作用[8]。FOXL2是一个藏在人体内的“变性基因”,可以使人的性别特征得以维持,但如果这个基因出现任何异常,女性则有可能会长出男性所特有的睾丸和胡须,这一发现不仅改变了人们一直以为人类的性别是与生俱来的传统观念,而且有可能会为变性手术带来质的飞跃,并使雌雄同体婴儿的治疗得到改善。
Loffler等[9]通过原位杂交技术发现,FOXL2不仅在小鼠卵巢发育过程中的干细胞和卵母细胞中表达,而且在体细胞中也有表达,并且有微弱的杂交信号在小鼠胚胎的睾丸组织被检测到。Uhlenhaut等[10]研究者发现了一个很有趣的现象,即敲除FOXL2可使小鼠的雌性生殖器官向雄性转化。Takasawa等[11]通过试验得出在小鼠卵巢发育时期,FOXL2的转录产物可通过对WT1的拮抗来抑制Sf1的表达。Yang等[12]发现了FOXL2的另一重要功能,即FOXL2可抑制子宫内膜移位症的发生。2012年,Eozenou等[13]通过牛的的体内外试验发现,FOXL2对牛的发情周期有调控作用,并在牛的子宫内膜中表达,是独立于孕体的派生干扰素。Govoroun等[14]成功克隆出鸡FOXL2基因的开放读码框(cFOXL2),提出FOXL2是一种在鸟类卵巢发育中的早期调控因子。FOXL2通过对目的靶基因的转录调节作用,使其进行转录、蛋白表达,促进颗粒细胞的增殖分化,对卵巢的发育和功能维持都起着不可替代的作用。因此,对FOXL2基因功能及其蛋白表达的研究变得意义重大。
pPICZαA是一个融合表达载体,其C-端含有Myc和His标签的序列。目的蛋白的可溶性表达,不仅有利于对表达产物的检测,也为进一步回收和纯化目的蛋白以及研究目的蛋白提供了方便[15-16]。来航鸡FOXL2蛋白有305个氨基酸残基(分子质量大约为33.5 ku),其真核融合表达产物的 N-端总共融合了34个氨基酸残基肽(包含His标签和C-端含Myc标签,分子质量约为3.6 ku),因此融合表达产物共有339个氨基酸残基(分子质量约37 ku左右)。本试验SDS-PAGE检测结果显示,表达蛋白条带所处位置的相对分子质量大小约为37 ku,表明来航鸡FOXL2基因在毕赤酵母中成功表达出了FOXL2融合蛋白。Western blotting检测结果显示该蛋白为His融合蛋白,表明重组真核表达载体在毕赤酵母中成功表达出了目的融合蛋白。本研究为深入探索鸡FOXL2 基因的功能奠定了基础。
[参考文献]
[1]Al-Agha O M,Huwait H F,Chow C,et al.FOXL2 is a sensitive and specific marker for sex cord-stromal tumors of the ovary [J].The American Journal of Surgical Pathology,2011,35(4):484-494.
[2]Crisponil L,Deiana M,Loi A.The putative forkhead transciption factorFOXL2 is mutated in blepharophimisis/ptosis/epicanthus inversus syndrome [J].Nat Genet,2001(27):159-166.
[3]Pisarska M D,Barlow G,Kuo F T.Minireview:roles of the forkhead transcription factor FOXL2 in granulosa cell biology and pathology [J].Endocrinology,2011,152(4):1199-1208.
[4]Oshima Y,Naruse K,Nakamura Y,et al.Sox3:a transcription factor forCYP19 expression in the frog Rana rugosa [J].Gene,2009,445:38-48.
[5]Cheng J C,Klausen C,Leung P C K.Overexpression of wild-type but not C134W mutantFOXL2 enhances GnRH-induced cell apoptosis by increasing GnRH receptor expression in human granulosa cell tumors [J].PloS one,2013,8(1):e55099.
[6]Rosario R,Blenkiron C,Shelling A N.Comparative study of microRNA regulation on FOXL2 between adult-type and juvenile-type granulosa cell tumoursinvitro[J].Gynecologic Oncology,2013,129(1):209-215.
[7]Nonis D,McTavish K J,Shimasaki S.Essential but differential role of FOXL2wt and FOXL2 C134W in GDF-9 stimulation of follistatin transcription in co-operation with Smad3 in the human granulosa cell line COV434 [J].Mol Cell Endocrinol,2013,372(1/2):42-48.
[8]Jonckheere N,Vincent A,Perrais M,et al.The human mucin MUC4 is transcriptionally regulated by caudal-related homeobox,hepatocyte nuclear factors,forkhead box A,and GATA endodermal transcription factors in epithelial cancer cells [J].Journal of Biological Chemistry,2007,282(31):22638-22650.
[9]Loffler K A,Zarkower D,Koopman P.Etiology of ovarian failure in blepharophimosis ptosis epicanthus inversus syndrome:FOXL2 is a conserved,early-acting gene in vertebrate ovarian development [J].Endocrinology,2003,144(7):3237-3243.
[10]Uhlenhaut N H,Treier M.FOXL2 function in ovarian development [J].Mol Genet Metab,2006;88(3):225-234.
[11]Takasawa K,Kashimada K,Pelosi E,et al.FOXL2 transcriptionally represses Sf1 expression by antagonizing WT1 during ovarian development in mice [J].The FASEB Journal,2014,28(5):2020-2028.
[12]Yang W H,Gutierrez N M.Antagonistic regulation of StAR gene expression and synergistic regulation ofMc2Rgene expression by FOXL2 and SF-1 [J].Biol Reprod,2009,81:343.
[13]Eozenou C,Carvalho A V,Forde N,et al.FOXL2 is regulated during the bovine estrous cycle and its expression in the endometrium is independent of conceptus-derived interferon tau [J].Biology of Reproduction,2012,87(2):32.
[14]Govoroun M S,Pannetier M,Pailhoux E,et al.Isolation of ch-icken homolog of theFOXL2 gene and comparison of its expression patterns with those of aromatase during ovarian development [J].Developmental Dynamics,2004,231(4):859-870.
[15]Burrowes O J,Diamond G,Lee T C.Recombinant expression of pleurocidin cDNA using thePichiapastorisexpression system [J].J Biomed Biotechnol,2005(4):374-384.
[16]李青,周晓宏.新型生物防腐剂-多聚阳离子抗菌肽在毕赤酵母中的表达 [J].食品科学,2012(3):1-8.
Li Q,Zhou X H.New biological preservatives-polymer cationic antimicrobial peptide inPichiaexpression [J].Food Science,2012(3):1-8.
DOI:网络出版时间:2016-06-0816:2010.13207/j.cnki.jnwafu.2016.07.002
[收稿日期]2014-12-11
[基金项目]河南省基础与前沿项目(082300430020);河南省科技厅科技成果转化项目(00202011002)
[作者简介]刘静(1988-),女,河南南阳人,在读硕士,主要从事分子免疫学研究。E-mail:771065523@qq.com [通信作者]王三虎(1962-),男,河南武陟人,教授,博士,主要从事分子免疫学研究。E-mail:wangsanhu2012@126.com
[中图分类号]S832.2
[文献标志码]A
[文章编号]1671-9387(2016)07-0010-06
Eukaryotic expression and purification ofFOXL2 gene in leghorn
LIU Jing,HAN Li,LI Renfeng,XU Ping,LU Yi,YANG Meng,WANG Sanhu
(CollegeofAnimalScience,HenanInstituteofScienceandTechnology,Xinxiang,Henan453003,China)
Abstract:【Objective】 Eukaryotic expression and purification of leghorn FOXL2 gene were conducted to understand its biological function.【Method】 A pair of primers were designed based on the published nudeotide sequence of leghorn FOXL2 gene (GenBank accession number:JF_708868.1).The full-length coding sequence of the gene was amplified by PCR using the whole blood DNA as template.The product was double-digested by EcoRⅠ and XbaⅠ before being directionally cloned into the pPICZαA vector to obtain the eukaryotic expression vector pPICZαA-FOXL2.The recombinant expression vector was induced with methanol in GS115 and SDS-PAGE and Western blotting were used to detect the expressed protein.【Result】 The FOXL2 gene of 918 bp was cloned and its eukaryotic expression vector pPICZαA-FOXL2 was successfully obtained.The FOXL2 gene fusion expression in yeast GS115 was conducted and the 37 ku FOXL2 protein was obtained,which had good biological activities as shown by Western blotting detection.【Conclusion】 The leghorn FOXL2 gene was successfully expressed.
Key words:leghorn;FOXL2 gene;eukaryotic expression
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160608.1620.004.html

