Apelin-13对脑缺血再灌注损伤作用的初步研究*
蒯锦霞包海军李周儒董国凯殷文江孙晓明李姗姗蔡红星
Apelin-13对脑缺血再灌注损伤作用的初步研究*
蒯锦霞①包海军①李周儒①董国凯①殷文江①孙晓明①李姗姗①蔡红星①
【摘要】目的:研究Apelin-13对缺血/再灌注小鼠脑损伤的作用,并初步探讨其对自噬性细胞死亡的影响。方法:取健康雄性CD-1小鼠,随机分为假手术(sham)组、生理盐水(Saline)组、Apelin组;Apelin组和Saline组首先建立脑缺血再灌注(MCAO/R)模型,再灌注即刻给予同侧侧脑室注射Apelin-13或等量生理盐水,然后在再灌注48 h后,进行神经功能方面检测,同时利用2,3,5-氯化三苯基四氮唑(TTC)染色评估脑梗死体积;缺血再灌注24 h和48 h后,采用West-blot法检测各组自噬相关蛋白LC3的表达情况。结果:Apelin-13可显著降低小鼠脑缺血再灌注后神经功能缺损症状,减少脑梗死体积,减低自噬相关蛋白LC3的表达及LC3-Ⅱ/LC3-Ⅰ的比值。结论:Apelin-13对小鼠脑缺血再灌注损伤有一定的保护作用,抑制神经细胞的自噬性死亡可能是其作用机制之一。
【关键词】Apelin-13; 脑缺血再灌注模型(MCAO/R); 自噬; LC3
First-author’s address:Xuzhou Medical University,Xuzhou 221002,China
脑缺血缺氧可引起的神经细胞结构破坏和脑功能的缺损,脑缺血再灌注损伤是脑缺血缺氧后恢复缺血区血供的又一次损伤,也是一种继发性神经元损伤,与神经细胞的继发性神经元死亡密切相关[1]。近年来有研究表明自噬与脑缺血损伤的发生、发展有着密切的关系[2-3]。研究发现脂肪因子Apelin-13能够对神经细胞的损伤发挥保护作用,但其具体作用机制还不甚明了[4-6]。本实验拟通过观察Aplin-13在脑缺血再灌注损伤中是否起到了保护性作用,并通过检测自噬相关蛋白LC3的表达,研究其对神经细胞自噬的影响,探讨其在缺血再灌注脑损伤中的作用机制。
1 材料与方法
1.1 实验动物及分组 共48只健康雄性CD-1小鼠,体重30~35 g(由徐州医学院动物实验中心提供),随机分为如下各组,实验1:sham组6只、Saline组6只、Apelin-13组6只,共18只用于行为学检测和TTC实验;实验2组:sham组、再灌注24 h Saline组、再灌注48 h Saline组、再灌注24 h Apelin-13组、再灌注48 h Apelin-13组,每组6只,共30只用于Western-Blot测定。
1.2 小鼠MCAO/R模型的制备 参照甄毅岚等[6]的线栓法制作左侧大脑中动脉闭塞(MCAO)模型。小鼠用7%的水合氯醛(0.05/10 g)腹腔麻醉后,仰卧位固定于手术台上,酒精擦拭颈部消毒,行颈部正中切口、钝性分离左侧颈总动脉、颈外动脉、颈内动脉。结扎颈外动脉近端,在颈总动脉近心端结扎,远心端挂线备用。微动脉夹夹住颈内动脉,在颈总动脉上于分叉处约3 mm处剪一小口,插入专用线栓,将预制的活结稍打紧(防止线栓脱出)。打开夹住颈内动脉的动脉夹,将线栓缓慢插入颈内动脉,大约9 mm时感到有一定阻力停止推进,且向外拔1mm用丝线固定,阻断大脑中动脉起始部血流且不刺破血管。伤口以碘伏消毒,缝合颈部皮肤,保留线栓3~4 mm,术后动物侧卧置于单独的笼内。缺血后60 min,缓慢向外拉线10 mm,使其头端回撤至颈总动脉内,计时实施再灌注。Saline组、Apelin-13组采用线栓法建立小鼠MCAO/R模型;sham组仅给予分离血管,不予结扎及栓塞血管。Apelin组于再灌注即刻给予同侧侧脑室注Apelin-13 (0.33μg/g;注射定位:前囟左侧1 mm,后1 mm,深度2.5 mm),Saline组给予同侧侧脑室等量的生理盐水注射。
1.3 神经功能评分及大脑梗死体积检测 MCAO/R 48 h后,采用改良Bederson评分法进行神经功能缺损评分[7]。评分标准:0分,无明显神经病学症状;1分,不能完全伸展右侧前爪(左侧手术);2分,向右侧旋转;3分,行走时向右侧倾倒;4分,不能自行行走。0分及昏迷不醒者剔除。神经功能评分后,对脑组织进行TTC染色,正常组织呈鲜红色,梗死组织呈白色。SD小鼠在水合氯醛麻醉下心内灌注处死,冰板上快速断头取脑。把脑放入-20 ℃冰箱中冷冻,20 min后取出,切成2 mm的冠状切片,泡入1%TTC溶液中,37 ℃水浴箱中30 min,甲醛固定,图象分析仪测梗死体积。每只小鼠脑总梗死体积MV=Σ(A1+A2)t/2,其中t为切片厚度,A1和A2分别表示切块嘴、尾侧梗死面积。同样方法计算同侧大脑半球体积,计算出梗死灶体积占缺血侧大脑半球体积的百分比。
1.4 Western-Blot的检测 Saline组和Apelin-13组按时间点开颅取出小鼠伤侧的海马组织,sham组取同侧海马组织,提取蛋白质,采用12%的SDSPAGE胶进行蛋白质分离,等量(10 μL)蛋白样品上样。恒压电泳,全湿式电转法将蛋白质转移到硝酸纤维素膜(NC膜)上,丽春红染NC膜可见清晰的红色条带,表明蛋白质转膜成功。NC膜用5%脱脂奶粉溶液室温封闭NC膜4 h。分别加入一抗(抗GAPDH抗体,1∶1000;抗LC3抗体,1∶5000),4 ℃孵育过夜;二抗(生物素标记羊抗兔IgG,1∶1000稀释),4 ℃孵育1 h;用辣根酶标记亲和素(1∶1000稀释)与二抗结合,4 ℃孵育1 h,以上操作均在摇床上进行,且各步骤间均用TBST洗膜5 min×5次(操作分别按相关试剂盒说明书进行)。膜上加ECL超敏发光液,保鲜膜包好后,暗室内曝光30 s,X线片在显影液中显影2 min,定影液中定影5 min。最后利用Quantity One(Bio-Rid)软件分析蛋白光密度值。
1.5 统计学处理 应用SPSS 13.0统计学软件对数据进行处理,计量资料以(±s)表示,比较采用t检验和方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 神经功能评分 按照改良Bederson评分法,统计结果显示:MCAO/R 48 h后, Saline组Bederson评分(3.13±0.23)分与sham组(0.63±0.18)分相比显著升高(P<0.05),提示脑缺血再灌注后造成明显的神经功能缺损。术后48 h,Apelin-13组Bederson评分(2.38±0.18)分与Saline组相比有所降低(P<0.01),提示Apelin-13能够显著改善脑缺血再灌注后神经功能的缺失。见图1。
2.2 脑梗死体积检测 脑梗死范围测定是评价脑缺血损伤的金指标,缺血再灌注48 h后,TTC染色,sham组小鼠脑组织表现为均匀一致的鲜红色,无明显梗死灶形成;Saline组和Apelin-13组脑组织出现范围不等的白色梗死区域。Saline组梗死区域体积比例(22.35±1.50)明显高于sham组(0.52±0.20)(P<0.01),提示脑缺血再灌注后造成明显的大脑梗死。术后48 h, Apelin-13组脑梗死体积比例(10.55±1.01)与Saline组相比明显降低(P<0.01),提示Apelin-13能够显著降低缺血再灌注小鼠的梗死体积。见图2。

图1 缺血再灌注48 h后神经功能评分检测结果

图2 缺血再灌注48 h后大脑梗死体积比的统计结果
2.3 Western-Blot的检测结果 通过对MCAO/R后受损海马区神经细胞的LC3的表达分析发现,再灌注后24、48 h,Saline组海马区的LC3-Ⅱ/LC3-Ⅰ比值(0.366±0.319)、(0.408±0.035)与sham组(0.193±0.034)相比均增加,且在48 h达高峰,Apelin-13组LC3-Ⅱ/LC3-Ⅰ比 值(0.243±0.031)、(0.291±0.027)与Saline组相比从24 h开始显著降低,并且持续到了48 h,差异均有统计学意义(P<0.05)。见图3。
3 讨论
Apelin为孤儿G蛋白耦联受体APJ的天然配体,Apelin及其受体APJ广泛分布在中枢神经系统及外周[8-9],在中枢神经系统 中,Apelin参与应激以及痛觉的调制等生理作用;在心血管系统中,Apelin可调节心肌收缩力和降低动脉血压[10-11]。近年来有研究发现Apelin有显著抑制细胞凋亡的作用[12-13],而自噬与凋亡有着共同的调节因子,及复杂的相互调节关系。自噬作为一种早期的自我适应性机制,能清除受损的细胞器和蛋白,为组织稳态的恢复提供营养物质和能量[14]。因此通过调控细胞自噬的发生,可成为治疗缺血再灌注脑损伤的一种新的尝试手段。
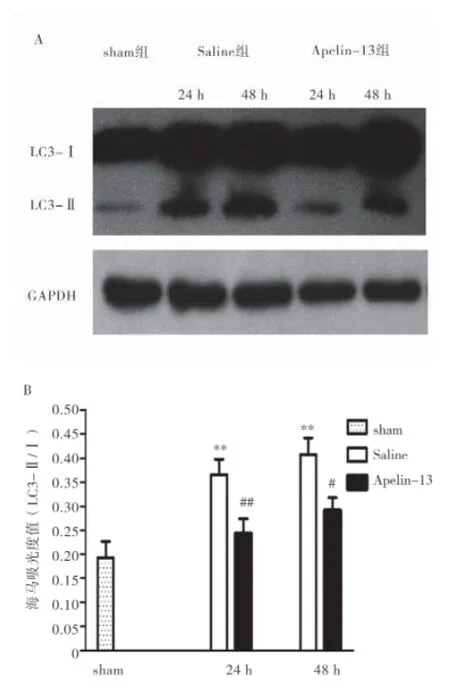
图3 Western-Blot的检测结果
本实验通过对脑室注射Apelin-13观测其对脑神经的保护作用,结果显示,与Saline组相比,Apelin-13组小鼠神经功能缺失显著降低,表明Apelin-13可明显改善脑缺血再灌注损伤后小鼠的神经功能缺损,发挥保护神经的作用。同时,本实验还采用了TTC染色法观察梗死体积,与Saline组相比,Apelin-13组脑缺血再灌注损伤的脑梗死体积明显减少,进一步表明Apelin-13对脑缺血再灌注损伤具有保护作用。
通过Western-Blot的检测结果,笔者发现Apelin-13能显著的降低LC3-Ⅱ/LC3-Ⅰ的比值。LC3蛋白是哺乳动物细胞中酵母ATG8基因的同源物,靶向定位于自噬体膜,参与自噬体的形成,被认为是观察自 噬是否存在的标记性分子[15-19],有Ⅰ型和Ⅱ型之分。哺乳动物细胞发生自噬时,细胞内LC3的含量及LC3-Ⅰ向LC3-Ⅱ的转化均明显增加,LC3-Ⅱ含量的多少与自噬泡数量的多少成正比[20-24]。因此,通过检测细胞内LC3-Ⅱ/LC3-Ⅰ比值的变化,可以明确地判断自噬水平的高低。本实验中,Apelin-13组LC3-Ⅱ/LC3-Ⅰ比值明显降低,表明Apelin-13对脑缺血再灌注过程的自噬有显著抑制作用。
综上所述,Apelin-13可明显减轻脑缺血再灌注损伤,保护大脑的功能。通过抑制细胞的自噬可能是其作用机制之一,但是自噬的发生是一个复杂的过程,其具体作用机制还有待于进一步的研究证实。
参考文献
[1]汪莹,许栋明,王文,等.脑缺血再灌注后神经细胞凋亡机制及药物保护作用的研究进展[J].中国康复理论与实践,2010,16(12):1140-1143.
[2]李春明,舒适,钱小路.自噬与脑缺血再灌注损伤的研究进展[J].中国脑血管病杂志,2015,12(6):330-332.
[3] Zhu M,Lu M, Li Q J,et al.Hyperbaric oxygen suppresses hypoxicischemic brain damage in newborn rats[J].J Child Neurol,2015,30(1):75-82.
[4] Khaksari M,Aboutaleb N,Nasirinezhad F,et al.Apelin-13 protects the brain against ischemic reperfusion injury and cerebral edema in a transient model of focal cerebral ischemia[J].Journal of Molecular Neuroscience,2012,48(1):201-208.
[5] Galanth C,Hus-Citharel A,Li B,et al.Apelin in the control of bpdy fluid homeostasis and cardiovascular functions[J].Curr Pharm Des,2012,18(6):789-798.
[6]甄毅岚,王亚男,李晟,等.线栓法制备不同体重 KM 小鼠局灶性脑缺血/再灌注模型的建立及评价[J].中国实验动物学报,2013,21(2)39-44.
[7] Bederson J B,Pitts L H,Tsuji M,et al.Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[8] Kim J.Apelin-APJ signaling:a potential therapeutic target for pulmonary arterial hypertension[J].Mol cells,2014,37(3):196-201.
[9] Galanth C,Hus-Citharel A,Li B,et al.Apelin in the control of body fluid homeostasis and cardiovascular functions[J].Curr Pharm Des,2012,18(6):789-798.
[10]廖慧颖.Apelin-APJ系统与血管发生[J].中国动脉硬化杂志,2014,22(3):304-308.
[11] Cudnoch J A,Czarzasta K,Gomolka R,et al.The role of apelin in pathogenesis of cardiovascular diseases and metabolic disorder[J].Kardiol Pol,2011,69(Suppl 3):89-93.
[12]张谢,宋毓飞,周华,等.bFGF抑制自噬相关蛋白LC3保护大鼠急性脊髓损伤[J].中国药理学通报,2014,30(11):1625-1626.
[13] Jiao H,Zhang Z,Ma Q,et al.Mechanism underlying the inhibitory effect of Apelin13 on glucose deprivation induced autophagy in rat cardiomyocyte[J].Experimental and Therapeutic Medicine,2013,5(3):797-802.
[14] Cui R R,Mao D A,Yi L,et al.Apelin suppresses apoptosis of human vascular smooth muscle cells via APJ/PI3-K/Akt signaling pathways[J].Amino Acids,2010,39(5):1193-1200.
[15]于大堂,李茗芳,倪兵,等.大鼠脊髓损伤后自噬相关蛋白LC3和BNIP3的表达[J].第三军医大学学报,2013,35(9):841-845.
[16] Codogno P,Meijer A J.Atg5:more than an autophagy factor[J].Nature Cell Biology,2006,8(10):1045-1047.
[17]张创杰,张连峰,周琳.自噬相关蛋白Beclin1、LC3和P62在进展期胰腺癌中的表达及临床意义[J].世界华人消化杂志,2015,23(2):318-323.
[18]王朗,卢燕云,周琴,等.小鼠脑缺血再灌注损伤模型的建立及评价[J].海南医学,2014,26(20):2965-2969.
[19]陈晓娟,肖宗宇,潘琪,等.改良线栓法大鼠脑缺血再灌注损伤模型的建立[J].中国医学创新,2015,12(3):24-27.
[20]曹慧,武璞,李敏,等.大鼠脑缺血再灌注损伤模型评价与分析[J].现代中医药,2015,15(6):111-113.
[21]李亮,龙俊,王知非.Apelin-13对局灶性脑缺血-再灌注损伤大鼠脑组织脑源性神经营养因子及受体表达的影响[J].中国医药导报,2014,11(4):21-24.
[22]袁平,何晓英,李小刚.大鼠脑缺血再灌注损伤过程中TRAF6的表达变化[J].重庆医学,2015,44(10):1314-1316.
[23]郭明宇, 彭诗博, 陈元操,等. Cystatin C对脑缺血再灌注损伤大鼠LC3的影响[J]. 承德医学院学报, 2016, 33(1):79-80.
[24]孙李晴. 大鼠脑缺血再灌注后Cathepsin L与细胞自噬的相关性研究[D].衡阳: 南华大学,2015.
①徐州医科大学 江苏 徐州 221002
doi:10.3969/j.issn.1674-4985.2016.20.005
收稿日期:(2016-03-29) (本文编辑:蔡元元)
*基金项目:国家自然科学青年基金项目(81302612);江苏省高校自然指导项目(15KJD180003)
通信作者:李周儒
The Effect of Apelin-13 on Mice after Middle Cerebral Artery Occlusion-Reperfusion Injury
KUAI Jin-xia,BAO Hai-jun,LI Zhou-ru,et al.//Medical Innovation of China,2016,13(20):018-021
【Abstract】Objective:To observe the effect of apelin-13 on the brain injury induced by middle cerebral artery occlusion-reperfusion(MCAO/R),and to explore the relationship between apelin-13 and autophagy in MCAO/R. Method:A total of 48 mice were randomly divided into sham,saline and apelin-13 groups.Firstly,mice s MCAO/R model was established using the suture’s method.After MCAO/R, Apelin-13 and saline groups were pretreated with an immediate injection of Apelin-13 and saline into the mice brain lateral ventricle.The effect of neurological deficit scores and the cerebral infarct volume was measured with TTC at 48h after MCAO/R.At last,to determine the role of Apelin-13 on the brain injury induced by MCAO/R,the autophagy associated proteins LC3 were also assessed with western-bloting.Result:Apelin-13 can significantly decreased neural dysfunction and cerebral infarct volume of mice after MCAO/R 48 h.Inadditionally,Apelin-13 also reduce the amount of protein LC3 expression and down-regulated protein LC3-Ⅱ/LC3-Ⅰratio,at 24 h and 48 h after MCAO/R.Conclusion:Apelin-13 preconditioning has obvious protective effect on mice after MCAO/R,and the mechanism may possibly by suppressing neuron autophagy.
【Key words】Apelin-13; MCAO/R; Autophagy; LC3

