骨肉瘤患者细胞侵袭相关IL-6、IL-12血清水平检测的临床意义*
陆潞廖品琥谢克恭陆敏安卢贤哲黄可王俊利韦叶生唐毓金
骨肉瘤患者细胞侵袭相关IL-6、IL-12血清水平检测的临床意义*
陆潞①廖品琥①谢克恭①陆敏安①卢贤哲①黄可①王俊利①韦叶生①唐毓金①
【摘要】目的:研究血清IL-6及IL-12水平在骨肉瘤患者与健康体检者之间的差异及临床意义。方法:采用酶联免疫吸附法(ELISA)检测160例骨肉瘤患者及250例健康体检者的外周血血清IL-6及IL-12水平,比较两组间IL-6、IL-12水平的差异及其相关性,探讨血清IL-6及IL-12水平与骨肉瘤发病及进展的关系。结果:骨肉瘤组患者血清IL-6水平明显高于对照组(P<0.01),IL-12水平明显低于对照组(P<0.01)。在骨肉瘤患者中,处于肿瘤发病Ⅲ~Ⅳ期的患者其血清IL-12水平低于Ⅰ~Ⅱ期患者(P<0.05);合并远处转移的患者血清IL-12水平低于不发生远处转移的患者(P<0.05)。血清IL-6水平与IL-12水平无明显线性相关(P>0.05)。结论:血清IL-6及IL-12水平在骨肉瘤患者表达异常,两者在骨肉瘤的发生中可能起免疫调节作用,IL-12的低表达可能与骨肉瘤的进展相关。
【关键词】骨肉瘤; 白细胞介素6; 白细胞介素12
First-author’s address:Affiliated Hospital of Youjiang Medical University for Nationalities,Baise 533000,China
骨肉瘤(Osteosarcoma)来源于原始间充细胞,是最常见的原发性恶性骨肿瘤,多发于青少年及50岁以上的中年人[1-2]。骨肉瘤由恶性成骨细胞分化和产生,其恶性程度较高,治疗困难,且容易发[7-8]。白细胞介素6(interleukin-6,IL-6)的异常表达与肿瘤的发病、侵袭转移相关,并与肿瘤的诊断、预后及治疗相关联[9-11]。白细胞介素12 (interleukin-12,IL-12)是一种具有多种生物活性和免疫调节功能的异戊二聚体细胞因子,由抗原提呈细胞、树突细胞、巨噬细胞或B细胞产生[12]。研究证实,IL-12在机体抗肿瘤免疫中发挥重要作用,影响肿瘤的发生、侵袭转移及预后[13-15]。本研究通过酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)对骨肉瘤患者及健康体检者进行了血清IL-6、IL-12表达水平的检测,结合临床资料进行相关分析,以了解IL-6和IL-12在骨肉瘤发生及进展中的作用。
1 资料与方法
1.1 一般资料 选取2005-2013年本院收治的骨肉瘤患者160例作为骨肉瘤组,均经病理诊断确诊为骨肉瘤。所有患者均排除家族肿瘤病史及自身免疫性疾病病史,且入院前未经抗肿瘤治疗,未服用皮质类固醇激素、阿霉素及有可能影响机体免疫功能的非甾体类抗炎药物。骨肉瘤患者临床分期标准参照第6版国际抗癌联合会颁布的肿瘤、节点转移分类。随机选取同时期到两所医院进行健康体检的250名体检健康者作为对照组考察对象,年龄、性别和居住地点均与骨肉瘤组相匹配,各项临床及实验室检查指标均正常,排除肿瘤病史、家族肿瘤病史或其他严重疾病史。所有受试对象均无血缘关系,本研究经本院伦理委员会批准,试验前征得所有受试对象同意并签署书面知情同意书。两组研究对象的年龄、性别比较差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 两组研究对象一般资料比较
1.2 血清IL-6及IL-12水平测定 室温下用促凝管于清晨抽取受试者肘正中静脉血4 mL并-80 ℃保存,分离血清后用于血清IL-6及IL-12水平检测。IL-6及IL-12p40 ELISA试剂盒为武汉华美生物工程有限公司提供,操作步骤严格按照试剂盒说明书进行。使用日本东京BIO-RAD 680酶标仪在450 nm波长下依次测定各孔OD值,应用软件绘制标准曲线并计算出各样本的浓度值,标准品浓度范围0~10 000 pg/mL。
1.3 统计学处理 采用SPSS 19.0统计学软件进行数据分析,计量资料以(±s)表示,比较采用t检验,计数资料比较采用 χ2检验,以P<0.05为差异有统计学意义;用Spearman方法进行IL-6水平与IL-12水平数据之间的线性相关分析,P<0.05表示具有线性相关。
2 结果
2.1 两组IL-6及IL-12水平比较 骨肉瘤组患者血清IL-6水平明显高于对照组,IL-12水平明显低于对照组,比较差异均有统计学意义(P<0.01),见表2。
2.2 骨肉瘤患者血清IL-6与L-12水平的相关性分析 经Spearman线性相关性分析,骨肉瘤患者血清L-6与L-12水平无明显线性相关(r=-0.074,P>0.05)。
表2 两组研究对象IL-6、IL-12水平比较(±s) pg/mL

表2 两组研究对象IL-6、IL-12水平比较(±s) pg/mL
组别 IL-6 IL-12骨肉瘤组(n=160) 28.36±6.02 200.05±88.96对照组(n=250) 16.78±4.19 272.58±104.56 P值 0.000 0.000
2.3 血清IL-6、IL-12水平与骨肉瘤临床特征之间的关系 在骨肉瘤患者中,血清IL-6水平与患者的年龄、性别、肿瘤大小、组织学分型、肿瘤部位、临床分期及转移均无明显相关,差异均无统计学意义(P>0.05),见表3;处于肿瘤发病Ⅲ~Ⅳ期的患者其血清IL-12水平低于Ⅰ~Ⅱ期患者(P< 0.05);合并远处转移的患者血清IL-12水平低于不发生远处转移的患者(P< 0.05)。血清IL-12水平与患者的年龄、性别、肿瘤大小、组织学分型及肿瘤部位均无明显相关,差异均无统计学意义(P>0.05),见表3。
3 讨论
骨肉瘤的发生与进展取决于机体自身的免疫状态,而T淋巴细胞介导的细胞免疫反应在骨肿瘤的免疫中占主导作用[16]。CD4+辅助性T细胞可分为Th1细胞和Th2细胞,对于机体细胞免疫及体液免疫的调节具有重要的作用,Th1细胞主要分泌IL-2、IL-12、IFN-γ及肿瘤坏死因子等Th1型细胞因子,介导机体的细胞免疫应答并促使CD8+细胞分化和成熟,Th2细胞则主要分泌IL-4、IL-6、IL-10等Th2型细胞因子,介导机体的体液免疫应答并抑制细胞免疫反应。体内Th1/Th2应答及细胞因子失衡与骨恶性肿瘤的发生及进展密切相关[17-18]。
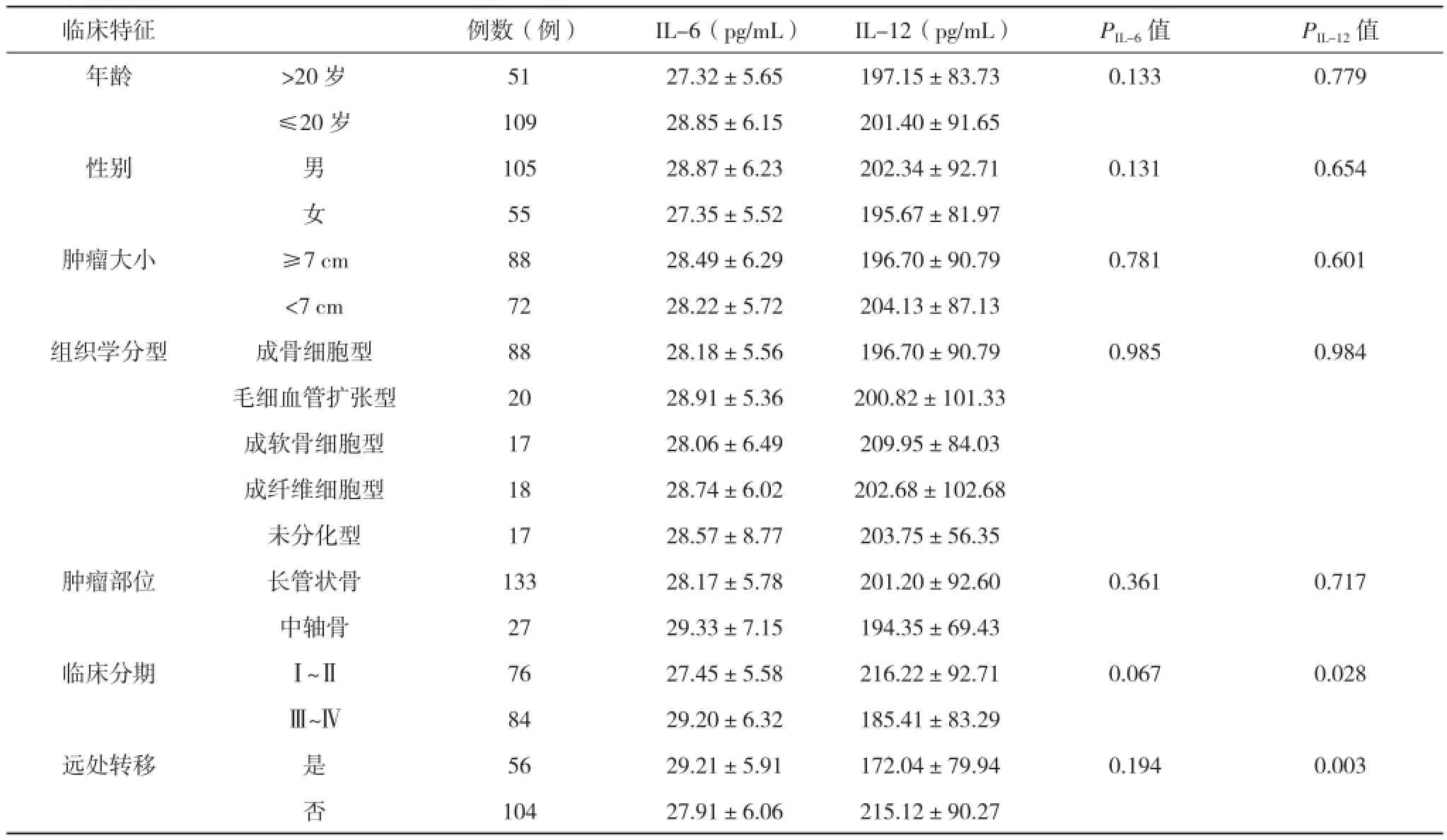
表3 血清IL-6水平与骨肉瘤临床特征之间的关系
作为最具有代表性的Th1细胞因子之一,IL-12处于Th1/Th2免疫应答的核心地位,在机体的固有免疫和后期的抗原特异性的适应性免疫之间建立起有效的关联:它能诱导CD4+初始T细胞(Th0)细胞优先向Th1细胞分化并促进Th1细胞分泌IFN-γ,同时IL-12能激活NK细胞并增强其细胞毒作用,活化巨噬细胞并诱导其成熟,提高其对癌细胞的杀灭能力[19]。已有明确的证据表明IL-12无论对原发或者继发性肿瘤均有抑制作用,这使它成为低免疫源性肿瘤治疗潜在的新靶点[13]。本研究发现,骨肉瘤患者与健康人群相比,血清IL-12表达明显下降,与国内郭爱林等[18]在恶性骨肿瘤中的研究结果相同。提示低表达的IL-12水平可能导致Th1细胞毒性反应减弱进而导致骨肉瘤的发生。同时笔者探讨了血清IL-12水平与骨肉瘤患者各临床特征的相关性,结果显示IL-12水平与骨肉瘤患者的年龄、性别、瘤体大小、组织学形态及部位并不存在相关性。临床分期为Ⅲ~Ⅳ期的患者和发生远处转移的患者血清IL-12均呈现显著的低水平,提示血清IL-12水平下降可能与骨肉瘤的进展相关,可能的机制是IL-12 通过诱导IFN-γ、干扰素-γ诱导单核因子(MIG)及干扰素-γ诱导蛋白-10(IP-10)的生成,进而抑制肿瘤血管生成,同时IL-12还能上调钙粘着素和血管细胞黏附分子水平,防止肿瘤转移。
IL-6是一种多功能的Th2细胞因子。在多种恶性肿瘤中,IL-6均呈高表达,它能诱导集体免疫,刺激并活化B细胞产生抗体,通过JAK/STAT信号通路调控肿瘤细胞的细胞周期, 调节癌基因的表达,促进血细胞的发育从而影响肿瘤的血管生成, 促进肿瘤间质的生长[20]。Hamada等[21]在新近胰腺癌细胞的实验研究中发现,IL-6能通过STAT3通路调节胰腺星形细胞的上皮样改变及胰腺癌相关基因的表达,提示应用IL-6的抗体可导致肿瘤细胞生长的终止。Lin等[10]的研究发现,IL-6能提高骨肉瘤细胞运动性,促进细胞间黏附分子(ICAM)-1表达,提示IL-6与骨肉瘤细胞迁移能力密切相关。同时,与其他Th2细胞因子一样,IL-6能抑制IL-12、IFN-γ等Th1细胞因子的产生,影响NK细胞和CTL细胞的活化。本研究发现,骨肉瘤患者与健康人群相比,血清IL-6表达明显增高,而IL-12水平明显下降[17-22],虽然两者间无明显的线性相关,但提示骨肉瘤患者体内可能以Th2免疫反应为主,而Th1细胞免疫反应受到抑制,Th1/Th2平衡被打破,发生了Th2漂移,从而导致机体的抗肿瘤免疫效应受到抑制。这与国内外学者们的研究结果相似[23-26]。同时笔者也探讨了血清IL-6水平与骨肉瘤患者各临床特征的相关性,但本次实验并未发现IL-6水平与骨肉瘤患者的各临床特征间存在关联。
总之,骨肉瘤患者机体存在免疫调节失衡,IL-6及IL-12参与其中,它们的表达异常与骨肉瘤的发生密切相关,可能在骨肉瘤患者抗肿瘤免疫中可能发挥重要作用,随着对骨肉瘤发生及进展研究的进一步深入,血清IL-6及IL-12表达水平的检测也有望成为骨肉瘤诊断、治疗及判断疗效预后的重要参考指标。
参考文献
[1] Moore D D,Luu H H.Osteosarcoma[J].Cancer Treat Res,2014,162(4):65-92.
[2] Hung G Y,Yen H J,Yen C C,et al.Improvement in high-grade osteosarcoma survival: results from 202 patients treated at a single institution in Taiwan[J].Medicine (Baltimore),2016,95(15):e3420.
[3] Kim J,Woo H Y,Kim E K,et al.Metastatic osteosarcoma to the breast presenting as a densely calcified mass on mammography[J].J Breast Cancer,2016,19(1):87-91.
[4]谢克恭,唐毓金,黄煜朗,等.不同浓度、作用时间白花蛇舌草注射液对MG-63细胞凋亡效果[J].中国医学创新,2016,13(3):1-4.
[5]周齐.百里醌抑制体外骨肉瘤细胞转移的实验研究[J].中国医学创新,2016,13(5):26-29.
[6] Xiao H,Chen L,Luo G,et al.Effect of the cytokine levels in serum on osteosarcoma[J].Tumour Biol,2014,35(2):1023-1028.
[7] Yao X,Huang J,Zhong H,et al.Targeting interleukin-6 in inflammatory autoimmune diseases and cancers[J].Pharmacol Ther,2014,141(2):125-139.
[8]誊秀华,周桂桃.IL-6水平检测与重症并发感染者的相关性分析[J].中国医学创新,2015,12(25):63-65.
[9]刘徽,朱波,林治华.IL-6信号通路与肿瘤[J].细胞与分子免疫学杂志,2011,27(3):353-355.
[10] Lin Y M,Chang Z L,Liao Y Y,et al.IL-6 promotes ICAM-1 expression and cell motility in human osteosarcoma[J].Cancer Lett,2013,328(1):135-143.
[11] Kamińska K,Czarnecka AM,Escudier B,et al.Interleukin-6 as an emerging regulator of renal cell cancer[J].Urol Oncol,2015,33(11):476-485.
[12] Vignali D A,Kuchroo V K.IL-12 family cytokines:immunological playmakers[J].Nat Immunol,2012,13(8):722-728.
[13] Jones L L,Chaturvedi V,Uyttenhove C,et al.Distinct subunit pairing criteria within the heterodimeric IL-12 cytokine family[J].Mol Immunol,2012,51(2):234-244.
[14] Luo M,Liang X,Luo S T,et al.Folate-modified lipoplexes delivering the interleukin-12 gene for targeting colon cancer immunogene therapy[J].J Biomed Nanotechnol,2015,11(11):2011-2023.
[15] Wang J,Nong L,Wei Y,et al.Association of interleukin-12 polymorphisms and serum IL-12p40 levels with osteosarcoma risk[J].DNA Cell Biol,2013,32(10):605-610.
[16] Lussier D M,O'Neill L,Nieves L M,et al.Enhanced T-cell immunity to osteosarcoma through antibody blockade of PD-1/ PD-L1 interactions[J].J Immunother,2015,38(3):96-106.
[17] Xiao H,Chen L,Luo G,et al.Effect of the cytokine levels in serum on osteosarcoma[J].Tumour Biol,2014,35(2):1023-1028.
[18]郭爱林,隋彦仿,范清宇,等.骨转移癌患者Th1/Th2亚群研究[J].肿瘤,2000,20(6):432-434.
[19] Wada T,Iijima H,Sekine F,et al.Effect of PSK on Th1/Th2 balance in tumor-bearing mice[J].Gan To Kagaku Ryoho,2003,30(11):1798-1801.
[20] Hodge D R,Hurt E M,Farrar W L.The role of IL-6 and STAT3 in inflammation and cancer[J].Eur J Cancer,2005,41(16):2502-2512.
[21] Hamada S,Masamune A,Yoshida N,et al.IL-6/STAT3 plays a regulatory role in the interaction between pancreatic stellate cells and cancer cells[J].Dig Dis Sci,2016,77(2):1-11.
[22]蔡冠雄.单个核细胞与骨肉瘤细胞之间相互作用的研究[D].福州:福建医科大学,2015.
[23]王运林,廖二元,戴如春,等.17β-雌二醇对人骨肉瘤MG-63细胞株IL-6、IL-11和NF-κB表达的作用[J].中国现代医学杂志,2005,15(24):3710-3714.
[24]李国慧,刘瑞花,李贵霞,等.苦参碱对人骨肉瘤细胞MG63凋亡影响的实验研究[J].河北医科大学学报,2014,35(1):53-55.
[25]吴丽美,伍绍国,陈卫文,等.构建裸鼠皮下荷瘤模型:人骨肉瘤细胞株MG63、U2OS和143B[J].中国组织工程研究,2015,19(27):4277-4281.
[26]袁赤亭,朱敏,范利荣,等.糖皮质激素受体在3种人成骨肉瘤细胞株MG63、U2-OS及HOS中表达及差异[J].医学研究杂志,2014,43(11):144-146.
doi:10.3969/j.issn.1674-4985.2016.20.001
收稿日期:(2016-04-13) (本文编辑:蔡元元)
*基金项目:国家自然科学基金资助项目(81260315);广西自然科学基金项目(2012GXNSFAA053169);百色市科学研究与技术开发项目(百科计20160610,百科计20140931)①右江民族医学院附属医院 广西 百色 533000
通信作者:唐毓金
Clinical Significance of Detection of Cell Invasion Related IL-6 and IL-12 Serum Levels in Osteosarcoma Patients
LU Lu,LIAO Pin-hu,XIE Ke-gong,et al.//Medical Innovation of China,2016,13(20):001-004
【Abstract】Objective:To explore the difference of serum IL-6 and IL-12 levels between the patients with osteosarcoma and healthy individuals,as well as its clinical signifcance.Method:By ELISA,the concentration of serum IL-6 and IL-12 levels were measured in 160 patients with osteosarcoma(osteosarcoma group) and 250 healthy individuals (controls group).Differences between serum IL-6 and IL-12 levels were compared and analyzed its correlation.The relationship between serum IL-6 and IL-12 levels and the incidence and progression of osteosarcoma were investigated.Result:The levels of serum IL-6 was significantly higher in the osteosarcoma group than in the control group(P<0.01),the level of serum IL-12 was significantly lower in the case group than in the controls group (P<0.01).Serum IL-12 levels in stages Ⅲ-Ⅳ were lower than those in stages Ⅰ-Ⅱ of osteosarcoma (P<0.05).Patients with metastasis had higher IL-12 levels than those without metastasis (P<0.05).No associations were found between IL-6 and IL-12 levels(P>0.05).Conclusion:This study indicates that serum IL-6 and IL-12 levels abnormal expression in osteosarcoma patients. IL-6 and IL-12 may play the role of immunoregulation in the pathogenesis of osteosarcoma,the lower serum IL-12 levels may be associated with development and progression of osteosarcoma.
【Key words】Osteosarcoma; Interleukin-6; Interleukin-12

