异种源性脱细胞神经支架修复坐骨神经损伤后再生的可行性*
陈少红季婉青侯博
异种源性脱细胞神经支架修复坐骨神经损伤后再生的可行性*
陈少红①季婉青②侯博③
【摘要】目的:评价异种脱细胞神经支架修复大鼠坐骨神经损伤的疗效。方法:以兔源性胫神经为原材料,通过萃取技术制备脱细胞神经支架;HE染色、甲苯胺蓝染色、免疫组化(IHC)、扫描电镜(SEM)、透射电镜(TEM)检测技术评价脱细胞效果;体内实验部分采用坐骨神经离断模型,按照移植物的不同,将SD大鼠随机分为两组:异种神经支架移植组(实验组)、自体神经移植组(对照组),术后12周内,流式细胞术检测大鼠外周血中CD3+、CD4+、CD8+淋巴细胞含量,以判定机体免疫系统情况;通过神经功能测定及形态学手段评价10 mm缺损神经的修复效果。结果:支架内的细胞和髓鞘成分能够彻底去除,基底膜管状结构保留较为完整。术后1、4、12周时间点,实验组大鼠外周血CD3+、CD4+、CD8+淋巴细胞含量与对照组比较,差异均无统计学意义(P>0.05)。4周及12周后,两组坐骨神经功能指数(SFI)比较差异均无统计学意义(P>0.05);实验组移植物内的再生轴突数量、再生髓鞘厚度方面与对照组比较,差异均无统计学意义(P>0.05)。结论:异种神经脱细胞支架干预10 mm大鼠坐骨神经缺损,并不会引起机体系统性排斥反应,同时能够有效促进损伤神经再生。
【关键词】异种; 细胞外基质; 支架; 神经再生; 免疫排斥反应
First-author’s address:Clinic Department of the People’s Government of Guangdong Province,Guangzhou 510030,China
外周神经损伤后,自体神经移植是治疗的“金标准”[1],但因其来源匮乏,需要二次手术以及尺寸难以匹配等问题,极大地限制该种治疗的临床应用和推广[2]。因此探寻一种安全、有效且易获取的神经替代物就显得尤为重要。异种神经脱细胞支架来源于其他物种的细胞外基质,除了具有天然细胞基质的性质外,最大的优点是该类支架取材方便,支架的尺寸大小可任意选取[3]。但基于物种间的差异,该类材料的安全性及有效性仍需进一步探讨。本实验中,笔者利用兔的胫神经制取脱细胞神经支架,尝试修补大鼠10 mm坐骨神经缺损。术后12周内评估神经修复效果,以期寻找一种较为理想的神经修补材料。
1 材料与方法
1.1 材料 硫代甜菜碱10(SB-10),硫代甜菜碱16(SB-16),TritonX-200(均购自Sigma aldrich公司),过氧乙酸(Adamas-Beta),α-MEM(Gibco)、南美血清(Gibco),一抗:层粘连蛋白(LN)抗体(Rabbit anti-Laminin Sigma aldrich L9393;1∶800),纤维粘连蛋白(FN)抗体(Rabbit anti-Fibronectin Abcam ab23751;1∶500),神经丝蛋白-200(NF-200) 抗 体(Rabbit anti-neurofilament 200 Sigma aldrich N4142;1∶2000),anti-Rat CD3 PE(eBioscience 17-0030;1∶100),anti-Mou CD4 APC(invitrogen MR5105;1∶200),anti-Rat CD8a FITC(eBioscience 11-0084;1∶50),Alex flour 488 anti-rabbit(Jackson 711-545-152;1:1000),Alex flour 594 anti-rabbit (Jackson 111-585-003;1∶1500),Real Envision二抗检测试剂盒(上海基因公司);摇床(江苏金坛),离心机(上海飞鸽),光学显微镜(Nikon-eclipse 80i,日本),透射电镜(FEI TECNAI SPIRIT G2香港),扫描电镜(FEI QUANTA 200,香港),冰冻切片机(Leica M750),解剖显微镜(Leica),超薄切片机(Leica)。
1.2 实验动物及分组 本研究所涉及新西兰成年兔及SD大鼠均由中山大学实验动物中心提供[(使用许可证编号:SYXK(粤)2012-0083)],并由中山大学附属第三医院伦理委员会批准。健康新西兰成年兔3只,雌雄不限,体质量3~3.5 kg,用于获取制备脱细胞支架的原材料;健康成年SD大鼠30只,雌雄不限,体量250~280 g,利用完全随机分组法将动物分为实验组和对照组,每组15只。手术过程于中山大学附属第三医院神经外科颅底实验室完成。
1.3 方法
1.3.1 兔源性脱细胞神经支架的制备方案和检测方法 分离兔两侧胫神经,手术显微镜下剥离表面的脂肪组织和血管,游离神经组织。按照下列步骤制备神经支架:(1)去离子水中浸泡6 h,期间换液3次;(2)将神经浸入125 mmol/L SB-10中,室温震荡12 h(90 r/min),去离子水漂洗3 h(0.5 h换液1次);(3)0.14%TritonX 200和0.16 mmol/L SB-16混合溶液中室温振荡24 h,去离子水漂洗3 h(0.5 h换液1次);(4)重复1~3步骤;(5)经上述处理过的神经于体积分数0.1%的过氧乙酸消毒6 h,无菌蒸馏水充分漂洗后,置于无菌PBS中4 ℃冰箱内保存备用。
1.3.2 支架形态学检测 HE染色检测脱细胞效果;LN(1∶800)、FN(1∶500)免疫组化染色证实支架的成分和结构;甲苯胺蓝染色及透射电镜检测髓鞘去除程度;扫描支架观察支架内部结构;NF-200免疫染色显示轴突去除情况。
1.3.3 外周血淋巴细胞亚群分析 术前及术后1、4、12周,两组大鼠通过尾静脉分别收集外周血500 μL于抗凝管中。按照以下步骤进行流式检测:(1)新鲜抗凝血,按1∶10的比例向抗凝管中加入红细胞裂解液,轻轻吹打混匀,1100 r/min离心4 min后弃上清。继以Buffer溶液重悬。(2)按合适浓度加入抗体(CD3-PE;1∶50、CD4-APC;1∶200、CD8-FITC;1∶50),避光孵育30 min。(3)每样品管加入1.5~2 mL Buffer溶液,1100 r/min离心4 min后弃去上清。(4)每样品管加入300 μL Buffer溶液重悬,上机检测(BD FACS Calibur流式细胞仪)。1.3.4 造模方法 大鼠麻醉后(戊巴比妥钠;腹腔注射),暴露右侧坐骨神经,造成10 mm长的神经缺损。(1)实验组:在解剖显微镜下(25倍视野),利用8-0尼龙线将支架与宿主的神经外膜缝合。(2)对照组:相同解剖位置切取10 mm长的坐骨神经后,将其翻转后再吻合于原处,术后青霉素肌肉注射于手术切口周围,预防感染。所有动物均在标准条件下饲养。
1.4 术后神经再生评价 术后1、2、4、12周对各组动物进行坐骨神经功能指数(Sciatic nerve function index,SFI)评价:设计长约1 m暗箱通道,铺以记录纸张,予大鼠双侧后脚涂墨水,驱赶其穿过通道,行走后,记录纸上留有足印。每次取5~6对足印进行以下测量:足印长度(PLF)、足距宽度(TSF)、中间足趾宽度(ITF);SFI=-38.3 PLF+109.5 TSF+13.3 ITF-8.8。SFI为0代表功能正常,-100代表功能完全丧失。12周后将移植物取出后行以下处理:40 g/L多聚甲醛溶液固定、脱水、包埋、切片(5 μm),NF-200(1∶2000)免疫组化观察轴突生长情况;2.5 mL/L戊二醛前固定,10 mL/L锇酸后固定,下行脱水后环氧树脂包埋、聚合、半薄切片行甲苯胺蓝染或经醋酸铀-柠檬酸铅双染后行透射电镜检测,Imagine-pro plus 6.0软件分析再髓鞘化神经纤维的数量,髓鞘的厚度,轴突的直径大小。
1.5 统计学处理 采用SPSS 19.0统计学软件进行数据分析,计量资料以(±s)表示,比较行重复测量资料的方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 手术伤口观察 所有动物一般状况良好,手术侧肢体均有不同程度的趾甲萎缩,脚垫出现溃疡在实验组有2只,对照组有1只。术后12周,重新暴露手术区,移植物与周围组织均有轻度粘连,两组动物均未发现有移植物皱缩或崩解。
2.2 支架形态学检测 HE染色显示细胞核完全去除(图1A);甲苯胺蓝染色及透射电镜显示致密的髓鞘结构完全去除(图1B、D);超微结构有轻微的变形,基底膜保留较为完整(箭头所示);扫描电镜显示支架内部为多孔状立体通道结构(图1C);荧光免疫证实支架成分富含纤维粘连蛋白(图1E)及层粘连蛋白(图1F);与正常神经(图1G)相比,支架内部轴突神经丝蛋白(图1H)已经完全去除。
2.3 外周淋巴细胞亚群分析结果 淋巴细胞亚群分析结果显示,与术前相比,术后第1周,两组大鼠外周血内CD3+、CD4+淋巴细胞及CD4+/CD8+均有不同程度升高,差异均无统计学意义(P>0.05);术后第4周CD3+、CD4+淋巴细胞及CD4+/CD8+较之前有所下降;术后第12周,两组大鼠上述变量基本降至术前水平,比较差异均无统计学意义(P>0.05)。术后1、4、12周时间点,两组间大鼠外周血CD3、CD4+、CD8+淋巴细胞含量比较,差异均无统计学意义(P>0.05)。见表1~4。


图1 异种来源的神经支架形态学检测
表1 两组术前外周淋巴细胞亚群分析(±s)

表1 两组术前外周淋巴细胞亚群分析(±s)
组别 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+实验组(n=15)72.55±3.11 56.42±4.23 42.01±3.19 1.54±0.27对照组(n=15)69.47±4.78 55.34±3.38 40.84±4.55 1.49±0.14 F值 0.68 1.33 0.21 11.46 P值 0.78 0.56 0.34 0.71
表2 两组术后1周外周淋巴细胞亚群分析(±s)

表2 两组术后1周外周淋巴细胞亚群分析(±s)
组别 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+实验组(n=15)79.32±4.12 61.42±6.13 35.75±3.19 2.14±0.41对照组(n=15)76.34±6.47 59.71±4.21 32.55±3.28 1.99±0.32 F值 0.77 0.91 1.56 7.32 P值 0.19 0.27 0.73 0.44
表3 两组术后4周外周淋巴细胞亚群分析(±s)

表3 两组术后4周外周淋巴细胞亚群分析(±s)
组别 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+实验组(n=15)73.33±2.23 55.41±3.73 40.13±5.56 1.63±0.23对照组(n=15)74.57±4.55 53.34±6.22 42.27±3.98 1.53±0.39 F值 0.79 1.49 1.21 9.88 P值 0.69 0.81 0.18 0.38
表4 两组术后12周外周淋巴细胞亚群分析(±s)

表4 两组术后12周外周淋巴细胞亚群分析(±s)
组别 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+实验组(n=15)69.19±5.67 57.45±5.61 39.01±3.19 1.48±0.38对照组(n=15)67.77±2.84 53.57±6.11 41.73±3.36 1.55±0.22 F值 1.67 0.56 0.33 5.21 P值 0.30 0.47 0.55 0.18
2.4 功能评价 12周恢复期内,两组大鼠均有不同程度的功能恢复。术后第1周,各组SFI值均在-98左右,2周后两组均有不同程度升高;4周及12周后,实验组SFI分别为(-90.6±2.8)、(-82.6±1.4),对照组分别为(-87.7±3.5)、(-77.8±1.5),两组4周及12周SFI值比较差异均无统计学意义(P>0.05)。见图2。
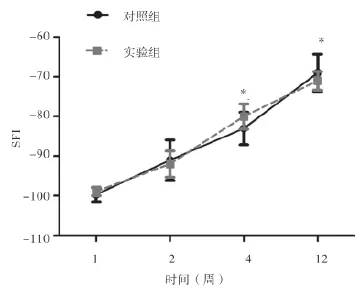
图2 术后12周内两组SFI评价
2.5 轴突及髓鞘再生评价 术后12周,重新暴露手术区,移植物与周围组织均有轻度粘连(图3A);实验组移植物内有NF-200阳性轴突通过(图3B),轴突呈现极性排列,与支架纵行丝状结构伴行,与远端神经内轴突形成联系,但离远端缝线1.5 cm处远处,轴突数量变少,直径变细(图3C)。甲苯胺蓝染色及TEM评价(图4):实验组移植物内 再生轴突数量(图4C、D、E)每一个高倍镜视野(1000倍)下为(80±7)个,但与对照组(80±5)个(图4A、B、E)比较差异均无统计学意义(P>0.05);移植物内再生髓鞘厚度方面(图4F),实验组为(0.53±0.12)μm,与对照组(0.52±0.08)μm比较,差异无统计学意义(P>0.05)。

图3 NF-200荧光染色显示实验组轴突再生情况(术后12周内)

图4 术后12周甲苯胺蓝及投射电镜下观察大鼠移植物内轴突再生情况
3 讨论
近年来,组织工程技术在神经修复领域的应用越来越广泛,脱细胞神经支架的研究也逐步走向临床阶段,虽然其促进神经修复的效果受到诸多学者的认可,但是来源匮乏直接影响其日后在临床上的应用[4-5]。同种异体神经支架一般来源于截肢的肢体或者尸体,和自体移植相比有诸多优势,但是由于某些社会习俗和宗教因素的影响,原材料的获取受到很大限制,因此需要寻找一种更加方便、有效的神经替代物。
去细胞支架来源于天然外周神经组织,经过处理,去除大部分抗原成分比如细胞和髓鞘成分,而保留完整的细胞外基质结构(ECM),研究表明ECM能够为增殖的雪旺氏细胞(SC)提供黏附和导向支持,这对后续形成bunger带至关重要,同时也为轴突再生铺平道路[6-9];另一方面研究认为ECM富含很多蛋白,像胶原蛋白(CollagenⅠ及Ⅳ型),纤维粘连蛋白(Fibronectin,FN),层粘连蛋白(Laminin,LN)等。这些成分通过影响轴突的再生速度和方向来左右神经再生的效果[10-11]。通过处理及后期检测,笔者制备的去细胞神经支架细胞及髓鞘成分完全去除,基底膜结构保存完整,富含LN、FN成分。
对异种移植物的应用最大的忧虑就是其生物安全性。理论上来说,利用萃取方法可以完全去除抗原成分,但实际上操作起来异常困难。有实验表明通过常见的萃取技术制备的去细胞支架依然可以检测到300 bp残余的DNA[12-13],但此残余量理论上不足以导致严重的排斥反应,有学者发现,实际DNA残余量远低于上述水平[14]。另外有观点认为在哺乳动物各物种间,ECM氨基酸的组成顺序具有高度一致性[15-16],这也是异种ECM不会引发排斥反应的重要原因之一;ECM成分所诱导的宿主淋巴细胞反应通过Th1和Th2这两种途径,前者和促炎因子有关,介导组织免疫排斥;后者抑制炎症的产生,介导免疫耐受。有实验证明异种细胞外基质成分所涉及到的反应仅限于Th2途径[17]。这些理论是异种脱细胞支架体内应用的强有力支持。在未给予免疫抑制剂的情况下,本实验中所有动物均没有发现全身性免疫排斥反应。虽然移植术后1周时,实验组动物外周血CD4/CD8比例有所提高,但考虑为手术切口局部炎症反应造成。动态分析在第4周和12周,该比例逐渐下降至术前水平。这些变化同时发生在对照组中,两组结果比较差异并无统计学意义(P>0.05),这证实兔源性异种神经支架移植到体内并未干扰大鼠机体的免疫系统。
目前外周神经支架有多种商业化产品,大部分为人工合成材料(PLGA,壳聚糖等)构成。因缺乏生物活性,修复效果欠佳;形状及尺寸较单一,很难保证个体化匹配[18],临床应用价值还有待提高。脱细胞神经支架可能能够解决上述顾虑,但该类支架临床应用较少,纵然近年来很多数据证实其临床应用的价值[19-20],但原材料的来源依然是个不容忽视的问题,因此异种脱细胞神经支架的价值就显得更为突出。在本实验中,笔者使用兔来源的神经支架修复大鼠坐骨神经缺损,取得较为理想的效果,这证实异种支架具有良好生物安全性及作用有效性。极有可能将来广泛应用到临床。虽然其他物种间未测试,但是本研究结果为异种脱细胞材料的临床应用提供实验参考。
综上所述,本研究认为,兔源性脱细胞神经支架修复大鼠10 mm长的神经缺损,能够达到自体移植修复水平,同时并未引起明显的全身性排斥反应,表明具有较为安全的生物学特性,为异种脱细胞神经移植物将来应用到临床提供实验依据。
参考文献
[1] Piccoli M,Urbani L,Alvarezfallas M E,et al.Improvement of diaphragmatic performance through orthotopic application of decellularized extracellular matrix patch[J].Biomaterials,2015,74(4):245-255.
[2] Gu X,Ding F,Yang Y,et al.Construction of tissue engineered nerve grafts and their application in peripheral nerve regeneration[J].Prog Neurobiol,2011,93(2):204-230.
[3] Badylak S F.Xenogeneic extracellular matrix as a scaffold for tissue reconstruction[J].Transpl Immunol,2004,12(3-4):367-377.
[4] Gilbert T W,Sellaro T L,Badylak S F.Decellularization of tissues and organs[J].Biomaterials,2006,27(19):3675-3683.
[5] Zhu S,Liu J,Zheng C,et al.Analysis of human acellular nerve allograft reconstruction of 64 injured nerves in the hand and upper extremity:a 3 years follow-up study[J].J Tissue Eng Regen Med,2016,21(4)2130.
[6] Navarro X,Vivo M,Valero-Cabre A.Neural plasticity after peripheral nerve injury and regeneration[J].Prog Neurobiol, 2007,82(4):163-201.
[7] Hoben G,Yan Y,Iyer N, et al.Comparison of acellular nerve allograft modification with Schwann cells or VEGF[J].Hand (N Y),2015,10(3):396-402.
[8] Luckenbill-Edds L.Laminin and the mechanism of neuronal outgrowth[J].Brain Res Brain Res Rev,1997,23(1-2):1-27.
[9] Gilbert T W,Freund J M,Badylak S F.Quantification of DNA in biologic scaffold materials[J].J Surg Res,2009,152(1):135-139.
[10] 侯博,李文胜,秦峰,等.改良萃取法制备脱细胞神经支架的去髓鞘效果评价[J].中山大学学报(医学科学版),2012,33(3):322-325.
[11] Allman A J,Mcpherson T B,Badylak S F,et al.Xenogeneic extracellular matrix grafts elicit a TH2-restricted immune response[J].Transplantation,2001,71(11):1631-1640.
[12] Isaacs J,Browne T.Overcoming short gaps in peripheral nerve repair:conduits and human acellular nerve allograft[J].Hand (N Y),2014,9(2):131-137.
[13] Junka R,Yu X.Novel acellular scaffold made from decellularized schwann cell sheets for peripheral nerve regeneration[J].Regen Eng Transl Med,2015,1(1):22-31.
[14] Hu M,Xiao H,Niu Y, et al.Long-term follow-up of the repair of the multiple-branch facial nerve defect using acellular nerve allograft[J].J Oral Maxillofac Surg,2016,74(1):211-218.
[15] Boecker A H,van Neerven S G,Scheffel J,et al.Predifferentiation of mesenchymal stromal cells in combination with a microstructured nerve guide supports peripheral nerve regeneration in the rat sciatic nerve model[J].Eur J Neurosci,2016,43(3):404-416.
[16] Grochmal J,Midha R.Recent advances in stem cell-mediated peripheral nerve repair[J].Cells Tissues Organs,2014,200 (1):13-22.
[17] Hsu S H,Chan S H, Chiang C M,et al.Peripheral nerve regeneration using a microporous polylactic acid asymmetric conduit in a rabbit long-gap sciatic nerve transection model[J].Biomaterials,2011,32(15):3764-3775.
[18] Zhe Z,Jun D,Yang Z,et al.Bladder acellular matrix grafts seeded with adipose-derived stem cells and incubated intraperitoneally promote the regeneration of bladder smooth muscle and nerve in a rat model of bladder augmentation[J].Stem Cells Dev,2016,25(5):405-414.
[19] Zhang Y,Zhang H,Katiella K,et al.Chemically extracted acellular allogeneic nerve graft combined with ciliary neurotrophic factor promotes sciatic nerve repair[J].Neural Regen Res,2014,9(14):1358-1364.
[20] Junka R,Yu X.Novel Acellular scaffold made from decellularized schwann cell sheets for peripheral nerve regeneration[J].Regen Eng Transl Med,2015,1(1):22-31.
①广东省人民政府机关门诊部 广东 广州 510030
②广州市妇女儿童医疗中心
③中山大学附属第三医院
doi:10.3969/j.issn.1674-4985.2016.20.007
收稿日期:(2016-06-01) (本文编辑:蔡元元)
*基金项目:广东省自然科学基金(2014A030313189,2014A030310408);广东省科技计划项目(2014A020211013,2015A020212016,2016A020214007)
通信作者:侯博
The Feasibility of Xenogeneic Acellular Nerve Scaffold to Repair Rat Sciatic Nerve Defect Regeneration/CHEN Shao-hong,JI Wan-qing,HOU Bo.//Medical Innovation of China,2016,13 (20):027-032
【Abstract】Objective:To evaluate remodeling effect of xenogeneic acellular nerve scaffold in a rat sciatic nerve defect model.Method:Scaffolds derived from rabbit tibial nerves were processed by extractive method,and results were monitored by HE,toluidine blue,immunohistochemistry, SEM,TEM.SD rats were randomly divided into two groups:xenogeneic acellular nerve scaffold group(experimental group) and autograft (control group)group.During 12 weeks postoperatively,the amount of CD3+,CD4+,CD8+in blood were measured to evaluate the systematic immunologic function.Regenerative results were determined by SFI test,and histological examination.Result:Cell component and myelin sheath were completely removed and intact basal lumina tubes were persistent.During observation,all animals had no sign of immunological rejection systematically,grafts bridged well without any disintegration.In the experimental group,the amount of CD3+,CD4+,CD8+in blood were not different with the control groups at 1,4,12 weeks postoperatively(P>0.05).Statistical analysis revealed that experimental group had no statistically significant differences between the experimental group and control group on aspect of SFI at 4,12 weeks(P>0.05).There had no statistically significant differences between the experimental group and control group on axon number and myelin sheath depth(P>0.05).Conclusion:Xenogeneic acellular nerve scaffold may be a promising approach in repairing peripheral nerve defect.
【Key words】Xenogeneic; Extracellular matrix; Scaffold; Nerve regeneration; Immunological rejection

