深绿木霉T2发酵液蛋白分离物诱导抗病作用研究
梁巧兰,韩 亮,周其宇
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
深绿木霉T2发酵液蛋白分离物诱导抗病作用研究
梁巧兰,韩亮,周其宇
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
采用生长速率法和产孢量测定法,研究了不同培养基和温度、pH、接菌量、培养基量对深绿木霉T2生长和产孢量的影响。结果表明,PDA培养基有利于深绿木霉T2的生长;深绿木霉T2发酵产孢最优条件为温度25℃、pH 7、接菌量为0.05 mL/L、培养基量为100 mL/250 mL,此条件下发酵72 h时产孢量最大,为1.5×109个/mL;76 h时产孢量下降;发酵液通过盐析及凝胶层析获得具有3个洗脱峰的蛋白质液,分别为Ⅰ,Ⅱ和Ⅲ;采用生长速率法和诱导活体接种法分别测定不同浓度的3个洗脱液对百合灰霉菌的抑菌率及其诱导抗病效果,结果表明洗脱峰Ⅰ蛋白质的100倍液对百合灰霉菌的抑菌率最小,仅为1.16%,而其诱导抗病效果最好,为84.77%。
深绿木霉T2菌株;发酵条件优化;蛋白质分离物;诱导抗病作用;百合灰霉菌
木霉属(Trichodermaspp.)真菌属半知菌亚门、丝孢纲、丝孢目的粘孢菌类,是一类普遍存在的真菌,常见于土壤中,是土壤微生物的重要组分之一,也见于植物残体及动物粪便中,经常可以从植物根围、叶围及种子、球茎表面分离到。目前发现的木霉菌有30多种,其中,有许多具有生防潜力,如哈茨木霉(T.harzianum)、绿木酶(T.virid)、康氏木霉(T.koningii)、钩木霉(T.hamatum)和长枝木霉(T.longibrachiatum)等[1]。据资料统计,木霉菌至少对18 属29 种植物病原真菌具有拮抗作用,由于其具有广谱性、适应性强等特点而被广泛应用于农业的各个方面。目前对木霉生防机制研究较为深入,但大多集中在微生物之间的相互作用,而忽略了寄主植物种类的选择。近年研究发现,有些木霉菌株可定殖于植物根部成为植物的共生体,或通过木霉发酵液处理植物根部,不仅可以促进植物的生长而且还可诱导植物的抗病性[2-6],这是因为木霉菌能够分泌抗生素类及酶类物质[7]。而有关深绿木霉T2发酵液对植物诱导抗病作用的研究报道很少。为此,试验从培养基、培养条件两方面对深绿木霉T2菌株发酵条件进行优化,对优化条件下深绿木霉T2菌株发酵液中的蛋白质进行了分离提取,并测定了不同浓度蛋白质对百合灰霉菌的抑制作用及诱导抗病效果,旨在为进一步探讨深绿木霉T2代谢产物对百合灰霉菌的诱导抗病机理,为开发深绿木霉新型生物农药提供理论依据。
1 材料和方法
1.1发酵培养基筛选
试验材料为甘肃农业大学实验室保存的深绿木霉T2、百合灰霉菌,种植于实验室中的百合幼苗。
分别以玉米粉、麦麸、燕麦片、葡萄糖、果糖、麦芽糖、蔗糖为碳源,按下列组合制成不同培养基。接种在PDA上培养3 d的T2菌饼上,用十字交叉法测量菌落直径,并用直径5 mm的打孔器打制菌饼9枚置于10 mL灭菌水中振荡配制孢子悬浮液,用血球计数板镜检产孢量,筛选出深绿木霉T2最佳发酵培养基[8]。
PDA培养基:马铃薯200 g,葡萄糖20 g,酵母粉为5 g,琼脂17 g,用自来水定容至1 000 mL;玉米粉培养基:玉米粉+不同碳源(葡萄糖、果糖、麦芽糖、蔗糖)+酵母粉+琼脂,不同碳源20 g;麦麸培养基:麦麸+不同碳源(葡萄糖、果糖、麦芽糖、蔗糖)+酵母粉+琼脂,不同碳源20 g;燕麦培养基:燕麦片+不同碳源(葡萄糖、果糖、麦芽糖、蔗糖)+酵母粉+琼脂,不同碳源20 g;其中,后3种培养基其他成分同PD。
1.2不同发酵条件对深绿木霉产孢的影响
不同温度对深绿木霉产孢的影响:向装有100 mL灭菌PDB培养液(马铃薯200 g,葡萄糖20 g,酵母粉5 g,自来水定容至1 000 mL)的250 mL三角瓶中接种1 mL T2孢子悬浮液(1×105个/mL),分别置于10、20、25、30℃条件下振荡培养(150 r/min),每处理重复3次。
不同pH对产孢的影响:将灭菌PDB培养液用1 mol/L NaOH或l mol/L HCl溶液调节pH分别为5、6、7、8、9然后分装于灭菌的250 mL三角瓶中,每瓶接种1 mL孢子悬浮液(1×105个/mL),于25℃条件下振荡培养(150 r/min),每次处理重复3次,于72 h后取上清液1 mL加入9 mL无菌水。
不同量培养基对产孢的影响:250 mL三角瓶中分别装入50、100、150、180 mL灭菌的PDB培养液,每瓶接种1 mL孢子悬浮液(1×105个/mL)。置于最适温度条件下振荡培养(150 r/min),每个处理重复3次。
接种量对产孢的影响:将灭菌的PDB培养液调节至最适pH,将最适量培养基装入250 mL三角瓶中,接种量分别设为0.05、0.50、1.00、1.50 mL孢子悬浮液(1×105个/mL)。于25℃下振荡培养(150 r/min),每个处理重复3次。
分别于72 h后取上述各处理的上清液1 mL加入9 mL无菌水,用血球计数板镜检产孢量[8]。
1.3木霉发酵液的制备及发酵液中蛋白质分离提取
试验在BIOF生物发酵罐中进行,发酵规格10 L,发酵液为PDB(马铃薯200 g/L、葡萄糖20 g/L、酵母粉5 g/L),酵母粉在发酵液中起生长因子的作用[9]。接菌液为深绿木霉T2孢子悬浮液1 mL接种于装有100 mL培养液的250 mL三角瓶中,置于25℃摇床(150 r/min),培养2 d,即为种子液。发酵条件按筛选的最佳条件设置,发酵开始后,每4 h取样1次,用血球计数板镜检产孢量,确定产孢量最大的时间及放罐时间;当产孢量达到最大时停止发酵,待发酵罐冷却后放罐,发酵液在4℃下5 000 r/min 离心10 min,取上清液,滤纸过滤,将一些悬浮的孢子和其他的杂质去除[10];4℃条件下采用硫酸铵盐析,硫酸铵过饱和后静置20 min,在4℃下5 000 rpm离心30 min。弃去上清液,以小量PBS溶解沉淀,装于透析袋中,以三蒸水作为透析缓冲液,4℃下透析除去残留的硫酸铵,每30 min更换1次透析液,采用纳氏试剂检验是否有NH4+残留,直至除去全部NH4+,获得深绿木霉T2发酵液粗蛋白,备用。
以Tris-HCl缓冲液120 mL(pH 8.0,Tris-HCl 0.02 mol/L,NaCl 0.09 mol/L) 溶胀约3.7 g Sephadex G-100凝胶,装入层析柱(40×1 cm ) ,连接Tris-HCl洗脱缓冲液层析柱与收集装置,以0.2 mg/mL VB12为标准作检测层析,如果VB12的黄色条带水平整齐的下行,则可使用此层析柱;否则应倾出凝胶再次装填层析柱,直到检测层析结果符合上述要求[11]。
取3 g深绿木霉T2发酵液粗蛋白,溶于2 mL洗脱缓冲液中,上样前在4℃条件下,3 000 r/min离心5 min,除去干扰层析的不溶物,以1 mL蛋白溶液上样,流速6滴/min,2 mL/管,收集蛋白溶液并用紫外分光光度计测定D595nm值(每管取50 μL样品,加入考马斯亮蓝G-250 200 μL,混匀,5 min内测定D595nm),并绘制洗脱曲线,对D595nm相近的样品进行合并,获得深绿木霉T2发酵液蛋白质分离物,分别用于对百合灰霉菌抑菌作用和诱导百合抗灰霉菌作用效果测定。
1.4分离蛋白质对百合诱导抗病作用
1.4.1不同浓度分离蛋白质对百合灰霉菌抑制作用测定分别量取PDA培养基45、49.5、49.9、49.95 mL置于三角瓶中,经灭菌后冷却到45℃,在无菌条件下分别加入分离蛋白质5、0.5、0.1、0.05 mL,混合均匀,制成PDA平板,使分离蛋白质的终浓度分别为10、100、500、1 000倍液,然后,将培养4 d的百合灰霉菌菌饼(Ф=0.5 cm)接种于PDA平板上,放置于25℃恒温恒湿培养箱中培养4 d后,用十字交叉法测量灰霉菌落直径大小,按公式计算分离蛋白质对灰霉菌的抑菌率[12]。
1.4.2分离蛋白质对百合灰霉病诱导抗病作用测定

用不同分离相的蛋白质(10、100、500、1 000倍液),喷雾处理健康的百合幼苗,48 h后用1×106个/mL的灰霉菌孢子悬浮液进行喷雾接种,以喷灭菌水为对照,每处理10株,重复3次,15 d后根据以下分级标准,观察记录发病情况,并用公式计算病情指数及诱导抗病效果[12-13]。
病害分级标准:0 级—叶片无病斑;1 级—病斑面积占整个叶面积1%以下;2 级—病斑面积占整个叶面积的2%~5%;3 级—病斑面积占整个叶面积6%~20%;4 级—病斑面积占整个叶面积的21%~40%;5级—病斑面积占整个叶面积的40%以上。

诱导抗病效果(%)=
1.5数据分析
采用DPS 3.0软件对所测数据统计分析,用平均
值表示测定结果,采用Excel 2010制表。
2 结果与分析
2.1培养基筛选
通过培养基筛选试验,发现以葡萄糖为糖源时深绿木霉T2在马铃薯、玉米粉、麦麸、燕麦4种培养基上生长速度明显快于以果糖、蔗糖、麦芽糖作为糖源的4种培养基,且菌落直径之间存在显著差异;在同一糖源不同培养基上以马铃薯葡萄糖培养基、玉米果糖培养基、麦麸果糖培养基、马铃薯麦芽糖培养基、燕麦麦芽糖培养基更有利于T2的生长较好,方差分析表明,96 h时以上培养基培养的T2菌落直径与其他培养基培养的菌落直径之间存在显著差异;以马铃薯、果糖为糖源时马铃薯培养基和其他3种培养基的产孢量之间存在显著差异,且高于其他糖源不同培养基的产孢量(表1)。
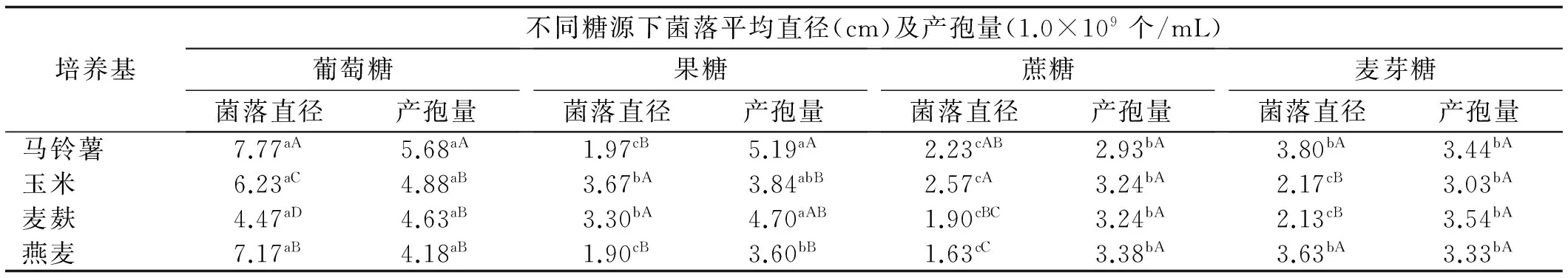
表1 不同培养基下深绿木霉T2的生长及产孢量
注:小、大写字母分别表示0.05水平上同一培养基不同糖源、不同培养基同一糖源菌落直径及产孢量的差异显著性
2.2不同条件对深绿木霉T2产孢的影响
2.2.1温度对深绿木霉T2产孢量的影响温度对深绿木霉T2产孢量有一定影响,其中,25℃条件下产孢量最大,为5.75×109个/mL,30℃条件下产孢量最低,为3.54×109个/mL,而15,20℃条件下的产孢量介于二者之间(图1)。
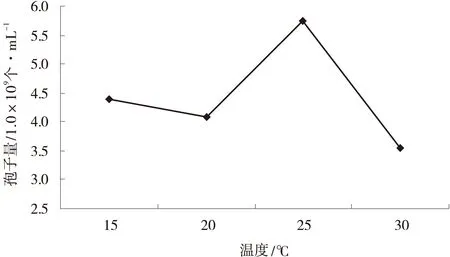
图1 不同温度下T2的产孢量Fig.1 Effects of different temperatures on T2 sporulation
2.2.2pH对深绿木霉T2产孢量的影响pH为7时有利于深绿木霉T2孢子的产生,产孢量最大,为5.97×109个/mL,pH为8时产孢量次之,为4.94×109个/mL,而pH为9时的产孢量最低,为2.89×109个/mL,pH为5、6时的产孢量均大于4.0×109个/mL(图2)。
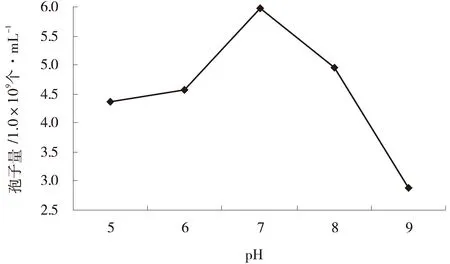
图2 pH值下T2的产孢量Fig.2 Effects of pH values on T2 sporulation
2.2.3不同量培养基对产孢量影响在250 mL三角瓶中随着培养基量的增多,深绿木霉T2产孢量逐渐增加,当培养基量为100 mL/250 mL时,产孢量最大,为6.34×109个/mL;但是,当培养基量增加到180 mL/250 mL时,产孢量下降为3.06×109个/mL(图3)。
2.2.4接种量对产孢的影响随着接种量的增大,产孢量逐渐降低,当接种量为T2孢子悬浮液0.05 mL(1×105个/mL)时,产孢量最大,为5.00×109个/mL,接种量为1.50 mL时产孢量最小,为3.54×109个/mL(图4)。
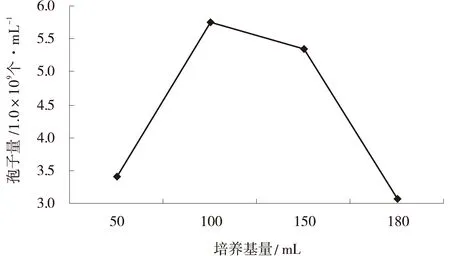
图3 不同量培养基下T2的产孢量Fig.3 Effects of different content medium on T2 sporulation
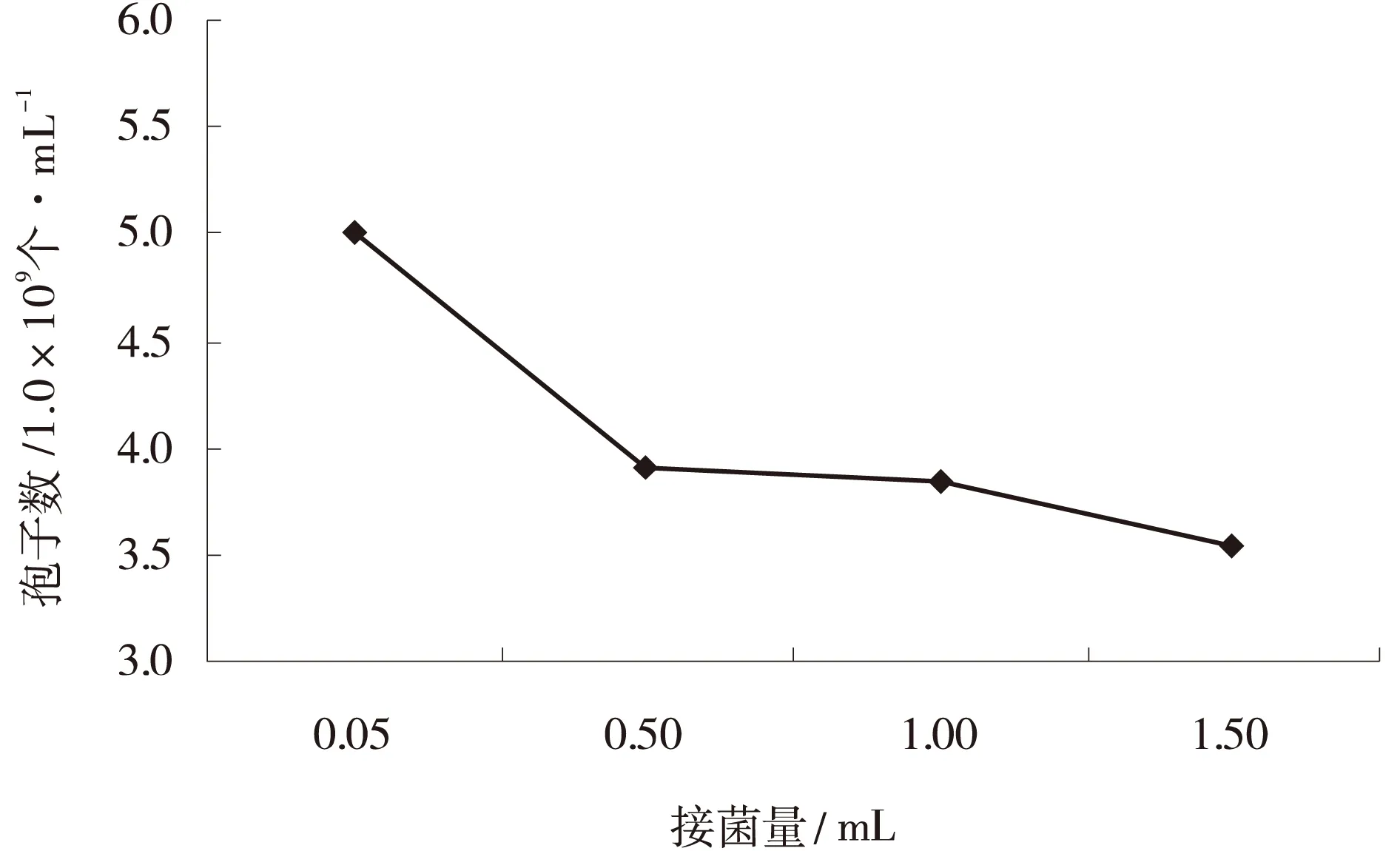
图4 不同接菌量下T2的产孢量Fig.4 Effects of fifferent inoculation on T2 sporulation
2.3木霉发酵液的制备及蛋白质的分离提取
发酵条件根据2.2中筛选的参数设置,在BIOF生物发酵罐中发酵,每4 h取样检测发现,72 h时产孢量最大,为1.5×109个/mL,76 h产孢量逐渐下降(图5)。
通过对深绿木霉发酵液中蛋白质的分离提取,获得的蛋白质在波长为595 nm时,D值出现了3个吸收峰(图6),将D值接近的蛋白质合并,获得了3组蛋白质。
2.4分离蛋白质对百合诱导抗病作用
通过3组分离蛋白质对百合灰霉菌抑菌率测定,结果表明第1组蛋白质10倍液的抑菌率最大,为32.93%, 100倍液抑制率较低,仅为1.16%,而500和1 000倍液均没有抑制作用(表2);诱导抗病作用测定,发现分离蛋白质100倍液对百合抗灰霉病的诱导效果最好,为84.77%,且与其他处理的诱导抗病效果之间存在极显著差异(表3)。
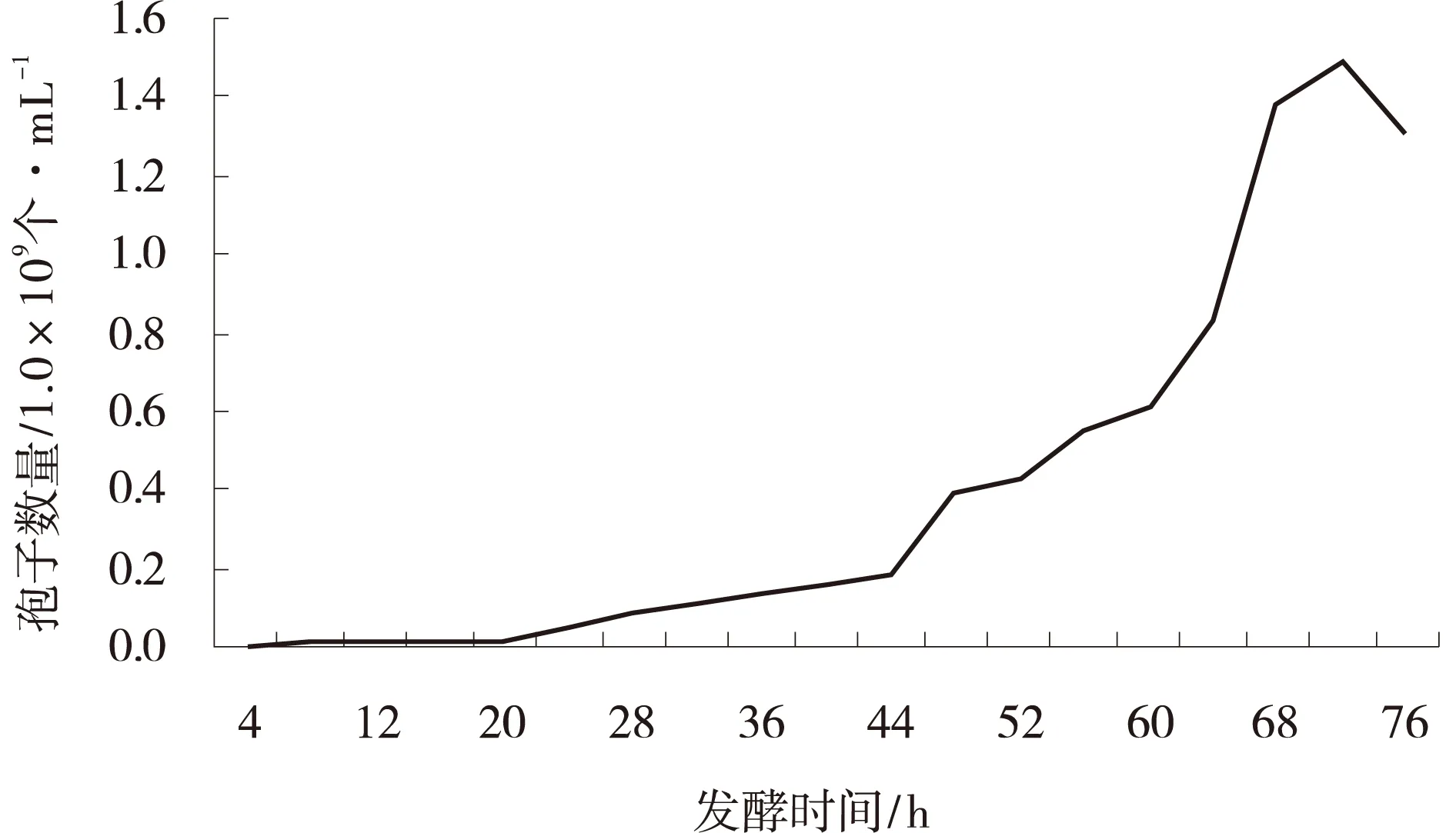
图5 深绿木霉T2发酵不同时间产孢量Fig.5 Sporulation of Trichoderma atroviride T2 in the fermentation process difference times
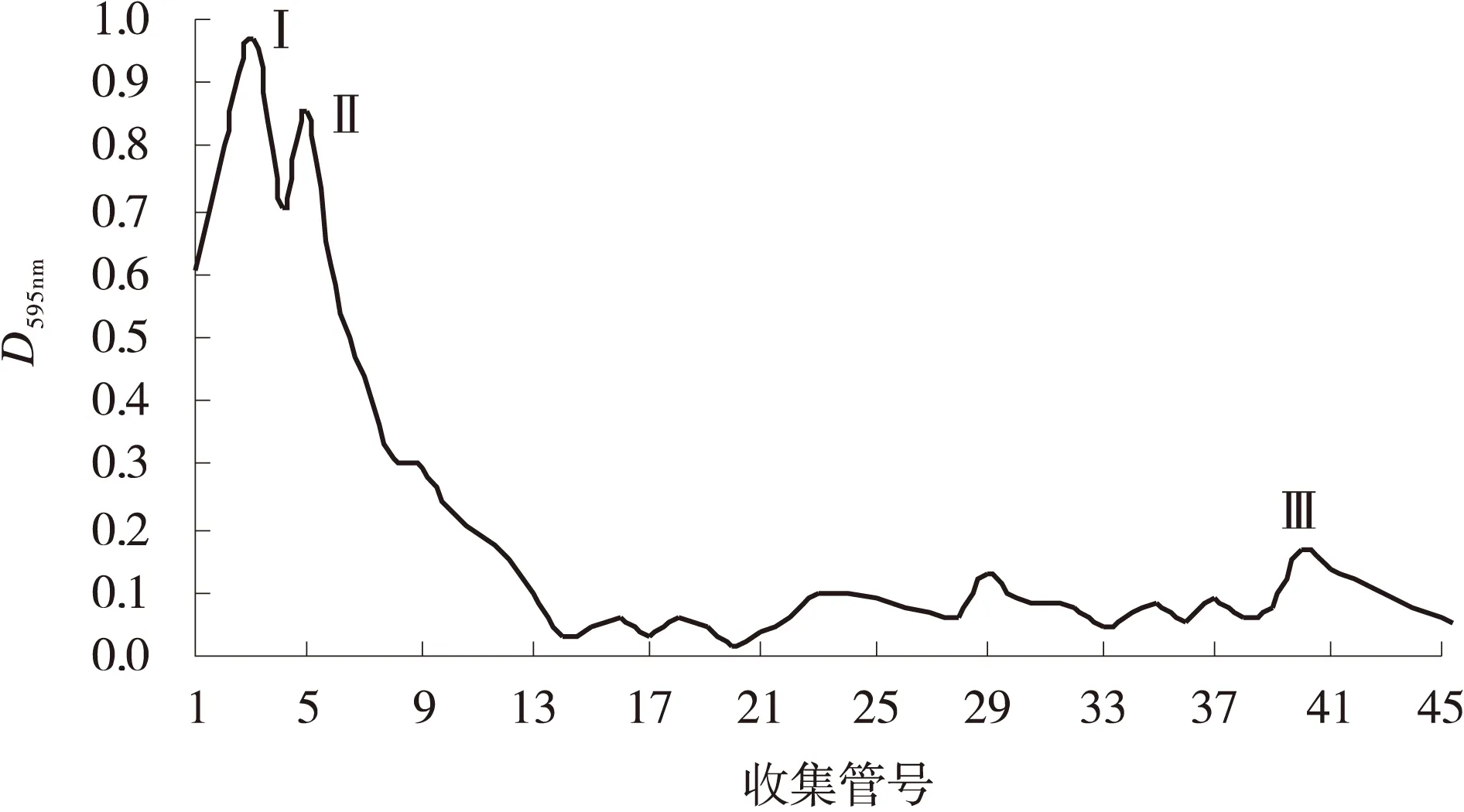
图6 从深绿木霉T2发酵液中分离提取的蛋白质洗脱曲线Fig.6 Elution profile of protein from Trichoderma atroviride T2 fermentation liquid deparation
3 讨论
发酵条件优化试验发现,深绿木霉T2最佳培养基为马铃薯葡萄糖酵母粉培养液,最适培养条件为温度25℃、pH为7、接菌量为0.05 mL/150 mL培养基、培养基量为100 mL/250 mL(培养基/三角瓶容积);利用该优化条件对深绿木霉T2发酵培养后,从发酵液中分离获得了3组吸收峰不同的蛋白质,测定了不同浓度分离蛋白质对百合灰霉菌的抑菌率及其诱导抗病效果,结果表明洗脱峰Ⅰ蛋白质100倍液对百合灰霉菌的抑菌率最小,仅为1.16%,而其诱导抗病效果最好,为84.77%。
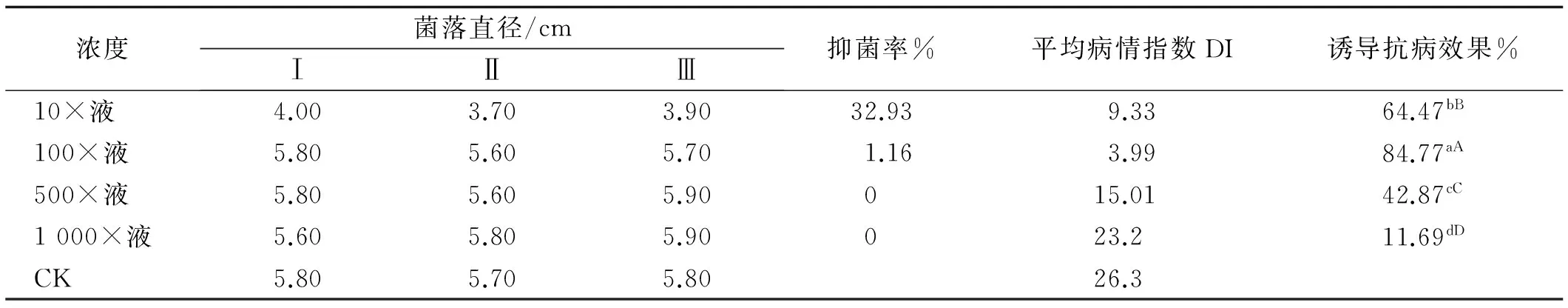
表2 分离蛋白质对百合灰霉菌抑菌率(4 d)和诱导抗病效果(15 d)
注:不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)
研究认为木霉菌生长最好的碳源为葡萄糖、果糖、甘露糖、半乳糖、木糖、海藻糖和纤维二糖[14];蛋白胨即可作为碳源又可作为氮源;在液体发酵培养基中应用糖蜜-酵母粉培养基模拟工业化生产条件研究木霉在20 L发酵罐中的生长情况,发现采用这种培养基可以获得比较理想的结果,孢子含量可达109个/g干重[15]。以棉籽粉或玉米浆代替啤酒酵母也可以产生理想的效果;Jackson[16]研究发现,在葡萄糖-丙氨酸基础培养基上产生的菌丝干重比在糖蜜-酵母培养基上产生的高。Lew is[17]研究发现,糖蜜-玉米浆培养基在支持木霉的生长与产孢方面优于蔗糖-硝酸培养基和葡萄糖-酒石酸培养基。国内有研究者应用虫草头孢废液,添加几种中草药(青蒿、黄芩、贯众和板兰根)作为培养基,接种哈茨木霉(T.harzianum)的分生孢子进行培养,可获得1.67×108个孢子/皿[18-22];另外矿质元素、维生素、温度、pH、光照等对木霉菌的生长也有一定的影响;而此次试验仅以玉米粉、麦麸、燕麦片、葡萄糖、果糖、麦芽糖、蔗糖为碳源,以酵母粉为氮源,对深绿木霉T2在16种组合培养基上的生长情况进行了测定,并以筛选出的生长速度快产孢量最大的马铃薯+葡萄糖+酵母粉培养基作为液体发酵培养基,从温度、pH、接菌量、培养基量4个方面对T2发酵条件进行了优化,对其他方面还有待于进一步探讨。
植物诱导抗病性被认为是植物保护技术的新途径[13]。真菌蛋白激发子对植物的诱导抗性研究是近年来国际上植物病理学研究的热点之一[23-24]。近年来研究发现,木霉菌除了直接或间接地抑制病原菌外,还能够促进种子萌发[25]、诱导作物产生系统抗病性,绿木霉、棘胞木霉、深绿木霉、哈茨木霉等均可诱导植物获得对广谱性致病真菌、细菌、病毒等微生物的局部或系统抗性。但是,有关从木霉菌中分离纯化激发子及其对食用百合的诱导抗病作用研究国内尚属空白,国外仅有从绿木霉中得到的多肽或蛋白质激发子如Sm1、类抗菌肽和哈慈木霉T22分泌的与番茄叶霉菌Avr4和Avr9同源的蛋白质激发子等几例报道[26-30]。其诱导抗病机理之一就是木霉产生了能够诱导植物产生抗病性的激发子,如有酶活性或其他功能的蛋白质、类抗菌肽、Avr同源体、低聚糖或低分子量化合物。许多木霉能产生木聚糖酶诱导植物乙烯的合成,从而激发植物的防御反应[26]。哈慈木霉分离物Th8,Th1和TH10处理红辣椒后葡聚糖酶活性增强[27];木霉产生的细胞壁降解酶(如几丁质酶、葡聚糖酶、蛋白酶等)能够降解病原真菌细胞壁,并释放出低分子量化合物,诱导植物防御相关酶的合成[28];而有关来源于深绿木霉T2发酵液的、能够诱导百合抗灰霉病的蛋白质分离物究竟为何种物质的问题还需要进一步研究。
[1]杨合同.木霉分类与鉴定[M].北京:中国大地出版社,2009.
[2]Yohei Yoshioka,Haruki Ichikawa,Hushna Ara Naznin,etal.Systemic resistance induced in Arabidopsis thaliana by Trichoderma asperellum SKT-1,amicrobial pesticide of seedborne diseases of rice[J].Pest Manag Sci,2012,68:60-66.
[3]胡琼.木霉对植物促生作用的研究进展[J].北方园艺,2010(7):197-200
[4]赵蕾,滕安娜.木霉对植物的促生及诱导抗性研究进展[J].植物保护,2010,36( 3):43-46
[5]Harman G E,Petzoldt R,Comis A,etal.Interactions between Trichoderma harzianum strain T22 and maize inbred line Mo17 and effects of this interaction on diseases caused by Pythium ultimum and Colletotrichum graminicola[J].Phytopathology,2004,94:147-153.
[6]Harman G,Howell C R,Viterbo A,etal.Trichoderma species opportunistic,avirulent plant symbionts[J].Nature,2004(2):3-56.
[7]杨合同,唐文华.木霉菌与植物病害的生物防治[J].山东科学,1999,12(4):7-14.
[8]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[9]庄敬华,高增贵,刘限,等.不同发酵条件对木霉产孢类型的影响[J].中国生物防治,2005,21(1):37-40.
[10]郝林华,牛德庆,陈靠山,等.拟康氏木霉液态发酵条件的研究[J].菌物学报,2005,24(2):235-244.
[11]武永红,黄敏,曹励民,等.香菇C91-3菌丝发酵液中蛋白的分离纯化及其抗肿瘤机理研究[J].时珍国医国药,2012(3):538-542.
[12]梁巧兰,魏列新,徐秉良,等.三种化学物质诱导观赏百合对黑斑病抗性的研究[J].植物保护,2011,37(2):36-40.
[13]朱丽梅,侯建文,罗凤霞,等.百合灰霉病的诊断及其病原物的分离纯化[J].金陵科技学院学报,2009(3):59-63.
[14]刘梅,徐同.木霉的营养生长及发酵条件[J].云南农业大学学报,2000,15(3):263-278.
[15]Papavizas G C,Dunn M T,Lewis J A.Liquid fermentation technology for experimental production of biocontrol fungi[J].Phytopathology,1984,74:1171-1175.
[16]Jackson A M,Whipps J M,Lynch J M .Effects of temperature,pH and water potential on grow th of four fungi with disease biocontrol potential[J].World J.Microbiol.Bio technol,1991,7:494-501.
[17]Lewis J A,Papavizas G C.Production of chlamydospores and co nidia byTrichodermaspp.in liquid and solid growth media[J].Soil Biol Biochem,1983,15:351-357.
[18]王慧中,赵培洁,陈卫辉.哈茨木霉浅层液体培养适宜条件的研究[J].浙江农业学报,1995,7(1):61-62.
[19]王慧中,赵培洁,陈卫辉.哈茨木霉浅层液体培养最适pH 的研究[J].江西农业大学学报,1995,17(1):77- 79.
[20]陈卫辉,赵培洁,王慧中,等.哈茨木霉液体培养技术研究[J].江西农业大学学报,1998,20(2):170-174.
[21]赵培洁,王慧中,陈卫辉.利用虫草头孢菌发酵废液培养哈茨木霉[J].中国生物防治,1995,11(1):48.
[22]赵培洁,王慧中,陈卫辉.哈茨木霉浅层液体培养最适采收时间的研究[J].植物病理学报,1995,25(3):220.
[23]魏林,梁志怀,罗赫荣,等.木霉代谢产物对豇豆种子活力及幼苗生理特性的影响[J].湖南农业学,2004(6):14-18.
[24]张旭东,刘云龙.木霉生防菌对植物生长的影响[J].云南农业大学学报,2001,16(4):299-303.
[25]程玲娟,徐秉良,梁巧兰.深绿木霉对几种牧草草种发芽率的影响[J].草原与草坪,2008,6:28-31.
[26]Hanson L E,Howell C R.Elicitors of plant defense reponse from biocontrol strains ofTrichodermaviren[J].Phytopathology,2004,94(8):171-176.
[27]Sriram S,Manasa S B,Savitha M J.Potential use of elicitors from Trichoderma in induced systemic resistance for the management ofPhytophthoracapsiciin red pepper[J].Journal Biology Control,2009,23(4):449-456.
[28]Woo S L,Scala F,Ruocco M,etal.The molecular biology of the interactions betweenTrichodermaspp,phytopathogenic fungi,and plants[J].Phytopathology,2006,96:181-185.
Study on induced resistant of protein isolate from fermentation broth ofTrichodermaatrovirideT2
LIANG Qiao-lan,HAN Liang,ZHOU Qi-yu
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
The effects of medium,temperature,pH value,inoculation amount on the growth and sporulation ofTrichodermaatrovirideT2 were studied and the result indicated that PDA medium performed better and its sporulation optimum fermentation conditions were 25℃,pH 7,inoculation amount of 0.5 mL/L,medium content of 100 mL/250 mL,sporulation reached the maximum at 72 h under these conditions,it was 1.5×109/mL sporulation began to decline at 76 h by growth rate method and spore production measurement method.Three proteins eluted peaks from fermentation brothTrichodermaatrovirideT2 were obtained by (NH4)2SO4precipitation and gel filtration chromatography,they were Ⅰ,Ⅱ and Ⅲ,respectively and their inhibition rates and induced resistance effects on their different concentrations to lilyBotrytiscinereawere measured by growth rate method and the induced in vivo inoculation method.The inhibition rate of protein elution peak Ⅰ 100 times was the minimum (1.16%),while its induced resistance was the best (84.77%).
TrichodermaatrovirideT2 strains;fermentation conditions optimization;protein isolates;induced resistance;lilyBotrytiscinerea
2016-02-27;
2016-05-18
甘肃省财政厅项目“深绿木霉T2蛋白激发子TraT2A分离纯化及诱导抗病作用机理研究”(甘财教2013(116))资助
梁巧兰(1968-),女,甘肃省平凉市崇信县人,博士,副教授,主要研究方向为作物保护和生物防治。
E-mail:liangql@gsau.edu.cn
S 763.1
A
1009-5500(2016)03-0028-07

