参芎葡萄糖注射液对肝脏6种亚型微粒体细胞色素P450酶的抑制作用*
孙 佳, 陆 苑, 潘 洁, 郑 林, 黄 勇, 王永林, 李勇军1,**
(1.贵州医科大学 民族药与中药开发应用教育部工程研究中心, 贵州 贵阳 550004; 2.贵州医科大学 贵州省药物制剂重点实验室, 贵州 贵阳 550004; 3.贵州医科大学 药学院, 贵州 贵阳 550004; 4.贵州医科大学 国家苗药工程技术研究中心, 贵州 贵阳 550004)
参芎葡萄糖注射液对肝脏6种亚型微粒体细胞色素P450酶的抑制作用*
孙佳1,2,3,4, 陆苑2,3, 潘洁3, 郑林2,3, 黄勇2,3, 王永林2,3, 李勇军1,3**
(1.贵州医科大学 民族药与中药开发应用教育部工程研究中心, 贵州 贵阳550004; 2.贵州医科大学 贵州省药物制剂重点实验室, 贵州 贵阳550004; 3.贵州医科大学 药学院, 贵州 贵阳550004; 4.贵州医科大学 国家苗药工程技术研究中心, 贵州 贵阳550004)
[摘要]目的: 考察参芎葡萄糖注射液对人肝微粒体细胞色素P450(CYP450)酶6种亚型CYP1A2、CYP2E1、CYP2C9、CYP2C19、CYP2D6、CYP3A4的体外抑制作用。方法: 在人肝微粒体孵育系统中,将不同浓度的参芎葡萄糖注射液和7种混合探针底物(非那西丁、氯唑沙宗、甲苯磺丁脲、奥美拉唑、右美沙芬、睾酮和咪达唑仑)共同孵育,采用超高效液相色谱-串联质谱法(UPLC-MS/MS)同时测定孵育液中CYP1A2、CYP2E1、CYP2C9、CYP2C19、CYP2D6和CYP3A4酶对应代谢物(对乙酰氨基酚、6-羟基氯唑沙宗、羟基甲苯磺丁脲、5-羟基奥美拉唑、右啡烷、6β-羟基睾酮和α-羟基咪达唑仑)的剩余量,与对照组进行比较,得到酶的剩余活性,用GraphPad v5.0软件计算半抑制浓度(IC50)值,考察参考葡萄糖注射液对人肝微粒体CYP450酶的抑制程度。结果: 在人肝微粒体孵育体系中,参芎葡萄糖注射液对6种CYP450亚型酶的IC50值均>15%。结论: 在临床剂量下,参芎葡萄糖注射液对人肝微粒体CYP1A2、CYP2E1、CYP2C9、CYP2C19、CYP2D6和CYP3A4无明显抑制作用。
[关键词]参考葡萄糖注射液; 细胞色素P450; 微粒体,肝; 药物相互作用
随着临床联合用药的日益普遍,由药物相互作用引发的不良反应逐年递增,因此,开展药物相互作用研究已引起高度重视,其应用价值和重要意义不容忽视。在人类代谢酶系统中,细胞色素P450(CYP450)是最重要的一种超基因家族酶,90%以上临床常见药物均需通过CYP450酶系进行I相代谢[1],且药物代谢酶被抑制约占代谢性药物相互作用的70%[2]。参芎葡萄糖注射液是由丹参和盐酸川芎嗪配伍组成的中药注射液品种,具有抗血小板聚集、扩张冠状动脉作用,还降低血液黏度,改善微循环,具有抗心肌缺血和心肌梗死的作用,临床广泛用于治疗闭塞性脑血管病及其他缺血性血管疾病[3-5]。参芎葡萄糖注射液与其他药物联合用药的情况也相当普遍,因药物间相互作用所带来的用药风险也不断增大。有关参芎葡萄糖注射液对CYP450抑制作用的研究未见报道。为了排除种属间的差异,本研究特采用人肝微粒体研究参芎葡萄糖注射液对CYP450酶6种亚型的体外抑制作用,以预测其是否会导致潜在的代谢性药物相互作用[6],这将有助于提高临床用药的安全性和有效性。
1实验方法
1.1实验仪器与材料
Waters超高液相色谱-三重四级杆质谱联用仪;Beckman Allegra 64R低温高速离心机;Thermo 700系列超低温冰箱;CS501A超级恒温水浴箱。参芎葡萄糖注射液(规格100 mL,批号20131125)由贵州景峰注射剂有限公司提供,非那西丁、奥美拉唑、甲苯磺丁脲和睾酮(批号分别为81105、90925、20321、10519)均购于德国Dr.Ehrenstorfer GmbH公司,右美沙芬(批号090M1298V)购于美国Sigma公司,咪达唑仑注射液购于江苏恩华药业股份有限公司,氯唑沙宗和对乙酰氨基酚(批号分别为100364-200301、100018-200408)购于中国食品药品检定研究院,右啡烷、羟基甲苯磺丁脲、5-羟基奥美拉唑、6-羟基氯唑沙宗和6β-羟基睾酮(批号分别为1-ALN-64-2、1-PSB-27-2、1-PSB-27-2、6-QFY-28-2、KIT0635)购于加拿大TRC公司,α-羟基咪达唑仑(批号FN101512-07)购于美国Cerilliant公司,人肝微粒体购于美国BD公司。NADP+购于Roche公司,G-6-P,G-6-PD购于Sigma公司,乙腈购于德国默克试剂公司。其他无机盐均为分析纯,甲醇为色谱纯。
1.2方法1.2.1液相条件色谱柱Waters BEH C18(2.1 mm×50 mm,1.7 μm)柱,流速0.35 mL/min,柱温 45 ℃,流动相 0.1%甲酸乙腈(A)-0.1%甲酸水溶液(B),检测7种专一性代谢产物的梯度条件为0~3.0 min 5%~65% A,3.0~3.5 min 65%~90% A,3.5~4.5 min 10% A;进样体积为 1 μL[7]。
1.2.2质谱条件电喷雾电离源(ESI),毛细管电压 3 kV,离子源温度 120 ℃,去溶剂气温度 350 ℃。去溶剂气 N2,流速 650 L/h;反吹气 N2,流速 50 L/h;碰撞气 Ar,流速 0.16 mL/min;质谱数据采集及处理软件为MassLynx V4.1工作站,扫描方式为多反应离子监测模式(MRM),离子对条件见表1[7]。
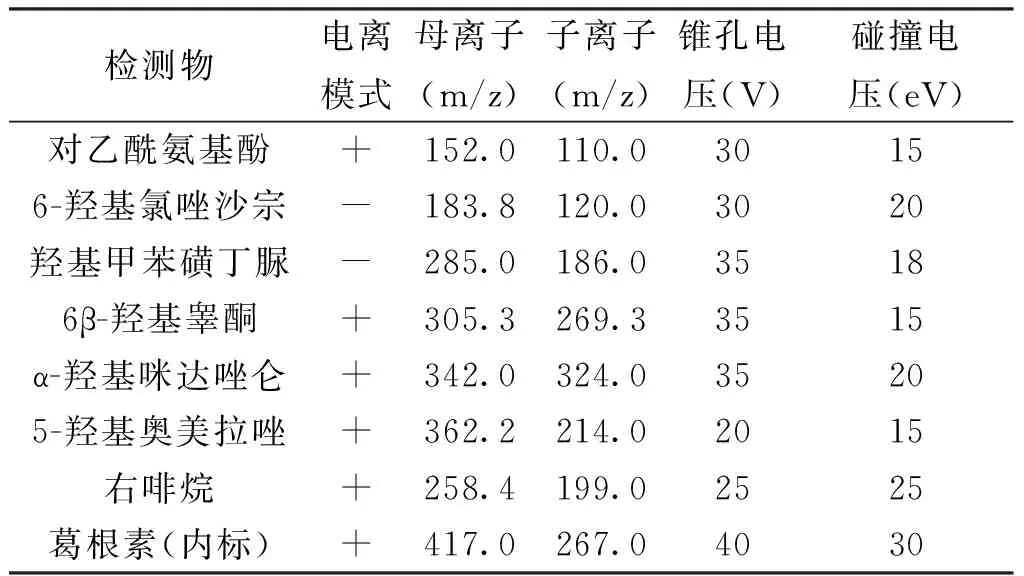
表1 质谱条件
1.2.3参芎葡萄糖注射液对CYP450的6种亚型酶的IC50值体外孵育系统的终体积为200 μL,包括含肝微粒体蛋白0.5 g/L,NADP+20 g/L,G-6-P 20 g/L,MgCl213.3 g/L,G-6-PD 40 U/mL,甲苯磺丁脲100 μmol/L、氯唑沙宗50 μmol/L、咪达唑仑25 μmol/L、睾酮100 μmol/L、右美沙芬50 μmol/L、奥美拉唑50 μmol/L和非那西丁50 μmol/L,以及不同浓度(注射液占孵育体系的0.25%、1.0%、2.0%、4.0%、6.0%、8.0%、10.0%和15.0%)的参芎葡萄糖注射液,其余为的0.1 mol/L PBS缓冲溶液(pH=7.4)。将不同浓度参芎葡萄糖注射液分别和NADPH再生系统、肝微粒体和PBS溶液于37 ℃预孵育3 min,再加入混合探针底物开始反应,孵育时间为60 min,其中有机试剂占反应体系的终浓度不得超过1% (V/V)。对照组加入等体积的葡萄糖注射液代替,每个样品平行操作3次,反应结束后加入100 μL冰冷的甲醇终止反应,再加入冰冷的葛根素内标(2 mg/L)溶液100 μL,涡混均匀后超声3 min,15 000 r/min离心10 min,用UPLC-MS/MS定量按照“1.2.1”和“1.2.2”项下分析7种探针药物对应的代谢物(羟基甲苯磺丁脲、6-羟基氯唑沙宗、α-羟基咪达唑仑、6β-羟基睾酮、右啡烷、5-羟基奥美拉唑和对乙酰氨基酚)。分析结果使用GraphPad v5.0软件作图,并计算出相对应CYP450酶活性的半抑制浓度(IC50值)。
2结果
孵育液中参芎葡萄糖注射液体积分数在15%以内对CYP450的6个亚型酶活性的抑制作用非常弱,GraphPad v5.0软件无法拟合出其IC50值。见图1。
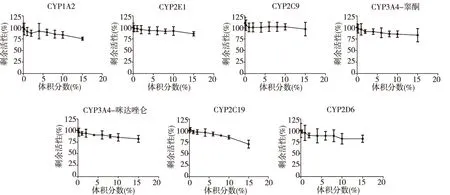
图1 参芎葡萄糖注射液对6种亚型CYP450酶的抑制曲线(n=3)Fig.1 Inhibition curve of Shenxiong glucose injection on 6 cytochrome P450 isoforms
3讨论
在药品说明书中,参芎葡萄糖注射液每100 mL参芎葡萄糖注射液分别含有20 mg丹参素和100 mg盐酸川芎嗪,其他主要成分分别是原儿茶醛、迷迭香酸、丹酚酸B、丹酚酸A[8]。参芎葡萄糖注射液临床常用剂量为100~200 mL/d,粗略地按人体血液为5 L计算,参芎葡萄糖注射液在血液中的体积百分比浓度最多为2%~4%,而实验结果表明参芎葡萄糖注射液对CYP450酶6种亚型的IC50值均大于15%,这浓度远超过临床剂量,说明参芎葡萄糖注射液对人CYP450无抑制作用。
CYP450酶活性被抑制或被诱导表达是导致药物代谢相互作用的主要原因,其中酶活性被抑制导致的药物相互作用的临床意义更为重要,当一种药物抑制某种特定亚型酶活性,会导致其他通过该亚型酶代谢的药物血药浓度明显升高,如果是治疗窗窄的药物,如华法林(CYP2C9特异性底物),则会发生严重地药物不良反应,甚至导致死亡。石杰[9]发现川芎嗪对大鼠肝药酶CYP1A2和CYP3A4均无影响。李峰[10]研究表明3种剂量的川芎嗪(50 mg/kg、100 mg/kg和300 mg/kg)对大鼠的肝重、微粒体产率、CYP450含量及NADPH Cyt C还原酶活性均无明显影响。虽然,存在种属差异,但这也佐证本实验结果。有报道表明丹参中的多种成分,如丹参总酚酸、丹参酮IIA对大鼠CYP450具有诱导作用[11-12]。并且,以丹参为主要原料药的复方丹参滴丸和复方丹参片对大鼠CYP450具有明显的诱导作用[13-15]。因此,需要进一步进行大鼠体内实验,考察参芎葡萄糖注射液是否具有诱导作用。
为了降低个体和避免种属间的差异,本实验采用人混合肝微粒体作为研究对象。本研究结果表明参芎葡萄糖注射液对人CYP450无明显抑制作用,因此临床上多种药物与参芎葡萄糖注射液联合使用时,由抑制作用而产生的药物不良反应风险不大。
4参考文献
[1] 刘蓬蓬, 贾天柱, 徐珊, 等. Cocktail 探针药物法评价生、制黄柏对CYP450酶亚型的影响[J]. 中药材, 2015(10):2065-2069.
[2] 艾常虹, 孙汉雄, 李桦, 等. 中药有效成分对细胞色素P450酶的抑制活性评价[J]. 中国药理学通报, 2011(4): 519-523.
[3] 陈兴坚, 刘建红. 参芎葡萄糖注射液的临床应用进展[J]. 中国实用医药, 2010(13): 247-249.
[4] 于红梅. 参芎葡萄糖注射液治疗脑梗死临床观察[J]. 中国现代医药应用, 2009(8): 132-133.
[5] 吴晓君, 周德莆. 参芎葡萄糖注射液抗冠心病心绞痛的临床疗效观察[J]. 现代医药卫生, 2010(9): 1344-1345.
[6] 魏春燕, 吴逢波, 徐珽. CYP450与药物相互作用[J]. 中国药业, 2014(6): 17-20.
[7] 陆苑, 谢玉敏, 潘洁, 等. 超高效液相色谱法检测6种探针底物代谢产物并评价人细胞色素P450同工酶的活性[J]. 贵阳医学院学报, 2015(6): 560-565.
[8] 郑林, 庞秀清, 兰燕宇, 等. UPLC法同时测定参芎葡萄糖注射液中6种主要成分[J]. 中成药, 2012(7): 1276-1279.
[9] 石杰, 陈安进, 张芳, 等. 血塞通及川芎嗪对细胞色素P450不同亚型代谢酶影响的研究[J]. 中国中西医结合急救杂志, 2008(6): 342-345.
[10]李峰, 楼雅卿. 磷酸川芎嗪与大鼠肝微粒体相互作用的研究[J]. 中国药理学通报, 1992(1): 32-35.
[11]胡冰, 段超慧, 岳洁浩, 等. 注射用丹参总酚酸(冻干)对人CYP450酶和P-糖蛋白体外抑制作用及对大鼠CYP1A2和CYP3A体内诱导作用[J]. 中国药理学与毒理学杂志, 2013(1): 6-12.
[12]和凡, 钟国平, 赵粒子, 等. 丹参酮ⅡA对大鼠细胞色素P450酶的诱导作用[J]. 中草药, 2009(6): 938-942.
[13]秦红岩, 魏玉辉, 杜玮, 等. 复方丹参片对大鼠肝脏细胞色素P450酶的影响[J]. 中成药, 2008(10): 1534-1536.
[14]施畅, 吴纯启, 马华智, 等. 复方丹参滴丸对大鼠肝CYP450酶系诱导作用的研究[J]. 解放军药学学报, 2003(5): 344-346.
[15]韦炳华, 王明军, 邝翠仪, 等. 复方丹参滴丸对大鼠肝微粒体细胞色素P450含量的影响[J]. 中药材, 2006(12): 1340-1342.
(2016-02-25收稿,2016-05-14修回)
中文编辑: 文箐颍; 英文编辑: 刘华
*[基金项目]国家科技支撑计划课题(2013BAI11B01); 贵州省科技重大专项项目[黔科合重大专项字(2011)6019号]; 贵州省中药现代化科技产业研究开发专项[黔科合ZY字(2013)3020号;黔科合中药字(2013)5062号]; 贵州省中药现代化科技产业研究开发专项[黔科合重G字(2013)4001]
[中图分类号]R969.2
[文献标识码]A
[文章编号]1000-2707(2016)07-0775-04
DOI:10.19367/j.cnki.1000-2707.2016.07.007
InvitroInhibition Effects of Shenxiong Glucose Injection on 6 Cytochrome P450 Isoforms in Human Liver Microsome
SUN Jia1,2,3,4, LU Yuan2,3, PAN Jie3, ZHENG Lin2,3, HUANG Yong2,3, WANG Yonglin2,3, LI Yongjun1,3
(1.EngineeringResearchCenterofMinistryofEducationfortheDevelopmentandApplicationofEthnicMedicineandTCM,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 2.GuizhouProvincialKeyLaboratoryofPharmaceutics,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 3.SchoolofPharmacy,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China. 4.NationalEngineeringResearchCenterofMiao'sMedicines,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To evaluate the in vitro inhibition effects of Shenxiong glucose injection on 6 cytochrome P450 isoforms (CYP1A2, CYP2E1, CYP2C9, CYP2C19, CYP2D6 and CYP3A4) in human liver microsome. Methods: Shenxiong glucose injection were incubated with human liver microsomes in the presence of 7 probe substrates for CYP450 isoforms, including phenacetin for CYP1A2, chlorzoxazone for CYP2E1, tolbutamide for CYP2C9, omeprazole for CYP2C19, dextromethorphan for CYP2D6, testosterone and midazolam for CYP3A4. Meanwhile, UPLC-MS/MS was adopted to measure remaining content of corresponding metabolite of CYP1A2, CYP2E1, CYP2C9, CYP2C19, CYP2D6 and CYP3A4 (Acetaminophen, chlorzoxazone 6-hydroxylation, hydroxytolbutamide, 5-hydroxy omeprazole, dextrorphan, 6 beta hydroxy testosterone and alpha hydroxy midazolam of midazolam). By comparison with control group, the remaining enzyme activities of cytochrome P450 isoforms were calculated. IC50 values were calculated by GraphPad v5.0 program to evaluate the inhibitory effects. Results: IC50values of Shenxiong glucose injection on CYP1A2, CYP2E1, CYP2C9, CYP2C19, CYP2D6 and CYP3A4 were more than 15%. Conclusion: Shenxiong glucose injection don't show inhibitory effect on CYP1A2, CYP2E1, CYP2C9, CYP2C19, CYP2D6 and CYP3A4 in human liver microsome.
[Key words]shenxiong glucose injection; cytochrome P450; microsomes,liver; drug interaction
**通信作者 E-mail:392828662@qq.com; liyongjun026@126.com
网络出版时间:2016-07-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160717.1318.012.html

