高效液相色谱法研究大鼠肝微粒体中布地奈德异构体的酶促反应动力学
刘艳双,郭 炜
(1.河北省永清县人民医院儿科,河北 永清 065600;2.河北医科大学药学院临床药学与药事管理学教研室,河北 石家庄 050017)
高效液相色谱法研究大鼠肝微粒体中布地奈德异构体的酶促反应动力学
刘艳双1,郭炜2*
(1.河北省永清县人民医院儿科,河北 永清 065600;2.河北医科大学药学院临床药学与药事管理学教研室,河北 石家庄 050017)
[摘要]目的研究布地奈德2个差向异构体在大鼠肝微粒体孵育体系中的酶促反应动力学。方法超速离心法制备大鼠肝微粒体,采用高效液相色谱法测定布地奈德2个差向异构体在大鼠肝微粒体孵育体系中的浓度。结果布地奈德与大鼠肝微粒体孵育后,2个差向异构体的代谢存在差异,在孵育初期或微粒体酶浓度较低时,22R-布地奈德的代谢较快,随着孵育时间的延长或微粒体酶浓度的增加,22S-布地奈德的代谢明显多于22R-布地奈德;22S-布地奈德的Km、Vmax约为22R-布地奈德的2倍。结论 布地奈德差向异构体的这种代谢差异与22R-布地奈德的亲和力较高(Km小于22S-布地奈德)、Vmax值较小有关。
[关键词]布地奈德;微粒体,肝;大鼠
doi:10.3969/j.issn.1007-3205.2016.05.016
布地奈德(budesonide)是一种具有高效局部抗炎作用的糖皮质激素[1-2],由于其显著的首过效应,多以呼吸道给药的形式治疗哮喘[3]、佐治肺炎等呼吸系统疾病(商品名:普米克)[4-8]。然而即使采用吸入的方式给药,布地奈德也会通过口咽部、气道的黏膜吸收,通过吞咽经胃肠道吸收从而发挥全身作用,如长期大剂量吸入给药导致的皮肤变薄、白内障、发育迟缓、骨流失和下丘脑-垂体-肾上腺轴抑制等作用。因此,有必要研究布地奈德进入体循环后的代谢排泄过程。临床上应用的布地奈德是其22R和22S差向异构体1∶1组成的混合物,且22R的活性较22S强2~3倍[9]。已有研究报道,布地奈德主要经肝脏代谢[特别是细胞色素P4503A(CYP3A)],产生多种代谢产物,主要有6β-hydroxy-budesonide、16α-hydroxy-prednisolone,以及经过脂化酶催化产生一些列与脂肪酸酯化的产物[10]。但目前并不清楚给予布地奈德后,2个差向异构体在肝微粒体的代谢速率及酶促动力学参数是否有差异。本研究采用体外大鼠肝微粒体孵育,用高效液相色谱法高效液相色谱法(high performance liquid chromatography,HPLC)检测布地奈德2个差向异构体的酶促反应动力学。
1 材料与方法
1.1仪器与试剂1200型高效液相色谱仪(美国Agilent公司,配备有四元溶剂输送系统、自动进样器、柱温箱和VWD检测器),配有Chemstation色谱工作站;CPA225D电子天平(德国Sartorius公司);KQ-300DE超声仪(昆山市超声仪器有限公司);Optima L-100 XP超速离心机(美国Beckman-Coulter公司)。布地奈德对照品(HPLC纯度99.4%,批号:100989-200801)、曲安奈德对照品(HPLC纯度98.8%,批号:100055-201103)购于中国食品药品检定研究院;氧化型辅酶Ⅱ(beta-nicotinamide adenine dinucleotide phophate Ⅱ,β-NADP)、葡萄糖-6-磷酸、葡萄糖-6-磷酸脱氢酶均为Sigma公司产品;甲醇、乙腈为色谱纯,水为自制重蒸水,其他试剂均为分析纯。雄性SD大鼠(体质量230~260 g,河北省实验动物中心)。BCA试剂盒(联科生物技术有限公司,中国杭州)。
1.2溶液配制布地奈德对照溶液:精密称取布地奈德对照品适量,用甲醇溶解并制成0.5 g/L的贮备液;精密量取适量,用4%甲醇稀释成50、25、12.5、6.25、3.125 μmol/L的系列浓度对照溶液,备用。内标溶液:精密称取曲安奈德对照品3.29 mg,用甲醇溶解并制成0.329 mg/L的溶液。
1.3色谱条件色谱柱:Symmetry C18柱(3.0 mm×100 mm,3.5 μm);流动相:乙腈-水(35∶65);流速:0.8 mL/min;检测波长:244 nm;柱温:30 ℃;进样量:10 μL。
1.4肝微粒体的制备[11]取雄性SD大鼠5只,禁食12 h后断头处死,开腹迅速取出肝脏,用滤纸吸干后称质量,然后置于冰Tris-HCl缓冲液中清洗,剪碎,洗至无色,加4倍质量的Tris-HCl缓冲液于冰浴中研磨匀浆。冰浴超声分散60 s,4 ℃低温离心(20 000×g)20 min,弃沉淀,取上清液4 ℃超速离心(100 000×g)60 min,弃上清,用Tris-HCl缓冲液清洗沉淀,并再次超速离心(100 000×g)60 min,所得沉淀即为肝微粒体。用适量Tris-HCl缓冲液悬浮沉淀,-80 ℃保存备用。
1.5肝微粒体蛋白浓度测定
1.5.1溶液的配制BCA工作液的配制:按需用量配制适量的BCA工作液,BCA试剂A与BCA试剂B按体积比50∶1混合,充分混匀。牛血清白蛋白储备液的配制:取 BSA标准蛋白(2 mg/mL)0.5 mL,用蒸馏水稀释并定容至10 mL,最终BSA浓度为100 mg/L。牛血清白蛋白标准溶液的配制:精密量取上述储备液,用蒸馏水配制成0、20、40、60、80、100 μg/mL的标准溶液。
1.5.2标准曲线制备分别取不同浓度的牛血清白蛋白标准溶液各50 μL,置于1.5 mL离心管(每管均作复管对照),每管分别加入BCA工作液1 mL,立刻涡旋30 s。放置37 ℃反应30 min,将蛋白浓度为0作为空白对照溶液,试管恢复至室温,采用分光光度计于562 nm波长测定吸光度,以吸光度A为横坐标,以蛋白浓度C为纵坐标进行曲线回归,即得标准曲线C=0.001 2A+0.051 1(r=0.997 8)。
1.5.3肝微粒体蛋白浓度的测定将制备的肝微粒体样品用Tris-HCl溶液稀释100倍(取微粒体100 μL用Tris-HCl溶液定容至10 mL,混匀),取50 μL依标准曲线项下测定吸收度,以同体积的Tris-HCL缓冲液代替肝微粒体样品同上处理后作为空白对照,根据标准曲线计算蛋白浓度,测得肝微粒体悬浮液的蛋白浓度为5.1 mg/mL。
1.6温孵过程及样品处理参考文献[11-12]条件,反应体系(200 μL,用Tris-HCl缓冲液溶解稀释)中含微粒体再生体系(β-NADP 0.5 mmol/L、葡萄糖-6-磷酸 5.0 mmol/L、葡萄糖-6-磷酸脱氢酶1.0 U/mL),肝微粒体蛋白0.3 mg/mL。37 ℃水浴振荡(150 r/min)一定时间后,立即加入含有内标的冰甲醇溶液400 μL,涡旋2 min,终止反应,10 000 g离心10 min,取上清液进样分析,每个样品平行温孵3份。并用灭活的微粒体(80 ℃水浴振荡10 min)做相应的对照溶液,建立标准曲线。同时做不含微粒体、不含微粒体再生体系的空白对照。每个反应体系中甲醇的终浓度<1%。
2 结 果
2.1方法学考察布地奈德对流动相的酸碱变化不敏感,在乙腈-水(35∶65)的体系下可以实现其2个差向异构体的基线分离,分离度为1.8(见图1)。结合文献[13]报道的出峰顺序,保留时间5.19 min和5.60 min的峰分别为22R-布地奈德及22S-布地奈德。由图1可见,大鼠微粒体及再生体系均不影响布地奈德的测定,专属性良好。22R-布地奈德及22S-布地奈德在1.57~50.30 μmol/L的范围内的回归方程分别为Y=980 737X-0.043 9(r=0.999 9)和Y=738 975X-0.074 3(r=0.999 9),线性关系良好。连续测定3日,其日内日间精密度均<15%。因此,本法可以用来测定布地奈德在大鼠微粒体中的浓度。

图1HPLC色谱图
A.不含药物及内标的微粒体体系;B.0.8 μmol/L布地奈德孵育0 min的微粒体体系;C.0.8 μmol/L布地奈德孵育15 min的微粒体体系;1:内标曲安奈德;2:22R-布地奈德;3:22S-布地奈德
Figure 1The HPLC chromatograms
2.2在大鼠肝微粒体中的酶促反应动力学
2.2.1孵育时间对布地奈德代谢速率的影响在上述温孵系统条件下,0.8 μmol/L的布地奈德在大鼠肝微粒体蛋白浓度为0.4 mg/L的体系中,经37 ℃温孵振荡5~30 min,以布地奈德的相对剩余浓度-时间作图(图2A)。由图2A可见,22R-布地奈德及22S-布地奈德在5~15 min呈线性消除,在15~30 min内二者的消除速度均减慢,因此温孵最佳时间选择为15 min。以孵育时间和22R-布地奈德与22S-布地奈德相对剩余浓度的比值作图(图2B),发现二者的比值从0 min的1.34降到10 min的1.29,然后增加到1.79,呈现先减小后增大的趋势。

图2孵育时间对布地奈德差向异构体代谢速率的影响
A.布地奈德差向异构体的相对剩余浓度;B.22R-与22S-布地奈德相对剩余浓度的比值
Figure 2The effects of incubation time on the metabolic rate of epimeric isomers of budesonide
2.2.2大鼠肝微粒体蛋白浓度对布地奈德代谢速率的影响在上述温孵系统条件下,0.8 μmol/L的布地奈德在大鼠肝微粒体浓度为0.05~0.40 mg/mL的体系中,孵育15 min,以布地奈德的相对剩余浓度-时间作图(图3A)。由图3A可见,22R-布地奈德及22S-布地奈德在微粒体浓度0.1~0.4 mg/mL的范围内呈线性消除,为减少药物与蛋白的结合,并使药物的代谢率约为20%,故确定最佳的微粒体蛋白浓度为0.3 mg/mL。以微粒体浓度和22R-布地奈德与22S-布地奈德相对剩余浓度的比值作图(图3B),发现二者的比值同样呈现先减小后增大的趋势。
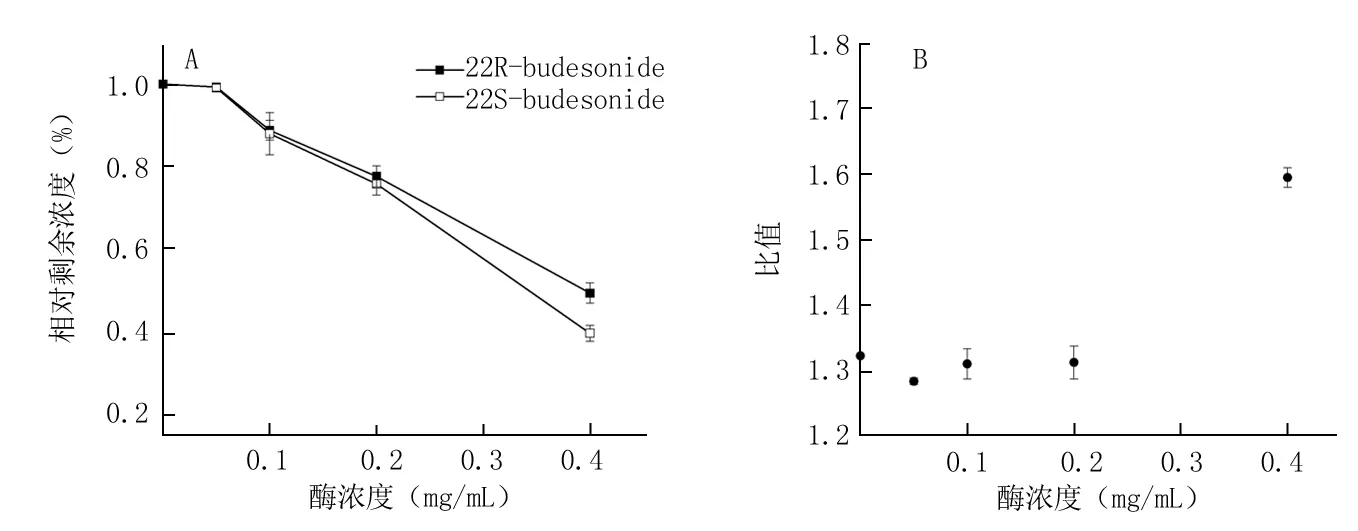
图3大鼠肝微粒体浓度对布地奈德差向异构体代谢速率的影响
A.布地奈德差向异构体的相对剩余浓度;B.22R-布地奈德与22S-布地奈德相对剩余浓度的比值
Figure 3The effects of microsomal enzyme concentration on the metabolic rate of epimeric isomers of budesonide
2.2.3底物浓度对布地奈德代谢速率的影响在上述温孵系统条件下,不同浓度的布地奈德溶液在肝微粒体蛋白浓度为0.3 mg/mL时,孵育15 min。以温孵液中布地奈德浓度的减少量(μmol/L)除以温孵时间(min)及蛋白浓度表示布地奈德的代谢速率V,[S]表示底物浓度,根据Eadie-Hofstee方程V=Vmax-KmV/[S],Vmax表示最大反应速率,Km表示米氏常数,利用GraphPad Prism 5.00 Software (GraphPad Software Inc,San Diego, CA, USA)进行非线性回归(图4)。计算得22R-布地奈德的Vmax=4.4 μmol·L-1·min-1·mg-1,Km=1.6 μmol·min-1·mg-1,肝内清除率=Vmax/Km=2.7 L·min-1·mg-1;22S-布地奈德的Vmax=8.5 μmol·L-1·min-1·mg-1,Km=2.7 μmol·min-1·mg-1,肝内清除率=3.1 L·min-1·mg-1。22S-布地奈德的Km、Vmax约为22R-布地奈德的2倍。
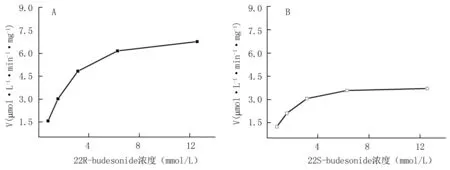
图4底物浓度对布地奈德差向异构体代谢速率的影响
A.22R-布地奈德;B.22S-布地奈德
Figure 4The effects of substrate concentration on the metabolic rate of epimeric isomers of budesonide
3 讨 论
药物经过代谢转化有利于其从体内的排出,肝脏中的微粒体酶在药物代谢中起到了重要作用,故常用肝微粒体酶的体外孵育法来研究药物的代谢[14-15]。通过肝微粒体温孵实验,计算药物在生物转化过程中的主要酶动力学参数(Km和Vmax),可阐明药物的代谢机制[16-17]。布地奈德在肝脏中代谢广泛,生成多种代谢产物,测定每个产物生成的酶动力参数非常复杂,需要代谢产物的对照品,而且不能从整体上反映布地奈德的酶动力学特征,因此本研究以布地奈德底物的消除来计算布地奈德的酶动力学参数。
临床上使用的布地奈德是22R-布地奈德和22S-布地奈德的混合物[18-19],因此,本研究也用其混合物作为底物进行孵育反应,然后用HPLC分离测定孵育体系中布地奈德的2个差向异构体的浓度。通过计算布地奈德2个差向异构体的肝内清除率,表明布地奈德是一个肝代谢药物,且代谢较快,另外实验中也发现,布地奈德2个差向异构体的肝微粒体代谢依赖于烟酰胺腺嘌呤二核苷酸磷酸(NADPH)。
研究布地奈德在大鼠肝微粒体的酶促反应动力学,发现其差向异构体代谢速度存在差异,在孵育初期或微粒体酶浓度较低时,22R-布地奈德的代谢较多,表现在22R-布地奈德与22S-布地奈德剩余浓度的比值降低,进一步研究发现22R-布地奈德的Km值小于22S-布地奈德,说明22R-布地奈德与药物代谢酶的亲和力较高,是致使其代谢较快的原因;相
反,在孵育后期或微粒体酶浓度较高时,22S-布地奈德代谢较多,故22R-布地奈德与22S-布地奈德剩余浓度的比值增加,这与22S-布地奈德的Vmax、肝内清除率大于22R-布地奈德有关。
[参考文献]
[1]马兆越,林荣军.吸入性糖皮质激素对哮喘患儿血清1,25-(OH)2 D3、皮质醇及促肾上腺皮质激素水平的影响[J].儿科药学杂志,2015,21(4):1-3.
[2]刘琦,梁翠荣,谢元超,等.HPLC法测定布地奈德气雾剂的含量和有关物质[J].药物分析杂志,2014,34(3):471-474.
[3]李华文.孟鲁司特联合布地奈德治疗儿童哮喘的疗效分析[J].河北医科大学学报,2014,35(11):1320-1322.
[4]罗燕萍,梁景林.布地奈德联合特布他林佐治小儿毛细支气管炎[J].当代医学,2013,19(1):143-144.
[5]艾尼瓦尔·那斯肉拉,魏雪梅,杨晓红,等.布地奈德和沙丁胺醇雾化吸入治疗慢性阻塞性肺疾病急性加重期的疗效观察[J].临床荟萃,2012,27(20):1804-1806.
[6]沈玉祥.布地奈德联合盐酸氨溴索雾化吸入对小儿支气管肺炎的疗效分析[J].河北医科大学学报,2012,33(6):712-714.
[7]段世玲.空气压缩泵雾化吸入普米克令舒治疗小儿急性感染性喉炎的疗效观察[J].河北医科大学学报,2013,34(1):75-76.
[8]刘小娟.普米克令舒吸入佐治小儿毛细支气管炎疗效观察[J].中国中西医结合儿科学,2015,7(4):344-345.
[9]Matabosch X,Pozo OJ,Pérez-MaC,et al. Identification of budesonide metabolites in human urine after oral administration[J]. Anal Bioanal Chem,2012,404(2):325-340.
[10]Seidegärd J,Nyberg L,Borgä O. Differentiating mucosal and hepatic metabolism of budesonide by local pretreatment with increasing doses of ketoconazole in the proximal jejunum[J]. Eur J Pharm Sci,2012,46(5):530-536.
[11]张慧霞,王鑫,刘有平,等.白屈菜碱在大鼠肝微粒体中代谢的酶动力学及CYP450酶特异性抑制剂对其代谢的影响[J].沈阳药科大学学报,2015,32(4):276-280.
[12]冯素香,王蒙蒙,吴兆宇,等.大黄5种蒽醌类成分在大鼠肝微粒体中的代谢及酶促反应动力学[J].暨南大学学报:自然科学与医学版,2015,36(5):383-391.
[13]Lu Y,Sun Z,Zhang Y,et al. Simultaneous quantification of 22R and 22S epimers of budesonide in human plasma by ultra-high-performance liquid chromatography-tandem mass spectrometry:application in a stereoselective pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2013,921/922:27-34.
[14]张振清.我国药物代谢与药代动力学学科发展与展望[J].中国药理学与毒理学杂志,2015,29(5):752-754.
[15]张帅,郭魏魏,申雷.药物代谢在药品开发中的作用[J].中国现代药物应用,2014,8(23):209-210.
[16]贾佩佩,张晓旭,张智勇,等.染料木苷在大鼠肝微粒体中的代谢及酶促反应动力学研究[J].中国药学杂志,2015,50(9):797-801.
[17]邢晓丹.钩吻素子在大鼠肝微粒体中的酶促反应动力学研究[J].海峡药学,2013,25(8):33-36.
[18]Dignass A,Stoynov S,Dorofeyev A E,et al. Once versus three times daily dosing of oral budesonide for active Crohn's disease:a double-blind,double-dummy,randomised trial [J]. J Crohns Colitis,2014,8(9):970-980.
[19]Thulesiu HL,Cervin A,Tessen M. Trentment with a topical glucocorticoid,budesonide reduced the variability of rhinomanometric nasal airway resistance[J]. Rhinology,2014,52(1):19-24.
(本文编辑:刘斯静)
[收稿日期]2015-12-04;[修回日期]2015-12-27
[基金项目]廊坊市科学技术研究与发展计划(2014013055)
[作者简介]刘艳双(1977-),女,河北永清人,河北省永清县人民医院主治医师,医学学士,从事儿科疾病诊治研究。 *通讯作者。E-mail:guowei8043586@sina.com
[中图分类号]R969.1
[文献标志码]A
[文章编号]1007-3205(2016)05-0558-05
Study on the enzymatic reaction kinetics of epimeric isomers of budesonide in rat liver microsomes by HPLC
LIU Yan-shuang1, GUO Wei2
(1.Department of Paediatrics, People's Hospital of Yongqing County, Hebei, Langfang 065600;2.Department of Clinical Pharmacy and Pharmacy Administration Science, School of Pharmacy, Hebei Medical University, Hebei, Shijiazhuang, 050017)
【Abstract】ObjectiveTo identify the differences of the enzymatic reaction kinetics of two epimeric isomers of budesonide in rat liver microsomes.MethodsThe rat liver microsomes(RLM) was prepared by ultracentrifugation, and the concentration of epimeric isomers of budesonide co-incubated with RLM were determined by high performance liquid chromatography. ResultsThe metabolic differences of two isomers of budesonide were observed after budesonide incubated with RLM. The metabolism of 22R-budesonide was faster than that of 22S-isomer in the early stage of incubations or at low concentration of microsomal enzyme used. However, with the prolongation of incubation time or increased concentration of microsomal enzyme, the metabolism of 22S-budesonide was obviously faster than 22R-isomer. The values for Km and Vmaxof 22R-budesonide were about 2 times greater than those of the epimer(22S). ConclusionThe higher affinity for 22R-budesonide and with a small value of Vmax, was the main reason for the presented metabolic profile of epimeric isomers of budesonide.
[Key words]budesonide; microsomes, liver; rats

