用压力-容积环评价大鼠心功能方法的改进及注意事项
刘晓雨,谭 文
(华南理工大学生物科学与工程学院/生物医药前孵化器研究中心/广东省发酵与酶工程重点实验室,广州 510006)
用压力-容积环评价大鼠心功能方法的改进及注意事项
刘晓雨,谭 文
(华南理工大学生物科学与工程学院/生物医药前孵化器研究中心/广东省发酵与酶工程重点实验室,广州 510006)
【摘要】目的 探讨应用压力-容积环(pressure-volume loop,PV Loop)评价大鼠心功能过程中的影响因素及方法改进原则,分析主动脉弓缩窄(transverse aortic constriction,TAC)诱导的压力负荷对大鼠心脏功能的影响,从而为大鼠健康或疾病状态下的心功能分析提供更为科学全面的方法。方法 采用压力容积传感器从大鼠的颈动脉插入左心室,调整传感器到合适位置来改善压力-容积环的形状,结合配套软件对心功能进行多方面的评价,分别从压力及容积的定标、导管在左心室腔内的位置、呼吸机对测定的影响等方面分析应用压力-容积环测定大鼠心功能时的操作要点。结果 (1)通过颈静脉注射适量的高渗盐水定标,扣除心室壁平行电导率引起的容积,可以获得准确的左心室容积。(2)适度调节压力-容积导管,使传感器的位置完全进入心室但又不接触心室壁,可以得到更好的压力-容积信号。(3)停止呼吸机适当时间,消除非自主呼吸对测定的影响,有助于获得更稳定的数据。采用这一方法对主动脉缩窄手术(诱导心肌肥大)后1个月的大鼠进行分析,可以更好地评价大鼠在正常和疾病状态下的心功能。结论 本研究从容积定标、导管位置和呼吸机等方面对大鼠心脏的压力-容积环测定方法进行了改进和完善,并通过分析正常和心肌肥大的大鼠心功能验证了该方法的可靠性。
【关键词】压力-容积环;主动脉弓缩窄;心功能;方法改进
左心室压力-容积环分析[1]在啮齿类动物生理、病理状态下的心功能评价中应用广泛,已经成为基础研究中公认的评价动物心功能变化的“金标准”之一。采用压力-容积关系比较负荷和变力性对心室收缩的影响,表明负荷变化对心脏各项指数的影响与其对变力刺激敏感性接近,并且压力-容积关系参数理论分析的结果与试验数据一致[2]。通过这一方法对心肌梗塞引起的心衰进行功能评价,表明心肌缺血后,随着时间推移,从代偿性重构逐步发展为失代偿的心衰,心脏收缩和舒张功能均发生一系列显著变化[3],在衰老相关的晚期心衰大鼠中也可以观察到心脏各项参数的变化[4]。目前,基于清醒小鼠的压力-容积环分析检测也被建立起来[5],从而可以连续观察清醒状态下心脏收缩的变化情况。
压力-容积环分析也广泛用于大型动物或临床人体心功能的评价[6-12]。采用这一方法,结合超声心动图等技术,对具有正常射血分数的心衰病人(HFNEF)进行分析,表明不同病人之间具有不同的生理病理学机制[6-7]。近期一项研究将这一技术测定各种心血管疾病病人的心功能,表明压力-容积关系能更好地区分不同的临床症状的病人[8]。细胞移植是一种治疗心衰的新方法,采用压力-容积检测可以长期观察这种治疗对心衰病人的恢复效果[9]。对诸如狗等相对较为大型的动物,选择合适型号的压力-容积导管,也可以测定各种疾病状态下的心脏功能[10-11]。
尽管压力-容积关系已经广泛用于心脏功能评价,相关的操作流程已经较为完善[13],然而,对这项技术是否能科学、客观地反映心功能的状态尚有争议,相关方法学也需要进一步完善[14],与左心室功能检测相关的各种实验技术也需要不断提升[15]。为此,本研究分别从压力和容积的定标、压力容积导管在左心室腔的位置、呼吸机对评价的影响等方面改进这一心功能评价方法,探讨应用导管测定心功能过程中的操作原则和注意事项,并应用这一改进的方法测定主动脉弓缩窄手术(TAC)诱导的大鼠心肌肥大模型的心功能参数变化,为大鼠健康或疾病状态下的心功能分析提供更为科学全面的方法。
1 材料和方法
1.1 实验材料
1.1.1 实验动物:Wistar大鼠,雄性,8~10周龄,体重200±20 g,购买于广东省中山大学动物实验中心【SCXK(粤)2011-0029】,在中山大学动物实验中心进行实验【SYXK(粤)2011-0112】。
1.1.2 主要仪器:外科手术设备及器械(广州器化医疗设备有限公司)、小动物呼吸机(Harvard Apparatus,Holliston,MA,USA)、恒温加热垫(广州飞迪生物科技有限公司,型号:PLS-20A)、PowerLab数据采集分析系统(AD Instruments Inc.)、Millar压力容积导管SPR-838(Millar Instruments Inc.)、光纤冷光源(F-150S)、小动物电子秤(永康市华鹰衡器有限公司,型号:ASC-30)、恒温加热垫(广州飞迪生物科技有限公司,型号:PLS-20A)。
1.2 实验方法
1.2.1 主动脉弓缩窄手术建立大鼠心肌肥大模型:对大鼠实施主动脉缩窄手术,制造压力负荷诱导的大鼠心肌肥大模型[16]。其过程如下:大鼠称重后腹腔注射3%戊巴比妥钠(40 mg/kg)麻醉后,让其仰卧于手术台上(恒温垫控温37℃),固定大鼠四肢,头部。行经口气管插管,连接上小动物呼吸机,设置潮气量为4~6 mL/200 g,频率为65~70次/min。手术区域备皮,碘伏消毒,铺无菌纱布,用眼科弯镊和剪刀从左胸部位斜向把皮剪开,用眼科弯镊钝性分离两边的皮,暴露更多的肌肉。然后用弯头止血钳钝性分离胸大肌和胸小肌,暴露出肋骨。用眼科弯镊在第二和第三肋骨间无菌操作下开胸,并小心拨开左右两片胸腺,暴露主动脉弓。把4-0号的医用真丝编织线从右无名动脉和左颈总动脉之间穿过胸主动脉(结扎部位如图1所示)[17],将主动脉结扎于21 G(外径为0.8 mm)的针头上,随后把针头抽出。结扎牢固后,将胸腺轻轻回位盖住结扎部位。由胸腔引出一根消毒的塑料管,逐层关胸,缝好肌肉后,用注射器经塑料管吸出胸腔内的气体,使肺部能较好地扩张,然后拔掉塑料管并缝合伤口。继续通呼吸机15 min,待大鼠自主呼吸恢复后,拔出气管插管,放回笼子饲养。假手术组(SHAM)实施完全相同的操作,只是编织线穿过血管后不行结扎。
1.2.2 大鼠心功能的测定:左心室压力和容量测定的原理:Millar压力容积导管是一根末端带有一个微型压力感受传感器(PS)和四个感受容积的环状电极(E1-E4)的导管(图2)。其中导管两端的电极是兴奋性电极,中间的一对电极是干预记录电极。导管插进心脏后,四个电极可以跨距整个心室的长轴。通过微型压力感受器可以检测心室压力的变化。兴奋性电极之间经过高频低振幅的恒定电流,产生局部的电场。干预电极之间的电势与血液的电阻成正比,与血液的电导率成反比。干预电极可以记录心室内血液的电导率。一个心动周期内不同的时相中心室的血容量不同导致干预电极记录的电导率也不同。根据检测心室内的电导,转换为心室容积,转化公式:Volume=(1/α)×ρ×L2×G,其中Volume表示心室容积,α表示容积校正系数,ρ表示血液的电阻,L表示干预电极之间的距离,G表示检测的总电导。由于导管检测心室内血液的电导率是以电势值信号输出的,因此需要进行单位转换。将相对容积电导信号(以电势V表示)转化为绝对容积(μL)。此外,由于检测的总电导其实包含了血液、心室壁和周围的组织产生的电导,所以为了准确地得到心室容积,需要进行高渗盐水定标,以扣除心室壁和周围组织产生的电导[13]。
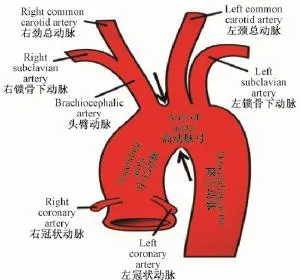
图1 实施TAC手术的主动脉弓缩窄部位[17]Fig.1 The site of transverse aortic constriction[17]
1.2.2.1 压力容积导管电导信号单位(ms)向容积单位(μL)转换:使用由厂家提供的绝缘体容积校准容器(见图3),置于37℃恒温加热垫上,往5个深1 cm、直径在5~9 mm范围内的孔中加入1%的肝素(生理盐水配制)进行润洗,然后抽出肝素,迅速往里面加入用1%的肝素抗凝的新鲜大鼠血液,将导管插入到孔中,保证导管的4个电极均浸没在血液中,保持10~20 s,此时,屏幕上可看见容积信号上升并维持一段时间。然后插入到下一个孔中,由于这五个孔的体积不一样,会产生不同的电导信号,直到采集完5个梯度的电导信号,然后重复2次。根据每个孔测得的实际容积信号V)与标示的容积(μL)数据(表1),拟合出校正标准曲线,由此得到线性方程的斜率和截距(图4),将斜率和截距代入方程即可将电导信号单位(ms)向绝对体积单位(μL)转换[13]。

图2 SPR-838 Millar导管Fig.2 A picture of SPR-838 Millar catheter
1.2.2.2 左心室内插入导管:将TAC手术后饲养4周的大鼠麻醉后,固定于37℃的恒温手术台上。经口插入气管导管,通上呼吸机,具体步骤参考模型制备的步骤(1.2.1部分)。对大鼠颈部周围进行备皮,行颈正中切口约3 cm,钝性分离皮下组织和颈前正中肌肉,找到呈“T”型的三块肌肉,在肌肉下找到右侧颈总动脉,用玻璃分针小心将动脉周围的神经分离,避免分离右侧颈动脉时牵拉迷走神经。然后在动脉下穿线,结扎右侧颈动脉远心端,并在近心端置小动脉夹,并穿线备用。在靠近近心端结扎处用眼科剪朝向心端呈45℃剪一“V”型小口,插入导管后,用靠近心端的线扎一个松结,松开动脉夹,并观察电脑屏幕上波形的变化。当导管往心脏方向前进时遇到助力,可以适度地将其往回退,然后再继续前进,直到屏幕上出现典型的心室内压波形,即可停止前进,为把近心端的松结扎紧,避免导管脱落,此时要适度地调整导管在左心室内的位置,直到出现稳定且漂亮的压力-容量环[18]。

图3 绝缘体校准容器Fig.3 Insulated calibrating container

表1 使用绝缘体校准容器平衡3次测得的实际容积Tab.1 The real volume measured by the insulated calibrating container
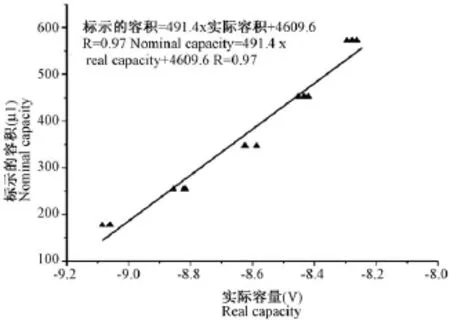
图4 校正标准曲线Fig.4 Calibrated standard curve(Volume)
1.2.2.3 采用平行电导对容积进行校正:用玻璃分针钝性分离大鼠右颈静脉,小心牵拉迷走神经。然后在颈静脉下穿线,结扎颈静脉远心端,并在近心端置小动脉夹,并穿线备用。在靠近近心端结扎处用眼科剪朝向心端呈45℃剪一“V”型小口,插入PE50导管后,用靠近心端的线扎紧,松开动脉夹,用注射器往PE50导管里推进约40μL 30%的高渗盐水,此时可见左心室容量迅速增大,压力-容积环往右移动(电导发生明显改变)且不伴随压力信号幅度的降低。等左心室容量恢复到给高渗盐水前的水平,再次重复推进高渗盐水,如此进行2~3次高渗盐水定标。选取左心室容量增大的一段数据,可得出给高渗盐水后左心室的舒张末容积-收缩末容积的线性关系,此直线与当左心室舒张末容积与收缩末容积相等时的直线(此直线表示心室没有血液)相交于一点,此点对应的体积为平行体积(Vp),即心室壁和周围组织产生的电导所引起的心室容量误差。所以最终表示左心室的容积要扣除这容量误差。相关研究表明[4,18],注射20~40 μL的30%高渗盐水,Vp一般为130~280 μL。
2 结果
2.1 高渗盐水定标对平行电导校正的影响
采用高渗盐水注射来确定心室壁的平行电导引起的容积是获得心室真实容积的有效方法。由图5A可知,大鼠静脉注射高渗盐水后,心室容量增加的同时会引起心室压力的降低。在此区域里,推算出的Vp值超出文献公认的规定值。选取容量增加同时心室压力没有明显变化的区域(压力容积曲线只发生左右平移,无上下移动,图5B中),推算出的Vp值在文献公认的范围内。由此可知,注射高渗盐水对平行电导进行校正时需要选取容量增加的同时心室压力没有明显变化的数据,如图5B上所示。
2.2 压力容积导管在左心室腔内的位置对压力-容积环测定的影响

图5 注射高渗盐水进行平行电导校正Fig.5 Parallel conductance corrected by hypertonic saline
研究发现,导管的位置对于容积的测定影响较大,如图6所示。调整前,左心室等容舒张期和等容收缩期中的容积发生明显变化,呈现不等容现象。经适度调整后,压力-容积环的等容舒张期和等容收缩期偏移减少,并且心室收缩末容积与调整前发生明显改变。此时压力容积导管前端的传感器器应该位于左心室内,并且不应该与心室壁有接触。导管末端进入心室长度随大鼠体重变化而稍有不同,例如体重约300 g的大鼠,导管进入长度约为6.3 mm,体重约400 g的大鼠,导管进入长度约6.8 mm。
2.3 呼吸机对压力-容积环测定的影响
研究发现,呼吸机会显著引起左心室压力和容积的波动,从而导致每个心动周期测定的压力-容积环发生偏移(图7)。而暂停呼吸机后,压力-容积环的位置变得相对稳定,并且心室压没有明显变化,因此为获得稳定的压力-容积环,可采集停呼吸机5~10 s的数据,然后再继续通上呼吸机。
2.4 主动脉缩窄手术诱发大鼠心肌肥大的压力-容积环测定
主动脉弓缩窄手术(TAC)可通过压力负荷诱导心肌肥大,由图8可知,正常组(图8左)具有正常的心功能,而实施TAC手术一个月的肥大组(图8右)心功能下降,舒张功能恶化,收缩有关的dp/ dtmax、EF等参数与对照组没有明显差异,说明TAC手术后一个月大鼠心室明显扩张,但尚处于代偿期,心脏功能总体处于良好状态,压力-容积环右移。而大鼠实施TAC手术两个月后,dp/dtmax和EF均显著降低,Ped和Tau均明显增加,表明心脏收缩功能和舒张功能均受损,此时心脏进入失代偿阶段,压力-容积环右移且环的上下边沿均朝中心移动(数据未显示)。
3 讨论

图6 压力容积导管位置对压力-容积环测定的影响Fig.6 The infection of catheters position to PV-loop assessing
3.1 使用绝缘体校准容器进行校正
目前,使用Millar压力容积导管进行压力-容积环测定评价心功能时,多采用绝缘体校准容器将电导率信号转换为容积信号,以避免容器本身所具有的电导对信号的影响。绝缘体校准容器具有多个不同容积的孔,当往这些不孔内注射满大鼠血液后,将Millar管依次插入其中,通过不同孔的容积与电导率信号读数,绘制出两者的关系曲线。根据这一曲线,可以方便地见所测得的电导率数据转换为真实的容积。由于不同大鼠的血液理论上具有不同的电导率,因此每检测一只动物,均应该用该动物的血液进行电导率-容积的转换,即每只动物应该有自己的电导率-真实容积曲线。

图7 呼吸机对压力-容积环测定的影响Fig.7 The infection of respirator on the PV-loop assessment
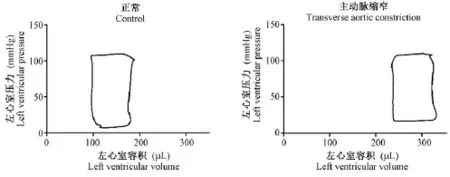
图8 正常生理状态及代偿性心肌肥大状态下的压力-容积曲线Fig.8 PV-loop curves in normal status and compensatory cardiac hypertrophy status
3.2 高渗盐水定标对平行电导校正的影响
平行电导是心室壁和周围组织产生的电导率。干预电极测定心室容积时实际上包含了这部分的电导率,因此需要静脉注射高渗生理盐水改变心室血液的电导率进行平行电导校正[13]。动物注射高渗盐水会增加容量负荷或引起收缩性改变,此时使容积信号发生改变。在收缩末容积-舒张末容积关系图上,收缩末容积与舒张末容积相等时的直线代表心室没有血液(容积信号仅由心室壁及周围组织的平行电导率产生),注射高渗盐水时的容积曲线与此曲线的交点即代表平行电导率引起的容积Vp。
3.3 Millar导管在左心室腔内的位置对压力-容积环测定的影响
压力-容积环的建立关键在于心室容积的测定。由于心室腔本身的形状是不规则的,Millar导管在心室腔内不同的位置,干预电极检测的电导率信号也随之变化。因此对Millar导管在心室腔内的位置进行调整,对于压力-容积环的测定非常重要。测定过程中导管末端的传感器如果与心室壁有接触,将会对信号产生极大干扰,使压力-容积环形状不规则,心功能参数不准确,因此测定时含传感器的导管应完全进入左心室,但又不能接触心室壁。
3.4 呼吸机对压力-容积环测定的影响
Millar导管进入左心室的方式有两种,分别是经右颈总动脉插管(关胸)以及经心尖顶端插管(开胸)。其中经心尖顶端插管必须通上呼吸机,而右颈总动脉插管可选择自由呼吸。但由于此过程必须使用麻醉药,稍微过量的麻醉药会显著抑制心率和心功能而导致测定的数据不准确,例如,动物实验常用的麻醉药戊巴比妥钠还会显著增加呼吸道粘液的分泌导致呼吸暂停甚至窒息死亡。因此,一般建议Millar导管经右颈总动脉插入左心室的过程也通上呼吸机。本研究发现,呼吸机对于左心室压力-容积环的测定会产生显著影响,特别是对左心室容积的测定。因此,为保证心功能测定的顺利进行,可记录停呼吸机几秒的数据,然后继续通上呼吸机。
本研究分别从压力和容积的定标、压力容积导管在左心室腔的位置、呼吸机对评价的影响等方面对大鼠压力容积环测定心功能的方法进行了完善和改进,并以心肌肥大模型进行验证,从而为大鼠健康或疾病状态下的心功能分析提供更为科学全面的分析手段。
参考文献:
[1] Kass DA.Clinical ventricular pathophysiology:a pressurevolume view[M].In:Ventricular Function,edited by Warltier DC.Baltimore,MD:Williams&Wilkins.1995;131-51.
[2] Pacher P,Nagayama,Takahiro,et al.Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats[J].Nature Protocols.2008.3(9):1422-1434.
[3] Shioura KM,Geenen DL,Goldspink PH.Assessment of cardiac function with the pressure-volume conductance system following myocardial infarction in mice[J].Am J Physiol Heart Circ Physiol.2007;293(5):H2870-7.
[4] Kaludercic,NinaTakimoto,EikiNagayama,et al.Monoamine Oxidase A-mediatedenhancedcatabolismofnorepinephrine contributes to Adverse Remodeling and pump failure in hearts with Pressure overload[J].Circ Res,2010,106(1):193 -U401.
[5] Joho S,Ishizaka S,Sievers R,et al.Left ventricular pressurevolume relationship in conscious mice[J].Am J Physiol Heart Circ Physiol.2007;292(1):H369-H377.
[6] Maurer MS,King DL,El-Khoury Rumbarger L,et al.Left heart failure with a normal ejection fraction:identification of different pathophysiologic mechanisms[J].J Card Fail.2005;11(3):177-87.
[7] Maurer MS,Kronzon I,Burkhoff D.Ventricular pump function in heart failure with normal ejection fraction:insights from pressure-volume measurements[J].Prog Cardiovasc Dis.2006;49(3):182-95.
[8] Shoucri RM.End-systolic pressure-volume relation,ejection fraction,and Heart failure:Theoretical aspect and clinical applications[J].Clin Med Insights Cardiol.2015;9(Suppl 1):111-20.
[9] Steendijk P,Smits PC,Valgimigli M,et al.Intramyocardial injection of skeletal myoblasts:long-term follow-up with pressurevolume loops[J].Nat ClinPract Card.2006;3 Suppl 1:S94-100.
[10] Little WC.The left ventricular dP/dtmax-end-diastolic volume relation in closed-chest dogs[J].Circ Res.1985;56:808 -15.
[11] Diakos NA,Pozios I,Katsaros L,et al.Afterload-induced left ventricular diastolic dysfunction during myocardial ischaemia and reperfusion[J].Exp Physiol.2015;100(3):288-301.
[12] Sagawa K,Maughan L,Suga H,et al.Cardiac Contraction and Pressure-VolumeRelationship[M].NewYork:Oxford University Press.1988.
[13] Pacher P,Nagayama T,Mukhopadhyay P,et al.Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats[J].Nat Protoc.2008;3(9):1422 -34.
[14] Clark JE,Marber MS.Advancements in pressure-volume catheter technology-stress remodelling after infarction[J].Exp Physiol. 2013;98(3):614-21.
[15] 王艳飞,曹雪滨,崔英凯,等.改良大鼠左心室插管术及心衰大鼠左心功能指标的测定[J].中国比较医学杂志[J].2008;18(12):34-36.
[16] Rockman HA,Ross RS,Harris AN,et al.Segregation of atrialspecific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy[J]. Proc Natl Acad Sci U S A.1991; 88:8277-81.
[17] Henry Gray.Anatomy of the Human Body[M].Philadelphia and New York:Lea and Febiger.1918;plate 506.
[18] Connelly KA,Prior DL,Kelly DJ,et al.Load-sensitive measures may overestimate global systolic function in the presence of left ventricularhypertrophy:acomparisonwithload-insensitive measures[J].Am J Physiol Heart Circ Physiol.2006;290(4):H1699-705.
〔修回日期〕2016-03-09
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016)06-0075-08
doi:10.3969.j.issn.1671-7856.2016.006.014
[基金项目]广州市重大专项科技项目(201300000051)。
[作者简介]刘晓雨(1990-),男,硕士生,主要研究方向:心肌肥大与心衰相关疾病,Email:513688273@qq.com。
[通讯作者]谭文,男,教授,主要从事医药生物学研究,Email:went@scut.edu.cn。better PV loops,it's important to adjust the position of the catheter in the left ventricle until all of the pressure and volume sensors were located in the ventricle as well as out of touch with the ventricular wall.3.Suspension the ventilator during the test is conducive to stable and reasonable data acquisition.We further assessed the cardiac functions of healthy rats and rats with cardiac hypertrophy with this improved method,which showed better performances.Conclusions This study we have evaluated the influences of calibration of volume,position of the catheter in the left ventricle(LV)and ventilator on measurements of rats PV loops,and further improved this method.Moreover,we have validated this method with measurements of cardiac functions of normal rats and cardiac hypertrophic rats.
Improvements and key points in the assessment of rat cardiac function using pressure-volume loop
LIU Xiao-yu,TAN Wen
(School of Bioscience and Bioengineering,South China University of Technology,Pre-Incubator for Innovative Drugs and Medicine Center,South China University of Technology,Guangdong Provincial Key Laboratory of Fermentation and Enzyme Engineering,Guangzhou 510006,China)
【Abstract】Objective To investigate the key factors for PV Loop evaluation in rats and to improve this method.To provide examples of cardiac function measurements obtained from normal rats and from rats with cardiac hypertrophy induced by transverse aortic constriction(TAC).To establish a more reliable method for rats heart measurements. Methods Rats underwent left ventricular catheterization through the right carotid artery.Through adjustments of the position of the pressure-volume conductance catheter,the optimal PV Loops and a number of cardiac functional parameters were acquired.The key influencing factors,calibration of volume,position of the catheter in the left ventricle(LV)and suspension of ventilator were assessed.Results 1.The real volume of left ventricle were acquired by injecting appropriate volume of hypertonic saline through jugular vein,which deducted the parallel conductivities of ventricular wall.2.To get
【Key words】Pressure-volume loop;Transverse aortic constriction;Cardiac function;Method improvement

