辛伐他汀不同干预方案对骨质疏松大鼠骨质量的影响
刘 昊,张 岩,张国彬2,邢 磊,贾忠宝2,田发明3
(华北理工大学1附属医院;2研究生学院;3医学实验研究中心;唐山063000)
辛伐他汀不同干预方案对骨质疏松大鼠骨质量的影响
刘 昊1,张 岩1,张国彬2,邢 磊1,贾忠宝2,田发明3
(华北理工大学1附属医院;2研究生学院;3医学实验研究中心;唐山063000)
【摘要】目的 探讨和比较不同干预方案下辛伐他汀对去卵巢大鼠骨丢失和骨质量下降的干预效果。方法 3月龄雌性SD大鼠32只,随机分为4组,每组8只:假手术(A)组、卵巢切除(B)组、卵巢切除加辛伐他汀前半程干预组(C)和后半程干预组(D)。除A组接受假手术外,其余各组大鼠行双侧卵巢切除术,C组于术后给予辛伐他汀(5 mg/kg/d)干预10周后停药,D组于术后10周开始接受辛伐他汀干预。术后20周处死所有大鼠,采用酶联免疫吸附测定法(ELISA)检测血清I型前胶原氨基端前肽(PINP)、I型胶原羧基端交联端肽(ICTP)水平,取第3、4、5腰椎,双能X线法检测大鼠第3腰椎骨密度,压缩试验检测第4腰椎侧最大载荷、弹性模量等生物力学指标,微计算机断层扫描技术(micro-CT)检测第5腰椎松质骨骨量和微观结构。结果 (1)血清学检测结果:B、C、D组PINP 和ICTP均显著高于A组;(2)骨密度:B组显著低于其余各组,C、D组显著低于A组(P<0.05);(3)生物力学:最大载荷、弹性模量B组显著低于其余3组(P<0.05)、C、D组显著低于A组(P<0.05);4、micro-CT:A组骨容积率(BV/TV)、骨小梁数量(Tb.N)显著高于其余3组,骨小梁分离度(Tb.Sp)显著低于其余3组(P<0.05),C、D组Tb.Sp显著低于B组(P<0.05)。结论 大鼠去卵巢20周后发生明显骨量丢失和骨质量下降,选择前半程干预和后半程干预均能部分阻止该模型骨量丢失、微结构退变和力学性能下降,但骨密度均不能恢复到正常水平。
【关键词】辛伐他汀;骨质疏松;骨密度;生物力学;Micro-CT
辛伐他汀是3-羟基3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl-coenzyme A,HMG-CoA)还原酶抑制剂家族成员之一,通过抑制胆固醇合成链中的限速酶HMG-CoA还原酶,减少胆固醇合成,目前临床上主要用于治疗高脂血症。1999年Mundy等[1]首次通过药物筛选报道了辛伐他汀具有促进骨形成的作用潜能,此后大量研究开始关注辛伐他汀的成骨作用,结果发现不同干预方式辛伐他汀促骨形成作用效果差异显著[2-6]。其中以体内给药干预的实验中结果的争议较多。虽然有部分研究肯定了辛伐他汀系统性给药的作用潜能[4],但也有临床和基础实验,未能发现辛伐他汀显著的促进成骨作用,则对此提出了质疑[5,6]。本研究在同一实验中采用不同干预方案,观察两者对卵巢切除造成的大鼠骨质疏松模型干预效果及其差别,以期为后续相关研究乃至临床应用提供理论参考和实验依据。
1 材料和方法
1.1 材料与设备
本研究应用3月龄清洁级雌性SD大鼠32只,(购自北京维通利华实验动物中心,动物合格证号SCXK(京)2013-0002号)体重(250±20)g,动物使用许可证号SYXK(冀)2010-0038。辛伐他汀(西之达,浙江瑞邦药业有限公司生产),酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(上海史瑞可生物科技有限公司),骨密度分析仪(美国Norland公司),AG-IS型生物力学分析系统(日本岛津公司)。
1.2 动物分组及处理
所有大鼠采用数字表法随机分为4组,每组8只:假手术组(Sham)只暴露卵巢,不予切除,直接缝合;其余大鼠接收双侧卵巢切除术,方法参照以往研究[7-12]。术后给予抗生素3 d,卵巢切除(B)组、卵巢切除加辛伐他汀前半程干预组(C)和后半程干预组(D)。除A组接受假手术外,其余各组大鼠行双侧卵巢切除术,B组为模型对照组,C组于术后给予辛伐他汀(5 mg/kg.d)灌胃干预10周后停药,D组于术后10周开始接受辛伐他汀干预。术后20周处死所有大鼠,采用ELISA法检测血清骨代谢标志物水平,取第3、4、5腰椎,双能X线法检测大鼠第3腰椎骨密度,压缩试验检测第4腰椎侧最大载荷、弹性模量等生物力学指标,微计算机断层扫描技术(microcomputed tomography,micro-CT)检测第5腰椎松质骨骨量和微观结构。
1.3 ELISA检测血清骨代谢指标
参照试剂盒说明,采用ELISA法检测血I型前胶原氨基端前肽(procollagen type I N-terminal propeptide,PINP)、I型胶原羧基端交联端肽(crosslinked C-telopeptides of type I collagen,ICTP)血清含量。
1.4 骨密度分析
应用 Norland-XR36双能 X线吸收测量 (dual energy X-ray absorptiometre,DEXA)骨密度仪,采用小物体扫描模式,准确度0.01%,扫描速度60 mm/ s,分辨率(resolution)1.0 mm ×1.0 mm,扫描宽度5.0 cm的参数值,检测第3腰椎,采用小动物扫描模式进行扫描。扫描结束后,用仪器自选工具选定兴趣区,读出每个标本的骨密度值。
1.5 生物力学分析
参照以往研究[12],于实验开始前去除第4腰椎椎体所有附件,包括横突、上下关节突、椎弓根及椎板等附件,仅保留椎体组织。并将椎体上下面进行打磨,制作成高度约为5 mm的标准件,椎体上下面应与椎体纵轴垂直。假设椎体为圆柱形,并根据每个椎体的前后径,计算出标准件的平均直径和体界面积。用胶水将椎体下端固定于测试平台上,以5 mm/min的速度进行椎体轴向压缩,直至椎体出现断裂,记录并分析最大压缩载荷及弹性模量。取所有大鼠的右侧股骨行三点弯曲试验,支点跨距(L)为20 mm,中央垂直(股骨与载荷成90°角)施加载荷,速率10 mm/min,直至股骨断裂,记录并分析最大压缩载荷及弹性模量。
1.6 Micro-CT检测
应用 SkyScan 1076Micro-CT(SkyScan,Aartselaar,Belgium)对第5腰椎体进行扫描检测,在40 k Vp及250 μA的条件下对标本进行扫描,收集数据,并利用Micro-CT配套软件对扫描图像进行三维重建及结果分析。兴趣区为上端生长板下1 mm至4 mm,直径为1.5 mm的圆柱体(皮质骨内侧的松质骨)。检测指标有:骨容积率(bone volume fraction,BV/TV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁数量(trabecular number,Tb.N)、骨小梁分离度(trabecular separation,Tb.Sp)。
1.7 统计学方法
实验数据建立Excel数据库,资料用SPSS 19.0来处理。各组数据经过Shapiro-Wilk正态性检验和Bartlett方差齐次检验后,利用单因素方差分析比较各组之间的差异,LSD-t检验比较两组间差异,P<0.05为差异有显著性意义。
2 结果
2.1 动物死亡情况
A组无大鼠死亡,B组有1只大鼠因腹胀死亡、C组有2只大鼠分别因为感染和不明原因死亡,D组有1只大鼠因麻醉死亡,最终各组分别有8、7、6、7只动物纳入最终结果。
2.2 血清学检测结果
PINP血清水平:A组PINP血清水平均显著低于其余三组(P<0.05);C、D高于B组,但差异无统计学意义(P>0.05);
ICTP血清水平:A组ICTP血清水平均显著低于其余三组(P<0.05);C、D低于B组,但差异无统计学意义(P>0.05)(表1)。
2.3 骨密度
表2示各组第3腰椎骨密度检测结果比较:B组显著低于其余各组(P<0.05),C、D组显著低于A组(P<0.05),与B组比较,C、D组骨密度分别提高6.16%和4.94%;C组高于D组,但差别无统计学意义(P>0.05)。
2.4 生物力学
表3示生物力学检测结果:各组间比较,第4腰椎最大载荷和弹性模量差异趋势相同:B组显著低于其余3组(P<0.05),C、D组显著低于A组(P<0.05),与B组相比,C组最大载荷和弹性模量分别提高45.1%和44.2%,D组最大载荷和弹性模量分别提高了38.4%和40.88%。
2.5 micro-CT检测结果
表4示micro-CT分析结果:BV/TV:A组显著高于其余各组(P<0.05),C、D高于B组,但差异无统计学意义;Tb.Th:由高到低依次为A、C、D、B组,但各组间比较差别均无统计学意义(P>0.05);Tb. N:A组显著高于B组(P<0.05),其余组间比较,差异无统计学意义(P>0.05);Tb.Sp:A组显著低于其余各组(P<0.05),C、D组显著低于B组(P<0.05)。三维重建结果见图1。
表1 血清学检测结果(±s)Tab.1 Results of serum PINP and ICTP analysis(±s)

表1 血清学检测结果(±s)Tab.1 Results of serum PINP and ICTP analysis(±s)
*与A组比较P<0.05
后半程干预组(D)(n=7)I型前胶原氨基端前肽PINP(μg/L) 95.17±13.81 170.83±14.43* 176.33±19.78* 175.50±8.66*I型胶原羧基端交联端肽ICTP(μg/L) 3.13±0.43 4.52±0.31* 4.35±0.19* 4.20±0.43*假手术组 卵巢切除组 卵巢切除加辛伐他项目Items (A)(n=8)(B)(n=7)汀前半程干预组(C)(n=6)
表2 骨密度检测结果(±s,n=8)Tab.2 Results of BMD test(±s,n=8)

表2 骨密度检测结果(±s,n=8)Tab.2 Results of BMD test(±s,n=8)
Note.*P<0.05 vs.the group A;#P<0.05 vs.the group B.
后半程干预组(D)(n=7)L3(g/cm2) 0.2743±0.0085 0.2367±0.0069* 0.2513±0.0079*# 0.2484±0.0076*#项目Items 假手术组(A)(n=8)卵巢切除组(B)(n=7)卵巢切除加辛伐他汀前半程干预组(C)(n=6)
表3 生物力学检测结果(±s,n=8)Tab.3 Results of biomechanical test.(±s,n=8)

表3 生物力学检测结果(±s,n=8)Tab.3 Results of biomechanical test.(±s,n=8)
Note.*P<0.05 vs.the group A;#P<0.05 vs.the group B.
后半程干预组(D)(n=7)最大载荷(N) 197.2±18.1 121.5±16.4* 176.3±24.9*# 168.2±16.8*#弹性模量(MPa) 815.0±57.7 479.5±76.0* 691.2±70.29*# 675.5±32.6*#项目Items 假手术组(A)(n=8)卵巢切除组(B)(n=7)卵巢切除加辛伐他汀前半程干预组(C)(n=6)
表4 micro-CT检测结果(±s,n=8)Tab.4 Results of micro-CT measurement.(±s,n=8)

表4 micro-CT检测结果(±s,n=8)Tab.4 Results of micro-CT measurement.(±s,n=8)
Note.*P<0.05 vs.the group A;#P<0.05 vs.the group B.
项目Items后半程干预组(D)(n=7)骨容积率BV/TV 26.13±2.10 19.83±2.24* 22.35±2.35* 21.38±2.26*骨小梁厚度Tb.Th 105.26±6.0 99.62±5.52 102.79±3.26 100.64±4.51骨小梁数量Tb.N 2.36±0.30 1.88±0.38* 2.12±0.39 2.11±0.34骨小梁分离度Tb.Sp 236.13±28.80 358.08±43.79* 294.33±26.30*# 305.83±51.90*#假手术组(A)(n=8)卵巢切除组(B)(n=7)卵巢切除加辛伐他汀前半程干预组(C)(n=6)
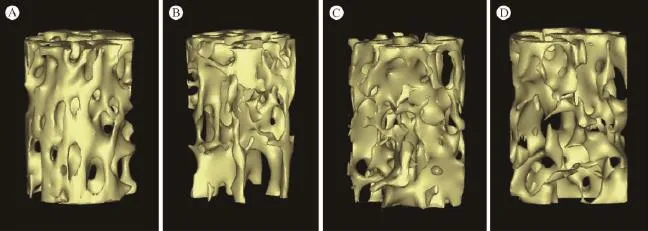
A,假手术组;B,卵巢切除组;C,前半程干预组;D,后半程干预组图1 L5 Micro-CT三维重建图A,Sham group;B,OVX group;C,first half period treated group;D,latter half period treated group Fig.1 Reconstruction of micro-CT images of L5 vertebrae
3 讨论
双侧卵巢切除大鼠因雌激素衰退导致骨转换水平增高,且骨吸收活性更加活跃,导致骨量丢失,其表现与人类绝经后骨质疏松相似,也因此成为目前最为常用的绝经后骨质疏松动物模型[7-12]。本研究在证实雌性大鼠卵巢切除后20周发生明显的骨量丢失、微观结构退变和生物力学性能下降的基础上,发现辛伐他汀两种干预方式,即前半程干预和后半程干预均可部分阻止该模型大鼠骨量丢失、微结构和生物力学性能退变,但骨密度均不能恢复至正常水平。
目前国内外针对辛伐他汀成骨潜能的研究大致分为系统性干预、局部用药以及体外刺激细胞三种,其中局部用药干预[2,3,13]及体外刺激细胞[14-17]的研究结果大多证实了辛伐他汀促进骨形成的作用潜能,但在系统性干预相关研究中,一部分研究肯定了辛伐他汀的成骨潜能[18-21],但也有研究结果未能证实其促进成骨作用[5,6,22]。作者认为,这些结果的矛盾主要原因,一方面与辛伐他汀本身代谢特点有关-即灌胃给药经肝脏代谢后仅有少量药物进入外周循环,对骨组织干预效果较弱,另一方面,与实验设计的差异以及不同实验的动物和药物本身的差别有关,因此本研究通过同一药物同批动物采用不同干预方案验证辛伐他汀对该模型骨量丢失的干预效果的差异,我们分别选取前半程干预和后半程干预,虽然从数值高低的统计分析我们没有发现两者的显著差异,但是与模型组比较,前半程干预组对骨密度、生物力学性能提高的比例、骨小梁分离度降低的比例均高于后半程干预组,提示该剂量下辛伐他汀预防性干预可能较治疗性干预对OVX大鼠骨丢失的干预效果更好,当然,这一推测需要进一步研究证实。
本研究中经micro-CT对松质骨的骨量和微结构的分析并未发现辛伐他汀能显著提高OVX大鼠骨密度,这与骨密度和生物力学检测结果并不一致。进一步对结果分析发现,虽然没有统计学差异,但辛伐他汀干预组骨量和微结构数据均优于模型组,作者认为,而micro-CT只反映松质骨的情况,而骨密度和生物力学指标反映的是整个椎体骨的骨量和力学性能,辛伐他汀对骨密度和力学性能的影响是其对皮质骨和松质骨共同作用的结果,可能辛伐他汀对两者任一的作用都不足够显著,但两者相加则达到显著水平。
PINP即I型前胶原氨基端前肽,是成骨细胞合成并释放出I型前胶原的细胞外分解产物,PINP在血液中的含量主要反映骨转换的情况和I型胶原的合成速率,升高提示骨转换活跃,I型胶原合成速率加快。目前认为PINP是新骨形成及骨转换水平的特异性的敏感指标[23-26]。ICTP是骨吸收过程中骨基质中I型胶原分解产物,具有很强的特异性,是反映骨吸收活跃程度的主要生化标志物之一[27]。本研究发现,大鼠卵巢切除后20周,两者血清水平均明显高于对照组,提示其骨转换仍处于较高水平,与人类绝经后骨质疏松的骨代谢状态一致。以往多数研究认为辛伐他汀的作用主要是促进骨形成[1-4],也有研究发现辛伐他汀干预卵巢切除大鼠既可以促进骨形成,又可以抑制骨吸收[28]。本研究发现辛伐他汀干预组PINP较模型组有升高趋势,ICTP有下降趋势,但两者均未能达到显著水平。考虑到本研究仅选取一个时间点检测了两个指标,不能完全反映骨代谢的动态变化,而以往研究也有骨代谢血清标志物水平与骨量变化不一致的结果[28]。
综上,辛伐他汀预防性干预和治疗性干预均可部分阻止该模型骨量减少、力学性能退变、微结构改变,两者相比,虽然没有统计学差异,但预防性干预表现出较治疗性干预效果更好的趋势,但仍需后续研究提供更确实的证据。
参考文献:
[1] Mundy G,Garrett R,Harris S,et al.Stimulation of bone formation in vitro and in rodents by statins[J].Science,1999,286(5446):1946-1949.
[2] Yang N,Cui Y,Tan J,et al.Local injection of a single dose of simvastatin augments osteoporotic bone mass in ovariectomized rats[J].J Bone Miner Metab,2014,32(3):252-260.
[3] Tan J,Yang N,Fu X,et al.Single-dose local simvastatin injection improves implant fixation via increased angiogenesis and bone formation in an ovariectomized rat model[J].Med Sci Monit,2015,21:1428-1439.
[4] Oxlund H,Andreassen TT.Simvastatin treatment partially prevents ovariectomy-induced bone loss while increasing cortical bone formation[J].Bone,2004,34(4):609-618.
[5] Van Staa TP,Wegman S,de Vres F,et al.Use of statins and risk of fractures[J].JAMA,2001,285(14):1850-1855.
[6] Von Stechow D,Fish S,Yahalom D,et al.Does simvastatin stimulate bone formation in vivo?[J].BMC Musculoskelet Disord,2003;4:8.
[7] Oliver RA,Yu Y,Yee G,et al.Poor histological healing of a femoral fracture following 12 months of oestrogen deficiency in rats[J].Osteoporos Int,2013,24(10):2581-2589.
[8] Durão SF,Gomes PS,Colaço BJ,et al.The biomaterialmediatedhealingofcriticalsizebonedefectsinthe ovariectomized rat[J].Osteoporos Int,2014,25(5):1535 -1545.
[9] Oliver RA,Yu Y,Yee G,et al.Poor histological healing of a femoral fracture following 12 months of oestrogen deficiency in rats[J].Osteoporos Int,2013,24(10):2581-2589.
[10] Durão SF,Gomes PS,Colaço BJ,et al.The biomaterialmediatedhealingofcriticalsizebonedefectsinthe ovariectomized rat[J].Osteoporos Int.2014,25(5):1535 -1545.
[11] Qiu C,Liu X,Wang J,Zhao Y,et al.Estrogen increases the transcription of human α2-Heremans-Schmid-glycoprotein by an interplay of estrogen receptor α and activator protein-1[J]. Osteoporos Int,2014,25(4):1357-1367.
[12] Luo Y,Zhang L,Wang WY,et al.Alendronate retards the progressionoflumbarintervertebraldiscdegenerationin ovariectomized rats[J].Bone,2013,55(2):439-448.
[13] Wang JW,Xu SW,Yang DS,et al.Locally applied simvastatin promotes fracture healing in ovariectomized rat[J].Osteoporos Int,2007,18(12):1641-1650.
[14] Chen PY,Sun JS,Tsuang YH,et al.Simvastatin promotes osteoblast viability and differentiation via Ras/Smad/ERK/BMP-2 signaling pathway[J].Nutr Res,2010,30(3):191-199.
[15] Kim IS,Jeong BC,Kim OS,et al.Lactone form 3-hydroxy-3-methylglutaryl-coenzymeAreductaseinhibitors(statins)stimulate the osteoblastic differentiation of mouse periodontal ligament cells via the ERK pathway[J].J Periodontal Res,2011,46(2):204-213.
[16] Qiao LJ,Kang KL,Heo JS.Simvastatin promotes osteogenic differentiation of mouse embryonic stem cells via canonical wnt/ β-catenin signaling[J].Mol Cells,2011,32(5):437-444.
[17] Miyazawa A,Matsuno T,Asano K,et al.Controlled release of simvastatin from biodegradable hydrogels promotes odontoblastic differentiation[J].Dent Mater J,2015,34(4):466-474.
[18] Ho ML,Chen YH,Liao HJ,et al.Simvastatin increases osteoblasts and osteogenic proteins in ovariectomized rats[J]. Eur J Clin Invest,2009,39(4):296-303.
[19] Seferos N,Pantopoulou A,Kotsiou A,et al.The influence of simvastatin inratsmandibleandfemurbonemassunder Freund's adjuvant arthritis[J].Stomatologija,2012,14(2):46-52.
[20] Chan MH,Mak TW,Chiu RW,et al.Simvastatin increases serumosteocalcinconcentrationinpatientstreatedfor hypercholesterolaemia[J].J Clin Endocrinol Metab,2001,86:4556-4559.
[21] Meier CR,Schlienger RG,Kraenzlin ME,et al.HMG-CoA reductase inhibitors and the risk of fractures[J].JAMA,2000,283:3205-3210.
[22] Yao W,Farmer R,Cooper R,et al.Simvastatin did not prevent nor restore ovariectomy-induced bone loss in adult rats[J].J Musculoskelet Neuronal Interact.2006,6(3):277-283.
[23] Chen C,Liang MK,Zhang H,et al.Relationships between agerelated biochemical markers of bone turnover and OPG,TGF-β1 and TGF-β2 in native Chinese women[J].Endocr Res,2014,39(3):105-114.
[24] Bauer DC,Garnero P,Harrison SL,et al.Biochemical markers of bone turnover,hip bone loss,and fracture in older men:the 18MrOS study[J].J Bone Miner Res,2009,24(12):2032 -2038.
[25] Burshell AL,Möricke R,Correa-Rotter R,et al.Correlations between biochemical markers of bone turnover and bone density responses in patients with glucocorticoid-induced osteoporosis treated with teriparatide or alendronate[J].Bone,2010,46 (4):935-939.
[26] Boonyanurak P,Wilawan K.Levels of biochemical bone marker procollagen type I N-propeptide(PINP)in Thai women aged 40 -70 years[J].J Med Assoc Thai,2009,92(7):873-877.
[27] Naylor KE,Jacques RM,Paggiosi M,et al.Response of bone turnover markers to three oral bisphosphonate therapies in postmenopausal osteoporosis:the TRIO study[J].Osteoporos Int,2016,27(1):21-31.
[28] Chen SH,Chou FF,Ko JY.The use of simvastatin with aromasin in an ovariectomized rat model:effects on the skeletal system[J].Chang Gung Med J,2010,33(5):509-51.
〔修回日期〕2016-03-23
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016)06-0042-06
doi:10.3969.j.issn.1671-7856.2016.06.009
[基金项目]河北省自然科学基金(H2013209255)、河北省高等学校科学研究计划(QN20131007)、唐山市老年医学重点实验室资助项目(14140221B)。
[作者简介]刘昊,主治医师,主要从事骨与关节退行性疾病的研究。E-mail:15100526293@163.com。
[通讯作者]田发明,副教授,硕士研究生导师,E-mail:tfm9911316@163.com。to detect the bone mineral density,L4 vertebra was used to analyze the maximum loading and elastic modulus by compression test,and the microstructure of the L5 vertebra was detected by micro-computed tomography.Results 1. ELISA analysis:the concentrations of serum P1NP and ICTP in the groups A,B and C were significantly higher than that of group A(P<0.05).2.BMD test showed that the rats in group B had significantly lower BMD than the other 3 groups(P <0.05),while the BMD of groups C and D were markedly lower than that of group A(P<0.05).3.Biomechanical test:the maximum load and elastic modulus of L4 vertebrae in the group B were significantly lower than the other 3 groups(P<0.05),and those of the groups C and D were markedly lower than that in the group A(P<0.05).4.micro-CT:BV/TV and Tb.N in the sham operated rats were significantly higher than those of the other 3 groups,while the opposite trends was found in Tb.Sp(P<0.05),and the Tb.Sp in the groups C and D were significantly lower than that of group B(P<0.05).Conclusions Our data demonstrate that bone loss and deterioration of bone micro-structure and biomechanical properties occurred at 20 weeks after ovariectomy,both the first-half-period and latter-half-period treatment by simvastatin may partially prevent these changes,but can not restore the BMD to normal level.
Effects of simvastatin treatment with different intervention programs on the bone quality of osteoporotic rats
LIU Hao1,ZHANG Yan1,ZHANG Guo-bin2,XING Lei1,JIA Zhong-bao2,TIAN Fa-ming3.
(1.Affiliated Hospital,2.Graduate School,3.Medical Research Center,North China University of Science and Technology,Tangshan 063000,China)
【Abstract】Objective To investigate the effects of simvastatin on the bone loss and deterioration of bone quality with different intervention programs.Methods Thirty two 3-month-old female Sprague-Dawley(SD)rats were randomized into 4 groups of 8 animals in each:All rats but those in the sham group(A)received bilateral ovariectomy,and treated by vehicle(B),simvastatin(5 mg/kg/day)at first half period(C)or at latter half period(D).The rats in group C received simvastatin by a gavage after the OVX operation immediately,and stopped at 10 weeks after OVX.The rats in group D began to receive simvastatin treatment from 10 weeks after OVX and ended at 20 weeks after OVX.At week 20,all rats were sacrificed and the concentrations of serum PINP and ICTP were detected by ELISA,L3 vertabra was used
【Key words】Simvastatin;Osteoporosis;Bone mineral density;Biomechanics;Micro-CT;Rats

