浙江省不同地理株白纹伊蚊mtDNA-COⅠ基因多态性研究
郭 颂,凌 锋,王金娜,吴瑜燕,侯 娟,龚震宇
浙江省不同地理株白纹伊蚊mtDNA-COⅠ基因多态性研究
郭颂,凌锋,王金娜,吴瑜燕,侯娟,龚震宇
浙江省疾病预防控制中心,杭州310051
摘要:目的比较浙江省不同地理区域白纹伊蚊种群线粒体细胞色素C氧化酶亚基Ⅰ(mtDNA-COⅠ)序列的多态性,探讨其遗传特征。方法采集登革热历史流行区和非流行区的白纹伊蚊雌性成蚊,PCR扩增COⅠ基因,测序后结合Genbank中获得的各地白纹伊蚊序列进行比对,分析基因特征和种群分化并构建系统进化树。结果用于分析的线粒体COⅠ基因长度为686 bp,碱基A+T平均含量为67.8%,G+C平均含量为32.2%,变异位点中包括15个碱基转换位点和3个颠换位点。96个个体中存在20个单倍型,整体单倍型多样性为0.497,核酸多样性为0.717,核酸平均差异数为0.001 05。衢州、温州苍南和丽水的白纹伊蚊COⅠ序列多态性高于其它地区,且温州苍南和衢州白纹伊蚊种群与其它地区白纹伊蚊种群存在中等遗传分化。结论浙江省不同地理株白纹伊蚊COⅠ序列表现出一定程度的遗传多态性和的遗传分化,可能由环境、气候和人文因素综合所致。
关键词:白纹伊蚊;细胞色素C氧化酶亚基Ⅰ;多态性
白纹伊蚊(Aedesalbopictus)在中国分布广泛,是浙江省登革热的唯一传播媒介,并且严重骚扰人群的正常生活。近年来由于全球气候的变化,城市及区域间的交通运输和人员交流的频繁,以及生态环境的变迁等,使得白纹伊蚊的种群密度和分布发生新的变化[1],还由于登革热输入病例对浙江省的登革热防控带来的考验。不同种间、不同地理株蚊虫的生态习性与传播疾病的类别和能力均有一定的差异[2]。线粒体的细胞色素C氧化酶亚基Ⅰ(COⅠ)基因拥有合适的长度和进化速率,能保证足够变异的同时又容易被通用引物所扩增,且序列本身几乎没有插入和缺失突变等,其在蚊种鉴定和遗传差异分析方面应用广泛[3-4]。特检测浙江省登革热历史流行区和非流行区的白纹伊蚊COⅠ序列遗传特征,探讨不同蚊虫群体的COⅠ基因分化及遗传差异。
1材料与方法
1.1样本的获取和基因组DNA的提取考虑浙江省登革热历史及地理区域代表性和对照原则,选择杭州市、宁波市、嵊泗县、建德市、衢州市、义乌市、丽水市和温州苍南县8个白纹伊蚊采样点。其中义乌市和宁波市为登革热历史流行区。每个采样点按照东南西北4个方位通过人诱法捕捉白纹伊蚊雌性成蚊,采集的标本浸入无水乙醇置于-80 ℃冰箱保存。采用DNA提取试剂盒(QIAGEN:69506)提取单个白纹伊蚊基因组DNA,-20 ℃保存备用。
1.2白纹伊蚊COⅠ基因的扩增和测序参考Folmer等[5]扩增COI基因的通用引物,上下游引物分别为,LCO1490:5′-GGTCAACAAATCATAAAGATATTGG-3′,HCO2198:5′-TAAACTTCAGGGTGACCAAAAAATCA-3′,引物由上海生工生物工程有限公司合成。以单个蚊虫基因组DNA为模板扩增COⅠ基因片段,采用25 μL反应体系:PCR预混液(Takara)12.5 μL,上下游引物(10 pmol/μL)各0.5 μL,DNA模板1.5 μL,ddH2O 10 μL。反应条件:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共35个循环;72 ℃后延伸7 min。扩增完后用1%的琼脂糖凝胶电泳检测扩增结果,产物4 ℃保存,阳性产物送至上海生工生物工程有限公司测序。
1.3COⅠ基因序列分析利用Lasergene v7.0软件查看基因的双向测序峰图,核对正确之后应用Mega 6.0进行比对。应用DnaSP v5软件统计各个地理种群COⅠ基因片段的多态性位点(polymorphic sites)、单倍型数(number of haplotypes)、单倍型多样性 (Hd,haplotype diversity)、核酸多样性 (π,nucleotide diversity)和核酸平均差异数(K,mean number of pairwise differences)。应用Arlequin v3.5软件,计算群体间的分化指数(Fst,F-statistics)和基因流(Nm,Nm=(1-Fst)/4Fst)。
使用Mega 6软件构建系统发生树,采用基于Kimura双参数校正模型的邻接法(neighbor-joining,NJ)方法,并用Bootstraping法对系统发生树进行评估,Bootstrap次数设置为1 000。分析中同时加入了从GenBank中获得的白纹伊蚊单倍型序列,GenBank序列号如下:AB738203(日本),HQ398902(越南),KF406541(巴基斯坦),KJ410335(印度),GQ143719(澳大利亚),KP843400(泰国),KC920788(马来西亚),KR068634(中国南京),JQ235749(中国云南),JQ728301(中国海南),NC006817(中国台湾)。
2结果
2.1白纹伊蚊COⅠ基因测序及变异分析从浙江省8个采样点共采集到96只雌性白纹伊蚊成蚊,提取基因组DNA并全部成功扩增出COⅠ基因,各个采样点COⅠ基因信息见表1。8个白纹伊蚊种群一共获得96个COⅠ序列,与GenBank收录的白纹伊蚊线粒体全序列(NC006817)进行比较,与其中编码COⅠ基因的序列相似性均达到99%以上,用于分析的序列长度为686 bp,无插入和缺失突变。所得COⅠ序列的平均A、T、G、C碱基含量分别为28.4%、39.4%、15.9%、16.3%,A+T的平均含量为67.8%,明显高于G+C平均含量32.2%,与双翅目昆虫的线粒体DNA的碱基组成一致。所分析的序列包含667个保守位点和18个变异位点,由此区分为20个单倍型,变异位点包含8个A/G转换,7个T/C转换, 2个A/T颠换和 1个C/G颠换(表2)。
所有的白纹伊蚊种群中温州苍南白纹伊蚊种群的COⅠ基因序列表现出最高的多样性(Hd=0.803,K=1.288,π=0.00 188),其次是衢州(Hd=0.758,K=1.045,π=0.001 52)和丽水(Hd=0.576,K=0.833,π=0.001 21)的白纹伊蚊种群,舟山嵊泗和义乌白纹伊蚊种群的COⅠ基因序列的多样性相对较低。
2.2种群分化和基因流种群分化指数(Fst)常用来表示两个种群间的遗传分化程度,在所选取的8个白纹伊蚊地理种群的配对Fst比较中,杭州、宁波、嵊泗、建德、丽水和义乌的白纹伊蚊种群之间的Fst值很低且统计学检验无统计学意义(P>0.05),表明这6个群体间无显著的遗传分化。而温州苍南种群分别与其他地区种群的Fst在0.077~0.127之间,表现出中等遗传分化,衢州种群与其他地区种群的Fst在0.061~0.091之间,也表现出中等遗传分化。白纹伊蚊种群间分化程度最大的是苍南和舟山嵊泗种群。苍南和衢州种群与其他地区种群之间的Nm均小于4,种群间基因交流较低。
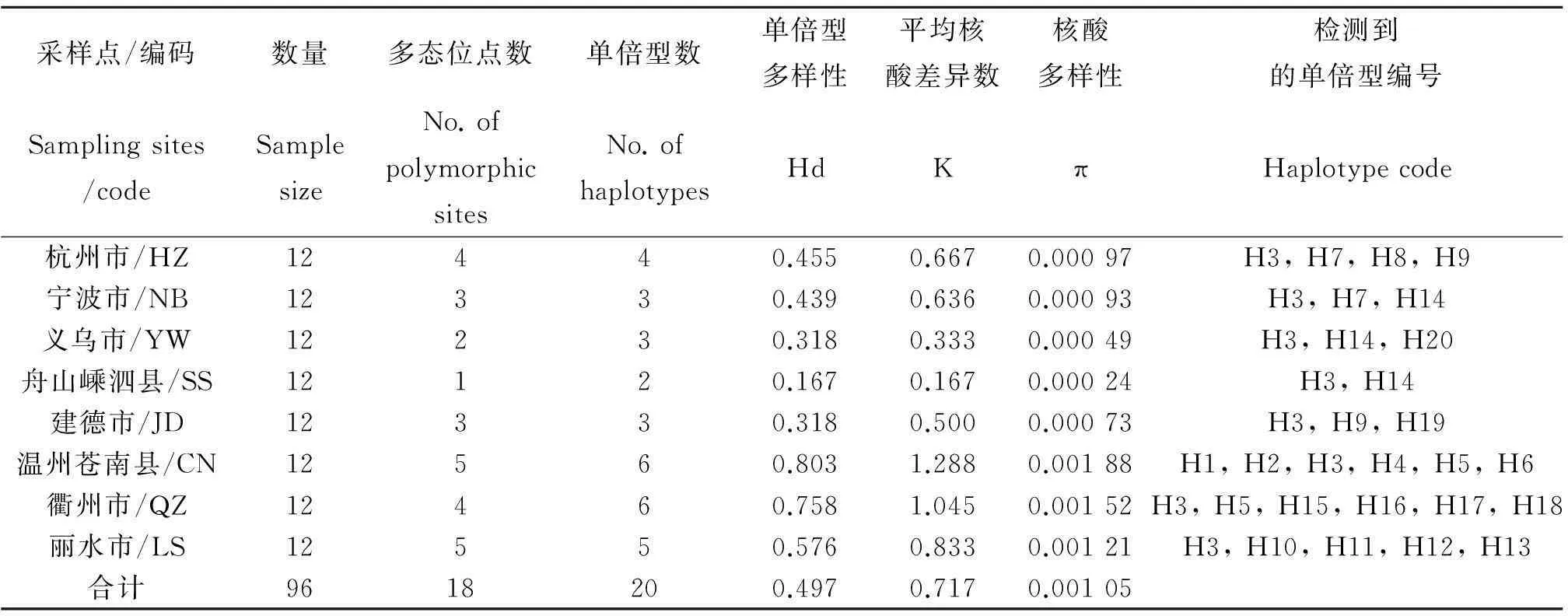
表1 不同采样点白纹伊蚊COⅠ基因多态性信息
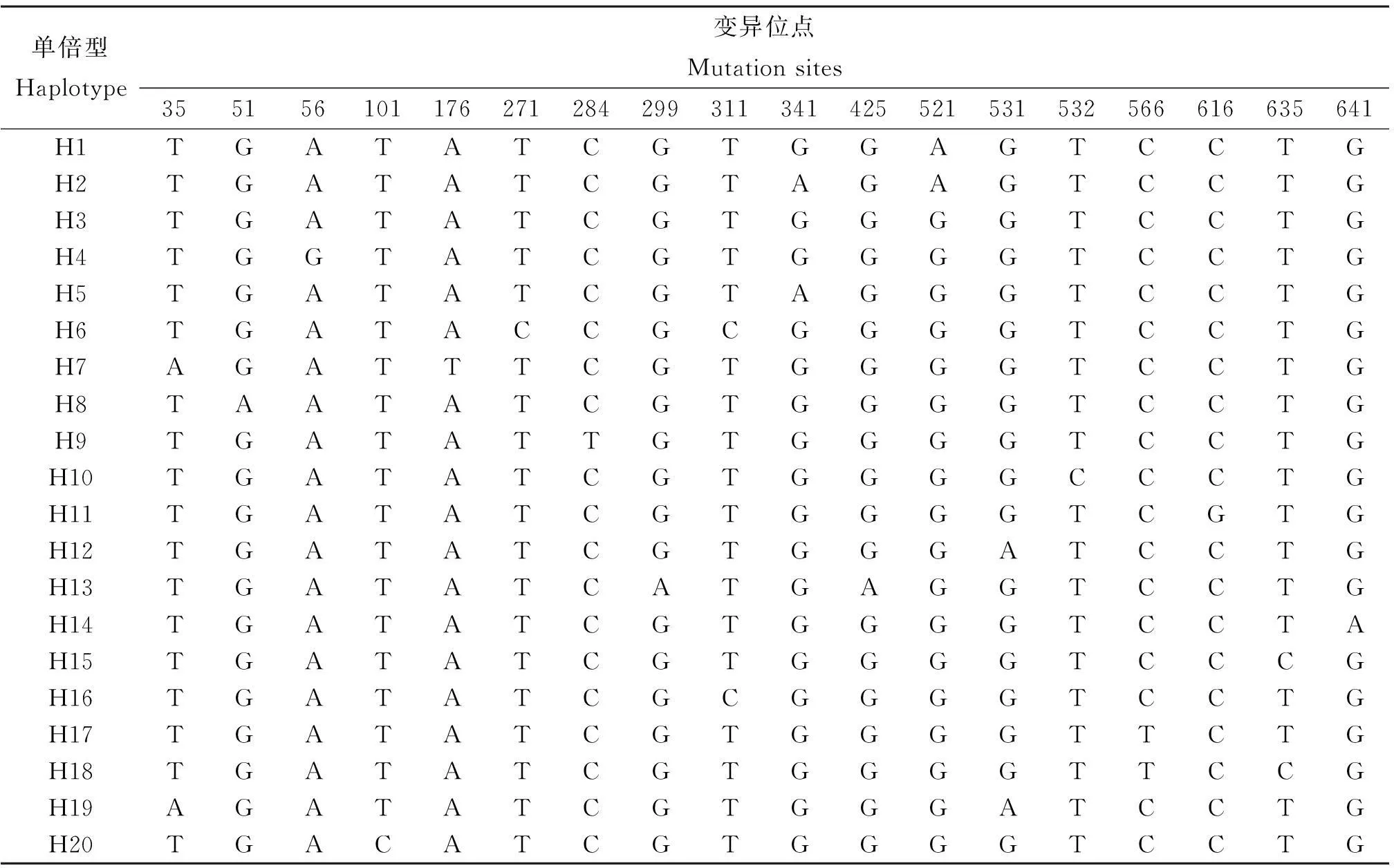
表2 白纹伊蚊COⅠ基因序列变异位点
2.3系统发生树分析从系统发生树中可以看出,浙江不同采样点白纹伊蚊线粒体COⅠ基因存在个体差异,对所获得的白纹伊蚊COⅠ基因序列基于K2P计算个体间的距离,其种内距离的范围在0.000~0.006之间,符合大部分种内距离<1%的遗传差异。所有的20个单倍型与来自海南、南京、台湾、日本、澳大利亚、巴基斯坦和越南的白纹伊蚊COⅠ序列共同形成一个大分支,其中来自衢州的单倍型H15、H17和H18形成一个独立分支,来自苍南的单倍型H1、H2、H5(衢州共有)和来自巴基斯坦的单倍型形成一个独立分支,义乌、宁波和舟山嵊泗共有的单倍型H14与来自海南的单倍型形成一个分支。同时,这些序列与来自云南,马来西亚,泰国和印度的白纹伊蚊COⅠ序列表现出一定的遗传分化。
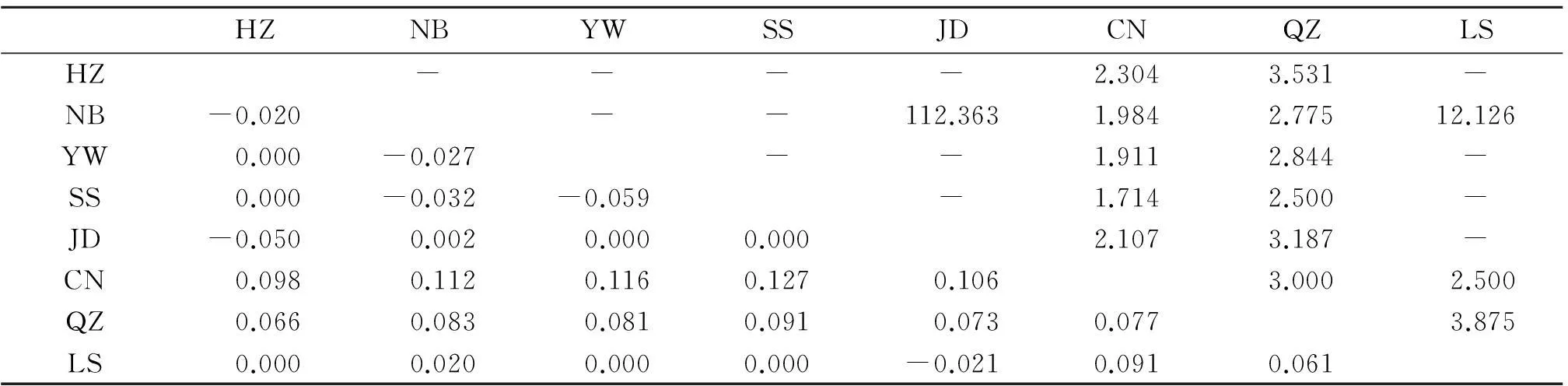
表3 浙江省白纹伊蚊种群配对Fst(左下)和Nm值(右上)

图1 基于COⅠ序列的白纹伊蚊单倍型系统发生树
Fig.1Phylogenetic analysis of haplotypes from Aedes albopitus based onCOⅠ gene
3讨论
蚊虫群体多样性跟蚊虫所分布地区的人文地理特征、气候、生态习性和蚊虫的迁移等密切相关[6-7]。本次采集到的白纹伊蚊COⅠ基因序列同一性在99%以上,遗传距离极小,在种内变异的范围内,与中国其他地区的结果类似[8-9],其多样性明显高于白纹伊蚊新入侵的区域[10],但是仍呈现出区域差异:西部衢州,南部丽水以及与福建省相邻的温州苍南地区的白纹伊蚊种群多样性较高,中东部地区及海岛的白纹伊蚊多样性相对较低。造成部分地区白纹伊蚊多样性较低的原因除了采样造成的选择偏倚以外,还可能与各地开展的爱国卫生运动中的灭蚊行为有关。故结果可作为白纹伊蚊种群动态的监测指标,结合抗药性水平等方面的监测,可以指导当地白纹伊蚊的科学控制和登革热的防控。
浙江省地处亚热带季风气候,气温适中,四季分明,光照充足,雨量充沛。省内地形复杂,山地和丘陵占70.4%,平原和盆地占23.2%,河流和湖泊占6.4%,多样的地形环境和气候会对于白纹伊蚊的遗传分化产生影响。一般认为Fst<0.05显示种群出现轻度分化,0.05 参考文献: [1]Yang SR, Liu QY. Trend in global distribution and spread ofAedesalbopictus[J]. Chin J Vector Biol Ctrl, 2013, 24(1): 1-4. (in Chinese) 杨舒然, 刘起勇. 白纹伊蚊的全球分布及扩散趋势[J]. 中国媒介生物学及控制杂志, 2013, 24(1): 1-4. [2]Tien TK, Vazeille-Falcoz M, Mousson L, et al.Aedesaegyptiin Ho Chi Minh City (Viet Nam): susceptibility to dengue 2 virus and genetic differentiation[J]. Trans Roy Soc Trop Med Hyg, 1999, 93(6): 581-586. [3]Ma Y, Lu L. Research advance in DNA barcode technology[J]. Chin J Vector Biol Ctrl, 2010, 21(3): 275-280. (in Chinese) 马英, 鲁亮. DNA条形码技术研究新进展[J]. 中国媒介生物学及控制杂志, 2010, 21(3): 275-280. [4]Kamgang B, Ngoagouni C, Manirakiza A, et al. Temporal patterns of abundance ofAedesaegyptiandAedesalbopictus(Diptera: culicidae) and mitochondrial DNA analysis ofAe.albopictusin the Central African Republic[J]. PLoS Negl Trop Dis, 2013, 7(12): e2590. [5]Folmer O, Black M, Hoeh W, et al. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates[J]. Mol Mar Biol Biotechnol, 1994, 3(5): 294-299. [6] de Lourdes Munoz M, Mercado-Curiel RF, Diaz-Badillo A, et al. Gene flow pattern amongAedesaegyptipopulations in Mexico[J]. J Am Mosq Ctrl Assoc, 2013, 29(1): 1-18. [7] Rochlin I, Ninivaggi DV, Hutchinson ML, et al. Climate change and range expansion of the Asian tiger mosquito (Aedesalbopictus) in northeastern USA: implications for public health practitioners[J]. PLoS one, 2013, 8(4): e60874. [8]Fang YL, Zhang SY, Xie HG, et al. Study on mtDNA-COI genetic characteristics ofAedesalbopictusin different geographic strains[J]. Strait J Prev Med, 2011, 17(3): 1-4. (in Chinese) 方义亮, 张山鹰, 谢汉国, 等. 不同地理株白纹伊蚊mtDNA-COI基因特征研究 [J]. 海峡预防医学杂志, 2011, 17(3): 1-4. [9]Yang F, Zhang RL, Liu Y, et al. Genetic polymorphism analysis on mtDNA-COI ofAedesalbopictusin Shenzhen, China[J]. Chin J Vector Biol Ctrl, 2015, 26(4): 337-340. (in Chinese) 阳帆, 张仁利, 刘阳, 等. 深圳市白纹伊蚊细胞色素C氧化酶亚基Ⅰ基因多态性分析 [J]. 中国媒介生物学及控制杂志, 2015, 26(4): 337-340. [10]Kamgang B, Brengues C, Fontenille D, et al. Genetic structure of the tiger mosquito,Aedesalbopictus, in Cameroon (Central Africa)[J]. PLoS one, 2011, 6(5): e20257. [11]Puebla-Olivares F, Bonaccorso E, De Los Monteros AE, et al. Speciation in the emerald toucanet (Aulacorhynchusprasinus) complex[J]. The Auk, 2008, 125(1): 39-50. [12]Fang YL, Zhang SY, Xie HG, et al. mtDNA-ND4 gene analysis of dengue vectorAedesalbopictus[J]. Chin J Zoonoses, 2011, 27(6): 530-533. (in Chinese) 方义亮, 张山鹰, 谢汉国, 等. 登革热媒介白纹伊蚊mtDNA-ND4基因特征分析 [J]. 中国人兽共患病学报, 2011, 27(6): 530-533. [13]Jing X, Wang XJ. Investigation on the hover ability and spread range ofAedesalbopictus[J]. Chin J Vector Biol Ctrl, 1998, 9(3): 165-167. (in Chinese) 景晓, 王学军. 白纹伊蚊飞翔能力和扩散距离观察 [J]. 中国媒介生物学及控制杂志, 1998, 9(3): 165-167. DOI:10.3969/j.issn.1002-2694.2016.02.007 通讯作者:龚震宇,Email: zhygong@cdc.zj.cn Corresponding author:Gong Zhen-yu, Email: zhygong@cdc.zj.cn 中图分类号:R384 文献标识码:A 文章编号:1002-2694(2016)02-0133-04 收稿日期:2015-08-08;修回日期:2015-11-21 Genetic polymorphism analysis of cytochrome C oxidase subunit I gene in Aedes albopictus from Zhejiang Province, China GUO Song,LING Feng,WANG Jin-na,WU Yu-yan,HOU Juan,GONG Zhen-yu (Zhejiang Provincial Center for Disease Control and Prevention, Hangzhou 310051, China) Abstract:In order to study the characteristics of mitochondrial DNA Cytochrome C oxidase subunit I (mtDNA-COI) gene of Aedes albopictus from Zhejiang and to explore genetic polymorphism of this vector, adult female mosquitoes were collected from dengue epidemical and non-endemic areas from Zhejiang, and their COI genes were amplified by PCR and sequenced for genetic analysis including genetic feature, population differentiation and phylogenetic tree construction. The COI fragment contained 686 nucleotides with 18 polymorphic sites including 15 transition sites and 3 transversion sites. The percentage of A+T content in COI gene was 67.8%, while the percentage of G+C was 32.2%. There were 20 haplotypes obtained from 96 specimens among 8 geographic populations from Zhejiang Province. The overall haplotype diversity, nucleotide diversity and mean number of pairwise differences were 0.497, 0.717 and 0.001 05, respectively. Aedes albopictus population from Cangnan, Quzhou and Lishui showed higher genetic polymorphism than other sampling sites, and Aedes albopictus population from Cangnan, Quzhou showed moderate differentiation with other populations. A certain degree of genetic polymorphism and genetic differentiation were found in Aedes albopictus populations from Zhejiang, which may be caused by some factors such as environment, climate and humanity. Keywords:Aedes albopictus; cytochrome C oxidase subunit I; polymorphism 国家十二五科技重大专项(No. 2012ZX10004-219)和2015年浙江省医药卫生平台计划(骨干人才A类)(No. 2015RCA005)联合资助 Supported by the Project of the State Scientific & Technological Development of the 12th Five Year Plan (No. 2012ZX10004-219) and the medical research program of Zhejiang Province (No. 2015RCA005)

