巨片形吸虫病快速诊断胶体金免疫层析试条的研制与评价
周 岩,许学年,程 娜,刘榆华,孔令颖,姚恺龄,石 峰,张建国,Peter Chun,罗家军
巨片形吸虫病快速诊断胶体金免疫层析试条的研制与评价
周岩1,许学年1,程娜1,刘榆华2,孔令颖3,姚恺龄3,石峰1,张建国4,Peter Chun3,罗家军2
1.中国疾病预防控制中心寄生虫病预防控制所,卫生部寄生虫病病原与媒介生物学重点实验室心,世界卫生组织热带病合作中心,上海200025;;2 大理州血吸虫病防治研究所,大理671000;;3 益思美诠生物科技(上海)有限公司,上海201206;;4 宾川县血吸虫病防治站,宾川671600
摘要:目的建立快速、简便诊断巨片形吸虫病的胶体金免疫层析试条方法。方法提取巨片形吸虫总RNA,通过RT-PCR获得FgCL1-YN基因片段,并克隆入pET28a(+)表达载体,异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达得到重组蛋白(rFgCL1-YN);将rFgCL1-YN和羊抗鼠IgG抗体分别包被于硝酸纤维素膜的适宜位置作为检测带和质控带,以胶体金标记抗人IgG4抗体的鼠单抗作为检测试剂,制备检测特异性IgG4型抗体的免疫层析试条。用该试条检测巨片形吸虫病患者(30份)、日本血吸虫病患者(15份)以及健康人(32份)血清,评价其诊断价值,同时用ELISA法进行平行检测作为对照。结果试条检测法的敏感性为100%(30/30),特异性为97.9%(46/47),总体符合率为98.7%(76/77)。ELISA法检测的敏感性、特异性和总体符合率分别100%(30/30)、100%(47/47)和100%(77/77)。试条法与ELISA法的敏感性、特异性和总体符合率,经四格表确切概率法检验,P值分别为1、0.5和0.5,全部大于0.05。显示,试条法与ELISA法检测巨片形吸虫病患者血清的结果高度一致。另外,试条法的检测时间为10 min,血清用量低于10 μL,且具较高的敏感度。结论以rFgCL1-YN建立的快速诊断胶体金免疫层析试条,检测巨片形吸虫病具有较高的诊断价值。
关键词:巨片形吸虫病;组织蛋白酶L1;免疫层析试条;ELISA;诊断
The forth round of Three-Year Public Health Action Plan (2015-2017)
巨片形吸虫病是由巨片形吸虫(Fasciolagigantica)感染引起的一种人兽共患寄生虫病[1-3]。2011年底,在云南省大理白族自治州宾川县暴发人体巨片形吸虫病,发病人数约30人,由于之前我国巨片形吸虫病多为散发,对该病缺乏了解,导致病因查找历经数月之久,给患者及家属带来极大痛苦及经济损失[4-10]。因此,建立合适的巨片形吸虫病诊断方法,满足临床快速诊断和现场流行病学调查的需要是当务之急。传统的粪便虫卵检测是诊断巨片形吸虫病的金标准,但由于急性期和异位感染病人无法在粪样中查获虫卵、慢性期病人虫体间歇性排卵的特点易导致漏诊[11-12]。免疫学诊断,特别是酶联免疫吸附试验(ELISA)现已广泛用于片形吸虫病的辅助性诊断检测,如血清抗体检测取得了良好效果[13-15]。其中组织蛋白酶L1,作为一种具有诊断潜力的检测抗原被广泛用于抗体检测[16-17]。Wongkham C等利用重组的组织蛋白酶L1检测患者血清内的IgG4型特异性抗体,其敏感性和总符合率分别为100%、99.3%[18]。O′ Neill SM等使用天然CL1作为诊断抗原检测血清中特异性IgG4型抗体,相对于肝片形吸虫病患者,与其它病人血清反应均成阴性[19]。Raina OK等利用重组的28 kDa FgCL1蛋白作为抗原在动物血清学诊断上具有很好效果[20]。但是ELISA方法检测步骤繁琐、耗时长、需要专门设备等缺点,难以在现场快速应用。近年来采用金标免疫层析法进行寄生虫病的流行病学调查和临床诊断,显示其简单、微量、快速、准确和经济的特点,只须短时间培训现场人员即可操作,特别适合在基层和现场使用,是一种极有应用前景的诊断手段。本研究采用巨片形吸虫FgCL1-YN重组抗原(rFgCL1-YN),利用rFgCL1-YN的高抗原反应性以及IgG4 型抗体检测的高特异性,研制了胶体金免疫层析试条,检测巨片形吸虫病患者血清中的IgG4型特异性抗体,并评价了其诊断价值。
1材料与方法
1.1材料
1.1.1巨片形吸虫成虫巨片形吸虫成虫采自云南省大理州宾川县自然感染巨片形吸虫牛的肝胆管,虫体经形态学鉴定,用生理盐水冲洗洗净后,直接放在冻存管中于液氮中保存备用,后再经cox1、ITS1-2间隔区和nad1分子鉴定,确认为巨片形吸虫。
1.1.2血清样品巨片形吸虫病患者血清30份,采自云南省大理州宾川县暴发病例,健康人血清32份,由中国疾病预防控制中心寄生虫病预防控制所健康教育咨询检测中心提供,日本血吸虫病患者血清15份,采自安徽省。
1.1.3表达载体大肠埃希菌DH5α、BL21(DE3)和原核表达载体pET28a(+)由本实验室保存。
1.1.4胶体金免疫层析试条的制备试条由上海益思美诠生物科技上海有限公司制备。其制作方法为以塑料板为底板,用黏合剂将硝酸纤维素膜(NCM)贴于底板的中间,再将吸水膜和试剂垫分别粘贴于NCM的纵向两端,吸水膜与NCM 以及NCM与试剂垫在其交界处有重叠连接。在NCM与试剂垫的连接处粘贴胶纸用作控流。在NCM的近吸水膜处,横向地以线形包被羊抗鼠IgG抗体,作为质控(Control,C)带;在NCM的近试剂垫处,横向地以线形包被复性后的rFgCL1-YN(浓度0.25 μg/mL)作为检测(Test,T)带、3.5 mm宽切条。
鼠抗人IgG4-胶体金结合物的制备:按文献[21]方法,用柠檬酸三钠还原氯金酸,制备颗粒直径为15 nm的胶体金溶液,按文献[22]制备鼠抗人IgG4单克隆抗体-胶体金结合物。
1.1.5主要试剂和工具酶TRIzol试剂、SuperScriptTMⅡ逆转录酶购自Invitrogen 公司;AxyPrep质粒,DNA小量试剂盒购自爱思进生物技术(杭州)有限公司;凝胶回收试剂盒(E.Z.N.A.Ultra-Sep® Gel Extraction Kit)购自美国Omega公司;XhoI、NcoI限制性内切酶,T4DNA连接酶和小牛肠碱性磷酸酶(CIP)购自美国NEB公司;BugBuster蛋白抽提剂、rLysozyme溶菌酶和Benzonase核酸酶购自美国Novagen公司;Ni-NTA树脂购自德国Qiagen公司;辣根过氧化物酶(HRP)标记的鼠抗人IgG4单克隆抗体、制备胶体金的鼠抗人IgG4单克隆抗体均购自美国SouthernBiotech公司;羊抗鼠IgG抗体购自美国Sigma公司;四甲基联苯胺(TMB)购自天根(北京)生化科技有限公司;酶标板(96孔板)购自丹麦Nunc公司;氯金酸(HAuCl·Cl3·4H2O)购自上海国药集团化学试剂有限公司;硝酸纤维素膜购自德国Sartorius公司。
1.2方法
1.2.1Total RNA的提取用Invitrogen公司TRIzol试剂提取巨片形吸虫成虫Total RNA,-80 ℃保存。用紫外分光光度计测出RNA样品的浓度。
1.2.2RT-PCR根据FgCL1(AF112566)核苷酸序列,合成下列引物,逆转录引物:5′-CGTGCCACCATCG-3′,PF:5′-CATGCCATGGGCTCGAATGATGATTTGTGG-3′,PR: 5′-CCGCTCGAGAC
TGGCCAGCGAAGCA-3′(由上海英俊生物技术有限公司合成),使用SuperScriptTMⅡ逆转录酶进行反转录,所得的cDNA作为模板,进一步PCR扩增。反应条件为预变性95 ℃ 5 min,变性94 ℃ 1 min,退火58 ℃ 1 min,复性72 ℃ 2 min,循环30次,最后一个循环复性延长至7 min,样品4 ℃保存。
1.2.3rFgCL1-YN 表达载体的构建上述PCR产物进行1%琼脂糖凝胶电泳,割胶回收的目的片段和pET28a(+)表达载体质粒分别经NcoI和XhoI限制性内切酶双酶切,使用T4DNA连接酶连接,转化至E.coliDH5α扩增后提取质粒,测序(由华大基因研究中心测序)验证插入序列。获得rFgCL1-YN重组表达质粒。
1.2.4重组蛋白的表达、纯化及复性将重组质粒转化E.coliBL21(DE3)感受态细胞中进行表达,按照组氨酸标签蛋白表达和纯化试剂盒(Qiagen 公司)操作说明进行变性方式纯化目的蛋白。使用BugBuster®蛋白抽提剂、rLysozyme溶菌酶和Benzonase核酸裂解酶表达细菌,用组氨酸标签亲和纯化柱(Ni NTA树脂)纯化表达产物,使用含不同pH值的洗脱液洗涤树纯化脂重组蛋白。行12%十二烷基磺酸钠-聚丙烯酰胺电泳(SDS-PAGE),检测重组蛋白的纯化情况。
收集合并洗脱液,用含50 mmoL Tris·HCl,1 mmol EDTA,DTT 0.15 g/L,甘油100 ml/L的透析buffer,分别配制成含6 mol/L、4 mol/L、2 mol/L、0 mol/L尿素(pH 8.0)梯度的透析液,逐级透析。透析结束后,取出透析袋内样品,4 ℃离心,10 000 r/min,离心10 min。收集上清,取样进行12%的SDS-PAGE电泳分析,蛋白浓度的测定参考Bradford方法,-20 ℃保存备用。
1.2.5试条的使用和评判采用动力流体型血清学检测方法。将2滴(80 μL)胶体金试剂加入试剂垫,待胶体金试剂进入NCM后,将7 μL待测血清加于控流胶纸端的NCM处。仅出现C线者判为阴性,出现C和T线者判为阳性,无C线者判为无效。检测结果均在10 min内判断。
1.2.6间接ELISA方法检测血清中的抗体参照文献[23]进行,并做适当调整。以复性后的重组抗原为包被抗原,包被浓度为0.5 μg/mL,每孔包被量为100 μL,4 ℃过夜,甩干,加入200 μL PBST (含1% 的BSA) 37 ℃封闭2 h,PBST洗涤3次,5 min/次。血清样本用PBST (含1% 的BSA) 进行稀释,稀释度为1∶200作为一抗,100 μL/孔,37 ℃孵育1.5 h,PBST洗涤3次,5 min/次。HRP-鼠抗人IgG4作为二抗(工作浓度为1∶5 000),100 μL/孔,37 ℃孵育1 h,PBST洗涤4次,5 min/次。加入100 μL/孔TMB后,测定吸光度(A450)值。以32个健康者血清的A450均值加上4个标准差作为阳性阈值,每一受检样本的A450大于或等于此阈值为阳性。
1.2.7统计学分析采用SPSS 11.0软件对各种方法的检测结果进行四格表确切概率法检验。检验水准α=0.05。
2结果
2.1FgCL1-YN基因的克隆根据AF112566的序列特征,设计了逆转录引物和正反向PCR引物。RT-PCR扩增结果如图1所示。克隆片段长度为915 bp,GenBank登录号:KT713623。
2.2FgCL1-YN重组抗原蛋白的表达和纯化使用T4DNA连接酶,将目的片段和载体片段进行连接,构建成rFgCL1-YN原核表达质粒。在1 mmol/L的IPTG 条件下37 ℃诱导4 h。在34 kD处可见明显的重组蛋白条带,该重组蛋白主要在沉淀(包涵体)中表达。用Ni-NTA树脂纯化重组蛋白。使用变性纯化方法将得到的重组蛋白,再行透析复性。结果如图2所示。
2.3试条法和ELISA法检测结果以rFgCL1-YN为检测抗原的试条检测法,其敏感性为100%(30/30),特异性为97.9%(46/47),总体符合率为98.7%(76/77)。使用rFgCL1-YN以间接ELISA方法检测血清中的特异性抗体。巨片形吸虫病患者、健康人对照组、日本血吸虫病患者的A450值的平均值分别为0.275±0.217、0.004±0.005、0.010±0.004。ELISA法检测的敏感性、特异性和总体符合率分别100%(30/30)、100%(47/47)和100%(77/77)。试条法与ELISA法的敏感性、特异性和总体符合率,经四格表确切概率法检验,P值分别为1、0.5和0.5,全部大于0.05。显示,试条法与ELISA法检测巨片形吸虫病患者血清的结果高度一致,结果见表1。

Marker: DNA 分子量标准;1:FgCL1-YN RT-PCR扩增结果
Marker: DNA marker; 1: RT-PCR product of FgCL1-YN.
图1FgCL1-YN RT-PCR 扩增凝胶电泳分析图
Fig.1Agarose gel electrophoresis analysis of RT-PCR product of FgCL1-YN
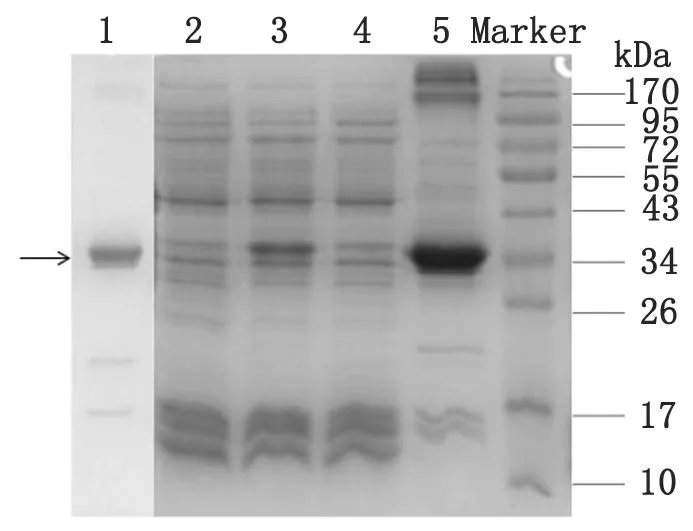
Marker:蛋白分子量标准;1:纯化复性后的rFgCL1-YN;2:未诱导全细胞;3:诱导全细胞;4:诱导全细胞裂解上清;5:诱导全细胞裂解沉淀
Marker: protein marker; 1: purified rFgCL1-YN with renaturation; 2: noninducedE.colicell lysate; 3: inducedE.colicell lysate; 4: inducedE.colicell lysate supernatant; 5: inducedE.colicell lysate precipitate.
图2rFgCL1-YN重组蛋白表达及纯化的SDS-PAGE电泳分析
Fig.2Evaluation on the immunoreactivity of rFgCL1-YN by SDS-PAGE
用倍比稀释的巨片形吸虫病患者混合血清,检测试条的灵敏度,起始血清量(每mm膜宽)为2 μL,逐级倍半减至0.016 μL,1-5号试条(每mm膜宽血清量分别为2 μL、1.0 μL、0.5 μL、0.25 μL和0.125 μL)呈阳性。显示本试条具有较高的灵敏度,见图3。
表1试条法和ELISA法检测寄生虫病患者和健康人血清
Tab.1Detection results of the sera from different patients and healthy donors using immunochromatographic strip test and ELISA

血清Serum检测例数No.ofcasedetected阳性数No.ofcasepositive试条法GICAELISA法ELISA巨片形吸虫病fascioliasisgigantic303030血吸虫病schistosomiasis1500健康者healthydonors321(无法判别)0合计total773130

1-8:血清量倍半递减的试条检测结果; C:质控带;T:检测带
1-8: pooled positive sera;C: control line; T: test line.
图3 免疫层析试条灵敏度检测
Fig.3Sensitivity of the detection limit of the immunochromatographic strip test
3讨论
金标免疫层析法是一种快速、实用的诊断方法。以微孔滤膜为固相载体,抗原抗体在膜上结合,渗滤浓缩促进反应,再以胶体金作为指示剂直观显色。本研究结合CL1的高抗原反应性优势和免疫层析试条的简便、快捷的特点,研制了巨片形吸虫病的胶体金免疫层析试条,并通过ELISA法平行检测验证了该试条的诊断价值。实验表明,该试条具有较高的敏感性和特异性,以及较高的灵敏度。通过目测定性结果能够快速判读,并能以极低的检测极限,检测微量阳性感染血清中的特异性抗体。
利用天然或重组的组织蛋白酶L1作为诊断抗原,已成为诊断巨片形吸虫病的标准血清学诊断方法之一。组织蛋白酶L1属于半胱氨酸蛋白酶类,在片形吸虫童虫和成虫阶段都有表达,宿主感染2-4周后体内即可检测到抗体[24-25],可作为巨片形吸虫病早期诊断抗原,在该病的诊断中有重要意义。
研究还表明ELISA法检测IgG4型特异性抗体相比检测所有亚型IgG抗体,具有更高的特异性[26]。本研究在试条研制过程中,曾使用该重组抗原建立了检测IgG的免疫层析试条,但为数不少的日本血吸虫病患者和健康人血清出现假阳性(实验数据未列出),其效果远不及检测IgG4的免疫层析试条。另外,鉴于巨片形吸虫和肝片形吸虫的CL1同源性高达95%以上,推测本研究研制的试条或许可用来检测人体肝片形吸虫病,但需进一步实验验证。
Victoria MS等[27]使用肝片形吸虫的FhCL1重组蛋白研制的LFIA试条,用于检测人体肝片形吸虫病具有良好的诊断价值,该试条尚不确定是否能应用于人体巨片形吸虫病的检测。该试条使用葡萄球菌蛋白A(SPA)和FhCL1的单抗(mAb-MM3)分别作为检测带和质控带,将胶体金与FhCL1结合作为检测试剂。由于SPA可与各亚型的IgG结合,所以LFIA试条检测血清中的抗体包括所有IgG 亚型。尽管检测对象均为CL1的抗体,但LFIA试条与本研究研制的试条仅检测IgG4型抗体相比,有着显著的不同。
CL1诱导宿主产生的抗体,在治愈后会持续较长时间,抗体检测难于区分治愈病例和现症病人。在巨片形吸虫病流行区进行临床样本检测及大规模现场调查中,本试条可作为病例筛查试剂,检测阳性结果应注意区分现症病例与治愈病人。
参考文献:
[1]Mas-Coma MS, Esteban JG, Bargues MD, et al. Epidemiology of human fascioliasis: a review and proposed new classification[J]. J Bull World Health Organ, 1999, 77(4): 340-346.
[2]Mas-Coma S, Valero MA, Bargues MD, et al.Fasciolalymnaeidsand human fascioliasis, with a global overview on disease transmission, epidemiology, evolutionary genetics, molecular epidemiology and control[J]. J Adv Parasitol, 2009, l69: 41-146. DOI: 10.1016/S0065-308X(09)69002-3
[3]Mas-Coma S, Bargues MD, Valero MA, et al. Fascioliasis and other plant-borne trematode zoonoses[J]. Int J Parasitol, 2005, 35: 1255-1278. DOI: 10.1016/j.ijpara.2005.07.010
[4]Fang W, Li TM, Li KR, et al. Experimental infection ofGalbapervia,RadixswinhoeiandPhysaacutawithFasciolahepaticain Dali, Yunnan[J]. Chin J Parasitol Parasit Dis, 2014, 32(4): 285-288. (in Chinese)
方文,李天美,李科荣,等. 大理地区肝片形吸虫感染中间宿主实验研究[J]. 中国寄生虫学与寄生虫病杂志,2014,32(4):285-288.
[5]Chen MX, Ai L, Xu XN, et al. Twenty six cases of humanFasciolagiganticainfection in Dali, Yunnan province[J]. Chin J Endemiol, 2012,31(6): 595-598. (in Chinese)
陈木新,艾琳,许学年,等. 云南省大理州巨片形吸虫群体感染26例分析[J]. 中国地方病学杂志,2012,31(6):595-598.
[6] Chen JX, Chen MX, Ai L, et al. An outbreak of human fascioliasis gigantic in southwest China[J]. PLoS One, 2013, 8(8): e71520. DOI: 10.1371/journal.pone.0071520
[7]Zhang GL, Su HY, Zhou J, et al. Clinical analysis of 11 cases of fascioliasis[J]. Infect Dis Info, 2012, 25 (4): 242-246. (in Chinese)
张国丽,苏慧勇,周俊,等. 片形吸虫病11例临床分析[J]. 传染病信息,2012,25 (4) :242-246.
[8]Yang RJ, Liu YC, Yang XM, et al. Analysis of 18 human cases infected withFasciolagigantica[J]. Int J Med Parasit Dis, 2012, 39 (40): 246-249. (in Chinese)
杨汝军,刘彦才,杨锡铭,等. 人体巨片形吸虫病18例分析[J]. 国际医学寄生虫病杂志,2012,39(40):246-249.
[9]Wang YQ, Zhou Y, Cheng N, et al. Cloning, expression and immunodiagnostic evaluation of theFasciolagiganticathioredoxin peroxidase[J]. Chin J Parasitol Parasit Dis, 2015, 33(2): 81-85. (in Chinese)
王月琪,周岩,程娜,等. 巨片形吸虫硫氧还蛋白过氧化物酶克隆、表达和免疫学诊断价值评价[J]. 中国寄生虫学与寄生虫病杂志,2015,33(2):81-85.
[10]Zhou J, Gu W, Jiao JM, et al. First outbreak ofFasciolagiganticainfection in Yunnan province: An clinical analysis of 10 cases[J]. World Chin J Dis, 2012, 20(21): 1978-1981. (in Chinese)
邹静,顾伟,焦建明,等. 云南省首次爆发流行巨片形吸虫感染10例[J]. 世界华人消化杂志,2012,20(21): 1978-1981.
[11]Duthaler U, Rinaldi L, Maurelli MP, et al.Fasciolahepatica: comparison of the sedimentation and FLOTAC techniques for the detection and quantification of faecal egg counts in rats[J]. Exp Parasitol, 2010, 126: 161-166. DOI: 10.1016/j.exppara.2010.04.020
[12]Hillyer GV. Immunodiagnosis of human and animal fasciolosis[M]. In: Dalton JP, ed. Fasciolosis. Wallingford: CABI Publishing, 1999: 435-447.
[13]Espino AM, Diaz A, Perez A, et al. Dynamics of antigenemia and coproantigens during humanFasciolahepaticaoutbreak[J]. J Clin Microbiol, 1998, l36: 2723-2726.
[14]Carnevale S, Rodriguez MI, Guarnera EA, et al. Immunodiagnosis of fasciolosis using recombinant procathepsin L cystein proteinase[J]. Diagn Microbiol Infect Dis, 2001, 41: 43-49. DOI: 10.1016/S0732-8893(01)00288-7
[15]Carnevale S, Rodriguez MI, Santillan G, et al. Immunodiagnosis of human fasciolosis by enzyme-linked immunosorbent assay (ELISA) and a micro-ELISA[J]. Clin Diagn Lab Immunol 2001, 8: 174-177. DOI: 10.1128/CDLI.8.1.174-177.2001
[16]Intapan PM, Tantrawatpan C, Maleewong W, et al. Potent epitopes derived fromFasciolagiganticacathepsin L1 in peptide-based immunoassay for the serodiagnosis of human fascioliasis[J]. Diagn Microbiol Infect Dis, 2005, 53: 125-129. DOI: 10.1016/j.diagmicrobio.2005.05.010
[17]Mezo M, Gonzalez-Warleta M, Ubeira FM, et al. Optimized serodiagnosis of sheep fascioliasis by Fast-D protein liquid chromatography fractionation ofFasciolahepaticaexcretory-secretory antigens[J]. J Parasitol, 2003, 89: 843-849.
[18]Wongkham C, Tantrawatpan C, Intapan PM, et al. Evaluation of immunoglobulin G subclass antibodies against recombinantFasciolagiganticacathepsin L1 in an enzyme-linked immunosorbent assay for serodiagnosis of human fasciolosis[J]. Clin Diagn Lab Immunol, 2005, 12: 1152-1156. DOI: 10.1128/CDLI.12.10.1152-1156.2005
[19]O’Neill SM, Parkinson M, Strauss W, et al. Immunodiagnosis ofFasciolahepaticainfection (fascioliasis) in a human population in the Bolivian Altiplano using purified cathepsin L cysteine proteinase[J]. Am J Trop Med Hyg, 1998, 58: 417-423.
[20]Raina OK, Yadav SC, Sriveny D, et al. Immuno-diagnosis of bubaline fasciolosis withFasciolagiganticacathepsin-l and recombinant cathepsin l 1-d proteases[J]. Acta Trop, 2006, 98 (2): 145-151. DOI: 10.1016/j.actatropica.2006.03.004
[21]Frens G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J]. Nat Phys Sci, 1973, 241(105): 20-22.
[22]Hayat MA. Colloidal Gold, Volume 1: Principles, Methods and Applications (Colloidal Gold: Principles, Methods and Application)[M]. San Diego: Academic Press, 1989: 1-39.
[23]Hillyer GV, Sanchez Z, Deleon D, et al.Immunodiagnosis of bovine fascioliasis by enzyme-linked immunosorbent-assay and immunoprecipitation methods[J]. J Parasitol, 1985, 71: 449-454. DOI: 10.2307/3281536
[24]O’Neil SM, Parkinson M, Dowd AJ, et al. Short report immunodiagnosis of humanFascioliasisusing recombinantFasciolahepaticacathepsin L1 cysteine proteinase[J]. Am J Trop Med Hyg, 1999, 60(5): 749-751.
[25]Yadav SC, Saini M, Raina OK, et al.Fasciolagiganticcathepsin L cysteine proteinase in the detection of early experimental fasciolosis in ruminants[J]. Paraitol Res, 2005, 97: 527-534. DOI: 10.1007/s00436-005-1466-8
[26]Chaisiri W, Chairat T, Pewpan MI, et al. Evaluation of immunoglobulin G subclass antibodies against recombinantFasciolagiganticacathepsin L1 in an enzyme-linked immunoso rbent assay for serodiagnosis of human fasciolosis[J]. Clin Diagn Lab Immunol, 2005, 12(10): 1152-1156. DOI: 10.1128/CDLI.12.10.1152-1156.2005
[27]Victoria MS, Laura M, Mar1a JP, et al. Development and evaluation of a new lateral flow immunoassay for serodiagnosis of human fciolosis[J]. PLoS Negl Trop Dis, 2011, 5(11): e1376. DOI: 10.1371/journal.pntd.0001376
DOI:10.3969/j.issn.1002-2694.2016.02.003
通讯作者:许学年,Email:xuxuenian2@163.com
中图分类号:R383
文献标识码:A
文章编号:1002-2694(2016)02-0114-05
Corresponding author:Xu Xue-nian, Email: xuxuenian2@163.com
收稿日期:2015-09-11;修回日期:2015-11-21
Establishment and evaluation of colloid gold labeled immuno chromatographic strip test for rapid diagnosis of human fascioliasis gigantica
ZHOU Yan1,XU Xue-nian1,CHENG Na1,LIU Yu-hua2,KONG Ling-ying3,YAO Kai-ling3,SHI Feng1,ZHANG Jian-guo4,Peter CHUN3,LUO Jia-jun2
(1.National Institute of Parasitic Diseases, Chinese Center for Disease Control and Prevention/Key Laboratory of ParasiteandVectorBiology,MOH/WHOcollaboratingCentreforTropicalDiseases,Shanghai200025,China;2.DaliPrefectureInstituteofSchistosomiasisPreventionandControl,Dali671000,China;3.EASE-MedtrendBiotech(Shanghai),LTD,Shanghai201206,China;4.SchistosomasisControlStationofBinchuanCounty,Binchuan671600,China)
Abstract:To establish and evaluate a colloid gold-immunochromatographic assay (GICA) dynamic flow strip for the diagnosis of human fascioliasis, total RNA was prepared from Fascioliasis gigantica (F. gigantica) collected from Dali, Yunnan Province, China. FgCL1-YN gene was obtained by reverse transcription-polymerase chain reaction (RT-PCR). The PCR product was sequenced and cloned into pET28a(+) vector. The recombinant plasmid was expressed and induced by isopropyl-β-D-thiogalactopyranoside (IPTG) to obtain recombinant protein, rFgCL1-YN. The mouse anti-human IgG4 monoclonal antibodies was conjugated with colloid gold as detecting reagent; the rFgCL1-YN and goat anti-mouse IgG antibody were immobilized on nitrocellulose in proper position as test line and control line, separately. The prepared immunochromatographic strip was evaluated using serum samples from fascioliasis gigantica patients (30 cases), schistosomiasis japonica patients (15 cases) and healthy donors (32 cases). Sensitivity detected by the GICA strip test was 100% (30/30). One serum sample from a healthy control was an invalid result with the GICA. Reference sera from schistosomiasis were all negatives for anti- F. gigantica IgG4 antibodies using the GICA. The sensitivity, specificity and total diagnostic coincidence rate of rFgCL1-YN-based the enzyme-linked immunosorbent assay (ELISA) was 100% (30/30), 100% (47/47) and 100% (77/77) respectively. Comparison between the GICA and the ELISA was made by exact probabilities in 2×2 table analysis. The P value of the total diagnostic coincidence rate, sensitivity and specificity was 1, 0.5 and 0.5, respectively (P>0.05). High degree of agreement was observed between the GICA and ELISA. The detection time of GICA was 10 min, and the serum concentration was less than 10 μL with highly sensitive. The developed immunochromatographic strip test using recombinant FgCL1-YN antigen as coated antigen is a sensitive, simple and rapid assay for diagnosing human fascioliasis.
Keywords:fascioliasis gigantica; cathepsin L1; gold-immunochromatographic assay strip; ELISA; diagnosis
上海市第四轮三年行动计划项目(GWIV-29)

