兔须癣毛癣菌感染样本常规诊断与定量PCR诊断的比较研究
沈 洁,刘 月,刘利强,刘 娜,刘建钗,刘彦威,邢 鑫
兔须癣毛癣菌感染样本常规诊断与定量PCR诊断的比较研究
沈洁,刘月,刘利强,刘娜,刘建钗,刘彦威,邢鑫
河北工程大学农学院,邯郸动物医学重点实验室,河北056021
摘要:目的为探讨须癣毛癣菌快速、敏感、特异的诊断方法。方法采集患兔临床样本63例,分别进行培养法、镜检法和定量PCR法诊断,比较这些方法的敏感性、特异性、阳性预测值和阴性预测值。结果显示样本培养法、镜检法和定量PCR法的阳性率分别为65%、73%和86%;与常规方法(培养法和镜检法)相比,定量PCR法敏感性和阴性预测值均为100%,高于培养法(77.35%和45.45%)和镜检法(86.79%和64.17%),而特异性(90.90%对100%~100%)和阳性预测值(90.90%对100%~100%)两种方法无明显差异。结论培养法特异,但敏感性差、耗时长,有假阴性;镜检快速,但不特异,敏感性低;而定量PCR快速、敏感、又特异,可以替代镜检用于临床样品的诊断,但不能替代培养法。
关键词:定量PCR;常规诊断;兔、须癣毛癣菌
须癣毛癣菌是兔的常见皮肤真菌病的病原,不仅引起兔的皮肤及附属物感染,还能通过兔传染人,引起人的皮肤感染,因此,有效防控须癣毛癣菌感染,无论对促进养兔业健康发展,还是在公共卫生等方面都具有重要意义[1-2]。目前,对须癣毛癣菌病诊断基于病料的直接显微观察和病原真菌分离培养,尽管这些方法沿用了80余年,仍然存在多局限,如直接显微观察缺乏特异性,不能区分病原真菌的种类;分离培养及后续的鉴定较慢,通常需要2~4周[2]。大量临床资料和经验表明,须癣毛癣菌感染的疗效与转归,很大程度上取决于早期诊断和治疗[3]。然而,目前临床上皮肤真菌感染的诊断面临着巨大的困难和挑战,很大程度上制约了早期诊断和治疗,延误了最佳治疗时机,因此,发展敏感、特异、快速的诊断方法已经成为研究的热点和焦点。基于此2013年本实验室建立了兔须癣毛癣菌巢式PCR方法,虽然巢式PCR比常规PCR敏感,但巢式PCR需进行两次PCR较繁琐,且还需电泳进行验证,易污染[1]。针对巢式PCR的局限,2015年又建立了须癣毛癣菌敏感、特异、快速定量PCR方法,并与直接显微观察和分离培养方法进行比较,以期望找出更适合临床快速诊断的方法。
1材料与方法
1.1病料样品采集和常规诊断在2014年6月到10月,疑似皮肤真菌感染兔主要表现皮屑增多、结痂、脱毛、渗出、毛囊炎及痒感等症状。共收集来自不同兔场的病料样品(皮屑和被毛)63份(编号S1-S63),没有皮肤病变健康兔的皮屑和被毛10份作对照。病料采集时,用无菌手术刀片在病变与健康皮肤组织交界处刮取皮屑或被毛,每份病料样和对照样品分成3份,分别用于直接镜检、培养及定量PCR分析,其中用于定量PCR的病料-20 ℃保存。
镜检:取患兔的病料(皮屑和被毛)于载玻片,滴加改良复方KOH溶液,直接涂片。加盖玻片,酒精灯加热以促进角质溶解,但避免过度加热而使封固液沸腾,轻压盖玻片驱除气泡,吸除盖玻片周围溢液,放置10 min,使之软化透明后,置光学显微镜下观察。以查到菌丝和(或)孢子为阳性,未检出菌丝和(或)孢子为阴性。
培养:病料涂布在沙保弱培养基(含0.05 g/L氯霉素和0.5 g/L环己酰亚胺),27 ℃恒温培养箱培养5 d,每天观察菌落生长情况。纯化培养用土豆琼脂培养基,27 ℃,培养1周,观察菌落特征。用胶带黏的一面按在生长的菌落上,乳酸酚棉蓝染色,在显微镜下观察菌丝和孢子结构。
1.2定量PCR方法
DNA提取:将病料剪碎,放入液氮研磨,收集病料约0.05~0.1 g于1.5 mLEP管中,用真菌DNA提取试剂盒(Solarbio试剂盒)提取基因组DNA。
引物设计: 从GenBank找出与须癣毛癣菌及相关种类(包括犬小孢子菌、絮状表皮癣、红毛癣菌、白色念珠菌、烟曲霉)ITS基因。进行聚类分析,采用Primer Express2.0软件设计一对特异性引物,上游引物为(5′-GCAAAGAAG CCT GGAAGAAG-3′,核苷酸46-65),下游引物为(5′-GGAGACCATCTGTGAGAGTT-3,核苷酸166-185)预期扩增片段大小140 bp。引物由华大基因合成。
定量PCR:采用25 μL的反应体系:SYBR Premix Ex Taq(2×)12.5 μL,上、下游引物各0.5 μL,DNA模板1.0 μL,用双蒸水补足至25 μL。反应程序为:94 ℃预变性60 s;94 ℃10 s,60 ℃30 s,72 ℃30 s,进行40个循环。反应结束后,作熔解曲线,采用软件自动分析。
1.3ITS序列分析对于定量PCR与常规诊断不一致的样品,再进行ITS序列分析,经过直接显微检查、培养和定量PCR比较,最终确定样品阳性与阴性。
DNA提取:患兔采集病料样品剪碎,放入200 μL缓冲液(10 mmol/L Tris-HCIpH8.0,10 mmol/L Na2-EDTA,100 mmol/L NaCl,2%十二烷基硫酸钠)56 ℃过夜,加10 μL蛋白酶K孵育3 h。步骤按试剂盒(Solarbio试剂盒)方法进行。
第一轮PCR:上游引物为5′-CATCGAGTACATGTGCTCGC-3′,下游引物5′-CATCGA GTA CATGTGCT GC-3′,目的片段为435 bp。反应体系25 μL:Mix(2×)12.5 μL,引物各0.5 μL,模板DNA 1.0 μL,加双蒸水补足25 μL。反应条件:94 ℃变性3 min,94 ℃变性60 s,60 ℃退化75 s,72 ℃延伸120 s,共30循环,72 ℃延伸7 min,4 ℃终止反应。
巢式PCR:上游引物为5′-GCAAAGAAGCCTGGAAGAAG3′,下游引物5′-GGAGACCA TCT GTGAGAG TTG-3′,目的基因片段为288 bp。反应体系25 μL:Mix(2×)12.5 μL,引物各0.5 μL,模板DNA(第1轮PCR产物1∶6稀释)1.0 μL,加双蒸水补足25 μL。反应条件条件同第1轮PCR。取5 μL巢式PCR产物在0.5 g/L琼脂糖凝胶进行电泳。序列测定由上海生工生物工程技术服务公司完成。
1.4统计学处理数据处理采用SAS6.12统计软件包,采用方差统计分析,P<0.05为差异有统计学意义。
2结果
2.1常规检查在显微镜下,观察到呈串珠状的菌丝段(图1)者为阳性,检出阳性率为73%(46/63)培养基上兔须癣毛癣菌菌落为颗粒型,正面为浅黄色,背面为褐色,在显微镜下,小分生孢子为葡萄状,数量较多,大分生孢子为棒状,数量较少,同时还有特征性的螺旋菌丝和破梳子状菌丝(图2),阳性率为65%(41/63)。
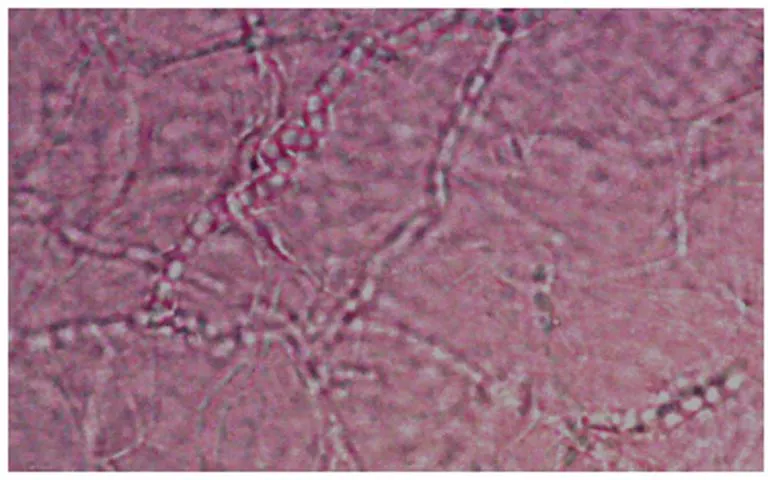
图1 皮屑中菌丝段(10×40)
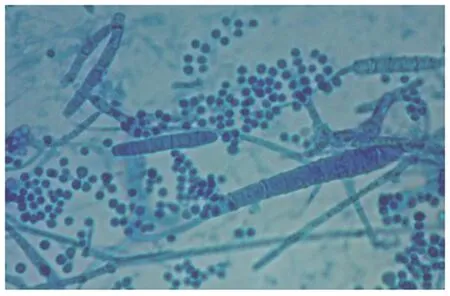
图2 养的菌丝和孢子(10×40)
2.2定量PCR检查定量PCR检测,呈“S”型扩增曲线,Ct值≤36.5,且Tm值介于为86.5 ℃~90.0 ℃之间时,说明样本含有须癣毛癣菌,阳性率为86%(54/63),10份对照样本为阴性。
2.3镜检与定量PCR检查比较在检测63份样本中,分离培养、镜检和定量PCR阳性结果是一致的。在12例样本检查结果不一致:S12、S14、S16、S23、S33镜检阳性、S13、S15、S26、S31、S48、S52ITS序列分析阳性,最终结论均为阳性。 S4镜检和ITS序列分析均阴性,最终结论亦然。
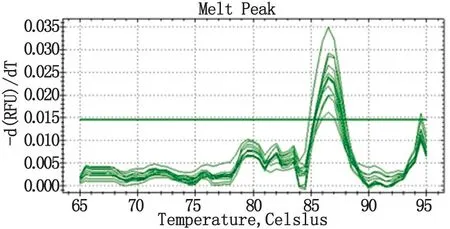
图3 定量PCR熔解曲线
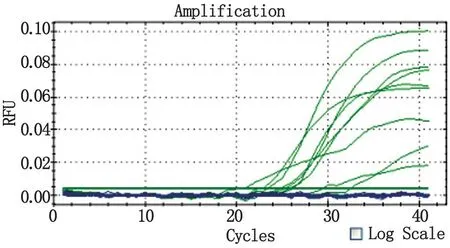
图4 定量PCR扩增曲线
2.4常规诊断与定量PCR方法性能比较培养的敏感性、特异性、阳性预测值和阴性预测值分别为77.35%、100%、100% 和45.45%,镜检的敏感性、特异性、阳性预测值和阴性预测值分别为86.79%、100%、100%和64.17%,定量PCR的敏感性、特异性、阳性预测值和阴性预测值分别为100%、90.9%、98.1%和100%(见表1)。与培养和镜检相比,定量PCR的敏感性(P<0.05)和阴性预测值(P<0.01)最高,而特异性和阳性预测值与培养和镜检没有明显差异(P>0.05)。
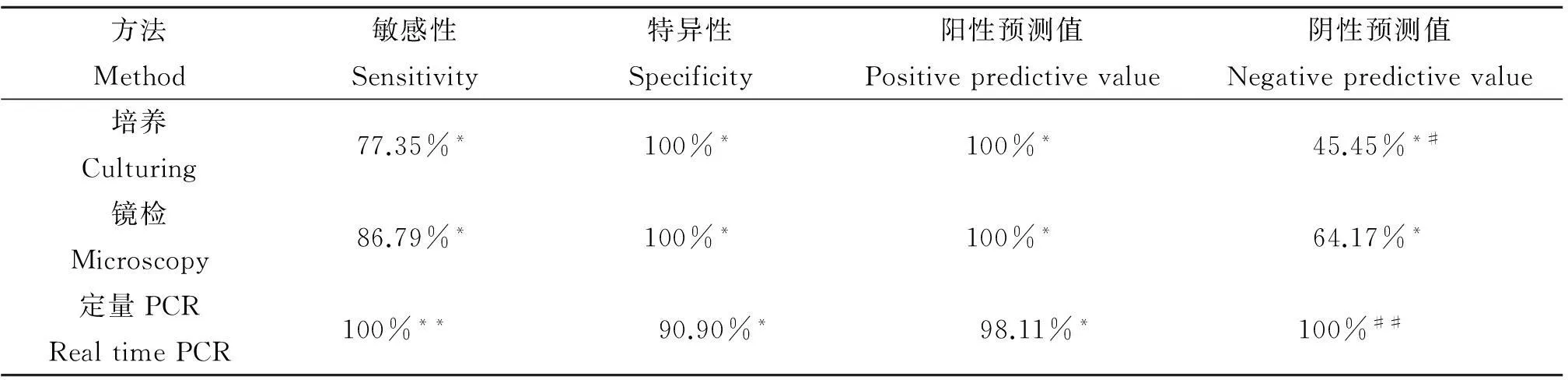
表1 常规诊断与定量PCR方法性能比较
*:**P<0.05; #:##P<0.01.
3讨论
3.1培养诊断方法及影响因素须癣毛癣菌分离培养常选用沙保弱培养基,纯化用土豆培养基,根据菌落形态和菌丝及孢子的结构进行诊断,有时也配合生理试验(如尿素酶和毛发穿孔试验)[4]。本试验从患兔病料分离的皮肤真菌,其菌落主要为颗粒型,有特征性螺旋和梳状菌丝,小分生孢子为圆形数量多,大分生孢子为棒状数量较少,这些完全符合亲动物须癣毛癣菌形态特征,即诊断为兔须癣毛癣菌。该菌生长缓慢,从分离培养、纯化到观察到特征形态变化,一般需要1~2周,即用培养诊断需要1~2周。文献报道时间长短不同,短则1周,长则4周[4-7]。用培养诊断方法,对临床样品检查阳性率报道不一致,一般为25%~80%。本试验阳性率为65%。造成阳性率差异原因有多种,首先病料中有20%为死菌丝,无法培养[7],特别是使用抗真菌药治疗病例,会造成菌丝死亡。我们发现5例样品经过药物治疗,镜检为阳性,而培养均为阴性。其次非皮肤真菌混合感染,由于非皮肤真菌生长快,破坏皮肤真菌生长[8]。另外,有实验证明念珠菌抑制皮肤真菌生长,致使皮肤真菌分离率降低[9]。本试验发现,与镜检和定量PCR相比,培养方法特异性和阳性预测值没有明显差异,敏感性最低(77.35%),有17.5%(11/63)假阳性。虽然培养诊断方法耗时长,敏感性差,但因培养方法可检测可培养任何病原真菌,且特异性高,也是其他诊断方法的基础,目前仍是不可替代诊断方法。
3.2镜检诊断结果及影响因素直接显微观察方法是把病料放在显微镜进行观察,通过寻找菌丝或孢子,对病料进行诊断。由于须癣毛癣菌为嗜角质真菌,主要在皮肤角质层或其皮肤附属物生长繁殖,这些组织特点较硬,不易直接观察到侵染的真菌,为软化角化的细胞,增加其透明性,一般滴加10%KOH,目前,报道该方法阳性率为67%~91%[2]。本试验阳性率为73%,比培养的方法高。镜检阳性率的高低与检查者的经验和病料采集有关。判断角化上皮有无感染,需要长时间的经验积累,最近报道有丰富经验的皮肤真菌形态学专家,对374例人临床样本进行直接显微检查,其阳性率为73.8%[2],这与本实验阳性率基本一致;病料采集时,首先应该与其他皮肤病进行鉴别,即取得病料应该是皮肤真菌感染病料,取病料应该在病变与健康皮肤组织交界处刮取皮屑或被毛。由于该方法局限和影响因素存在,本实验发现直接镜检敏感性低(86.79%),真正感染病料有时无法检出,有9.5%(6/63)假阳性;特异性差,即检查了菌丝,也不能确定感染真菌种类。由于直接显微检查速度快,简单,目前仍是临床皮肤真菌常用诊断方法之一。
3.3定量PCR与常规诊断方法比较近年来,为鉴定皮肤真菌的病原,建立多种分子生物学方法,包括基于染色体DNA(G+C)的含量、总DNA同源性、线粒体DNA限制酶断片长度多态分析、随机引物PCR、随机扩增DNA多态性分析、PCR指纹,特异基因序列分析等[5,10]。而这些方法是基于纯化培养样品,而不是临床病料样品。最近,建立了基于临床病料的方法,包括PCR反向线点杂交技术(PCR-RLB)[11]、特异基因和探针定量PCR[12]、复合PCR[13]、巢式PCR[14]、寡核苷酸芯片[15]和PCR-ELISA[16]等。这些分子生物学方法都是对人临床病料的检查,对动物皮肤真菌临床病料分子生物学检查,特别是兔须癣毛癣菌临床病料定量PCR检查方法还未见报道。本实验用定量PCR方法,对患兔临床病料进行检测,与常规培养和直接镜检方法相比,定量PCR的敏感性和阴性预测值明显高于常规方法,而特异性和阳性预测值与常规方法没有明显差异。在63例临床样品检查中,定量PCR阳性率为86%,其阳性率高于培养和直接镜检方法,多种指标综合评定,定量PCR方法优于常规方法。
综上所述,本试验建立定量PCR方法,只能检测须癣毛癣菌,对其它皮肤真菌和非皮肤真菌无法进行诊断。培养方法可诊断和培养任何病原真菌,因此,尽管定量PCR综合评定优于培养,但不能替代培养。直接镜检速度快、费用低,但缺乏特异性、敏感性低以及有假阴性。与直接镜检比,定量PCR更敏感,更特异性更强,完全可以替代直接镜检用于兔须癣毛癣菌的临床诊断。
参考文献:
[1]Liu YW, Liu N, Zhang YY, et al. Establishment of a method for rapid diagnosis ofTrichophytonmentagrophytesinfection in rabbits[J]. Chin Vet Sci, 2013, 43(11): 1184-1189. (in Chinese)
刘彦威,刘娜,张永英,等.家兔须癣毛癣菌感染快速诊断方法的建立.中国兽医科学[J].2013 ,43(11):1184-1189.
[2]Arabatzis M, Bruijnesteijn van Coppenraet LE, Kuijper EJ, et al. Diagnosis of common dermatophyte infections by a novel multiplex real-time polymerase chain reaction detection/identification scheme[J]. Br J Dermatol, 2007, 157(4): 681-689.
[3]Yadav P, Singal A, Pandhi D,et al. Clinico-mycological study of dermatophyte toenail onychomycosis in New Delhi, India[J]. Indian J Dermatol, 2015, 60(2): 153-158.
[4]Bergman A, Heimer D, Kondori N, et al. Fast and specific dermatophyte detection by automated DNA extraction and real-time PCR[J]. Clin Microbiol Infect, 2013, 19(4): 205-211. DOI: 10. 1111/1469 -069 1.12153
[5]Han HW, Hsu MM, Choi JS,et al. Rapid detection of dermatophytes andCandidaalbicansin onychomycosis specimens by an oligonucleotide array[J]. BMC Infect Dis, 2014, 14: 581. DOI: 10.1186/s12879-014-0581-5
[6]Robert R, Pihet M. Conventional methods for the diagnosis of dermatophytosis[J] . Mycopathologia, 2008, 166: 295-306.
[7]Paugam A, Lollivier C, Viguie C, et al. Comparison of real-time PCR with conventional methods to detect dermatophytes in samples from patients with suspected dermatophytosis[J]. J Microbiol Methods, 2013, 95(2): 218-222.
[8]Summerbell RC. Epidemiology and ecology of onychomycosis[J]. Dermatology(Basel), 1997, 194: 32-36.
[9]Bergmans AM, van der Ent M, Klaassen A, et al. Evaluation of a single-tube real-time PCR for detection and identification of 11 dermatophyte species in clinical material[J]. Clin Microbiol Infect, 2010, 16(6): 704-710.
[10]Frealle E, Rodrigue M, Gantois N. Phylogenetic analysis ofTrichophytonmentagrophyteshuman and animal isolates based on MnSOD and ITS sequence comparison[J]. Microbiology, 2007, 153: 3466-3477.
[11]Brillowska-Dabrowska A, Saunte DM, Cavling Arendrup M. Five-hour diagnosis of dermatophyte nail infections with specific detection ofTrichophytonrubrum[J] . J Clin Microbiol, 2007, 45: 1200-1204.
[12]Wisselink GJ, van Zanten E, Kooistra-Smid AMD. Trapped in keratin; a comparison of dermatophyte detection in nail, skin and hair samples directly from clinical samples using culture and real-time PCR[J]. J Microbiol Methods, 2011, 85: 62-66.
[13]Kim JY, Choe YB, Ahn KJ, et al. Identification of dermatophytes using multiplex polymerase chain reaction[J]. Ann Dermatol, 2011, 23: 304-312.
[14]Verrier J, Krahenbuhl L, Bontems O, et al. Dermatophyte identification in skin and hair samples using a simple and reliable nested-PCR assay[J]. Br J Dermatol, 2012, 168: 295-301.
[15]Li HC, Bouchara JP, Hsu MML, et al. Identification of dermatophytes by an oligonucleotide array[J]. J Clin Microbiol, 2007, 45: 3160-3166.
[16]Beifuss B, Bezold G, Gottlober P, et al. Direct detection of five common dermatophyte species in clinical samples using a rapid and sensitive 24-h PCR-ELISA technique open to protocol transfer[J]. Mycoses, 2011, 54: 137-145.
DOI:10.3969/j.issn.1002-2694.2016.02.013
通讯作者:刘彦威,Email:Liuyw.edu@126.com
Corresponding author:Liu Yan-wei, Email: liuyw.edu@126.com
中图分类号:R379
文献标识码:A
文章编号:1002-2694(2016)02-0165-04
收稿日期:2015-06-10;修回日期:2015-10-12
Comparison of real-time PCR with conventional methods to diagnose Trichophyton mentagrophytes in clinical specimens from rabbits
SHEN Jie,LIU Yue,LIU Li-qiang,LIU Na,LIU Jian-chai,LIU Yan-wei,XING Xin
(Key Laboratory of Animal Medicine, Agricultural College, Hebei University of Engineering, Handan 056021, China)
Abstract:To investigate a rapid, specific and sensitive method to diagnose Trichophyton mentagrophytes infections in rabbits, a total of 63 clinical specimens were collected from rabbit with suspected dermatophytosis. These specimens were examined by both conventional diagnostic (direct microscopy and culture) method and real-time PCR assay, which were compared by sensitivity, specificity, positive and negative predictive value. The results showed that real-time PCR assay for Trichophyton mentagrophytes was positive in 86%, followed by direct microscopy(73%) and culture method(65%). Comparing with direct microscopy and culture method, real-time PCR assay had significantly higher sensitivity (100%vs 86.79%-77.35%) and negative predictive value (100% vs 64.17%-45.45%), while no significant differences were observed in specificity (90.90% vs 100%-100%) and positive predictive value (98.11% vs 100%-100%). In vitro culture is a specific diagnostic test, but is in poor sensitivity and long turnaround time of technique, with false negative results. Direct microscopy is a rapid diagnostic method but it lacks specificity and sensitivity. The specific result and short response time makes this real-time PCR assay very suitable as a routine diagnostic assay for Trichophyton mentagrophytes. It could advantageously replace the direct microscopy, but not the culture method.
Keywords:real-time PCR; Trichophyton mentagrophytes; conventional diagnosis; rabbit
河北省自然基金项目(No.C180501);河北省教育厅重点项目(No.Z02014048)和邯郸市科技局资助项目(No.1422101047-3)联合资助
Supported by the Natural Science Foundation Project of Hebei Province (No. C180501), the Key Project of Hebei Province Department of Education (No. Z02014048) and the Science and Technology Bureau--Funded Project (No. 1422101047-3)

