猴源溶组织内阿米巴原虫巢式PCR检测方法的建立
汪 凯,刘 浩,李文超,顾有方*
(1.安徽科技学院 动物科学学院,安徽 凤阳 233100;2. 凤阳县畜牧兽医局,安徽 凤阳 233100)
猴源溶组织内阿米巴原虫巢式PCR检测方法的建立
汪凯1,刘浩2,李文超1,顾有方1*
(1.安徽科技学院动物科学学院,安徽凤阳233100;2. 凤阳县畜牧兽医局,安徽凤阳233100)
摘要:目的:建立猴源溶组织内阿米巴原虫巢式PCR 检测方法并初步应用于临床检测;方法:根据溶组织内阿米巴原虫16S rDNA基因序列,设计1 对阿米巴属原虫保守引物和1 对溶组织内阿米巴原虫特异性引物,建立猴源溶组织内阿米巴原虫巢式PCR 检测方法,摸索出了该检测方法的最佳反应条件,进了行特异性和敏感性试验,并对96份猕猴粪便样品进行检测;结果:该巢式PCR方法能特异性地扩增出猴源溶组织内阿米巴原虫目的片段,与莫氏内阿米巴、波氏内阿米巴、迪斯帕内阿米巴、大肠内阿米巴、微小隐孢子虫等11种相关原虫基因组DNA 无交叉反应;最低能检测到0.3 fg的阳性参照DNA;对临床样品检测结果表明该PCR技术检查阳性者显微镜检查均为阳性;结论:建立的巢式PCR方法具有高度的特异性和敏感性,对于溶组织内阿米巴原虫病的诊断和流行病学调查具有重要的应用价值。
关键词:溶组织内阿米巴原虫;猴;巢式PCR;检测
溶组织内阿米巴(Entamoebahistolytica) 又称痢疾阿米巴,是引起阿米巴性结肠炎和肠外脓肿的病原体[1]。全世界约有5 000 万人感染,每年导致10万人死亡[2],其死亡率在原虫寄生虫病患者中仅次于疟疾[3]。
E.histolytica在猕猴、猩猩和狒狒等非人灵长类动物肠道内感染均较为普遍[4],尤其是最近报道显示E.histolytica在菲律宾食蟹猴群中高度流行[5]。阿米巴原虫在猴群中的流行不仅对非人灵长类动物自身健康带来威胁,而且可能具有人兽共患潜力,在公共卫生上具重要意义[4]。
从形态上看,溶组织内阿米巴的包囊或裂殖子阶段与寄生于人或非人灵长类肠道的其它非致病性阿米巴如莫氏内阿米巴(E.moshkovskii)和迪斯帕内阿米巴(E.dispar)难以区分,因此传统的镜检方法难以区分不同的阿米巴原虫虫种[6]。尽管可以通过粪便培养后利用同工酶分析区分E.histolytica和E.dispar,但该方法周期较长,大约需几周的时间才能得到结果,而且对试验设备的要求较高,难以普及应用[7]。因此,目前主要通过分子诊断方法对阿米巴原虫进行种类鉴定和基因分型,常用的靶基因有16S rRNA、HLY6基因、30-kDa蛋白基因等,其中16S rRNA基因已成为区分阿米巴原虫虫种的重要靶基因[8]。鉴于国内目前有关溶组织内阿米巴原虫的分子检测方法报道较少,本试验根据猴源溶组织内阿米巴原虫16S rRNA基因序列,建立一种能够快速检测猴源溶组织内阿米巴的巢式PCR方法,为溶组织内阿米巴的分子检测和防控提供简便可靠的技术工具。
1材料与方法
1.1虫体及对照基因组DNA
微小隐孢子虫、人隐孢子虫、人五毛滴虫、莫氏内阿米巴、波氏内阿米巴、迪斯帕内阿米巴、大肠内阿米巴、柔嫩艾美耳球虫、人芽囊原虫、犬贾第虫、犬弓首蛔虫基因组DNA均由本实验室分离保存。溶组织内阿米巴阳性对照为插入猴源溶组织内阿米巴16S rDNA片段的重组质粒,由本室制备、保存。
1.2猕猴粪便样品
96份猕猴粪便样品,采自安徽某动物园。
1.3主要试剂
rTaq DNA 聚合酶、PCR Buffer、dNTPs和DNA Marker DL2000均为Takara公司产品;粪便DNA提取试剂盒,为天根生化科技(北京)有限公司品。
1.4引物的设计与合成
参照Que等[5]的引物,引物根据E.histolytica16S rDNA基因设计,共设计2对引物,其中第一对引物E-1:5'- TAAGATGCAGAGCGAAA -3',E-2:5'- GTACAAAGGGCAGGGACGTA-3',第二对引物为EH-1:5'- AAG CAT TGT TTC TAGATC TGA G-3',EH-2:5'- AAG AGG TCT AAC CGA AAT TAG-3'。预计扩增产物片段为439 bp。上述引物均由生工生物工程(上海)股份有限公司合成。
1.5巢式PCR反应
以溶组织内阿米巴重组阳性质粒为巢式PCR首轮扩增模板, 两轮PCR反应体系相同,均为5 U/μL rTaq酶0.2 μL,2.5 mM dNTP 2 μL,10×PCR缓冲液2.5 μL,20 mol/L上、下游引物各0.25 μL,模板1 μL,加双蒸水至25 μL,其中第2轮PCR时用2 μL首轮PCR产物作为模板。巢式PCR首轮反应条件为96 ℃,2 min;92 ℃ 60 s,56 ℃ 60 s,72 ℃ 90 s,共30个循环;72 ℃,7 min。第二轮PCR反应条件为96 ℃,2 min;92 ℃ 60 s,48 ℃ 60 s,72 ℃ 90 s,共30个循环;72 ℃,7 min。
1.6特异性试验
以溶组织内阿米巴重组阳性质粒为阳性对照,分别以微小隐孢子虫、人隐孢子虫、人五毛滴虫、莫氏内阿米巴、波氏内阿米巴、迪斯帕内阿米巴、大肠内阿米巴、柔嫩艾美耳球虫、人芽囊原虫、犬贾第虫、犬弓首蛔虫DNA为模板,ddH2O为阴性对照,进行巢式PCR反应后经1%琼脂糖凝胶电泳分析以检测其特异性。
1.7敏感性试验
将3 ng /μL溶组织内阿米巴重组阳性质粒按1 ∶10°~1 ∶108进行10倍系列稀释。从每个稀释液中各取1μL作为首轮PCR模板进行巢式PCR扩增,扩增产物经1%的琼脂糖凝胶电泳以检测其敏感性。
1.8临床样本的检测
对所采集的猕猴粪便采用水洗离心沉淀并碘染后镜检的方法进行检测,以镜检发现阿米巴包囊判为阳性,同时提取所有粪便样品的基因组DNA,按本试验所建立的巢式PCR方法对所有样品进行PCR检测,电泳后若在439 bp出现条带则判为阳性。
2结果与分析
2.1特异性试验
利用特异性引物对溶组织内阿米巴16S rDNA阳性对照及11种其它寄生虫DNA进行PCR扩增,只有溶组织内阿米巴重组阳性质粒为模板的PCR扩增出特异条带,其它DNA作为模板均无条带出现(图1)。

图1 溶组织内阿米巴特异性引物PCR扩增不同虫体DNA的电泳结果
M:DL2000 DNA Marker;1:ddH2O;2:溶组织内阿米巴;3:微小隐孢子虫;4:人隐孢子虫;5:人五毛滴虫;6:莫氏内阿米巴;7:波氏内阿米巴;8:迪斯帕内阿米巴;9:大肠内阿米巴;10:柔嫩艾美耳球虫;11:人芽囊原虫;12:犬贾第虫;13:犬弓首蛔虫
Fig.1PCR amplicon from different genomic DNAs with specific primers ofE.histolytica
M:DL2000 DNA Marker;1:ddH2O;2:Entamoebahistolytica;3:Cryptosporidiumparvum;4:Cryptosporidiumhominis;5:Pentatrichomonashominis;6:Entamoebamoshkovskii;7:Entamoebapolecki;8:Entamoebadispar;9:Entamoebacoli;10:Eimeriatenella;11:Blastocystishominis;12:Giardiacanis;13:Toxocaracanis
2.2敏感性试验
将3 ng /μL溶组织内阿米巴重组阳性质粒进行10倍系列稀释后进行巢式PCR扩增,结果显示PCR扩增可检测到1 ∶104稀释的阳性参照DNA,即对阳性参照模板最低可检测到0.3 fg(图2)。
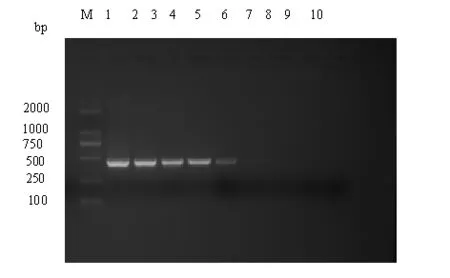
图2 溶组织内阿米巴巢式PCR敏感性试验结果
2.3临床样本的检测
96份猕猴粪便样品,水洗离心沉淀并碘染后镜检共检出阳性样品25份,阳性率为26.04 %;PCR方法检出阳性数为30份,阳性率为31.25 %。其中,PCR检测均为阳性者,镜检均呈阳性。
3结论与讨论
内阿米巴属原虫是可寄生于人和动物多种脏器的人兽共患原虫,种类较多,包括致病性和非致病性的虫种,其中致病性种类主要是溶组织内阿米巴,可引起人和动物出现痢疾和肝脓肿,严重者可危及生命[11]。致病性和非致病性的内阿米巴属原虫的包囊和滋养体在形态上很难区别,因此,传统的诊断方法很难确定病原种类,开发新的方便、易行、快捷、费用低、敏感性高的检测方法已迫在眉睫。
PCR技术由于其灵敏度高,而且易于操作,对寄生虫的各个生活史阶段都可以检测,尤其是巢式PCR技术由于经过两轮PCR扩增使诊断的特异性、灵敏度大大增强,特别适合检测杂质较多但目的基因含量少的样本,如粪便样本等。目前国外已有针对阿米巴原虫不同基因的PCR方法用于检测或区分内阿米巴原虫不同虫种,其中16S rDNA基因由于在不同内阿米巴虫种之间存在稳定的遗传偏差,而且该基因在基因组上具有多拷贝性,使得该基因比单拷贝基因更易检测,因此该基因目前作为区分内阿米巴虫种的一个重要靶基因广泛应用于内阿米巴原虫虫种的检测和虫种分类方面[9]。
本研究以含有猴源溶组织内阿米巴16S rDNA基因重组质粒作为阳性参照模板,建立了猴源溶组织内阿米巴的巢式PCR检测方法。对PCR检测方法而言,特异性和敏感性是评价其其优良与否的关键指标,两者缺一不可[10]。本试验特异性试验结果显示只有猴源溶组织内阿米巴扩增出目的条带,其他所有对照包括内阿米巴原虫对照均不能扩增出目的条带,表明所建立的巢式PCR方法具有较强的特异性。敏感性试验结果显示该方法对阳性参照模板最低可检测到0.3 fg,显示该方法具有较高的敏感性。本试验中所用阳性参照模板为重组质粒,其DNA纯度要比实际工作中样品提取的DNA纯度要高,而且实际样品如粪便中提取的DNA中可能含有较多的PCR抑制因子,因此本试验的敏感性试验结果只能用于样品检测的一个参考,但本试验建立的方法对于某些难以大量获得病原体的情况下的检测却很有意义[11]。
本试验中,比较巢式PCR方法和水洗离心沉淀并碘染后镜检法的结果,显示常规方法往往会出现大量的假阳性。猕猴等非人灵长类动物可感染多种内阿米巴原虫,包括E.histolytica、迪斯帕内阿米巴(E.dispar)、波列基内阿米巴(E.polecki)、 结肠内阿米巴(E.coli)、诺氏内阿米巴(E.nutalli)等[12]。而E.histolytica与其它内阿米巴在形态上难以区分,因此常规方法镜检时可能把非致病性的内阿米巴误认为E.histolytica,因而人为提高了E.histolytica的阳性率。其次,猕猴粪便中含有大量的干扰物质如各种酵母菌、纤毛虫等,检查者的技术水平也会影响检查结果。本试验中,PCR 技术检查阳性者显微镜检查都为阳性,表明所建立的巢式PCR方法与传统方法具有较好的一致性,说明该方法具有较好的临床应用价值。
参考文献:
[1]陈奕,程训佳.溶组织内阿米巴致病因子的研究进展[J].中国寄生虫学与寄生虫病杂志,2006,24(6):457-460.
[2]WALSH J A. Problems in recognition and diagnosis of amebiasis: estimation of the global magnitude of morbidity and mortality[J]. Reviews of Infectious Diseases, 1986, 8(2): 228-238.
[3]NGUI R, ANGAL L, FAKHRURRAZI S A, et al. DifferentiatingEntamoebahistolytica,entamoebadisparandEntamoebamoshkovskiiusing nested polymerase chain reaction (PCR) in rural communities in Malaysia[J]. Parasites & Vectors, 2012, 5(1): 187.
[4]FENG Meng, YANG Bin, YANG Liu, et al. High prevalence ofEntamoebainfectionsin captive long-tailed macaques in China[J]. Parasitology Research, 2011, 109(4): 1093-1097.
[5]RIVERA W L, YASON J A, ADAO D E.EntamoebahistolyticaandE.disparinfections in captive macaques (Macacafascicularis) in the Philippines[J]. Primates, 2010, 51(1): 69-74.
[6]HAMZAH Z, PETMITR S, MUNGTHIN M, et al. Differential detection ofEntamoebahistolytica,Entamoebadispar, andEntamoebamoshkovskiiby a single-round PCR assay[J]. Journal of Clinical Microbiology, 2006, 44(9): 3196-3200.
[7]HUSTON C D, HAQUE R, PETRI W A. Molecular-based diagnosis ofEntamoebahistolyticainfection[J]. Expert Reviews in Molecular Medicine, 1999(12): 1-11.
[8]FOO P C, CHAN Yean-yean, SEE TOO W C, et al. Development of a thermostabilized, one-step, nested, tetraplex PCR assay for simultaneous identification and differentiation of Entamoeba species,EntamoebahistolyticaandEntamoebadisparfrom stool samples[J]. Journal of Medical Microbiology, 2012, 61(Pt9): 1219-1225.
[9]董海聚,王荣军,张龙现.内阿米巴属原虫分子检测及基因分型方法研究进展[J].中国人兽共患病学报,2014,30(7):747-752.
[10]肖淑敏,李国清,杨建伟,等.牛源贾第虫套式PCR检测方法的建立[J].中国人兽共患病学报,2008,24(1):26-29.
[11]高振永,李国清,岳彩玲,等.猴源环孢子虫巢式PCR检测方法的建立[J].中国动物传染病学报,2010,18(5):32-36.
[12]FENG Meng, CAI Jun-long, MIN Xiang-yang, et al. Prevalence and genetic diversity of Entamoeba species infecting macaques in southwest China[J]. Parasitology Research, 2013, 112(4): 1529-1536.
(责任编辑:马世堂)
收稿日期:2016-01-06
基金项目:安徽省第七批“115”产业创新团队项目;安徽省教育厅重大项目(KJ2014ZD09);安徽省教育厅重点项目(KJ2015A189);安徽省高校优秀青年人才支持计划重点项目(gxyqZD2016220);安徽省省级大学生创客实验室项目(2015ckjh027);安徽科技学院校级大学生创客实验室项目(Xj201550);安徽科技学院重点学科项目(AKZDXK2015A04)。
作者简介:汪凯( 1991-),女,安徽省池州市人,在读硕士研究生,主要从事动物寄生虫病研究。 *通讯作者:顾有方,教授,E-mail:youfanggu@163.com。
中图分类号:S855.9
文献标识码:A
文章编号:1673-8772(2016)03-0010-04
Establishment of Nested PCR Assay for Detection of Monkey-DerivedEntamoebahistolytica
WANG Kai1,LIU Hao2, LI Wen-chao1, GU You-fang1*
( 1.College of Animal Science,Anhui Science and Technology University,Fengyang 233100,China;2.Animal Husbandry and Veterinary Bureau of Fengyang, Fengyang 233100,China)
Abstract:Objective: To develop a nested PCR assay for the detection of monkey-derived Entamoeba histolytica. Method Based on the monkey-derived E. histolytica 16S rRNA gene sequences, one pair of Entamoeba genus specific primers and one pair of E. histolytica species specific primers were designed. With these primers, a nested PCR amplification conditions were optimized. A series of tests were conducted regarding the specificity and sensitivity. Results: The nested PCR assay was specific and there is no cross-reaction with other parasites, such as E. moshkovskii,E. polecki,E. dispar,E .coli and C. parvum. The assay was able to detect as low as 0.3 fg of control positive DNA. The results of detection of clinical samples showed that the assay was coinciding with the traditional method. Conclusion: The nested PCR assay reported here detects E. histolytica accurately and sensitively and will be an effective tool for molecular epidemiology and diagnosis of E. histolytica in monkey feces.
Key words:Entamoeba histolytica;Monkey;Nested PCR;Detection

