重金属Cu2+胁迫对红树植物秋茄幼苗生长及某些生理特性的影响
赵 胡,唐 俊,郑文教
(1. 阜阳师范学院 生命科学学院,安徽 阜阳 236041; 2. 厦门大学 环境与生态学院,福建 厦门 210093)
重金属Cu2+胁迫对红树植物秋茄幼苗生长及某些生理特性的影响
赵 胡1,唐 俊1,郑文教2
(1. 阜阳师范学院 生命科学学院,安徽 阜阳 236041; 2. 厦门大学 环境与生态学院,福建 厦门 210093)
摘要:为揭示铜污染对红树植物的毒性效应和植物的抗性机制,作者研究了红树植物秋茄(Kandelia obovata)幼苗在不同质量浓度的Cu2+(0,0.5,5,50,100,200 mg/L)离子胁迫90 d后,幼苗生长、部分生理指标的变化以及Cu2+在幼苗体内的累积情况。测定的主要参数有: 幼苗的主根长度、侧根数目、生物量、叶片的光合速率、色素含量、可溶性糖和蛋白含量及抗氧化酶系活性。研究结果表明: 当Cu2+浓度范围在(0.5~200 mg/L)时,主根长度、侧根数目、生物量、叶片的光合速率、色素含量、可溶性糖和蛋白含量均呈降低趋势; 根系POD活性持续升高,叶片和根系的SOD和CAT活性呈先升后降趋势;根系 MDA含量在整个 Cu2+胁迫浓度范围保持相对稳定,叶片 MDA含量在高浓度 Cu2+胁迫下增加;Cu2+主要累积在根部而向地上部分转运的较少。根据不同浓度的Cu2+离子对秋茄幼苗生长及生理特性影响,秋茄幼苗对Cu2+胁迫的耐受质量浓度范围为5 ~50 mg/L。
关键词:红树植物; 秋茄(Kandelia obovata); Cu2+; 抗氧化酶; 累积
红树林是一类分布于热带、亚热带陆海交汇的海湾河口潮间带的木本植物群落。作为海岸河口湿地生态系统的重要初级生产者,红树林生态系统蕴藏丰富的生物资源,对维护海岸河口区的生态平衡、保护环境起着重要的作用[1]。近年来,随着中国沿海地区经济以及港口海运业的快速发展,排入海湾河口区的重金属迅速增加。同时,红树林沉积物的厌氧环境,高硫含量以及低还原电位等特殊的理化性质,使之成为海岸带重金属的富集源与库[2]。卢豪良等[3]调查了福建省云霄县漳江口红树林湿地自然保护区秋茄(Kandelia obovata)群落中沉积物中重金属 Cu2+的含量为 39.86~67.32 mg/kg,且秋茄根际样品中Cu2+的含量显著高于非根际Cu2+的含量。田海涛等[4]总结了中国近海域不同海湾地区红树林沉积物中Cu2+的含量为4.7~27 mg/kg。这些研究结果表明红树林湿地在不同程度上已受重金属 Cu2+污染胁迫。国内外对重金属污染胁迫下的红树植物生长及生理生态机制的影响都进行了较为广泛的研究[5-7],但重金属铜胁迫对红树植物秋茄幼苗的影响则尚未见相关的报道。作者主要探讨了铜暴污实验90 d的处理对秋茄幼苗的生长和某些生理特性的影响以及相关抗氧化酶系统的调节作用,以期为揭示铜污染对红树植物的毒性效应和植物的抗性和毒害机制、利用红树植物净化重金属污染和生态环境保护提供科学依据。
1 材料与方法
1.1 试验材料
成熟的秋茄繁殖体(胚轴) 2013 年5月采自于福建九龙江口浮宫镇(24º24'N,117º55'E)红树林区。选择生长正常、质量与大小一致且无病虫害的胚轴用于试验栽培。
1.2 胁迫处理
栽培于盛砂塑料网框的砂基上,并套入大小相近的塑料盆中,每盆砂基高14 cm、直径30 cm,每盆种植种苗10 株。设5个暴污级组,用盐度为15的海水和CuSO4·5H2O 配制为Cu2+质量浓度分别为0.5、5、50、100、200 mg/L的培养液,进行暴污处理栽培,以不
[Foundation: National Natural Science Foundation of China,No.41001189; Natural Science Foundations of the Anhui Bureau of Education,No. 2015KJ006; Natural Science Foundations of Fuyang Normal College,No. 2013FSKJ04ZD]
1.3 测定指标及方法
1.3.1 生理生化指标
2013 年8月,选择典型晴朗天气,采用PPSYSTEMS国际有限公司的CIRAS-1便携式光合作用系统同步测定了CK与CuSO4·5H2O 配制为Cu2+质量浓度分别为0.5、5、50、100、200 mg/L处理下秋茄幼苗第二对叶片光合参数指标。测定指标主要包括净光合速率(Pn,μmol/(m2·s))、气孔导度(Gs,mol/(m2·s))、蒸腾速率(Tr,mmol/(m2·s))。各处理在胁迫的第90天上午取秋茄幼苗的第 3~5 叶位成熟叶片和根尖,立即带回实验室进行生理指标的测定。试验均重复3 次,其中,叶绿素含量采用丙酮乙醇提取法测定[8]; 可溶性糖含量采用蒽酮比色法测定[9]; 可溶性蛋白含量按照Bradford[10]的方法测定; 超氧化物歧化酶(SOD)活性采用氯化硝基四氮唑蓝(NBT)光化学还原法测定[9]; 过氧化物酶(POD)活性采用愈创木酚氧化法测定[9]; 过氧化氢(CAT)活性采用碘量法[9]; 丙二醛(MDA)含量参照Heath和刘祖祺[11]等方法测定。
1.3.2 Cu2+含量的测定
将对照组和不同浓度Cu2+处理90 d的秋茄幼苗的不同器官分组于80℃下烘干72 h,经研钵磨碎过100目尼龙筛。植物样品用 HNO3-HClO3消化[12],用Z-5000 型原子吸收分光光度计(HITACHI,JAPAN)测定Cu2+元素含量(火焰法+石墨炉法)[13]。
1.3.3 生长指标
用直尺测量株高和主根长度,叶面积采用剪纸称质量法。将上一步试验剩余的秋茄幼苗,在实验室用去离子水洗净,分根、茎、原胚轴和叶,在 105℃下杀青 15 min后,在 80℃下烘干 72 h,用感量为0.01 g的电子天平称量干质量,统计单株生物量。
1.3.4 数据处理
用 SPSS13.0软件进行单因素方差分析(Anova),用LSD 法比较各处理间差异显著性,Excel 软件制图。
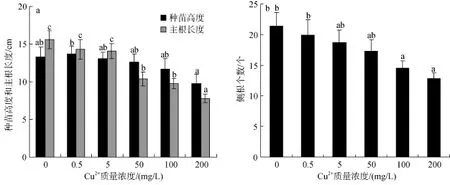
2 结果与分析
2.1 Cu2+胁迫对秋茄幼苗生长的影响
Cu2+胁迫对秋茄种苗生长高度没有显著影响,但在Cu2+处理质量浓度达到50~200 mg/L时主根长度与对照差异显著(P<0.05)。Cu2+质量浓度为 50、100和200 mg/L时,主根长度比对照组降低了33.3%、37.1% 和50%(图1a)。Cu2+处理质量浓度为100~200 mg/L侧根数目较对照组显著减少(图1b); 叶面积在Cu2+处理质量浓度200 mg/L也较对照组明显减少(图1c)。
Cu2+处理质量浓度在50~200 mg/L时,秋茄幼苗的生物量随Cu2+浓度的增加而显著减小(P<0.05)。在Cu2+处理质量浓度在 50 mg/L 时,幼苗的生物量只有对照的80.0%; 当Cu2+质量浓度达到200 mg/L时,幼苗的生物量比对照显著下降了45.4%(图1d)。这说明在Cu2+胁迫下秋茄幼苗的生长受到了严重的抑制,并且抑制程度随着 Cu2+质量浓度的增加而加强。
2.2 Cu2+胁迫对秋茄幼苗光合参数和叶绿素含量的影响
表1表明,秋茄幼苗叶片的Pn、Gs、Tr随Cu2+处理质量浓度的增加而降低; Cu2+处理质量浓度为5、50和100 mg/L时,叶片净光合速率分别为对照的78.8%、15.7%和12.0%(P<0.05); 当Cu2+处理质量浓度达200 mg/L 时,叶片净光合速率为负值,表明秋茄幼苗叶片在高浓度 Cu2+胁迫下出现负增长; 而Gs、Tr也仅为对照组的11.0%、17.7%(P<0.05)。
另外,幼苗叶片总叶绿素含量(TCC)也随着随Cu2+处理质量浓度的增加而呈降低趋势,Cu2+处理质量浓度为5、50、100和200 mg/L时,总叶绿素含量分别比对照降低9.3%、16.1%、23.7%和37.3%(P<0.05)。
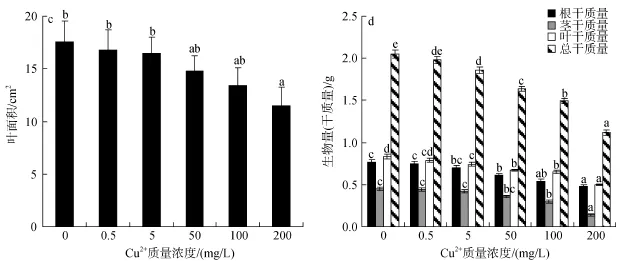
图1 Cu2+胁迫对秋茄幼苗生长的影响Fig. 1 Effect of Cu2+on the growth of Kandelia obovata seedlings
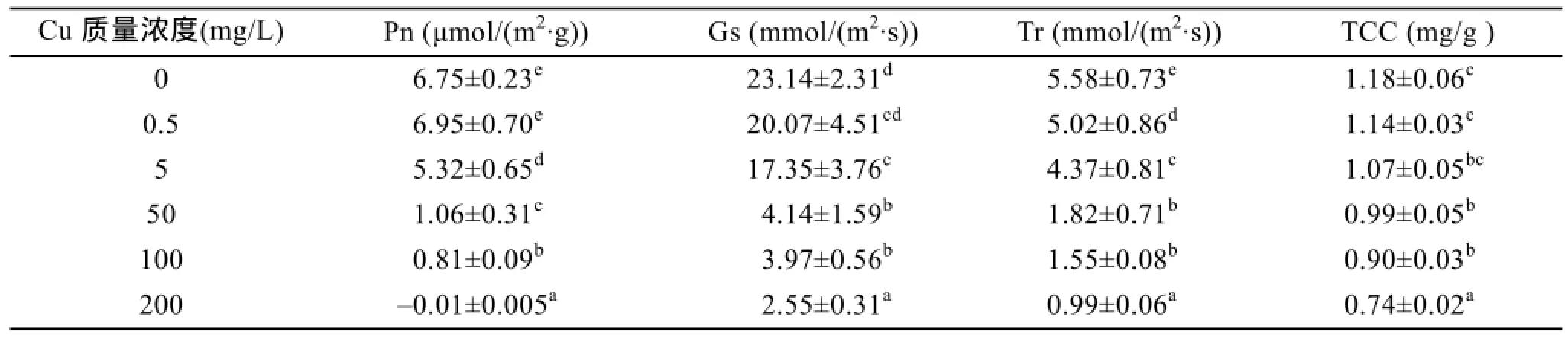
表1 Cu2+处理下秋茄叶片的Pn、Gs、Tr和 TCCTab. 1 Pn,Gs,Tr,and TCC of Kandelia obovata leaves treated using different Cu2+concentrations
2.3 Cu2+胁迫对秋茄幼苗根尖、叶片可溶性糖和蛋白含量的影响
由图2a可以看出,随着培养液Cu2+处理浓度的增加,幼苗根尖和叶片中可溶性糖含量相应减少,并在Cu2+质量浓度达到5和50 mg/L时,根尖与叶片的可溶性糖含量与对照组比较达显著性差异(P<0.05)。可溶性蛋白含量在根尖与叶片中随着Cu2+处理浓度的增加表现有所差异(图 2b),在 Cu2+质量浓度达到 5~50 mg/L时,根尖可溶性蛋白含量与对照组相比略微增加但差异不显著(P>0.05); 而叶片可溶性糖含量在培养液中Cu2+质量浓度为0.5 mg/L时显著降低(P<0.05),并随着Cu2+处理质量浓度的增加进一步降低。
2.4 Cu2+胁迫对秋茄幼苗根尖、叶片抗氧化酶和MDA含量的影响
不同浓度 Cu2+胁迫栽培 90 d,秋茄幼苗根系和叶片抗氧化酶和 MDA含量的变化如图 3。从图 3a可以看出,随着生长基 Cu2+质量浓度升高,幼苗根系 POD活性与对照组比较差异显著(P<0.05),尤其在50~200 mg/L的Cu2+处理质量浓度范围保持较高水平,如50、100和200 mg/L理组幼苗根系POD活性分别比对照组根系POD活性高3.8、4.1和5.1倍;而叶片POD活性也随着生长基Cu2+浓度升高而升高,但提升的幅度不及根系POD活性显著。如Cu2+质量浓度在0.5~50 mg/L,叶片POD活性与对照组比较差异不显著(P>0.05); 当Cu2+质量浓度达100和200 mg/L时,叶片POD活性较对照提高34.4%和29.9%,并与对照组比较差异显著(P<0.05)。从图3b看出,在Cu2+质量浓度在0.5~50 mg/L范围内,根系SOD活性与
对照组比较差异不显著(P>0.05); 当Cu2+质量浓度达100和200 mg/L时,根系SOD活性与对照组比较分别降低了 20.5%和 26.6%并差异显著(P<0.05); 叶片SOD活性在整个Cu2+浓度范围内表现先升后降的趋势,在Cu2+质量浓度0.5~5 mg/L,SOD活性略微上升但与对照组比较差异不显著(P>0.05); 随着生长基 Cu2+质量浓度进一步加大SOD活性显著下降,如Cu2+质量浓度达100和200 mg/L时,叶片SOD活性仅为对照组的81.5%和 44.9%,与对照组比较差异显著(P<0.05)。从图3C看出,在低质量浓度组Cu2+(0.5~5 mg/L)处理,根系和叶片CAT活性显著提高; 随着Cu2+处理质量浓度增加,CAT的活性显著下降,与对照比较差异显著(P<0.05)。Cu2+胁迫对幼苗根系和叶片MDA含量的影响见图 3d,在整个 Cu2+处理浓度范围内,根系中MDA含量保持一定的相对稳定性,与对照组比较差异不显著(P>0.05); 而叶片中MDA含量在高质量浓度组处理范围内(100~200 mg/L)显著升高,如在Cu2+处理质量浓度分别为100和200 mg/L时,MDA含量分别比对照组提高了 56.6%和 108.6%,与对照相比差异显著(P<0.05)。
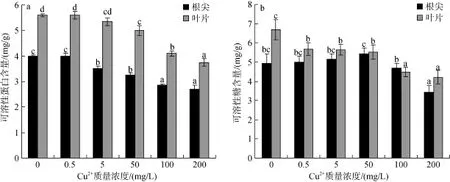
图2 Cu2+胁迫对秋茄幼苗可溶性糖和可溶性蛋白含量的影响Fig. 2 Effect of Cu2+on the soluble sugar and protein contents of Kandelia obovata seedling
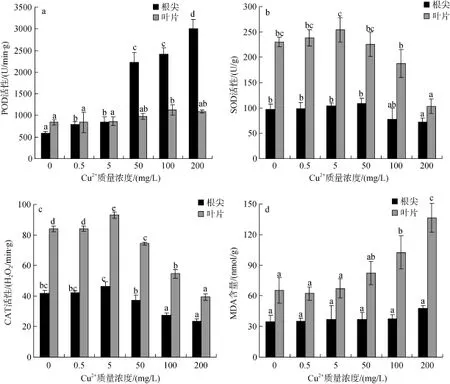
图3 Cu2+胁迫对秋茄幼苗抗氧化酶活性和丙二醛含量的影响Fig. 3 Effect of Cu2+on the antioxidant enzyme activities and MDA content of Kandelia obovata seedlings
2.5 Cu2+胁迫对秋茄幼苗吸收累积 Cu2+的影响
基于试验 Cu2+处理水平,相应秋茄各部分吸收累积重金属的量见表 2。由表 2可知,秋茄幼苗在不同浓度Cu2+溶液中生长90 d后,Cu2+在秋茄各部分的累积有所不同。在各 Cu2+浓质量度组中,Cu2+累积量为根系>原胚轴>茎>叶片,Cu2+主要是积累在根部,向地上器官转运的较少,而且随着生长基中 Cu2+浓度的提高,这一特征明显加强,如在各Cu2+处理水平上根系累积 Cu2+量分别为对照组的2.9、3.0、16.1、16.9和45.7倍,而叶片中Cu2+累积量仅为对照组的1.2、1.3、1.5、1.7和2.3倍。然而,在 Cu2+质量浓度达到 200 mg/L时,秋茄幼苗茎叶Cu2+含量反而降低,可能的原因是高浓度的 Cu2+胁迫使幼苗根系已严重受到毒害,幼苗的原胚轴发生萎缩失水,使得根系与原胚轴吸收转运Cu2+的能力降低,最终导致向地上器官茎叶Cu2+含量在高浓度Cu2+胁迫下减少。
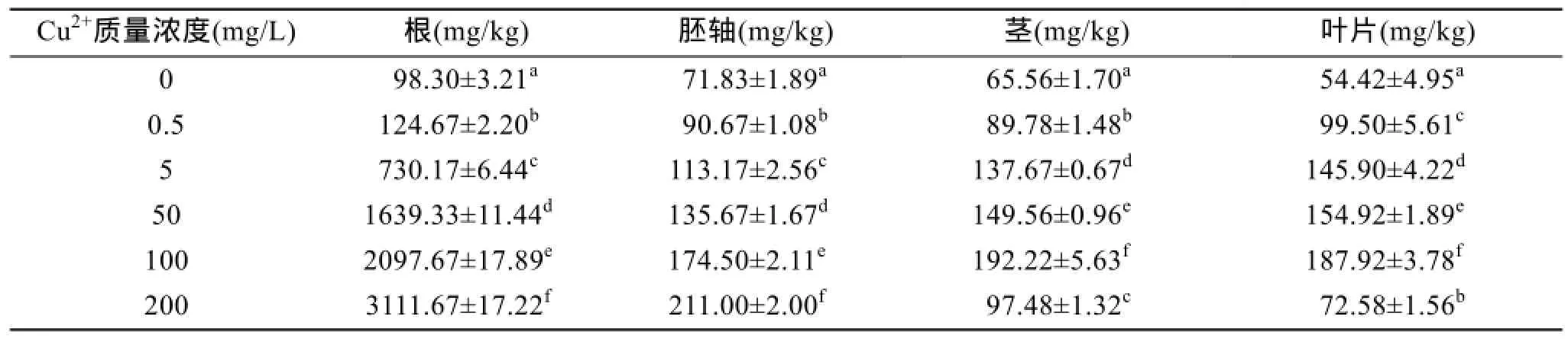
表2 Cu2+胁迫对秋茄幼苗不同器官Cu2+累积的影响Tab. 2 Effect of Cu2+on the accumulation and distribution of Cu2+in Kandelia obovata seedlings
3 讨论
3.1 Cu2+胁迫对秋茄幼苗生长的影响
Cu2+是植物生长的必需的微量元素,但 Cu2+又是重金属元素,过高的Cu2+对植物产生毒害。在本试验中,由于用盐度为15 的海水作为处理对照组,因海水的本底含有一定量的 Cu2+,足以满足秋茄幼苗对 Cu2+的生理需求。然而,海水中的 Cu2+的质量浓度(测定值为 30 ppb)相对于我们实验设定的 Cu2+梯度来说可以忽略不计。高质量浓度 Cu2+对秋茄幼苗产生毒害,抑制了幼苗的生长,主要表现在: 高质量浓度 Cu2+抑制根系长度,减少侧根的数目,降低幼苗的生物量。作者研究发现,高质量浓度的Cu2+处理使得秋茄幼苗根系粗短,根尖发黑,表现出明显的Cu2+毒性症状。刘治昆等[14]研究用不同质量浓度的Cu2+处理两种柳树幼苗发现它们耐受 Cu2+毒性浓度存在明显差异。从秋茄幼苗的生长对 Cu2+胁迫的响应来看 Cu2+处理质量浓度达到 50 mg/L时,对幼苗的生长已产生显著影响。Cu2+对秋茄幼苗最适质量浓度水平应是低于0.5 mg/L。
3.2 Cu2+胁迫对秋茄幼苗光合参数和叶绿素含量的影响
叶片 Pn降低主要有两方面的原因: 气孔限制和非气孔限制[15],从本实验结果看,秋茄幼苗Pn、Gs、Tr随着生长基Cu2+处理质量浓度的增加而降低表明 Pn随 Cu2+胁迫而下降可能来自与这两方面的因素,而 Cu2+胁迫下叶片光合作用能力下降不仅是由于 Gs下降所导致 CO2供应减少,更主要是由于非气孔因素阻碍了 CO2的利用,从而造成细胞间CO2积累; 秋茄在遭受 Cu2+胁迫过程中,Gs降低CO2进入叶片受阻,最终导致光合速率降低。Gs的下降与叶片水势降低、保卫细胞失水引起气孔关闭有关,Pn、Tr与植物组织的水分状况密切相关[16-17],本研究表明,Cu2+胁迫下秋茄的Tr与Gs变化趋势相似说明高浓度Cu2+引起基质中水分胁迫可能是影响秋茄 Gs下降的主要原因。鲁艳等[18]研究发现重金属 Cu2+、Ni2+处理导致盐生草净光合速率降低,本研究结果与此一致。
叶绿素含量降低是植物遭受重金属毒害的普遍生理现象[19-20]。叶绿素含量减少,一方面是重金属与叶绿体中蛋白质中SH 结合或取代其中的Fe和 Mg元素,另一方面是在重金属胁迫条件下植株体内活性氧(ROS)产生增多,破坏叶绿体结构和功能,使叶绿素分解所致引起叶绿素含量的减少[21]。在本实验中,Cu2+处理能抑制秋茄光合色素合成。叶绿素是植物进行光合作用所必需的,叶绿素含量减少必然导致植物光合作用降低,生长受抑制,生物量随之降低。
3.3 Cu2+胁迫对秋茄幼苗根系、叶片可溶性糖和蛋白含量的影响
重金属胁迫下,由于外界渗透势较低,植物会发生失水现象,为避免渗透伤害,植物细胞会主动积累可溶性糖和蛋白来降低胞内渗透势,避免因失水而导致的伤害。胁迫作用使植物的物质代谢发生改变,一些渗透调节物质相继生成并积累,一些大分子物质(淀粉、蛋白质)分解成小分子物质(糖、氨基酸)。这些小分子物质具有较强的亲水性,可以稳定胶体性质,降低细胞的渗透势,提高植物的保水能力。这些物质渗透调节能力的大小可直接反映植物抗逆性的强弱[22-23]。从作者的研究结果来看,在一定 Cu2+处理浓度范围类,秋茄根系和叶片均持有较高的可溶性糖和蛋白含量,表明秋茄对 Cu2+胁迫具有一定的自我调节和耐受性。
3.4 Cu2+胁迫对秋茄幼苗根系、叶片抗氧化酶和MDA含量的影响
重金属对植物毒害作用的主要途径是过量的重金属导致氧化胁迫,结果是发生脂质和生物大分子过氧化反应,破坏细胞的膜结构。SOD、POD、CAT共同组成了植物体内一个有效的活性氧清除系统,三者协调一致的共同作用,能有效清除植物体内的自由基和过氧化物。本研究结果显示,不同Cu2+处理秋茄幼苗根系POD 活性均普遍高于对照组,表明在Cu2+胁迫下,秋茄幼苗具有很强的清除 H2O2的能力。有研究表明高活性的POD加强植物细胞壁木质化,进而进一步的抵御重金属对植物的伤害[24]。SOD 和CAT是植物体内消除活性氧的重要的酶。随着生境 Cu2+胁迫浓度的提高,红树植物秋茄幼苗根系和叶片SOD、CAT活性,均表现为先上升后下降的变化趋势,其中SOD、CAT活性持最高水平的,根系在Cu2+胁迫质量浓度为 5~50 mg/L范围,而叶片则在Cu2+质量浓度为0.5~5 mg/L左右。SOD、CAT活性随胁迫浓度的增加表现为低浓度促进高浓度抑制的两个反应阶段,这符合植物对胁迫反应的典型特征,即当胁迫发生后,植物会采取各种措施提高抗性以适应不良环境,但当胁迫发生超过植物耐受极限时,自身防御系统也会受到损害,乃至死亡,这与文献报道的研究结果相似[25-26]。大量研究证明[26-27],环境胁迫是脂质过氧化的诱变剂,浓度越高脂质的过氧化产物MDA积累越多,二者密切相关。从本文研究结果来看,秋茄幼苗在 Cu2+胁迫下根系保持稳定的MDA含量,表明根系对抵御重金属Cu2+胁迫方面发挥重要作用。高浓度下 Cu2+胁迫提高叶片中 MDA含量,可能的原因是由高浓度 Cu2+处理引起次生胁迫造成的。
3.5 Cu2+胁迫对秋茄幼苗吸收累积 Cu2+的影响
许多研究表明,红树植物对重金属有一定的抗,性和耐受力,且具有吸收重金属的能力,从而对废水有一定的净化作用。在本研究中,随着Cu2+处理浓度的增大,秋茄叶 Cu2+含量有随之增加的趋势,这说明了秋茄对环境 Cu2+污染有一定的净化能力。但秋茄叶对 Cu2+的累积量相对较低,这与前人的研究结果是一致的[28-29]。许多研究认为重金属在红树植物体内的分布趋向于根部积累,并且根系对重金属均有较强的滞留效应,作者的研究结果与此一致。
参考文献:
[1] 林鹏. 中国红树林[M]. 北京: 科学出版社,1997,297-316. Lin Peng. Mangrove Ecosystem In China[M]. Beijing:Science Press,1997,297-316.
[2] 王文卿,林鹏. 红树林生态系统重金属污染的研究[J].海洋科学,1999,23(3): 45-48. Wang Wenqing,Lin Peng. Studies on the heavy metal pollution in mangrove ecosystems - a review[J]. Marine Sciences,1999,23(3): 45-48.
[3] 卢豪良,严重玲. 秋茄根系分泌低分子量有机酸及其对重金属生物有效性的影响[J]. 生态学报,2007,27(10): 4173-4181. Lu Haoliang,Yan Chongling. Exudation of low-molecularweight-organic acids by Kandelia candel (L) Druce roots and implication on heavy metal bioavailability in mangrove sediments[J]. Acta Ecologica Sinica,2007,27(10): 4173-4181.
[4] Tian H T,Cao L L,Wang P,et al. Distribution and eco-logical evaluation of heavy metals in multi-medium of the Dongzhai Harbor[J]. Marine Science Bulletin,2013,15(2): 87-96.
[5] 万永吉,郑文教,方煜,等. 重金属铬(Ⅲ) 胁迫对红树植物秋茄幼苗SOD、POD活性及其同工酶的影响[J].厦门大学学报(自然科学版) ,2008,47(4): 571-574. Wan Yongji,Zheng Wenjiao,Fang Yu,et al. Effects of Cr (III) stress on activities and isozymes of SOD and POD of Kandelia candel mangrove seedlings[J]. Journal of Xiamen University (Nat. Sci. Edi.),2008,47(4):571-574.
[6] Zhang F Q,Wang Y S,Lou Z P,et al. Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings (Kandelia candel and Bruguiera gymnorrhiza)[J]. Chemosphere,2007,67: 44-50.
[7] Yan Z Z,Ke L,Tam F Y. Lead stress in seedlings of Avicennia marina,a common mangrove species in South China,with and without cotyledons[J]. Aquatic Botany,2010,92: 112-118.
[8] 陈福明,陈顺伟. 混合法测定叶绿素含量的研究[J].林业科技通讯,1984,2: 4-8. Chen Fuming,Chen Shunwei. Study on the measurement of chlorophyll content by mixed method[J]. Forestry Science and Technology Communication,1984,2: 4-8.
[9] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000: 167-195. Li Hesheng. Principles and techniques of plant physiology and biochemistry experiment[M]. Beijing: Higher Education Press,2000: 167- 195.
[10] Bradford M M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Annual Biochemistry,1976,72: 248-254.
[11] 刘祖祺,张石城. 植物抗性生理学[M]. 北京: 中国农业出版社,1994,371-372. Liu Zuqi,Zhang Shicheng. Plant resistant physiology[M]. Beijing: China Agriculture Press,1994,371-372.
[12] Hossner L R. Dissolution for total elemental analysis[M]. Wisconsin: Madison,WI,1996: 49-64.
[13] 黄玉环. 原子吸收光谱法测定红树林中的重金属[J].福建分析测试,2003,12(3): 1812-1814. Huang Yuhuan. Determination of heavy metals in mangrove by atomic absorption spectrometry[J]. Fujian Analysis and Testing,2003,12(3): 1812-1814.
[14] 刘治昆,陈彩虹,陈光才,等. Cu2+胁迫对2种速生柳幼苗生长及生理特性的影响[J]. 西北植物学报,2011,31(6): 1195-1202. Liu Zhikun,Chen Caihong,Chen Guangcai,et al. Growth and physiological characteristics of Salix jiangsuensis and Salix baby lonica seedling under Cu2+stress[J]. Acta Botany Boreal-Occident Sinicia,2011,31(6): 1195-1202.
[15] Farquhar G D,Sharkeyut D. Stomatal conductance and photosynthesis[J]. Ann Rev Plant Physiol,1982,33: 317- 345.
[16] 姜小凤,王淑英,苏敏,等. 水分胁迫对春小麦光合和渗透调节物质的影响[J]. 核农学报,2013,27(5):698-702. Jiang Xiaofeng,Wang Shuying,Su Min,et al. Effect of water stress on photosynthetic parameters and osmotic regulators in spring wheat Longchun 27[J]. Journal of Nuclear Agricultural Sciences,2013,27(5): 698-702.
[17] 谢涛,杨志峰. 水分胁迫对黄河三角洲河口湿地芦苇光合参数的影响[J]. 应用生态学报,2009,20(3):562-568. Xie Tao,Yang Zhifeng. Effects of water stress on photosynthetic parameters of Phragmites australis in estuarine wetland of Yellow River Delta [J]. Chinese Journal of Applied Ecology,2009,20(3): 562-568.
[18] 鲁艳,李新荣,何明珠,等. 矿业废弃地先锋植物盐生草在镍、铜处理下抗氧化酶系统的变化[J]. 西北植物学报,2011,31(2): 370-376. Lu Yan,Li Xinrong,He Mingzhu,et al. Photosynthesis and physiological characteristics in Halogeton glomeratus with heavy metal treatments[J]. Acta Botany Boreal-Occident Sinicia,2011,31(2): 370-376.
[19] Rodriguez E,Santos C,Azevedo R,et al.Chromium (VI)induces toxicity at different photosynthetic levels in pea[J]. Plant Physiology and Biochemistry,2012,53:94-100.
[20] 王洪斌,成明,钱鹏,等. 金属离子对中肋骨条藻的胁迫效应及叶绿素a合成的影响[J]. 海洋科学,2012,36(7): 104- 108. Wang Hongbin,Cheng Ming,Qian Peng,et al. The stress effects of metal ions on Skeletonema costatum and the influences on hlorophyll a synthesis[J]. Marine Sciences,2012,36(7): 104-108.
[21] 孙赛初,王焕校,等. 水生维管束植物受锅污染后的生理生化变化及受害机制初探[J]. 植物生理与分子生物学学报,1985,11(2): 113-121. Sun Saichu,Wang Huanxiao,et al. Preliminary studies on physiological changes and injury mechanism in aquatic vascular plants treated with cadmium[J]. Acta Photophysiologica Sinica,1985,11(2): 113-121.
[22] 肖强,郑海雷,陈瑶,等. 盐度对互花米草氧化和抗氧化系统的影响[J]. 生态学杂志,2005,24(4): 373-376. Xiao Qiang,Zheng Hailei,Chen Yao,et al. Effects of salinity on the growth and proline,soluble sugar and protein contents of Spartina alterniflora[J]. Chinese Journal of Ecology,2005,24(4): 373-376.
[23] 赵素达,董树刚,吴以平,等. 盐胁迫对孔石莼的生理生化影响[J]. 海洋科学,2005,25(2): 275-280. Zhao Suda,Dong Shugang,Wu Yiping,et al. Biochemical and physiological effects of salinity stress on Uulva purtusa[J]. Marine Sciences,2005,25(2): 275-280.
[24] Hegedüs A,Erdei S,Horváth G. Comparative studies of H2O2detoxifying enzymes in green and greening barley seedlings under cadmium stress[J]. Plant Sci,2001,160:1085-1093.
[25] Thounaojam T C,Panda P,Mazumdar P,et al. Excess copper induced oxidative stress and response of antioxidants in rice[J]. Plant Physiology and Biochemistry,2012,53: 33-39.
[26] Zhang H X,Xia Y,Wang G P,et al. Excess copper induces accumulation of hydrogen peroxide and increases lipid peroxidation and total activity of copper-zinc superoxide dismutase in roots of Elsholtzia haichowensis[J]. Planta,2008,227: 465-475.
[27] 周亚维,焉婷婷,李朋富,等. 盐度胁迫下盐生隐杆藻抗氧化防御系统的变化[J]. 海洋科学,2010,34(9): 30-35. Zhou Yawei,Yan Tingting,Li Pengfu,et al. Changes in antioxidative defense systems of Aphanothece halophytica in response to salt stresses[J]. Marine Sciences,2010,34(9): 30-35.
[28] 郑逢中,林鹏,郑文教. 红树植物秋茄幼苗对镉耐性的研究[J]. 生态学报,1994,14(4): 408-413. Zheng Fengzhong,Lin Peng,Zheng Wenjiao. Study on the tolerance of Kandelia candel mangrove seedlings to cadmium[J]. Acta Ecologica Sinica,1994,14(4): 408-413.
[29] Macfarlane G R,Pulkownik A,Burchett M D. Accumulation and distribution of heavy metals in the grey mangrove,Avicennia marina (Forsk.)Vierh.: biological indication potential[J]. Environmental Pollution,2003,123: 139-151.
(本文编辑: 谭雪静)
中图分类号:Q945. 78
文献标识码:A
文章编号:1000-3096(2016)04-0065-08
doi:10.11759//hykx20140804002
收稿日期:2014-08-04; 修回日期: 2014-09-14
基金项目:国家自然科学青年基金(41001189); 安徽省教育厅自然科学基金(2015KJ006); 阜阳师范学院自然科学基金校级重点项目(2013FSKJ04ZD)
作者简介:赵胡(1977-),男,安徽六安人,博士,主要从事植物生理与分子生物学研究,E-mail: zhaohu8196@sina.com; 郑文教,通信作者,教授,E-mail: zhengwenjiao2008@sina.com加污染物培养作为对照(CK),每盆加入培养液1 700 mL,每个浓度梯度均设3个重复,共18个盆栽。实验盆栽置于玻璃温室、自然透光下栽培每7 d更换培养液一次,每天用自来水补足蒸发散失的水量。栽培处理90 d后取样分析测试各项参数。
Growth and physiological characteristics of Kandelia obovata seedlings under Cu2+stress
ZHAO Hu1,TANG Jun1,ZHENG Wen-jiao2
(1. College of Life Science,Fuyang Teachers College,Fuyang 236041,China; 2. College of Environment & Ecology,Xiamen University,Xiamen 210093,China)
Received: Aug. 4,2014
Key words:mangrove; Kandelia obovata; Cu2+; antioxidant enzymes; accumulation
Abstract:To reveal the toxic effects of copper on mangroves and the mechanism of plant resistance,the growth of Kandelia obovata seedlings,changes in some of their physiological indices,and the accumulation of copper in them under different copper concentrations were investigated for 90 days. The main parameters that were determined included main root length,lateral root number,biomass,photosynthetic rate,pigment content,soluble sugar and protein contents,and antioxidant enzyme activities. The results showed marked reductions in the main root length,lateral root number,biomass,photosynthetic rate,pigment content,and soluble sugar and protein contents with increasing copper concentration. POD activity was more sensitive to copper stress in the roots than in the leaves. The activities of SOD and CAT first increased and then decreased as the copper concentration increased. The MDA content in the roots remained relatively stable under copper stress,whereas its content in the leaves increased under a high concentration of copper. Copper absorbed by K. obovata was mainly accumulated in the roots,and only a small amount of copper was transferred to the aboveground plant parts. The growth and physiological characteristics of the plant indicated that K. obovata tolerated copper concentrations of approximately 5-50 mg/L.

