镉锌互作条件下ABA 对水稻幼苗根系生长和生长素分布的影响
蔡凤香+陈豆豆+杨飞+郑欣+张思韬+赵凤云


摘要:脱落酸(abscisic acid,ABA)和生长素是植物体内重要的信号分子,以水稻(Oryza sativa L.) 中花 11 号为材料分析了镉锌互作条件下ABA对水稻幼苗根系生长和生长素分布的影响。结果表明,在镉锌互作条件下添加ABA合成抑制剂——钨酸钠(sodium tungstate,TS) 促进初生根侧根的生长,抑制植株、初生根、不定根和不定根侧根的生长。与镉加锌处理相比,添加ABA使生长素在根尖的积累减少,相反,添加TS使生长素的积累增加,说明ABA与生长素平衡有密切关系。进一步研究表明,在蛋白质水平上,ABA对生长素的调节与蛋白运输和降解有关。
关键词:ABA; 水稻幼苗;生长素;镉锌互作;根系
中图分类号: S511.01文献标志码: A文章编号:1002-1302(2016)06-0114-04
收稿日期:2015-05-14
基金项目:山东省自然科学基金(编号:ZR2014DM010、ZR2015CL009);山东省淄博市科技发展计划(编号:111089、113106)。
作者简介:蔡凤香(1989—),女,山东菏泽人,硕士研究生,主要从事分子生物学研究。E-mail:526260632@qq.com。
通信作者:赵凤云,博士,教授,主要从事分子生物学研究。E-mail:zfy1226@126.com。镉不是植物生长的必需元素,高浓度镉对植物有较强的毒害作用[1]。一般情况下,当镉在植物中的含量超过 1 mg/kg 时,植物的生长会受到严重影响[2]。研究发现在处理时间相同的情况下,随着镉浓度的增加洋葱根的生长速率递减。在相同浓度镉处理的情况下,随着处理时间的延长,单位时间内生长速率递减或停止生长[3]。锌对植物的生长发育有重要调节作用,是植物生长不可缺少的微量元素。缺锌会导致植株生长缓慢或停止[4],但锌过量则抑制植物地上部分和根系的生长发育[5]。已有研究表明,低浓度的锌能促进植物的生长发育,而高浓度的锌会对植物造成伤害。 在植物体内,当锌含量大于 50 mg/kg时,就会发生锌中毒[ 6]。镉胁迫下添加适当浓度的锌能缓解镉对植物的毒害,改善植物的生长;但过量的锌则会加重镉毒害[7-8]。镉与锌复合污染对植物的影响与二者的浓度、植物种类、处理时间及处理方式等有关。众所周知,生长素是调节根系生长发育不可缺少的信号分子,它是根细胞分裂、伸长生长、向地性应答和侧根发育所必需的[9]。生长素对植物生长的诱导具有正负两重性,表现为低浓度促进生长,高浓度抑制生长[10]。生长素促进根生长的最适浓度约为10-11~10-9 mol/L[11] 。ABA 是环境对植物生长发育影响的重要调节因子[12]。我们的前期研究发现,ABA 是调节水稻根系生长的重要信号分子[13],它能缓解镉胁迫引起的生长素过量积累,从而减轻镉对根系生长的抑制作用。对水稻幼苗 进行GUS 染色发现,ABA 能影响生长素的分布,用 MG132、BFA 检测表明,ABA 对生长素分布的调节与蛋白降解和运输有关[14]。本试验旨在研究镉锌互作条件下 ABA 是否参与根系生长的调节以及 ABA 与生长素的关系。
1材料与方法
1. 1试验材料与处理
挑选籽粒饱满的中花11号(Oryza sativa L.)水稻种子,去壳后消毒:75% 乙醇(30 s)、0.2%氯化汞(15 min)、2% 次氯酸钠(15 min),用无菌水冲洗干净,按每瓶45粒分别种入含1 μmol/L脱落酸(ABA)、0.2 m mol/L钨酸钠(TS)、0.2 mmol/L Cd(NO3)2+0.3 m mol/L Zn(NO3)2(Cd+Zn)、0.2 mmol/L Cd(NO3)2+0.3 mmol/L Zn(NO3)2+1 μmol/L ABA(Cd+Zn+ABA)、0.2 mmol/L Cd(NO3)2+0.3 mmol/L Zn(NO3)2+0.2 mmol/L TS(Cd+Zn+TS)的MS培养基中,放入培养箱内[光周期为 14 h光照,光照度为 200 μmol/(m2·s),温度 26 ℃;夜间10 h,温度 20 ℃] 培养13 d。每种处理至少重复3次,每次至少3个重复。
1.2水稻形态学指标统计
每个处理3个重复,每个重复20株(共60株),进行下列指标统计,株高:从叶尖到茎基部的长度;初生根长度:从根茎连接处到初生根根尖的长度;初生根侧根数量:只统计长度大于1 mm的侧根;初生根上侧根的长度:所有侧根长度的平均值;不定根数量和长度:只统计长度大于1 cm的不定根;不定根上侧根数量,只统计长度大于1 mm的侧根;不定根侧根长度:所有侧根长度的平均值。
1.3ABA对镉锌互作水稻初生根生长素分布的影响
利用GUS 染色法对转DR5-GUS基因水稻进行根尖生长素的分布和积累测定,GUS 染色参考Petersson 等的方法[15]进行。转基因水稻种子分别种在含ABA、TS、(Cd+Zn)、(Cd+Zn+ABA)、 (Cd+Zn+TS) 的MS培养基中,放入培养箱内[光周期为 14 h光照,光照强度为 200 μmol/(m2·s),温度 26 ℃;夜间10 h,温度 20 ℃]培养3天,取不同处理的初生根根尖在避光条件下进行GUS染色24小时,脱色后在体视显微镜下观察并拍照。每种处理至少拍20株,且至少重复3次,每次至少3个重复。
1.4ABA在蛋白水平对水稻根系生长素分布的影响
MG132 (蛋白降解抑制剂)/BFA (蛋白运输抑制剂)处理:将在MS固体培养基上生长6 d的转DR5-GUS基因的水稻幼苗转入Hoagland培养液中过夜。然后加入MG132(50 μmool/L)/BFA (50 μmol/L)Hoagland培养液中预处理3 h后再转入分别含(Cd+Zn)、(Cd+Zn+ABA)和 (Cd+Zn+TS) 的Hoagland培养液中处理12 h。取不同处理的初生根根尖在避光条件下进行GUS染色24 h,脱色后在体视显微镜下观察并拍照。每种处理至少拍20株,且至少重复3次,每次至少3个重复。
1.5数据处理及分析
利用SPSS16.0软件对数据进行统计分析,采用t检验,分析对照与处理不同处理之间的差异。若P<0.05 则2组数据间具有显著性差异;若P<0.01则2组数据间具有极显著性差异。所有数据为 3 次重复试验的平均值±标准误。
2结果与分析
2.1ABA对镉锌互作水稻幼苗生长的影响
2.1.1ABA对镉锌互作水稻植株高度的影响如图1所示,单一ABA和钨酸钠(TS)处理的株高都比CK处理的低12.0%(P<0.01),但二者之间无明显差异;(Cd+Zn)处理的株高比(Cd+Zn+TS)处理的高30.2%(P<0.01),比(Cd+Zn+ABA)处理的低8.2%(P<0.01),其中(Cd+Zn+TS)处理的株高最低,比(Cd+Zn+ABA)处理的低29.5%(P<0.01)。
2.1.2ABA对镉锌互作水稻初生根生长发育的影响
2.1.2.1ABA对镉锌互作水稻初生根长度的影响如图2所示,单一ABA和TS处理的初生根的长度分别比CK处理的短4.5%和17.3%;(Cd+Zn) 和(Cd+Zn+ABA)处理的初生根长度相似,差异不显著,二者分别比(Cd+Zn+TS)处理的长141%和139%(P<0.01),差异极显著。
2.1.2.2ABA对镉锌互作水稻初生根侧根数量的影响如图3所示,单一ABA和TS处理的初生根上侧根数目分别比CK处理的多42.5% 和30.0%,差异显著;(Cd+Zn)和(Cd+Zn+ABA)处理的差异不显著,(Cd+Zn+ABA)比(Cd+Zn+TS)处理的多85.9%(P<0.01),差异极显著。
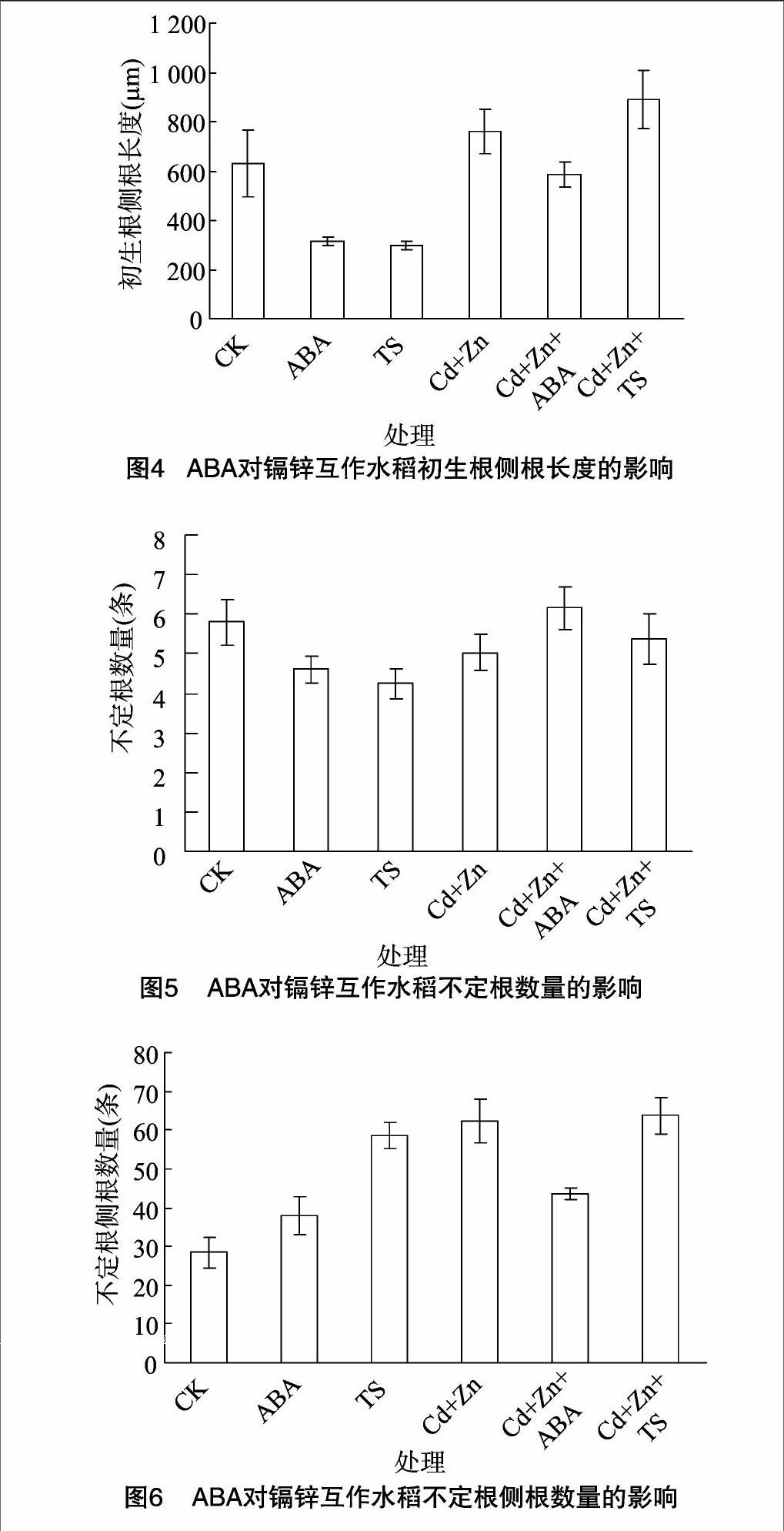
2.1.2.3ABA对镉锌互作水稻初生根侧根长度的影响单一ABA和TS处理的初生根上侧根的长度分别比CK的短50.3%和52.8%(P<0.01)(图4),差异极显著;(Cd+Zn)处理的比(Cd+Zn+ABA)处理的长29.3%,(Cd+Zn+ABA)比(Cd+Zn+TS)处理的短33.9%(P<0.01),差异极显著。
2.1.3ABA对镉锌互作水稻不定根生长发育的影响
2.1.3.1ABA对镉锌互作水稻不定根数量的影响如图5所示,单一 ABA和TS处理的不定根的数量分别比CK处理的少20.7%和26.7%(P<0.01),差异极显著;(Cd+Zn)和(Cd+Zn+TS)处理分别比(Cd+Zn+ABA)处理少18.2%和12.7%,差异显著。
2.1.3.2ABA对镉锌互作水稻不定根侧根数量的影响如图6所示,单一 ABA和TS处理的不定根上侧根的数量分别比CK处理的多33.6%和105.6%(P<0.01),差异极显著;ABA处理的比TS处理的少35.0%;(Cd+Zn)处理的比(Cd+Zn+ABA)处理的多43.2%(P<0.01),差异极显著;(Cd+Zn+ABA)比(Cd+Zn+TS)处理的少31.7%。
2.1.3.3ABA对镉锌互作水稻不定根长度的影响如图7所示,单一ABA和TS处理的不定根长度与CK处理的类似;(Cd+Zn)处理的比CK处理的长58.7%(P<0.01),差异极显著;(Cd+Zn)处理的分别比(Cd+Zn+ABA)和(Cd+Zn+TS)处理的长15.7%和41.8%(P<0.01),差异极显著;(Cd+Zn+ABA) 处理的比(Cd+Zn+TS)的长25.3%(P<0.01),差异极显著。
2.1.3.4ABA对镉锌互作水稻不定根侧根长度的影响如图8所示,单一ABA处理的不定根上侧根长度比CK处理的短2.1%,TS处理的比CK处理的长23.1%(P<0.01),差异极显著;(Cd+Zn)处理的比(Cd+Zn+ABA)处理的短 23.5%(P<0.01),差异极显著;(Cd+Zn+ABA)处理的比(Cd+Zn+TS)处理的长66.2%(P<0.01),差异极显著。
2.2ABA对镉锌互作水稻根系生长素分布的影响
2.2.1ABA对镉锌互作水稻根系生长素分布的影响为了进一步了解上述不同处理对根系生长的影响是否与生长素的分布有关,利用转DR5-GUS基因水稻检测了根系生长素的分布变化,结果见图9。在处理到第3天时,初生根根尖生长素的积累和分布发生了明显变化,与CK处理 相比,单一ABA 处理使生长素积累减少,而TS处理则使生长素积累显著增加。(Cd+Zn+ABA)处理比(Cd+Zn)的生长素少,而(Cd+Zn+TS)处理比(Cd+Zn)的生长素多。就总体而言,含ABA 的处理生长素比不含ABA 的减少,含TS的处理比不含TS的多。本试验中TS显著干扰生长素的积累和分布,说明在非胁迫和(Cd+Zn)处理条件下适量的ABA 是维持生长素平衡所必需的。
2.2.2ABA在蛋白水平对水稻初生根生长素分布的影响为了进一步了解(Cd+Zn)处理下ABA调节生长素分布的机制,我们利用MG132 (蛋白降解抑制剂)/BFA (蛋白运输抑制剂)对转DR5-GUS基因水稻根系生长素的分布进行了检测,结果见图10。由图10可见,(Cd+Zn+ABA)处理比(Cd+Zn)处理的生长素积累减少,而(Cd+Zn+TS)处理比(Cd+Zn)处理积累的多。(Cd+Zn+ABA+MG132)处理比(Cd+Zn+ABA)处理的生长素积累增多,(Cd+Zn+ABA+BFA)处理与(Cd+Zn+ABA)处理相比生长素积累差异似乎不显著。(Cd+Zn+TS+BFA)处理比(Cd+Zn+TS)处理的生长素积累明显增多,相反,(Cd+Zn+TS+MG132)处理比(Cd+Zn+TS)处理生长素的积累明显减少。试验还分析了DRB(RNA合成抑制剂)和CHX(蛋白质从头合成抑制剂)对
生长素分布的影响,但是(Cd+Zn+ABA/TS+DRB/CHX)与(Cd+Zn+ABA/TS)相比生长素的积累和分布无明显变化。因此,本试验条件下ABA对生长素分布的调节与蛋白质降解和运输有密切关系。
3讨论
如前所述,ABA在调节根系生长的过程中发挥重要作用[12-14]。本研究结果也显示无论在非胁迫还是在(Cd+Zn) 处理条件下,适量的ABA 是调节水稻根系生长不可缺少的信号分子。本试验中,添加ABA 和ABA 抑制剂对水稻初生根和不定根的长度及其侧根的长度和数量都有不同程度的影
响,说明ABA 参与了该条件下根系生长的调节。已有研究显示,在种子萌发和根系生长过程中,ABA 和生长素信号存在交互作用。如Wang 等报道,ABA 改变了拟南芥根尖生长素的分布,它与抑制根系生长与生长素运输有关。拟南芥种子萌发后,ABA 通过强化生长素信号来抑制胚轴的生长[15]。(Cd+Zn) 处理条件下添加 ABA 使生长素在根尖的积累减少,相反,添加 TS 使生长素的积累增加,说明该条件下 ABA 与生长素平衡有密切关系。综上所述,ABA 对镉锌互作水稻根系生长的调节与其改变生长素的积累和分布有密切关系。
参考文献:
[1]Jackson A P,Alloway B J. The transfer of cadmium from sewage sludge amended soils into the edible components of food crops[J]. Water Air Soil Pollue,1991,57/58:873-881.
[2]王一喆,王强. 镉对植物根系的毒害作用[J]. 广东微量元素科学,2008,15(4):1-5.
[3]刘东华,蒋悟生. 镉对洋葱根生长和细胞分裂的影响[J]. 环境科学学报,1992,12 (4):439-446.
[4]Song W Y,Choi K S,Kim D Y,et al. Arabidopsis PCR2 is a zinc exporter involved in both zinc extrusion and long-distance zinc transport[J]. The Plant Cell,2010,22(7):2237-2252.
[5]Madhava R K V,Sresty T V. Antioxidative parameters in the seedlings of pigeonpea [Cajanus cajan (L.) Millspaugh]in response to Zn and Ni stresses[J]. Plant Science,2000,157(1):113 -128.
[6]王俊,郭颖,吴蕊,等. 不同种植年限和施肥量对日光温室土壤锌累积的影响[J]. 农业环境科学学报,2009,28(1):93-98.
[7]艾伦弘,汪模辉,李鉴伦,等. 镉及镉锌交互作用的植物效应[J]. 广东微量元素科学,2005,12(12):6-11.
[8]Aravind P,Prasad M N V,Malec P,et al. Zinc protects Ceratophyllum demersum L. (free-floatinghydrophyte) against reactive oxygen species induced by cadmium[J]. Journal of Trace Elements in Medicine and Biology,2009,23(1):50-60.
[9]Joanovic M,Lefebvre V R,Laporte P,et al. How the environment regulates root architecture in dicots[J]. Advances in Botanical Research,2008,46:36-74.
[10]李珊珊,李建宏. 植物生长素的运输特性及在植物生长中的调节作用辨析[J]. 生物学教学,2012,37(5):59-60.
[11]宋廷杰. 生长素对植物不同器官的影响[J]. 生物学通报,2001,36(3):6.
[12]Xiong L M,Zhu J K. Regulation of abscisic acid biosynthesis[J]. Plant Physiol,2014,133:29-36.
[13]Zhao F Y,Cai F X. Gao H J,et al. ABA plays essential roles in regulating root growth by interacting with auxin and MAPK signaling pathways and cell-cycle machinery in rice seedlings[J]. Plant Growth Regul,2015,7(2):535-547.
[14]Zhao F Y,Wang K,Zhang S Y,et al. Crosstalk between ABA,auxin,MAPK signaling,and the cell cycle in cadmium-stressed rice seedlings[J]. Acta Physiol Plant,2014,36:1879-1892.
[15]Wang L,Hua D P,He J N,et al. Auxin Response Factor2 (ARF2) and its regulated homeodomain gene HB33 mediate abscisic acid response in arabidopsis[J].

