microRNAs 224和21对人胶质瘤干细胞存活的影响及相关的分子机制
王家清,于云龙,王慧星,刘华亭
(中国人民解放军第一〇七医院 神经外科,山东 烟台 264002)
microRNAs 224和21对人胶质瘤干细胞存活的影响及相关的分子机制
王家清Δ,于云龙,王慧星,刘华亭
(中国人民解放军第一〇七医院 神经外科,山东 烟台 264002)
目的 探讨microRNAs 224和21对人胶质瘤干细胞存活的影响及相关的分子机制。方法 qPCR检测恶性胶质瘤样品、人GBM干细胞、人工建立的GBM干细胞系和人体组织中microRNAs的失调表达情况。GBM神经球干细胞系、GBM干细胞系(0822、0308和A172)、人工建立的细胞系U373及永生化人星形胶质细胞分别转染miR-21,miR-224模拟物或抑制剂,然后通过膜联蛋白Ⅴ染色及Caspase 3/7活性检测细胞凋亡,活细胞计数检测细胞生长情况。利用TargetScan生物学软件预测miR-21和miR-224的靶基因,并利用荧光素酶报告检测microRNAs对Bim基因的靶向作用。Western blot检测细胞转染miR-21或 miR-224模拟物或抑制剂后对Caspase 3,Caspase 9及Bim蛋白表达的影响。结果 qPCR检测结果表明,GSC、人肿瘤组织和GBM神经球干细胞中,miR-21和miR-224显著上调表达(P<0.05)。细胞凋亡和细胞生长检测结果表明,miR-224和miR-21能调控GSC细胞凋亡和生长。靶基因预测分析Caspase 3,Caspase 9和Bim 3’-UTR序列为miR-224和miR-21潜在的靶基因,荧光素酶实验进一步证实Caspase 3,Caspase 9和Bim 3’-UTR序列为miR-224和miR-21的直接靶点。进一步的实验证明,miR-224和miR-21通过直接靶向Caspases和Bim调控细胞生长和凋亡。结论 上述结果表明miR-224和miR-21是GSC的凋亡抗性的重要生理驱动因子,其为胶质瘤的治疗提供了新的靶标。
miR-224;miR-21;Caspase 3;Caspase 9;Bim;胶质瘤干细胞;抗凋亡
多行性成胶质细胞瘤(glioblastoma,GBM)是具有很强破坏性的脑部肿瘤,患者从确诊到死亡的平均时间约为12~14个月[1]。患者在确诊后,一般先通过外科手术切除肿瘤部位,再利用替莫唑胺进行化疗和放疗,这是目前治疗多行性胶质细胞瘤的标准方法[2]。然而,GBM在治疗后短期内总会复发。最近有研究表明,在人脑肿瘤中存在组织异质性,并且越来越多的证据表明肿瘤形成,复发和其低存活率均与一群称为胶质瘤干细胞(glioma stem cells,GSCs)的具有化疗和放疗抗性的细胞有关[3-8]。
GBM被认为源自神经干细胞(NSCs)的转化或成熟的有遗传损伤的胶质瘤细胞去的分化[9-10]。GSCs、神经干细胞和神经前体细胞(neural precursor cells,NPCs)具有一些类似的特征:能表达一些标志分子,如CD133;并且具有自我更新、多潜能性和迁移能力[9-13]。CD133是一种能有效区分NSCs和GSCs的细胞分子标记。CD133可能不是所有GSCs都具有的分子标记,并且CD133作为细胞表面分子标记表明胶质瘤细胞具有干细胞样细胞特性。研究表明,对于人原发性GBM,CD133是GSC的分子标记[14-15]。
MicroRNAs(miRNAs)是小的非编码调节RNA分子,其对许多生物学过程具有显著的影响。最近研究发现miRNAs可以作为肿瘤生长和存活的促进因子,因此比较恶性胶质瘤和正常脑组织中miRNAs的相对表达量受到越来越多的关注[16-19]。NSCs中与神经发育有关的miRNAs在GBM发育过程中发挥重要作用,并且70%已知的miRNAs在脑组织中均有表达[17]。经过对GBM和其它癌症中miRNAs的分析发现其具有致癌性,或通过诸如治疗抗性,免疫逃避和失调表达等机制促进肿瘤生长。GBM中miRNAs的表达量通常比较高,如miR-21,miR-26a和miRs-221/222[20-24]。而GBM中研究的比较深入的致癌性miRNAs一般通过抑制肿瘤抑制因子的表达而促进癌症发生,如miR-21通过靶向肿瘤抑制因子PTEN而促进癌症的发生[16,19]。
GBM中能降低肿瘤生长和侵染并通常下调表达的那些miRNAs被称为肿瘤抑制miRNAs。有研究表明,miR-7和miR-34a能抑制致癌基因EGFR,c-Met和Notch家族成员的表达[25-29]。尽管miRNA与肿瘤抑制功能有关,其重要的发挥作用的靶蛋白却仍然未知,如miR-124和miR-137[30]。一些能促进或抑制GBM的miRNAs在其它癌症中可能具有类似的致癌或肿瘤抑制特性[16,19],尽管miRNA的致癌性已得到充分的研究,对miRNA靶向一些未知靶基因的研究仍然存在许多争议[31-32]。miRNAs在一种GBM中失调表达,不代表其在另一种GBM中也失调表达,因此本研究集中探讨与正常脑干细胞相比,在GBM干细胞中失调表达的那些miRNAs。本研究重点探讨miR-21和miR-224抑制剂对细胞的影响,以期为临床中胶质瘤的治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞与组织:样品来源于根据世界卫生组织标准为GBM类型的患者外科手术切除的组织。根据以前的报道,富含GSCs的人原发性GBM以0308,0822和1228命名[33],进行相关实验之前告诉患者并征得其同意。GBM干细胞系(0308,0822,1228)从Dr.Jeongwu Lee处获得,并按以前所述的方法培养[27-28,33]。
1.1.2 主要试剂及仪器:DMEM培养基、胎牛血清、胰蛋白酶购自Gibco(Gibco,美国);鼠抗人caspase-3/9抗体、兔抗人BCL2L11抗体购自CST(Cell Signaling Technology,美国);鼠抗人α-tubulin抗体购自Sigma(美国);miRNAs及相应的阴性对照购自锐博生物(中国);miRNeasy and miScript RT kits(Qiagen,美国);Agilent Site Directed Mutagenesis kit(Santa Clara,美国);脂质体2000购自Invitrogen(美国);Caspase 3/7 Glo底物检测溶液 (Promega,美国);BCA蛋白浓度检测试剂盒购自碧云天生物技术研究所(中国);PE-膜联蛋白-Ⅴ凋亡染色试剂盒(BD Pharmingen,美国);Glomax光度计、双荧光素酶报告检测系统(Promega,美国);Bio-Rad凝胶成像系统(Bio-Rad,美国);miR-224模拟物,miR-224抑制剂,miR-21模拟物,miR-21抑制剂均购自RIBOBIO(中国)。
1.2 方法
1.2.1 细胞培养:GBM细胞系U373、A172和永生化星形胶质细胞均购自ATCC,根据以前所描述的方法进行培养[25-26]。
1.2.2 qPCR检测:qPCR检测不同组织和细胞类型中miRNAs的表达水平。来自CD133+ NSCs和CD133+GBM干细胞样品,根据说明书的要求利用miRNeasy and miScript RT kits提取样品总RNA。反转录后,cDNA稀释至终浓度为10 ng/ml,每个样品使用50~100 ng的cDNA进行qPCR反应。U6作为检测时的内参基因。
1.2.3 MicroRNAs,siRNAs与转染:根据实验目的,转染miRNA或miRNA抑制剂的细胞或铺于细胞培养板中直接进行转染,或经多聚-L-鸟氨酸和层粘连蛋白处理以能够贴壁,处理后第二天进行转染。按照说明书的要求,用脂质体2000进行转染。
1.2.4 Western blot检测:收集细胞样品,加入RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度后,每个样品取50 蛋白蛋白,加入2×SDS-PAGE上样缓冲液,沸水煮样5 min使蛋白变性,SDS-PAGE分离蛋白,将蛋白转移至PVDF膜上。2.5%脱脂奶粉室温封闭2 h,加入一抗4 ℃轻摇过夜孵育(抗Caspase 3抗体,1:1000稀释;抗Caspase 9抗体,1:1000稀释;抗PARP抗体,1:1000稀释;抗Bim抗体,1:2000稀释;抗α-tubulin抗体,1:5000稀释),PBST洗膜3次后,加入HRP标记的二抗(1:2000比例稀释),37 ℃孵育2 h。ECL法化学发光显影检测蛋白表达。α-tubulin作为蛋白上样时的内参蛋白。
1.2.5 细胞计数:通过细胞计数检测转染miRNA或miRNA抑制剂对细胞活性的影响。miRNA转染后3~5天进行细胞计数。取10 μL细胞样品利用细胞计数仪进行计数。
1.2.6 Caspase 3/7活性检测:检测caspase活性以评估转染miRNAs或miRNA抑制剂后对细胞凋亡的影响。miRNA转染后3~4 d,使用Caspase 3/7 Glo底物溶液检测Caspase 3/7活性。双荧光素酶报告检测系统检测荧光素酶活性 (Promega)。使用Glomax光度计进行发光检测。通过细胞数目和Bradford分析蛋白浓度从而对发光读数进行校正。所得数值以RLU/细胞数每毫升表示。
1.2.7 细胞流式检测细胞凋亡:使用双染色流式检测试剂盒检测细胞凋亡比例。miRNA转染后4~5 d,按照说明书的要求,使用PE-膜联蛋白Ⅴ凋亡染色试剂盒进行染色,然后通过FACSCalibur分选阳性细胞,并用FlowJo软件进行分析。
1.2.8 荧光素酶活性检测:构建Caspase 3-3’-UTR、Caspase 9-3’-UTR和BCL2L11荧光素酶报告质粒,然后进行双荧光素酶活性检测以证实miRNAs的特异性靶位点。细胞按照如上所述的方法铺板,转染miRNA、相应的报告质粒及对照质粒。转染后48 h,使用双荧光素酶报告检测系统检测荧光素酶活性。转染了对照miRNA和空载体的细胞的荧光素酶活性作为对照。
1.2.9 3’-UTR突变:设计针对BCL211、CASPASE 3和CASPASE 9的突变引物,利用Agilent Site Directed Mutagenesis kit在miRNA结合的靶位点引入突变。将miR-21在BCL211和CASP3上的结合位点进行突变,miR-224在CASP3上的结合位点进行突变。引物序列如下:miR-582在CASP3结合位点F:5’-CCCCCCACTTAAGACTGTGTATTCTAGTTTTGTCAACGGCGGCAA-ATGA TGATGTGG-3’;R:5’-CCACATCATCATTTGCCGCCGTTGAC-AAAACTAGAAT ACACAGTCTTAAGTGGGGGG-3;野生型序列:5’-CCCCCCACTTAAGACTGT GTATTCTAGTTTTGTCAAACTGTAGA-AATATGTGTGG-3’。对于miR-21在BCL2L11上的结合位点:F: 5’ CTTATCAACTGAG CCAAATGTCTGTCGCGCCGGGTGTTT-CCTTTACCTTGTAAAATTTTG-3’, R: 5’-CAAAATTTTACAAGGTAA AGGAAACACCCGGCGCGACAGACA-TTTGGCTCAGTTGATAAG-3’;野生型序列:5’-CTTATCAACTGAGCCAAATGTCTGTGT-GCAATTGTGTTTCCTTTACC TTGTAAAATTTTG-3’。对于miR-21在CASP上的结合位点:F: 5’-A A A TT AG GAATAAATAA-AAATGGATACTGCGCGCCGCATTATGAGAGGCAATGTTGTT AA-3’, R: 5’-TTAACAACATTGCCTCTCATAATGCGGCGCGCAGTAT-CCATTT TTATTTATTCCTAATTT-3’,野生型序列:5’-AAATTAGGAATAAATAAAAATG GATACTGGTGCAGTCATTATG-AGAGGCAATGATTGTTAA-3’。

2 结果
2.1 GSC、人肿瘤组织和GBM神经球干细胞中,miR-21和miR-224显著上调表达 qPCR检测CD133+NSCs和3个CD133+GSC样品中miR-224和miR-21的表达情况。结果表明,与NSCs相比,3个GSC样品中miR-224和miR-21均表现出显著的差异化表达。由于它们的独特性和潜在的致癌性,接下来的实验中对miR-224和miR-21进行进一步分析,见图1A和1B。为进一步明确miR-224和miR-21在正常组织和GBM组织中的表达情况,qPCR检测了多个GBM和3个正常人组织样品中miR-224和miR-21的表达。结果发现,大部分GBM中miR-224表达量升高,见图1C,但在3个GBM组织中,未检测到miR-224,表明不是所有的GBM肿瘤能上调miR-224的表达。与正常脑组织相比,GBM中miR-21的表达量显著升高,见图1D。
接下来检测了3种GBM干细胞系中miR-224和miR-21的表达情况见图1E和F,这些细胞系用不含血清的培养基培养。在无血清条件下培养比在有血清条件下培养更接近原始的GBMs(0308,0822,和1228)。然后通过qPCR进一步检测了在有血清条件下培养时,GBM细胞系A172、U373和永生化星形胶质细胞中miR-224和miR-21的表达水平。所有的GSC样品、绝大部分人GBM组织和GBM干细胞系中,miR-224和miR-21的表达量均显著升高。

图1 qPCR检测miR-224和miR-21在GSCs中上调表达**P<0.01,***P<0.001,与对照组比较Fig.1 Real-time PCR verification of miR-224 and miR-21 up-regulation in ±s)**P<0.01, ***P<0.001, compared with control group
2.2 miR-224和miR-21调控GSC生长和凋亡 将miR-224和miR-21抑制剂转染入GBM神经球干细胞系中,并用含血清的培养基培养,以证实它们的致癌潜力。转染miR-21抑制剂后,GBM干细胞系(0822)及人工建立的细胞系U373的生长受到抑制,见图2A。两种GBM干细胞系(0822和0308)转染miR-224抑制剂后,与对照组相比,细胞生长明显被抑制,见图2B,而用含血清培养的GBM细胞系A172及永生化人星形胶质细胞转染miR-224后,生长的更快,见图2C。永生化人星形胶质细胞用miR-224抑制剂处理后,与对照组相比,其生长速度没有变化,见图2C。这些结果与miR-224和miR-21具有致癌性是一致的。miR-21抑制剂转染的所有GBM干细胞系具有更高的Caspase 3/7活性,或膜联蛋白Ⅴ/7-AAD表达量(图2D)。miR-224抑制剂转染的GBM干细胞系中,Caspase 3/7活性增加了1~2倍(见图2E)。这些结果与miR-224和miR-21相关的抗凋亡机制是一致的。

图2 转染miR-21和 anti-miR-224抑制剂引起细胞凋亡**P<0.01,***P< 0.001,与对照组比较Fig.2 Forced expression of anti-miR-21 and anti-miR-224 triggers ±s)**P<0.01, ***P<0.001, compared with control group
2.3 miR-224和miR-21通过直接靶向Caspase 3,Caspase 9和Bim 3’-UTR序列调控促凋亡基因的表达为证实miR-224和miR-21的生物学相关性,本研究分别探讨了miR-224和miR-21可能的靶基因。根据TargetScan软件预测结果,miR-21可能靶作用于Bim和Caspase 3,miR-224可能靶向Caspase 3和Caspase 9,见图3A。另外,图3A也显示了突变实验中的突变碱基位点(红色)。Western blot结果表明,miR-224转染的GBM细胞系U373、A172和星形胶质细胞系中,Caspase 3和Caspase 9的表达量降低,见图3B。和上述结果相一致,0882 GBM干细胞系转染miR-224抑制剂后,与对照组相比,Caspase 3和Caspase 9表达量增加,见图3B。GBM细胞系转染miR-21模拟物后,Bim和Caspase 3蛋白表达量降低,而转染miR-21抑制剂后, Bim和
Caspase 3表达量增加,见图3C。转染了miR抑制剂后,靶蛋白的表达量升高表明这些miRs是Caspase 3和Bim的潜在的生理调节因子。qPCR检测结果证实Caspase 3和Caspase 9的mRNA表达对miR-224很敏感。本研究结果也表明,1228和A172两种细胞系过表达miR-21后,PARP的剪切减弱,而这是细胞凋亡活性下降的标志,见图3D。荧光素酶活性检测结果表明,miR-224、miR-21和预测的基因靶位点有特异性相互作用 见图3E和F,即miR-224靶向CASP3和CASP9,miR-21靶向BIM和CASP3,见图3G和H。突变3’UTR区域的miRNAs结合位点后,与野生型质粒相比,miRNAs部分增强了荧光素酶活性,见图3I。这些数据表明,肿瘤干细胞表达的miRNAs有效下调了凋亡信号通路中至关重要蛋白的表达。

图3 miR-224 和miR-21靶向作用于Bim和*P<0.05,**P<0.01,***P<0.001,与对照组比较Fig.*P<0.05, **P<0.01, ***P<0.001, compared with control group
2.4 Caspases和Bim分别是miR-224和miR-21的靶基因 本研究使用同时敲低Caspase和Bim表达并转染miR-224和miR-21抑制剂的方法探讨miR-224和miR-21分别靶向Caspase和Bim对细胞数量的影响。siRNA沉默Bim表达后,miR-21抑制剂不能抑制细胞的生长,见图4A。并且siRNA沉默Bim表达后,miR-21抑制剂不能引起Bim表达增加,见图4B。使用miR-224抑制剂和Caspase的siRNA共处理细胞后得到了类似的结果。Western blot结果显示,针对Caspase的特异性siRNA能有效的敲低细胞中Caspase 3的表达,见图4B和4C。而且,利用pan-Caspase抑制剂ZVAD和miR-224抑制剂共同处理GSCs细胞部分逆转了Caspase抑制剂所导致的细胞数量下降,见图4D。
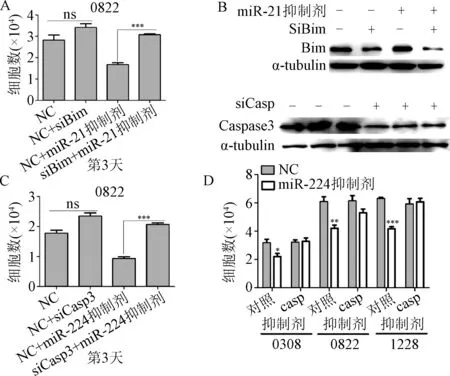
图4 Caspase 3和Bim是miR-224和miR-21的靶位点*P<0.05,***P<0.01,***P<0.001,与对照组比较Fig.4 Caspase 3 and Bim as critical targets of miR-224 and ±s)*P<0.05, **P<0.01, ***P<0.001, compared with control group
3 讨论
由于GSCs的形成和调控机制仍然未知,研究miRNAs的功能和其治疗潜力是至关重要的。一些研究表明,miRNAs的能调控GSCs[25,27,29,36-37]。本研究探讨了两个独特的抗凋亡miRs,miR-21和miR-224的生物学功能。有研究已经证明,miR-224在垂体瘤中过表达,并预测其靶向Smad3,但在其它方面的作用没有相关报道。目前尚无关于miR-21在癌症中作用的相关报道,据信其位于致肿瘤miRNA群内[34-35]。研究表明miR-21和miR-224在许多人的GSCs和GBM肿瘤组织中过度表达。本研究发现,miR-21和miR-224直接靶向凋亡mRNAs Caspase 3、Caspase 9和Bim。miR-21和miR-224作为致癌因子发挥功能,使得永生化星形胶质细胞和GBM细胞系生长速度加快,而miR-21和miR-224抑制剂导致凋亡细胞死亡并抑制GBM干细胞数量下降。通过敲低Bim和Caspase3表达逆转了miR-21和miR-224抑制剂的效应,表明它们在癌症中是致癌miRs的重要靶标。
尽管对癌症干细胞假说的了解越来越深入,miRNAs在癌症干细胞中的作用却少有研究。相当数量的miRNAs可能在癌症干细胞中发挥重要作用,本研究集中探讨了两种能保护细胞免于凋亡的miRNAs。干细胞的自我更新和增殖部分是由诱导凋亡所调控的。因此,干细胞的数量是那些败给分化/凋亡和那些通过增殖新生成的细胞平衡的结果。干细胞凋亡调控失调被认为是一些癌症的病理学基础,这些癌症部位的凋亡抗性导致肿瘤不受控制持续生长[38]。
Bcl-2和Caspase家族成员在细胞凋亡中扮演主要角色。众所周知Caspase剪切通路起始于Caspase被固有或外部途径活化。Caspase 9是固有活化途径起始因子,伴随细胞色素c的释放,其在线粒体膜上被激活;Caspase3是介导许多细胞蛋白切割的因子[39]。miR-224在下调两种caspase通路成分表达中的作用很明显是抗凋亡的。
Bcl-2家族包括数量众多的结构相关蛋白,这些蛋白能通过控制线粒体膜通透性并结合细胞色素c的释放调控固有凋亡途径。促凋亡蛋白BCL2L11 (Bim)通过结合于Bcl-2家族的抗凋亡成员,包括Bcl-xl和Mcl-1,或通过激活促凋亡成员Bax和Bak而调控细胞凋亡[40-41]。本研究结果表明miR-21能调节Bim表达,从而抑制GBM干细胞凋亡,增强Bcl-2表达,并减少PARP剪切。而且,miR-21也直接靶向Caspase3以增强对GSCs中凋亡抑制的影响。miR-224靶向凋亡起始因子Caspase9和效应器Caspase3,于是阻断了固有凋亡途径。
本研究证明,在这些独特的miRNAs存在的条件下,上调凋亡途径靶向蛋白表达对于增加凋亡活性是足够的。而特异性上调Caspase3全长表达已经被证明能使T细胞对凋亡更敏感[42],而在miRNA调控或癌症背景下,Caspase3表达对凋亡的影响尚没有相关报道。Bim通常会被细胞分裂素如ERK下调,而FOXO3a的表达能诱导Bim表达,但在miR抑制剂处理后通过增加Bim表达诱导凋亡以前尚未见相关报道。
许多GSCs样品中,miR-21和miR-224强烈上调表达,并且两者共同靶向固有凋亡途径中的相关成分,表明GSCs对线粒体膜不稳定和凋亡很敏感。GSCs可能通过增加这些miRNAs的表达而逃避凋亡。目前,一些抗肿瘤治疗能利用毒性分子的抗体递呈效应诱导癌细胞凋亡,抗体结合于诸如TRAIL之类的死亡受体上,然后诱导细胞凋亡,或通过抑制组蛋白乙酰化而引起细胞凋亡[43-45]。GBM中,肿瘤的起始和发育似乎是通过凋亡失调实现的;有报道已经证明造血干细胞中凋亡失调能导致细胞分化缺陷并增加患癌风险[46]。本研究结果揭示了一种独特的抑制肿瘤生长的方法,即利用抗凋亡致癌miRNAs miR-224和miR-21的拮抗剂抑制肿瘤生长。随着治疗脑部肿瘤的局部导入siRNAs和miRNAs的技术日趋完善,miR-224和miR-21的拮抗剂可以作为有效的导入载荷。本研究证明miR-224和miR-21是GSCs凋亡抗性重要的生理驱动因子,其为肿瘤的治疗提供了新的靶标。
[1] Stupp R,Mason WP,Van Den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med,2005,352(10):987-996.
[2] Hegi ME,Diserens AC,Gorlia T,et al.MGMT gene silencing and benefit from temozolomide in glioblastoma[J].N Engl J Med,2005,352(10):997-1003.
[3] Singh S,Dirks PB.Brain tumor stem cells:identification and concepts[J].Neurosurg Clin N Am,2007,18(1):31-38.
[4] Vescovi AL,Galli R,Reynolds BA.Brain tumour stem cells[J].Nat Rev Cancer,2006,6(6):425-436.
[5] Galli R,Binda E,Orfanelli U,et al.Isolation and characterization of tumorigenic,stem-like neural precursors from human glioblastoma[J].Cancer Res,2004,64(19):7011-7021.
[6] Ignatova TN,Kukekov VG,Laywell ED,et al.Human cortical glial tumors contain neural stem-like cells expressing astroglial and neuronal markers in vitro[J].Glia,2002,39(3):193-206.
[7] Singh SK,Clarke ID,M.Terasaki,et al.Identification of a cancer stem cell in human brain tumors[J].Cancer Res,2003,63(18):5821-5828.
[8] Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells[J].Nature,2004,432(7015):396-401.[9] Bao S,Wu Q,Mclendon RE,et al.Glioma stem cells promote radioresistance by preferential activation of the DNA damage response[J].Nature,2006,444(7120):756-760
[10] Quinones-Hinojosa A,Chaichana K.The human subventricular zone:a source of new cells and a potential source of brain tumors[J].Exp Neurol,2007,205(2):313-324.
[11] Angelastro JM,Lame MW.Overexpression of CD133 promotes drug resistance in C6 glioma cells[J].Mol Cancer Res,2010,8(8):1105-1115.
[12] Beier D,Wischhusen J,Dietmaier W,et al.CD133 expression and cancer stem cells predict prognosis in high-grade oligodendroglial tumors[J].Brain Pathol,2008,18(3):370-377.
[13] Christensen K,SchrodeHD.r,B.W.Kristensen.CD133+ niches and single cells in glioblastoma have different phenotypes[J].J Neurooncol,2011,104(1):129-143.
[14] Campos B,Wan F,Farhadi M,et al.Differentiation therapy exerts antitumor effects on stem-like glioma cells[J].Clin Cancer Res,2010,16(10):2715-2728.
[15] Chirasani SR,Sternjak A,Wend P,et al.Bone morphogenetic protein-7 release from endogenous neural precursor cells suppresses the tumourigenicity of stem-like glioblastoma cells[J].Brain,2010,133 (7):1961-1972.
[16] Catania A,Maira F,Skarmoutsou E,et al.Insight into the role of microRNAs in brain tumors (review)[J].Int J Oncol,2012,40(3):605-624.
[17] Godlewski J,Newton HB,Chiocca EA,et al.MicroRNAs and glioblastoma; the stem cell connection[J].Cell Death Differ,2010,17(2):221-228.
[18] Kim TM,Huang W Park R,et al.A developmental taxonomy of glioblastoma defined and maintained by MicroRNAs[J].Cancer Res,2011,71(9):3387-3399.
[19] Purow B.The elephant in the room:do microRNA-based therapies have a realistic chance of succeeding for brain tumors such as glioblastoma[J].J Neurooncol,2011,103(3):429-436.
[20] Huse JT,Brennan C,Hambardzumyan D,et al.The PTEN-regulating microRNA miR-26a is amplified in high-grade glioma and facilitates gliomagenesis in vivo[J].Genes Dev,2009,23(11):1327-1337.
[21] Moore LM,Zhang W.Targeting miR-21 in glioma:a small RNA with big potential[J].Expert Opin Ther Targets,2010,14(11):1247-1257.
[22] Ren Y,Kang CS,Yuan XB,et al.Co-delivery of as-miR-21 and 5-FU by poly(amidoamine) dendrimer attenuates human glioma cell growth in vitro[J].J Biomater Sci Polym Ed,2010,21(3):303-314.
[23] Shi L,Chen J,Yang J,et al.MiR-21 protected human glioblastoma U87MG cells from chemotherapeutic drug temozolomide induced apoptosis by decreasing Bax/Bcl-2 ratio and caspase-3 activity[J].Brain Res,2010,1352(9):255-264.
[24] Zhang J,Han L,Ge Y,et al.miR-221/222 promote malignant progression of glioma through activation of the Akt pathway[J].Int J Oncol,2010,36(4):913-920.
[25] Guessous F,Zhang Y,Kofman A,et al.microRNA-34a is tumor suppressive in brain tumors and glioma stem cells[J].Cell Cycle,2010,9(6):1031-1036.
[26] Kefas B,Comeau L,Erdle N,et al.Pyruvate kinase M2 is a target of the tumor-suppressive microRNA-326 and regulates the survival of glioma cells[J].Neuro Oncol,2010,12(11):1102-1112.
[27] Kefas B,Comeau L,Floyd DH,et al.The neuronal microRNA miR-326 acts in a feedback loop with notch and has therapeutic potential against brain tumors[J].J Neurosci,2009,29(48):15161-15168.
[28] Kefas B,Godlewski J,Comeau L,et al.microRNA-7 inhibits the epidermal growth factor receptor and the Akt pathway and is down-regulated in glioblastoma[J].Cancer Res,2008,68(10):3566-3572.
[29] Li Y,Guessous F,Zhang Y,et al.MicroRNA-34a inhibits glioblastoma growth by targeting multiple oncogenes[J].Cancer Res,2009,69(19):7569-7576.
[30] Silber J,Lim DA,Petritsch C,et al.miR-124 and miR-137 inhibit proliferation of glioblastoma multiforme cells and induce differentiation of brain tumor stem cells[J].BMC Med,2008,6(14):564-575.
[31] Misawa A,Katayama R,Koike S,et al.AP-1-Dependent miR-21 expression contributes to chemoresistance in cancer stem cell-like SP cells[J].Oncol Res,2010,19(1):23-33.
[32] Zhou X,Zhang J,Jia Q,et al.Reduction of miR-21 induces glioma cell apoptosis via activating caspase 9 and 3[J].Oncol Rep,2010,24(1):195-201.
[33] Lee J,Kotliarova S,Kotliarov Y,et al.Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines[J].Cancer Cell,2006,9(5):391-403.
[34] Kumar P,Luo Y,Tudela C,et al.The c-Myc-regulated microRNA-17~92 (miR-17~92) and miR-106a~363 clusters target hCYP19A1 and hGCM1 to inhibit human trophoblast differentiation[J].Mol Cell Biol,2013,33(9):1782-1796.
[35] Landais S,Landry S,Legault P,et al.Oncogenic potential of the miR-106-363 cluster and its implication in human T-cell leukemia[J].Cancer Res,2007,67(12):5699-5707.
[36] Ernst A,Campos B,Meier J,et al.De-repression of CTGF via the miR-17-92 cluster upon differentiation of human glioblastoma spheroid cultures[J].Oncogene,2010,29(23):3411-3422.
[37] Godlewski J,Nowicki MO,Bronisz A,et al.Targeting of the Bmi-1 oncogene/stem cell renewal factor by microRNA-128 inhibits glioma proliferation and self-renewal[J].Cancer Res,2008,68(22):9125-9130.
[38] Zeuner A,Pedini F,Signore M,et al.Stem cell factor protects erythroid precursor cells from chemotherapeutic agents via up-regulation of BCL-2 family proteins[J].Blood,2003,102(1):87-93.
[39] Wyllie AH.“Where,O death,is thy sting?” A brief review of apoptosis biology[J].Mol Neurobiol,2010,42(1):4-9.
[40] Hughes P,Bouillet P,Strasser A.Role of Bim and other Bcl-2 family members in autoimmune and degenerative diseases[J].Curr Dir Autoimmun,2006,9(12):74-94.
[41] Willis SN,Adams JM.Life in the balance:how BH3-only proteins induce apoptosis[J].Curr Opin Cell Biol,2005,17(6):617-625.
[42] Sabbagh L,Kaech SM,Bourbonniere M,et al.The selective increase in -3 caspase expression in effector but not memory T cells allows susceptibility to apoptosis[J].Journal of Immunology,2004,173(9):5425-5433.
[43] Camidge DR.Apomab:an agonist monoclonal antibody directed against Death Receptor 5/TRAIL-Receptor 2 for use in the treatment of solid tumors[J].Expert Opin Biol Ther,2008,8(8):1167-1176.
[44] Park KJ,Lee SH,Kim TI,et al.A human scFv antibody against TRAIL receptor 2 induces autophagic cell death in both TRAIL-sensitive and TRAIL-resistant cancer cells[J].Cancer Res,2007,67(15):7327-7334.
[45] Zhu QY,Wang Z,Ji C,et al.C6-ceramide synergistically potentiates the anti-tumor effects of histone deacetylase inhibitors via AKT dephosphorylation and alpha-tubulin hyperacetylation both in vitro and in vivo[J].Cell Death Dis,2011,2(1):e117.
[46] Fuchs Y,Steller H.Programmed cell death in animal development and disease[J].Cell,2011,147(4):742-758.
(编校:师维康)
Effect of microRNAs 224 and 21 on human glioblastoma stem cell survival and the possible molecular mechanisms
WANG Jia-qingΔ, YU Yun-long, WANG Hui-xing, LIU Hua-ting
(Department of Neurosurgery, The People ’s Liberation Army 107 Hospital, Yantai 264002, China)
ObjectiveTo explore the effect of microRNAs 224 and 21 on human glioma stem cells survival and the possible molecular mechanisms.MethodsqPCR was used to detect the dysregulated expression of microRNAs in malignant glioma samples, human GBM stem cells, artificially established GBM stem cell lines and human tissues.Caspase 3/7 assay, Annexin V apoptosis/fluorescence assay were performed to determine the effect of miR-21 or miR-224 mimics and inhibitor on cell apoptosis.Living cells count was used to assess miR-21 or miR-224 mimics and inhibitor on cell growth.TargetScan was used to explore potential targets of miR-21 and miR-224, and dual luciferase reporter assay was used to identify whether the 3’UTR of Caspase 3, Caspase 9 and Bim mRNA was a binding target of miR-21 or miR-224.Western blot was used to detect the expression of Caspase 3, Caspase 9 and Bim protein after transfection of miR-21 or miR-224 mimics or inhibitors.ResultsmiR-21 and miR-224 are strongly upregulated in GSC samples, multiple GBM human tumor specimens, and GBM neurosphere stem cell lines(P<0.05).Caspase 3/7 assay and Annexin V apoptosis/fluorescence assay results showed that miR-224 and miR-21 regulated GSC apoptosis.Living cells count results demonstrated that miR-224 and miR-21 regulated GSC growth.miR-224 and miR-21 regulate pro-apoptotic gene expression by directly targeting Caspase 3, Caspase 9, and Bim 3’-UTRs.ConclusionThese results indicate that miR-224 and miR-21 are important physiologic drivers of GSC resistance to apoptosis, providing new points of therapeutic leverage against these treatment-resistant cells.
miR-224; miR-21; Caspase 3; Caspase 9; Bim; gloima stem cell; anti-apoptotic
10.3969/j.issn.1005-1678.2016.11.008
王家清,通信作者,男,硕士,副主任医师,研究方向:脑胶质瘤的诊治,E-mail:w107wjq@163.com。
R739.41
A

