非电解质乙二醇水溶液脱硫石膏制备高强石膏*
蒋光明, 赵浚雯, 张贤明, 吕晓书, 官宝红
(1. 重庆工商大学 废油资源化技术与装备教育部工程研究中心,重庆 400067;2. 浙江大学 环境与资源学院,杭州 310058)
非电解质乙二醇水溶液脱硫石膏制备高强石膏*
蒋光明1,2, 赵浚雯1, 张贤明1, 吕晓书1, 官宝红2
(1. 重庆工商大学 废油资源化技术与装备教育部工程研究中心,重庆 400067;2. 浙江大学 环境与资源学院,杭州 310058)
摘要:研究了常压非电解质乙二醇-水溶液脱硫石膏制备α-半水石膏工艺,对转化过程和产物特性做了表征分析;研究了不同金属离子对于转化过程的调控作用,对调控机制作了分析。结果表明脱硫石膏在乙二醇水溶液中(乙二醇浓度80 mol%,反应温度95 ℃)可成功转化为α-半水石膏;微量金属阳离子K+,Mg2+的添加可显著加快转化速率,而Fe3+的加入则会减缓转化;添加K+产物α-半水石膏晶体呈梭子状,添加Mg2+后可获得细长α-半水石膏晶须,而添加Fe3+后则获得扁平硬币状α-半水石膏晶体;金属阳离子对于转化速率和产物形貌的调控主要通过影响溶液pH及晶体表面选择性吸附实现,确切的机理还需进一步分析表征。研究内容将有助于常压非电解质醇水溶液α-半水石膏制备技术的发展,并利于脱硫石膏的高附加值资源化利用。
关键词:脱硫石膏;α-半水石膏;相态转化;形貌调控
脱硫石膏(Flue gas desulfurization gypsum, 简称FGD gypsum)是燃煤电厂采用湿法石灰石-石膏技术烟气脱硫工艺产生的工业副产物,年产量巨大。据不完全统计,2014年中国脱硫石膏产量为7 550万t,到2015年预计将到8 000万t[1]。目前,我国脱硫石膏综合利用率达48%,但主要作为低端产品应用于建筑石膏、粉刷石膏、水泥缓凝剂与路基材料等[2-3],经济附加值不高。脱硫石膏的主要成分为二水硫酸钙 (>90 wt%, CaSO4·2H2O),与天然石膏组分类似,因此可代替天然石膏作为工业原料生产高经济附加值的产品,如高强石膏(α-半水石膏,α-CaSO4·0.5H2O),一种优质胶凝材料,胶凝性能及强度远高于普通建筑石膏,广泛应用于建筑材料、医药、化工以及新型功能材料领域。因此,以脱硫石膏为原料,制备α-半水石膏,可有效提升脱硫石膏的利用价值和经济价值,减轻电厂经济负担,符合国家可持续发展战略[4]。
以二水石膏制备α-半水石膏的技术发展已有半个世纪。20世纪70年代,德国科学家研发了二水石膏制备α-半水石膏的蒸压法技术并商业化,但该技术需要高压设备,反应温度为200~300 ℃(蒸汽加热),反应进程和产品质量不易控制[5-6]。始于20世纪80年代的常压盐溶液法技术,即在水中加入电解质实现常压和较低温度(90~100 ℃)下将二水石膏脱水转化为高强石膏,无需高压设备,具有反应温度低、转化效率高、产品质量好等优势[7-8]。国内外学者们研究了纯水、各种电解质(NH4Cl,CaCl2,KCl,H2SO4,H3PO4,CaCl2-HCl,CaCl2-MgCl2-KCl)溶液中石膏相变规律,以及各种添加剂(金属离子、酒石酸钠和柠檬酸钠、表面活性剂、羧酸)对于石膏结晶过程和晶体形貌控制的影响[9-10]。我国于2009年顺利完成了国内外首个电厂脱硫石膏常压盐溶液法制备高强石膏的中试,制备温度为95 ℃,盐溶液体系为CaCl2-MgCl2-KCl[11-12]。近年来,Guan开发了一种新的非电解质醇水溶液二水石膏制备α-半水石膏技术,如甘油水溶液[13],并详细阐明了制备热力学相关问题[14-15]。相比于电解质溶液法,醇水溶液中无高浓度杂质离子引入,可供高纯度α-半水石膏制备,且醇水无腐蚀性,无毒无害,可回收,总体而言,可操作性及经济性都较优。
此处将利用醇水溶液法,在常压下以脱硫石膏为原料,在80 mol%乙二醇-水中制备α-半水石膏。文章首先对乙二醇水溶液中脱硫石膏能否转化为α-半水石膏进行了探索试验,并以金属离子为转晶剂,对转化动力学及产物α-半水石膏晶体形貌进行了调控。研究内容可进一步丰富常压醇水溶液α-半水石膏技术,并有助于推动脱硫石膏的高附加值资源化利用。
1实验部分
1.1实验材料
脱硫石膏原料取自杭州半山电厂。乙二醇(纯度≥99.5%)、丙酮(纯度≥99.5%)、无水乙醇(纯度≥99.7%)、氯化钾(纯度≥99.5%)、六水氯化镁(纯度≥99.0%)、六水氯化铁(纯度≥99.5%)均为分析纯,产于国药集团化学试剂有限公司。
1.2脱硫石膏转化试验
所有转化试验均在一个有效容积为1.2 L的五口含玻璃夹层的反应器中完成。机械搅拌使反应体系均匀稳定,搅拌速度为250 r/min。反应所需温度通过油浴控制,水银温度计校正,其控制精度为 ±0.5 ℃。同时为保证反应器内水蒸汽不流失,使用球形冷凝器冷凝。具体实验流程:配置设定浓度的500 mL 乙二醇浓度为80 mol%乙二醇水溶液,加入到反应器中并加热到预设温度。等温度稳定后向反应器中再添加50 g二水石膏,形成悬浊液,开始反应。按预设间隔移取10 ml的悬浊液,真空抽滤,沸水洗涤,乙醇及丙酮固定,将得到的固相在60 ℃,0.08 MPa真空干燥箱干燥后用于后期物相分析。探索金属离子作用时,即在配置乙二醇水溶液时加入一定量金属盐,获得所需浓度。
1.3材料表征分析
X射线衍射仪(XRD,D/Max-2550pc, RigakuInc.,Japan)用以确定石膏固体粉末相态。测试使用Cu-Kα发射源,扫面范围为2θ= 10~80°,扫速为8° min-1。用热重-示差扫描量热分析仪(TG/DSC)分析石膏固体粉末相态及组成,仪器采用耐驰热重-示差扫描量热仪(TG-DSC,STA 409PC NETZSCH Germany)。将约15 mg经60 ℃干燥后的固体粉末样品放入氧化铝坩埚中(坩埚用盖子密封),在流速为20 mL min-1的氮气气氛中以10 K min-1从室温程序升温到500 °C。从得到的TG和DSC曲线上可以计算各个温度段内的失重及吸放热峰,用以计算样品成分及比例。扫描电子显微镜(SEM,HITACHI S-4800 Japan)同时观察确定晶体形貌。样品制备时需将固体粉末粘附在导电胶上,做喷金处理(使得样品导电)后在5 kV或15 kV的电压下操作。
2结果与讨论
2.1脱硫石膏性质
脱硫石膏原料的组分见表1,以SO3wt%计算可知,脱硫石膏中二水硫酸钙CaSO4.2H2O的含量达94 wt%,其余部分包括少量金属氧化物(Al2O3,Fe2O3,MgO,Na2O和K2O, 总含量达到2.46 wt%),及自由水、尘土和灰分(共3.54 wt%)等。金属氧化物及尘土灰分主要来源于烟气以及本身石灰石浆液。

表1 脱硫石膏化学组成
图1(a)为脱硫石膏颗粒的SEM图,显示脱硫石膏呈斜棱柱状,颗粒尺寸较均匀,在30 ~ 40 μm左右。图1(b)为脱硫石膏的XRD衍射图,只显示二水石膏的衍射峰(2θ=11.62°,20.11°,23.39°以及29.11°),无其他相存在。由于XRD的检测限在5.0 wt%左右,故可断定脱硫石膏中杂质单相含量不会超过5 wt%。对脱硫石膏的组分、形貌及相态分析表明脱硫石膏主要由二水石膏组成,纯度较高,且颗粒较均匀。

图1 脱硫石膏原料SEM Fig.1 SEM image
2.2乙二醇水溶液脱硫石膏转化为α-半水石膏
脱硫石膏向α-半水石膏转化反应温度一般为95 ℃,这样才能达到转化所需热力学条件。乙二醇沸点高,能与水以任意比互溶,无毒无害,因此作为首选溶剂。根据Guan报道的石膏三相在甘油水溶液中的相图,80 mol%的乙二醇浓度可推动二水石膏向α-半水石膏转化,因此制备条件选用80 %的乙二醇水溶液。图2为反应过程中固体相相态随反应时间的变化图,结果显示在前8 h内,固体相XRD曲线仍只显示二水石膏的特征衍射峰(2θ=11.62°,23.39°以及29.11°,如黑色圆对应峰),但是从第12 h开始,固体中开始出现半水石膏的峰值(2θ=14.70°,25.62°和29.71°,如图中黑色方框对应峰所示)。随着反应的进行,二水石膏相的特征衍射峰越来越弱,但α-半水石膏相的特征衍射峰越来越强,到20 h后,二水石膏相已经检测不出,只剩下α-半水石膏相检出。图3为最终产品的热重分析数据,显示随着温度升高,固相在98 ℃开始脱水,到175 ℃达到稳定,失重达6.65 wt%。由于固相中基本为石膏,故在 98~175 ℃温度段的失重主要来自于结晶水的脱除, 而6.65 wt%的失重非常接近于α-半水石膏的理论结晶水含量值6.21 wt%。图3中DSC曲线在149 和171oC分别出现一个明显的吸热峰和放热峰,分别对应α型半水石膏失去0.5个结晶水形成可溶性无水石膏,以及可溶性无水石膏相变为不溶性无水石膏时的吸放热反应。整个TG/DSC结果证实在在乙二醇水溶液中脱硫石膏可以转化为α-半水石膏。
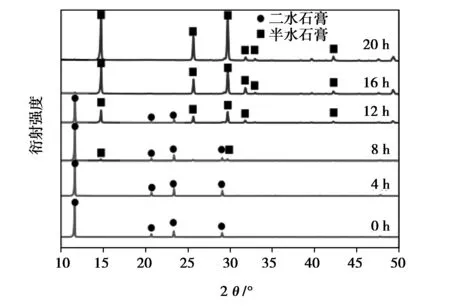
图2 脱硫石膏转化为α-半水石膏固相XRD随时间变化Fig. 2 XRD patterns for the phase evolution along the phase transition from FGD gypsum to α-calcium sulfate hemihydrates
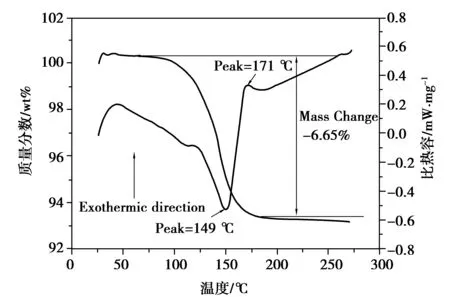
图3 产物α-半水石膏热重分析图Fig. 3 the TG/DSC pattern for the product α-calcium sulfate hemihydrates

图4 不同KCl浓度下脱硫石膏转化为α-半水石膏速率图Fig. 4 Kinetics for the phase transition of FGD gypsum to α-calcium sulfate hemihydrates under different KCl concentrations
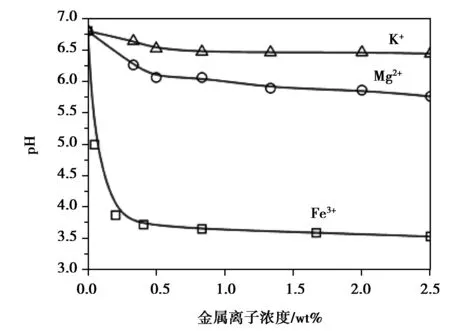
图5 添加不同金属离子后溶液pH值随其浓度变化值Fig. 5 Dependence of pH on the ion concentration and species
表2对比了K+,Mg2+以及Fe3+在相同浓度1.0 wt%下,脱硫石膏开始脱水及完成转化的时间。结果显示K+和Mg2+对于整个脱水过程起加速作用,Mg2+的效率要高于K+,而Fe3+则起减速作用。pH对于转化速率有着重要的影响,pH越低越有利于转化快速进行[17],因此考察了添加不同浓度金属离子后溶液pH变化情况,见图5。结果显示,金属离子的加入均会降低溶液pH,Fe3+最强,可将pH降至3.5,Mg2+次之,pH降至6.0,K+最弱,降至6.5。Mg2+和K+对于pH降低的效果及效率与其加快脱硫石膏转化的顺序一致,因此两者主要通过降低pH来加快转化。但添加Fe3+后pH已降至3.5,但转化却减慢了,这可能是因为Fe3+在溶液中水化形成Fe(OH)x, 而这种絮状物容易吸附在脱硫石膏表面或α-半水石膏晶体表面,抑制脱硫石膏的溶解,同时抑制α-半水石膏的晶体生长,总体抑制了整个转化反应。

表2 添加1.0 wt%不同金属阳离子后脱硫石膏开始转化以及完全转化所需的时间
2.3形貌控制
α-半水石膏属于一种重要的胶凝材料,其胶凝效果取决于其形貌[18]。α-半水石膏晶体一般为五角十二面体,六棱双锥柱状,长径比不同则性能不一。图6为加添1wt%的K+, Mg2+和Fe3+后α-半水石膏晶体形貌。结果显示添加K+后,α-半水石膏颗粒呈梭子状(图6(a)(b)),长约80 μm, 宽约25 μm,且部分梭子晶体相互间有所交联;而Mg+则使得最终的α-半水石膏晶体成线状,长约150 μm,宽只有2.5 μm,长宽比达60, 接近晶须(图6(c)(d));Fe3+添加后α-半水石膏晶体成六角硬币状,似乎α半水石膏的棱柱结构在长度维度被压缩了(图6(e)~(f))。

图6 添加不同金属离子后α-半水石膏形貌图Fig. 6 Morphology of the α-calcium sulfate hemihydrate under differention species
很多研究者对金属离子调控晶体形貌的机理进行了研究,其中最被接受的机理是金属离子会以某种形式吸附在晶体表面[19-20],由于吸附在不同晶面所需能量不同,因此会出现吸附选择性。当吸附上晶面后,其可调控该晶面的生长速率,最终导致形貌的不同。从图6的结果可以看出,K+和Mg2+主要吸附在α半水石膏棱柱晶体的侧面,导致该晶面生长受阻,而断面生长不受抑制,因此α半水石膏晶体趋向于变长。添加K+后梭子晶体的形成应该是由于在侧面的吸附效果没有Mg2+的牢固,有效果,但不够明显,因此图中显示α半水石膏晶体的侧面坑洼不平。Fe3+明显应该是吸附在α半水石膏晶体的端面,使得晶体侧面得到生长,因此颗粒显得比较“胖”,但不“长”。对金属离子调控晶体形貌的机理正在进一步探究。
3结论
主要对非电解质醇水溶液中脱硫石膏制备α半水石膏工艺进行了探索实验。实验结果显示:在含80 mol%乙二醇水溶液中,反应温度为95 ℃时,脱硫石膏可成功转化为α半水石膏。转化速率及产品形貌可通过添加少量金属离子完成。该研究内容将丰富醇水溶液法α半水石膏制备技术在工业固废资源化利用中,推进脱硫石膏高经济附加值利用进程。
参考文献(References):
[1] 潘荔,毛专建,杨帆.中国燃煤电厂脱硫石膏综合利用[J].设备监理,2015(4):40-44
PAN L,MAO ZH J,YANG F.Production and Comprehensive Utilization of Desulphurization By-product Gypsum [J].Plant Engineering Consultants,2015(4):40-44
[2] 吴荣.脱硫石膏在水泥基材料中的应用[J].粉煤灰综合利用,2015(3):53-56WU R.Application of Flue Gas Desulphurization (FGD) Gypsum in Cementitious Material[J].Fly Ash Comprehen-sive Utilization,2015(3):53-56
[3] 高英力,陈瑜,马保国.粉煤灰-脱硫石膏水泥基材料水化活性及微结构[J].土木建筑与环境工程,2011(5):137-142
GAO Y L,CHEN Y,MA B G.Microstructure and Hydration Activity of Cement-based Materials Containing Fly Ash-desulphurization Gypsum [J].Jouranl of Civil Architechtural & Environmental engineering,2011(5):137-142
[4] 婿桂萍,唐仕童.从烟气脱硫残渣中制取α-半水石膏的研究[J].吉林化工学院学报,2002,19(2):3-7
XU G P,TANG SH T.Study on α-Form Calcuim Sulfate Hemihydra from Flue Gas Desulfuriza Scrubbing Sludge Waste[J].Jounral of Jilin Institute of Chemical Technology,2002,19(2):3-7
[5] ENGERT J,KOSLOWSKI T.The New Gypsum Binder Alpha 2000 Production Technology and Products[J].ZKG International,1998,51:229-237
[6] 桂苗苗,丛钢.脱硫石膏蒸压法制α-半水石膏的研究[J].重庆建筑学报,2001(2):62-65
GUI M M,CONG G.The Research on Producing α-form Calcium Sulfate Hemihydrate from the FGD Gypsum[J].Journal of Chongqing Jianzhu University,2001(2):62-65
[7] POWELL A.Calcium Sulfate Hemihydrate Prepared in Sodium Chloride Solution[J].Australian Journal of Chemistry,1962(15):868-874
[8] YANG L C,GUAN B H,WU Z B.Characterization and Precipitation Mechanism of α-calcium Sulfate Hemihydrate Growing out of FGD Gypsum in Salt Solution[J].Science in China Series E-technological Sciences,2009,52:2688-2694
[9] 吴晓琴,杨有余,裘建军.常压盐溶液法转化脱硫石膏制备α-半水石膏的相变机理[J].武汉科技大学学报,2011(2):37-40
WU X Q,YANG Y Y,QIU J J.Mechanism of α-calcium Sulfate Hemihydrate Produced from FGD Gypsum in Thermal Solution[J].Journal of Wuhan University of Science and Technology,2011(2):37-40
[10] LI Z B,DEMOPOULOS G P.Model-based Construction of Calcium Sulfate Phase-transition Diagrams in the HCl-CaCl2-H2O System between 0 and 100 ℃[J].Industrial & Engineering Chemistry Research,2006,45:4517-4524
[11] GUAN B H,YANG L C,WU Z B,et al.Preparation of α-calcium Sulfate Hemihydrate from FGD Gypsum in K,Mg-containing Concentrated CaCl2Solution under Mild Conditions[J].Fuel,2009,88:1286-1293
[12] GUAN B H,KONG B,FU H L.Pilot Scale Preparation of Alpha-Calcium Sulfate Hemihydrate from FGD Gypsum in Ca-K-Mg Aqueous Solution under Atmospheric Pressure[J].Fuel,2012,30(3):1-7
[13] GUAN B H,JIANG G M,FU H L,et al.Thermodynamic Preparation Window of Alpha Calcium Sulfate Hemihydrate from Calcium Sulfate Dihydrate in Non-electrolyte Glycerol-water Solution under Mild Conditions[J].Industrial & engineering chemistry research,2011,50 (23):13561-13567
[14] GUAN B H,JIANG G M,WU Z B,et al.Preparation of Alpha-Calcium Sulfate Hemihydrate from Calcium Sulfate Dihydrate in Methanol Water Solution under Mild Conditions[J].Journal of the American Ceramic Society,2011,94(10):3261-3266
[16] SOLBERG C,HANSEN S.Dissolution of CaSO4·0.5H2O and Precipitation of CaSO4·2H2O:A Kinetic Study by Synchrotron X-ray Powder Diffraction [J].Cement and Concrete Research,2001,31(4):641-646
[17] GUAN B H,SHEN,Z X,WU Z B,et al.Effect of pH on the Preparation of α-calcium Sulfate Hemihydrate from FGD Gypsum with the Hydrothermal Method[J].Journal of the American Ceramic Society,2007,91:3835-3840
[18] LEWRY A J,WILLIAMSON J.The Setting of Gypsum Plaster.Part II:The Development of Microstructure and Strength[J].Journal of Materials Science,1994,29(21):5524-5528
[19] GUAN B H,YANG L C,WU Z B.Effect of Mg2+Ions on the Nucleation Kinetics of Calcium Sulfate in Concentrated Calcium Chloride Solutions[J].Industrial & Engineering Chemistry Research,2010,49 (12):5569-5574
[20] 彭家惠,瞿金东,张建新.丁二酸对α-半水石膏晶体生长习性与晶体形貌的影响[J].东南大学学报(自然科学版),2011(11):1307-1310
PENG J H,QU J D,ZHANG J X.Effect of Succinic Acid on Crystal Growing Gabit and Crystal Morphology of α-hemihydrate Desulfogypsum[J].Journal of Southeast University(Natural Science Edition),2011(11):1307-1310
责任编辑:李翠薇
doi:10.16055/j.issn.1672-058X.2016.0004.003
收稿日期:2016-01-20;修回日期:2016-03-10.
*基金项目:重庆市基础与前沿研究计划项目(cstc2015jcyjA20007);重庆市教委科学技术研究项目(KJ1500601).
作者简介:蒋光明 (1987-), 男, 浙江绍兴人, 讲师, 博士, 从事固废资源化、功能纳米材料合成研究.
中图分类号:X773
文献标志码:A
文章编号:1672-058X(2016)04-0015-07
Preparation of High-strength Gypsum from FGD Gypsum in Non-electrolyte Ethylene Glycol-water Solution
JIANG Guang-ming1,2, ZHAO Jun-wen1, ZHANG Xian-ming1,LU Xiao-shu1,**, GUAN Bao-hong2
(1.Engineering Research Center for Waste Oil Recovery Technology and Equipment,Ministry of Education, Chongqing Technology and Business University, Chongqing 400067, China;2.School of Environmental Engineering, Zhejiang University, Hangzhou 310058, China.)
Abstract:The preparation of alpha-calcium sulfate hemihydrates from flue gas desulfurization gypsum was conducted in non-electrolyte 80 mol% glycol-water solution at 95 ℃ under normal atmosphere. The phase transition is confirmed to be feasibility through the analysis of the solid phase evolution with the time. Trace metal cations K+, Mg2+can significantly accelerate the conversion rate, while the addition of Fe3+will slow down the conversion. The alpha-calcium sulfate hemihydrate crystals show a shape of shuttle with the addition of K+, but a shape of elongated whisker and flat coin when Mg2+and Fe3+are introduced, respectively. The regulation of ion on the conversion rate and the morphology of the products is mainly achieved via its effect on modifying the solution pH and its selective adsorption on crystal surface. This work will promote the development of the technology of the preparation of the alpha-calcium sulfate hemihydrates under normal atmospheric pressure in non-electrolyte alcohols-water solution.
Key words:flue gas desulfurization gypsum; alpha-calcium sulfate hemihydrates; phase transition; morphology regulation

