Ser473-Akt磷酸化介导阿托伐他汀保护大鼠脑缺血再灌注损伤
陶希,卢伟,胡治平,宋涛,邓景贵,蔡华安,王淑玲,刘佳
Ser473-Akt磷酸化介导阿托伐他汀保护大鼠脑缺血再灌注损伤
陶希1,卢伟2,胡治平2,宋涛1,邓景贵1,蔡华安1,王淑玲1,刘佳1
[摘要]目的探讨Akt之Ser473位点(Ser473-Akt)磷酸化在阿托伐他汀保护大鼠脑缺血再灌注损伤中的作用。方法40只雄性Sprague-Dawley大鼠随机分成正常组(n=10)、假手术组(n=10)、缺血再灌注(I/R)组(n=10)和干预组(n=10)。采用线栓法制作大鼠脑缺血2h再灌注72h模型。正常组和假手术组不做任何处理,I/R组仅生理盐水灌胃,干预组在再灌注后大鼠苏醒时、24h、48h分别予生理盐水配制的阿托伐他汀10mg/kg灌胃。72h时处死所有大鼠,留取脑标本分别行HE染色及TUNEL染色,Western blotting检测脑前额叶皮质Akt及其Ser473-Akt表达。结果缺血再灌注72h后,干预组神经细胞形态学变化较I/R组减轻;干预组凋亡阳性细胞数显著少于I/R组(t=-6.014,P<0.001);I/R组前额叶皮质Ser473-Akt较正常组和假手术组显著增加(t>20.327,P<0.001),而干预组明显高于I/R组(t=3.649,P=0.007)。结论Ser473-Akt磷酸化在阿托伐他汀的神经细胞保护中起重要作用,通过抑制凋亡减轻大鼠脑缺血再灌注损伤。
[关键词]脑缺血/再灌注;Ser473-Akt;磷酸化;阿托伐他汀;细胞凋亡;大鼠
[本文著录格式]陶希,卢伟,胡治平,等.Ser473-Akt磷酸化介导阿托伐他汀保护大鼠脑缺血再灌注损伤[J].中国康复理论与实践,2016,22(6):655-659.
CITED AS:Tao X,Lu W,Hu ZP,et al.Protective effect of Ser473-Akt phosphorylation mediated atorvastatin on cerebral ischemia -reperfusion injury in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(6):655-659.
脑缺血再灌注损伤是一个非常复杂的病理生理过程。缺血后脑组织再灌注损伤与快速级联反应有关,如氧化应激、钙离子超载、凋亡基因激活、兴奋性氨基酸与炎症介质释放等,这些机制均可加重原有的缺血损伤,导致神经细胞进一步死亡[1-3]。其治疗一直是临床上的难点。阿托伐他汀是多脏器缺血研究中比较热门的药物,具有非胆固醇依赖性的抗炎、抗兴奋毒素、抗氧化、抗血小板聚集及免疫调节等多向性功能[4-6],在临床上已普遍应用于脑梗死急性期的治疗及二级预防[7]。基础研究发现,阿托伐他汀对缺血再灌注大鼠脑组织有保护作用,其机制可能与下调12/ 15-LOX、p38MAPK及cPLA2表达,降低血脑屏障的通透性等有关[8]。但是,关于阿托伐他汀神经细胞保护作用的研究仍不够深入,本研究从Akt之Ser473位点(Ser473-Akt)磷酸化角度探讨其在凋亡抑制水平的保护作用。
1 材料和方法
1.1实验动物及分组
40只健康雄性Sprague-Dawley大鼠,体质量220~250g,合格证号:SCXK(湖南)2009-0004,由湖南斯莱克景达有限公司提供。实验前饲养1周。根据实验动物保护协议和章程,所有大鼠在合适的温度及湿度条件下自由饮水和进食。实验前根据随机数字表将大鼠分成正常组(n=10)、假手术组(n=10)、缺血再灌注(ischemia-reperfusion,I/R)组(n=10)和干预组(n=10)。
1.2方法
1.2.1造模
参考Longa提出的线栓法制作可逆性大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型并加以改进[9]。大鼠称重,以10%水合氯醛350mg/kg腹腔麻醉,仰卧位固定于手术台上,颈前缘备皮并络合碘消毒,颈前正中切口约1.5cm,钝性分离皮下组织,暴露右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)及颈内动脉(internal carotid artery,ICA),仔细分离迷走神经,结扎CCA近心端和ECA根部,微动脉夹夹住ICA,在CCA靠近分叉处置一丝线备用。在CCA距离分叉约2cm处剪一斜向切口,将标记好的前端圆钝的栓线沿切口插入并经过分叉处进入ICA内,扎紧CCA分叉前预置的丝线,松开微动脉夹,继续沿入颅方向缓慢插入栓线,微感阻力时即停止,插入深度距离CCA分叉处约(18.0±2.0)mm,表明栓线已经阻断大脑中动脉主干血流。再将原分叉处备用线扎活结。缝合皮肤,栓线尾端固定于皮肤上。缺血达2h即小心抽出栓线,形成再灌注。在缺血期间及再灌注后2h保持肛温(37±0.5)℃。
I/R组和干预组采用此MCAO模型。假手术组仅将栓线插入ICA约10mm,其余步骤相同。凡手术中动物死亡、蛛网膜下腔出血或无神经功能缺损者均视为模型制作失败,不计在内,再以同一批次的大鼠制成合格模型后补足数量。
1.2.2神经功能缺损评分
采用Longa法进行神经功能缺损评分[10]。0分:正常,无神经损伤症状。1分:不能完全伸展左侧前爪。2分:行走时向左侧转圈。3分:行走时向左侧倾倒。4分:不能自发行走,或意识丧失。其中,0分和4分者被剔除。
1.2.3干预方法
正常组和假手术组不做药物处理,干预组以适量生理盐水稀释的阿托伐他汀10mg/kg(辉瑞公司)灌胃,I/R组以等体积生理盐水灌胃。灌胃时间:大鼠苏醒时,再灌注后24h和48h。
1.2.4HE染色及TUNEL染色
再灌注72h,取各组大鼠5只,以10%水合氯醛350mg/kg腹腔麻醉,剪开胸腔,暴露心脏,以钝性针头插入左心室,剪开右心耳,先以生理盐水300ml快速冲洗,再以4%多聚甲醛PBS缓冲液400ml行心脏灌注,致肝脏变白时停止,取脑组织浸泡于4%多聚甲醛PBS缓冲液,4℃保存过夜,然后进行梯度酒精脱水,二甲苯透明,石蜡包埋,切片,片厚5 μm。取前额叶脑组织作为观察对象。取相邻组织分别行HE染色,显微镜下观察脑组织的病理改变。每张切片用高倍镜(400×)随机观察8个不同视野[11]。
根据TUNEL细胞凋亡检测试剂盒(显色法)(江苏碧云天生物技术有限公司)进行染色。石蜡切片经梯度酒精脱蜡;滴加20μg/ml不含DNase酶的蛋白酶K,37℃温箱作用15~30min,PBS洗涤;加新鲜配制的3%H2O2置室温孵育10min,PBS洗涤;配制新鲜生物素标记液,在每个样品上滴加标记缓冲液50 μl,置暗盒中保持切片湿润,37℃孵育60min,PBS洗涤;滴加标记反应终止液0.2ml,室温孵育10min,PBS洗涤;配制Streptavidin-HRP工作液及DAB显色液,在每个样品上滴加Streptavidin-HRP工作液50 μl,置暗盒中保持切片湿润,室温孵育30min,PBS洗涤;滴加DAB显色液0.3ml,室温孵育,根据显色结果孵育适当时间,一般30~60min,PBS洗涤;常规梯度酒精脱水透明,封片。光镜下,切片中呈棕褐色的为凋亡阳性细胞,高倍镜下每张切片计数8个不同视野的阳性细胞数,取平均值。
1.2.5脑皮质标本的处理及Western blotting检测
再灌注72h,取各组大鼠5只,以10%水合氯醛350mg/kg腹腔麻醉,开颅取脑,置于冰面上,快速分离距离额极5mm的梗死边缘区脑皮质,取约组织200mg置-80℃冰箱保存。
取上述冰冻脑组织约50mg行液氮碾磨,经细胞裂解液充分处理,再冰上超声、离心及变性等处理。采用BCA法(江苏碧云天生物技术有限公司)检测蛋白浓度。SDS-PAGE(美国BIO-RAD公司)分离蛋白质,并转膜。将膜置于5%脱脂奶粉的TBST封闭液中,室温摇床约2h。将膜分别与Akt单抗(兔抗鼠,1:900,SIGMA公司)和Ser473-Akt单抗(兔抗鼠,1:800,SIGMA公司)结合,4℃孵育过夜。第二天以TBST液洗去一抗。再将膜与二抗(山羊抗兔,1:2000,北京中山金桥公司)充分结合约2.5h,洗去二抗。使用β-actin作为内参(北京中山金桥公司)。采用暗盒显影设备及Quantity One软件分析条带相对灰度值,图片以.tif格式保存。
1.3统计学分析
采用SPSS 13.0软件进行统计分析。所有计量资料采用(±s)表示,两独立样本间比较采用t检验。方差齐时,采用单因素方差分析;方差不齐时,采用Games-Howell方法分析。显著性水平α=0.05。
2 结果
2.1HE染色
正常组与假手术组额叶前皮质区结构正常,神经细胞排列紧密,胞浆丰富,核仁清晰。I/R组脑组织神经细胞稀疏、形态不规则,细胞皱缩,胞核固缩深染,甚至部分核消失。干预组上述改变有所减轻。见图1。
2.2TUNEL染色
正常组及假手术组仅见极少TUNEL阳性细胞。I/ R组TUNEL阳性细胞散在于整个缺血半暗带,分布欠均匀,部分区域相对集中,高倍镜下胞核呈棕褐色的为阳性细胞。与正常组及假手术组比较,I/R组阳性细胞数显著增加(P<0.001);干预组阳性细胞数显著少于I/R组(P<0.001)。见表1、图2。
2.3Western blotting检测
各组间Akt表达无显著性差异(P>0.05)。正常组和假手术组Ser473-Akt表达无显著性差异(P>0.05)。I/ R组Ser473-Akt表达较正常组和假手术组均显著升高(P<0.001);干预组Ser473-Akt表达明显高于I/R组(P<0.01)。见表2、图3。
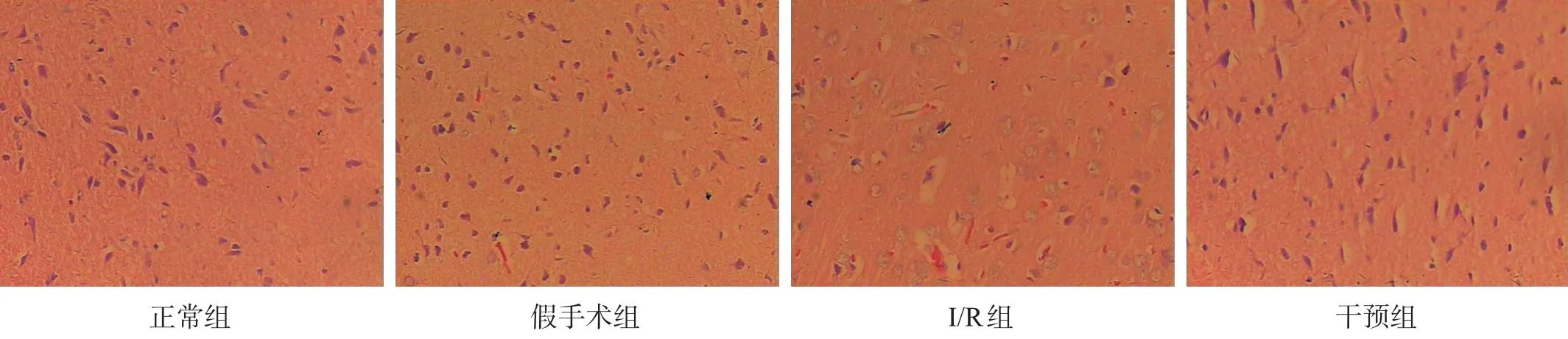
图1 HE染色观察病理组织学(400×)

图2 TUNEL染色检测凋亡细胞(400×)
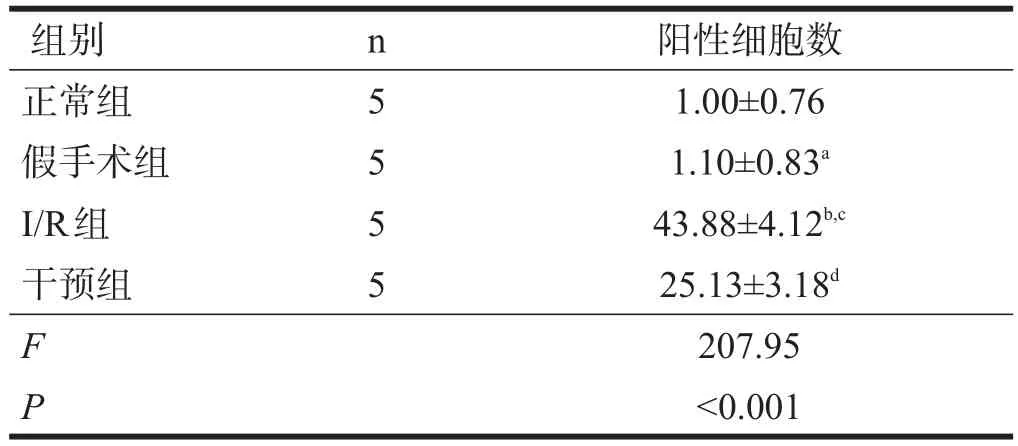
表1 各组TUNEL染色阳性细胞比较(n)
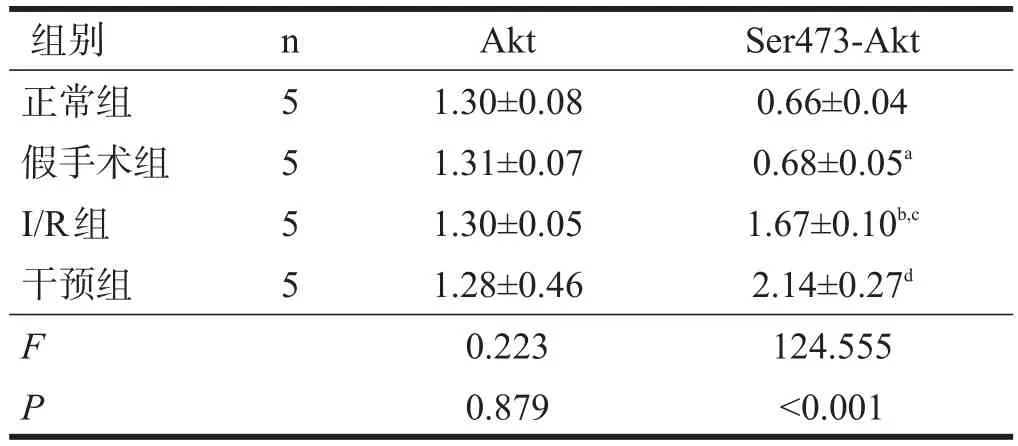
表2 各组Western blotting检测Akt和Ser473-Akt的表达

图3 各组Western blotting检测Akt和Ser473-Akt变化
3 讨论
PI3K/Akt信号通路对细胞增殖和凋亡起关键作用。PI3K是细胞内重要信号传导分子,可被细胞因子、生长因子及激素等细胞外信号激活,Akt作为PI3K下游的主要靶因子,在促进细胞存活、增殖、代谢及抑制细胞凋亡等方面扮演重要角色。Akt分子由3部分组成,从氨基端(N-)至羧基端(C-),分别为PH域、激酶域和调节域。其中激酶域Thr308和调节域Ser473的磷酸化作用是激活Akt的必要条件[12-13]。一般认为,当细胞外因子与酪氨酸激酶受体结合后,PI3K移至浆膜并活化,再促使PIP2转化为PIP3,并在细胞内聚集,后者与PDK1的PH域结合后,使PDK1活化,此时激酶域Thr308发生磷酸化(细胞膜外),之后是PDK2活化及Ser473的磷酸化(细胞质内)[13-14]。Kroner等研究发现,Thr308和Ser473的磷酸化作用是前后相继进行的,互相独立[15]。所以,Akt活性的最终实现需要Ser473的磷酸化,众多研究中把测定Ser473-Akt的水平作为Akt活化的主要标志,可反映活性Akt的整体量[16-17]。本研究亦以此位点作为观察Akt活性的标准。
研究发现,在大鼠脑缺血再灌注应激反应中,PI3K/Akt信号通路对细胞增殖及抗凋亡等发挥重要作用。其机制可能与以下几点有关[18-20]。①参与糖原和蛋白质的合成,如糖原合成激酶3(glycogen synthase kinase 3,GSK3)是PI3K/Akt关键作用底物,其失活则抑制糖原合成。②促进细胞存活,如抑制P53活性,促进神经元存活;③抑制细胞凋亡,具体途径包括Bad通路、caspase通路、FKHR通路及I κ K激酶等;④与其他信号通路交联。这些下游信号蛋白在Akt被激活后发挥重要作用,从而促进细胞增殖及凋亡抑制。
阿托伐他汀是一种3-羟基-3-戊二酸单酰辅酶A还原酶抑制剂,具有非胆固醇依赖性的细胞增生分化、抗炎、免疫调节等多向性功能,是减少临床心脑血管事件的关键药物之一[4-7]。其中,PI3K/Akt信号通路亦是其作用机制的研究热点之一。Cheng等研究GK大鼠心肌缺血再灌注,发现小剂量阿托伐他汀后处理可以明显减轻心肌线粒体超微结构损伤,降低梗死面积,其机制可能与激活PI3K/Akt信号途径有关[21]。Ding等体外培养大鼠乳鼠皮质神经元,再使用谷氨酸诱导皮质神经元凋亡,结果发现阿托伐他汀干预能对抗谷氨酸的毒性作用,减少神经元凋亡,增加细胞存活率,其机制也与激活PI3K/Akt信号通路有关[22]。阿托伐他汀对缺血脑组织及再灌注损伤的保护作用已被广大研究者接受,但其保护作用是否亦与PI3K/Akt信号途径有关,相关文献报道较少。
本研究结果显示,各组间总Akt表达水平无明显差异,与既往研究结果一致[21-22]。正常组和假手术组均有少量Ser473-Akt表达,但两组间比较无显著性差异,排除了手术本身对蛋白表达的影响。I/R组缺血2h再灌注72h后,Ser473-Akt表达较前两者明显增加,提示Ser473-Akt作为内源性因子对大鼠脑缺血再灌注损伤72h时仍有自身保护效应。当使用阿托伐他汀10mg/kg干预后,我们发现缺血再灌注72h时Ser473-Akt表达较I/R组进一步增加,提示阿托伐他汀有促进Ser473-Akt磷酸化作用,有利于神经细胞增殖,减少凋亡,从而减轻缺血应激对脑组织的损伤。但是,阿托伐他汀促进Ser473-Akt磷酸化作用的上游机制尚不清楚。
根据HE染色,本研究发现阿托伐他汀干预可以明显减轻再灌注所造成的脑组织病理损伤。同时,本研究采用TUNEL染色半定量分析了阿托伐他汀干预对凋亡细胞的影响,结果发现神经细胞凋亡明显减少,提示阿托伐他汀保护鼠脑缺血再灌注损伤的机制与抑制神经细胞凋亡有关。据此,我们推测Ser473-Akt磷酸化可能在其中扮演着重要角色,进一步检测Ser473-Akt下游凋亡相关蛋白的表达会更有意义。
综上所述,Ser473-Akt磷酸化在阿托伐他汀的神经细胞保护中起重要作用,通过促进神经细胞增殖及凋亡抑制,从而减轻大鼠脑缺血再灌注损伤。其具体上下游机制有待进一步研究。
[参考文献]
[1]Saad MA,Abdelsalam RM,Kenawy SA,et al.Ischemic preconditioning and postconditioning alleviates hippocampal tissue damage through abrogation of apoptosis modulated by oxidative stress and inflammation during transient global cerebral ischemia-reperfusion in rats[J].Chem Biol Interact,2015,232:21-29.
[2]Bedirli N,Bagriacik EU,Emmez H,et al.Sevoflurane and isoflurane preconditioning provides neuroprotection by inhibition of apoptosis-related mRNA expression in a rat model of focal cerebral ischemia[J].J Neurosurg Anesthesiol,2012,24(4):336-344.
[3]Zukhurova M,Prosvirnina M,Daineko A,et al.L-theanine administration results in neuroprotection and prevents glutamate receptor agonist-mediated injury in the rat model of cerebral ischemia- reperfusion[J].Phytother Res,2013,27(9):1282-1287.
[4]Profumo E,Buttari B,Saso L,et al.Pleiotropic effects of statins in atherosclerotic disease:focus on the antioxidant activ ity of atorvastatin[J].Curr Top Med Chem,14(22):2542-2551.
[5]Feldt M,Bjarnadottir O,Kimbung S,et al.Statin-induced anti- proliferative effects via cyclin D1 and p27 in a window-of-opportunity breast cancer trial[J].J Transl Med,2015,13:133.
[6]童保文,林志鸿,谢良地,等.兔颈动脉球囊损伤后血小板聚集和活化及阿托伐他汀的作用[J].南方医科大学学报,2014,34 (8):1162-1166.
[7]史德海,张卉田,赵梦杨,等.脑心通胶囊联合阿托伐他汀在急性脑梗死二级预防中的作用[J].中国全科医学,2011,14 (23):2699-2700.
[8]Cui L,Zhang X,Yang R,et al.Neuroprotection of early and short-time applying atorvastatin in the acute phase of cerebral ischemia:down-regulated 12/15-LOX,p38MAPK and cPLA2 expression,ameliorated BBB permeability[J].Brain Res,2010,1325:164-173.
[9]Clark WM,Lessov NS,Dixon MP,et al.Monofilament intraluminal middle cerebral artery occlusion in the mouse[J].Neurol Res,1997,19(6):641-648.
[10]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[11]Song T,Liu J,Tao X,et al.Protection effect of atorvastatin in cerebral ischemia-reperfusion injury rats by blocking the mitochondrial permeability transition pore[J].Genet Mol Res,2014,13(4):10632-10642.
[12]Fresno Vara JA,Casado E,de Castro J,et al.PI3K/Akt signalling pathway and cancer[J].Cancer Treat Rev,2004,30(2):193-204.
[13]Ma K,Cheung SM,Marshall AJ,et al.PI(3,4,5)P3 and PI(3,4)P2 levels correlate with PKB/akt phosphorylation at Thr308 and Ser473,respectively;PI(3,4)P2 levels determine PKB activity[J].Cell Signal,2008,20(4):684-694.
[14]Osaki M,Oshimura M,Ito H.PI3K-Akt pathway:its functions and alterations in human cancer[J].Apoptosis,2004,9 (6):667-676.
[15]Kroner C,Eybrechts K,Akkerman JW.Dualregulation of plateletprotein kinase B[J].J Biol Chem,2000,275(36):27790-27798.
[16]Chua BT,Gallego-Ortega D,Ramirez de Molina A,et al.Regulation of Akt(Ser473)phosphorylation by choline kinase in breast carcinoma cells[J].Mol Cancer,2009,8:131.
[17]Riaz A,Zeller KS,Johansson S.Receptor- specific mechanisms regulate phosphorylation of AKT at Ser473:role of RICTOR in beta1 integrin- mediatedcell survival[J].PLoS One,2012,7(2):e32081.
[18]Antoniv TT,Ivashkiv LB.Interleukin-10-induced gene expression and suppressive function are selectively modulated by the PI3K- Akt - GSK3 pathway[J].Immunology,2011,132(4):567-577.
[19]Zhong Z,Wang Y,Guo H,et al.Protein S protects neurons from excitotoxic injury by activating the TAM receptor Tyro3-phosphatidylinositol 3-kinase- Akt pathway through its sex hormone-binding globulin-like region[J].J Neurosci,2010,30 (46):15521-15534.
[20]Franke TF,Hornik CP,Segev L,et al.PI3K/Akt and apoptosis:size matters[J].Oncogene,2003,22(56):8983-8998.
[21]Cheng ZD,Wu LZ,Guo JJ,et al.Protective effect of atorvastatin postconditioning on myocardial ischemia- reperfusion injury in GK rat[J].Chin JArterioscler,2012,20(8):709-713.
[22]Ding Q,Dong Y,Jin Y,et al.The mechanisms of neuroprotective effect of atorvastatin on glutamate-induced neurotoxicity in cultured cortical neurons of rats[J].Chin Pharmacologic Bull,2010,26(12):1635-1640.
Protective Effect of Ser473-Akt Phosphorylation Mediated Atorvastatin on Cerebral Ischemia -reperfusion Injury in Rats
TAO Xi1,LU Wei2,HU Zhi-ping2,SONG Tao1,DENG Jing-gui1,CAI Hua-an1,WANG Shu-ling1,LIU Jia1
1.Department of Rehabilitation Medicine,Mawangdui Hospital of Hunan Province,Changsha,Hunan 410016,China;2.the Second Xiangya Hospital of Central South University,Changsha,Hunan 410011,China
Correspondence to LIU Jia.E-mail:1270168367@qq.com
Abstract:Objective To investigate the effect of Ser473-Akt phosphorylation in the protection of atorvastatin to cerebral ischemia-reperfusion(I/R)injury in rats.Methods Forty male Sprague-Dawley rats were randomly divided into normal group(n=10),sham group(n=10),I/R group(n=10)and intervention group(n=10).A model of cerebral ischemia-reperfusion in rats was establishied,with ischemia for 2 hours and reperfusion for 72 hours.The normal group and the sham group received no injury.I/R group was administered with normal saline only,and the intervention group received atorvastatin 10mg/kg prepared with normal saline at palinesthesia,24 and 48 hours after reperfusion.All rats were sacrificed 72 hours after reperfusion.HE staining and TUNEL staining were performed in the brain specimens.The expression of Akt and Ser473-Akt in the prefrontal cortex of the brain were detected with Western blotting.Results Compared with I/R group,72 hours after reperfusion,the damage of nerve cells significantly lessened in the intervention group;the apoptosis positive cells significantly reduced in the intervention group(t=-6.014,P<0.001).The expression of Ser473-Akt in prefrontal cortex was higher in I/R group than in the normal group and the sham group(t>20.327,P<0.001),and was higher in the intervention group than in I/R group(t=3.649,P=0.007).Conclusion The Ser473-Akt phosphorylation plays an important role in the protection of atorvastatin in nerve cell through anti-apoptosis of nerve cells,and reducing cerebral I/R injury.
Key words:cerebral ischemia-reperfusion;Ser473-Akt;phosphorylation;atorvastatin;apoptosis;rats
[中图分类号]R743.3
[文献标识码]A
[文章编号]1006-9771(2016)06-0655-05
DOI:10.3969/j.issn.1006-9771.2016.06.007
基金项目:湖南省医药卫生科研计划项目(No.B2010-090)。
作者单位:1.湖南省马王堆医院康复医学科,湖南省老年医学研究所,湖南长沙市410016;2.中南大学湘雅二医院神经内科,湖南长沙市410011。
作者简介:陶希(1981-),男,汉族,安徽枞阳县人,硕士,主治医师,主要研究方向:脑血管病康复的基础和临床。通讯作者:刘佳,女,本科,主任医师,主要研究方向:神经康复。E-mail:1270168367@qq.com。
收稿日期:(2015-12-01修回日期:2016-01-22)

