高效液相色谱法测定土壤中的二氯喹啉酸①
陈 虹,钟 明,唐昊冶,韩 勇,靳 伟
(中国科学院南京土壤研究所土壤与环境分析测试中心,南京 210008)
高效液相色谱法测定土壤中的二氯喹啉酸①
陈虹,钟明,唐昊冶,韩勇,靳伟
(中国科学院南京土壤研究所土壤与环境分析测试中心,南京210008)
摘要:用50 ml甲醇︰0.05 mol/L硼砂溶液(pH = 10)(9︰1,v/v)作为提取剂对20 g(或适量)土壤样品中残留的二氯喹啉酸振荡提取2 h,离心过滤后分取滤液25 ml浓缩,甲醇定容至2 ml,再用滤膜过滤后待测定;高效液相色谱仪(HPLC)以1.0 ml/min的甲醇︰1% 乙酸水溶液(55︰45,V/V)为流动相,柱温45℃,在238 nm的紫外光波长下进行二氯喹啉酸的外标法定量。该方法精密度为6.0%,检出限为0.012 mg/kg,不同类型土壤的加标回收率74.9% ~ 98.8%,能满足有机分析要求。该方法既简捷易操作,又能满足土壤中二氯喹啉酸低残留量的测定。
关键词:高效液相色谱;测定;土壤;二氯喹啉酸

二氯喹啉酸的测定方法主要有液相色谱法[6-7, 10-14, 21-24]、气相色谱法[13, 21]、毛细管电泳法[25]等。其中液相色谱法(HPLC)测定更为广泛,样品前处理较为简单,若为水样只需将其过滤膜后即可直接测定;但会出现低浓度水样测定准确与否这个问题,需浓缩后测定。文献报道采用毛细管电泳分析方法的则很少,其水样的前处理类似于液相色谱。但当采用气相色谱法(GC)测定时,需将二氯喹啉酸提取出来再酯化后才可以测定,前处理复杂,不过GCECD具较高的灵敏度,可以间接测定较低浓度的二氯喹啉酸。
对于土壤、植物等固体样品,前处理则复杂得多,需将二氯喹啉酸以合适的溶剂提取出来后才能进行仪器测定,相关研究文献较少,王一茹等[21]采取硼砂缓冲液直接提取过滤测定的方法,该法所得提取液中二氯喹啉酸浓度低时HPLC法难测准,且高浓度的硼砂盐溶液浓缩难度较大,不适于目标物的浓缩;不过作者对低浓度提取液采取柱富集、洗脱和衍生化后再GC法测定,尽管该法具有检测限低的优点,但过程非常繁琐。陈泽鹏等[12]将硼砂缓冲液与甲醇 1︰2复配后再提取土壤,之后将提取液调成酸性后再用二氯甲烷液液萃取其中的二氯喹啉酸,经浓缩换相后HPLC法测定,此液液萃取法似有不妥,因为二氯喹啉酸是难溶于二氯甲烷的。针对这些问题,本研究仍采用HPLC法,针对土壤样品的前处理过程和仪器测定的相关条件,做了优化,既确保了方法的简捷性,又满足了土壤中二氯喹啉酸较低残留量的测定,并对不同类型的土壤进行加标培养后再测定,来确认该方法的可行性。
1 材料与方法
1.1主要仪器与试剂材料
仪器:超高压液相色谱仪(Shimadzu UFLC-20A,配备二极管阵列检测器(SPD)及荧光检测器(FLD),日本);烘箱(DGG-9240,上海森信实验仪器有限公司);电子天平(精确至0.000 1 g,德国Sartorius公司);电子天平(精确至 0.001 g,上海良平仪器仪表有限公司);振荡器(ZD-16,南京英美尔科技开发有限公司);超纯水机(艾科浦Aquapro,AJY-6000-U上海富雪生物科技有限公司)。
标样及试剂:二氯喹啉酸(甲醇中二氯喹啉酸,二氯喹啉酸标准物质,纯度>99.7%,上海市农药研究所);甲醇(色谱纯,美国Tedia公司);蒸馏水(由本单位所属的开发公司统一制备供应);超纯水(用蒸馏水由纯水机制得);硼砂(分析纯,市售);乙酸(GR,市售)。
液相色谱柱:Agilent(美国),Zorbax SB-C18,4.6 × 250 mm,5 μm。
1.2实验方法
本研究基于以下原理选择该方法,即采用一定量合适的提取剂对土壤样品进行振荡提取,使吸附于土壤样品中的目标物尽量脱附扩散至提取剂中;而后将提取液注入液相色谱仪,进入色谱柱中的混合有机化合物在合适流动相的洗脱下,与液相色谱柱中的固定相以吸附-解吸-吸附-解吸……的方式逐一分离,流出色谱柱,再流入检测器得到各个化合物的电信号值,进而达到复杂混合物的分离与分析。
土壤样品预处理:称取10 g左右(精确至0.000 1 g)新鲜(风干)土壤样品于铝盒中,105℃烘干称重后测得水分。同时称20 g(精确至0.001 g)土壤样品于100 ml的三角瓶中,加入50 ml提取溶剂,并立即封盖,振荡提取。然后将提取液转入离心管4 900 r/min离心8 min,滤纸过滤后分取[26]25 ml清澈提取液旋转蒸发浓缩至约1 ml,再用甲醇定容至2 ml,并用0.45 μm的滤膜过滤后待液相色谱仪测定。
二氯喹啉酸标准溶液: 称取合适量的二氯喹啉酸标准物质,用甲醇超声溶解并定容,得二氯喹啉酸标准储备液。样品测定的同时将购得的二氯喹啉酸标准溶液稀释成合适浓度的标准溶液作为仪器质控样品。
液相色谱仪器分析条件:采用Agilent(美国)液相色谱柱,Zorbax SB-C18,4.6×250 mm,5 μm,参考文献[21]里的流动相条件对样品进行洗脱测定,即流︰动相为甲醇1% 乙酸水溶液(pH ≈ 3.0)(55︰45,v/v),流速为1.0 ml/min,柱温45℃,进样量20 μl,全波长扫描,选取238 nm通道进行外标法峰面积定量。
2 结果与讨论
2.1实验条件优化
2.1.1提取溶剂选择土壤对二氯喹啉酸有一定程度的吸附能力,但属可逆吸附[27]。土壤中残留的二氯喹啉酸可以通过溶剂提取的方式将其解吸出来,但是二氯喹啉酸在水中的溶解度非常小,可溶于部分有机溶剂,如甲醇、乙醇、丙酮等,故需要土壤中二氯喹啉酸的提取溶剂进行优化选择,实验分别选择甲醇、甲醇︰水(9︰1,v/v)、甲醇︰0.05 mol/L 硼砂溶液(pH = 10)(9︰1,v/v)和丙酮 4 种提取溶剂,对同一加标浓度(0.8 mg/kg)的不含二氯喹啉酸的风干 10目土壤样品进行提取,每种提取剂重复 3 次,所得平均回收率结果见图 1。
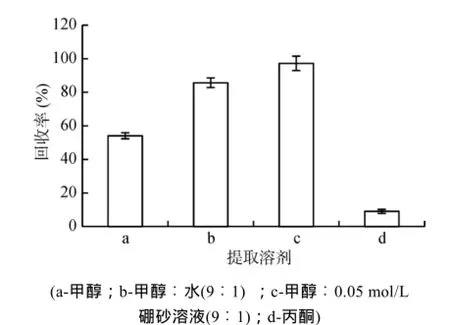
图1 提取溶剂选择(n = 3)Fig. 1 Extraction solvent for choice
由图1︰,溶剂甲醇0.05 mol/L硼砂溶液所提取的回收率最高,平均回收率可达97.3%,且重复性较好,完全满足样品的有机分析要求(通常认为绝对回收率能达到80% ~ 120% 即可,最低不得低于50%);提取剂甲醇︰水所提取的二氯喹啉酸的回收率次之,为85.7%,也能满足有机分析的要求;而其他两种提取剂的提取率则均较低,甲醇为54.1%,丙酮为9.04%。故选提取剂甲醇︰0.05 mol/L 硼砂溶液(pH = 10) (9︰1,v/v)最好。
二氯喹啉酸属弱酸性物质,其pKa = 4.35,当提取剂加入土壤中后,其中pH为10的硼砂溶液对土壤的pH有调节作用,使体系处于弱碱性环境,而二氯喹啉酸在碱性环境下,会转化为盐的形式存在,在水中的溶解性得以较大提高,故提取剂︰甲醇0.05 mol/L硼砂溶液的回收率较高。选择甲醇︰0.05 mol/L硼砂溶液的配比为 9︰1(v/v),则是考虑到若提取剂中的硼砂水溶液过多,不利于提取液的浓缩;特别是对于低浓度土壤样品,浓缩液量大时可以加快浓缩速度,提高工作效率,所以选择该配比9︰1(v/v)。
2.1.2振荡时间优化在振荡提取时,二氯喹啉酸从土壤中解吸并扩散到溶剂中需要一段时间,这段时间的长短,对其扩散到溶剂中的量会有影响,若太短,则会扩散不完全,若太长,一是资源的浪费,二是可能会带来损失,故需对振荡时间进行优化选择,寻求合适的振荡时间。实验选择最佳提取溶剂甲醇︰0.05 mol/L硼砂溶液(pH = 10)(9︰1,v/v)对同一水平加标土壤样品分别振荡提取 0.5、1、2、3 h,每一个振荡时长重复 3 个样品,经液相色谱仪测得平均回收率如图 2。

图2 振荡时间优化(n = 3)Fig. 2 Optimal shaking time
由图2可以看出,振荡提取2 h,所得的二氯喹啉酸的平均回收率最高,且相对标准偏差最小,样品提取的重复性较好,故选择2 h作为振荡提取最佳时长。
2.1.3流动相参考李丽春、王一茹等[6, 13, 21-22]的研究,本研究同样选取甲醇和 1% 乙酸水溶液作为流动相,经标样及样品反复测试优化选择后发现,在本研究条件下,流动相甲醇︰1% 乙酸水溶液以 55︰45(v/v)等梯度洗脱,流速为 1.0 ml/min 时,二氯喹啉酸标准样及土壤提取液的出峰较好,故选择该流动相配比。但当测定土壤提取液时,如果二氯喹啉酸出峰处有干扰峰,则需进行梯度洗脱,以期将干扰峰与二氯喹啉酸分离开,便于对二氯喹啉酸准确定性与定量。2.1.4检测波长采用二极管阵列检测器,对二氯喹啉酸进行 190 ~ 400 nm 全波长扫描,在保留时间4.6 min 的出峰处得到此时的紫外吸收光谱图(图 3)。由图 3 可见,在 230 ~ 238 nm 处二氯喹啉酸均能得到较好的吸收,吸收峰强度相差不大。但考虑到溶剂及流动相的吸收效应,紫外光波长 230 nm 时二氯喹啉酸的紫外吸收强度尽管较大些,但溶剂及流动相的吸收也很大,故不选。而选用 235 nm 时,目标物吸收峰强度及溶剂吸收峰强度均居中,238 nm 时目标物紫外吸收峰强度开始处于下行区,比 235 nm 时吸收要弱一些,但溶剂等吸收效应则较低(图 4)。二氯喹啉酸在这 3 个波长下的吸收强度相差并不大,综合考虑,本研究选取 238 nm 作为二氯喹啉酸定性定量时的检测波长。
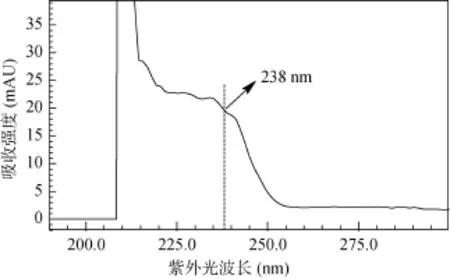
图3 二氯喹啉酸紫外吸收光谱图Fig. 3 Ultraviolet absorption spectra of Quinclorac
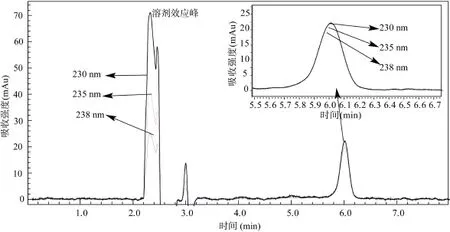
图4 不同波长紫外光下二氯喹啉酸(1.5 mg/L)的液相色谱图Fig. 4 Liquid chromatogram of Quinclorac (1.5 mg/L) under different wavelength ultraviolet
2.2标准曲线及精密度
标准曲线:用电子天平(精确至 0.000 1 g)称取适量的二氯喹啉酸标准品,甲醇超声溶解并定容至 50 ml,即得二氯喹啉酸标准储备液,精确浓度值由具体称样量及标准品的纯度含量计算而得。本研究所配标液为150 mg/L,分别移取合适的量稀释定容后得浓度为0.6、1.5、3.0、4.5 和 6 mg/L的标准曲线系列溶液,并以外标法校准样品中二氯喹啉酸的含量。液相色谱仪测定后所得校准曲线方程及线性相关性见图 5,曲线的线性相关系数 r > 0.999,完全满足分析要求。
仪器精密度:连续测定 1 mg/L 的二氯喹啉酸标准溶液 7 次,对其峰面积进行统计,得仪器精密度为 2.0% < 3%,满足 JJG 705-2014 HPLC 二极管阵列检测器精密度校准要求,故满足有机分析要求,分析结果是可靠的。
方法精密度:连续全流程分析 0.2 mg/kg 的二氯喹啉酸加标土壤样品 6 次,对校准后所得样品的浓度进行统计,得方法精密度为 6.0%,重复性较好,分析结果可靠。
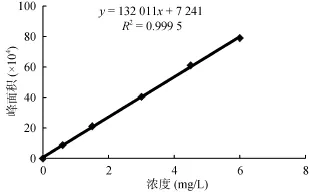
图5 二氯喹啉酸标准曲线Fig. 5 Standard curve of Quinclorac
检出限:以S/N = 3,并与较低的相近浓度的校准样信号值相比较,算得仪器的检出限为0.06 mg/L,根据样品的全部处理过程算得该方法的土壤检出限为0.012 mg/kg,故该方法完全满足土壤中二氯喹啉酸的测定。
2.3不同类型土壤样品的加标回收
采用本研究优化的方法对不同类型的土壤样品(空白均不含二氯喹啉酸残留)进行加标回收实验,结果见表1。
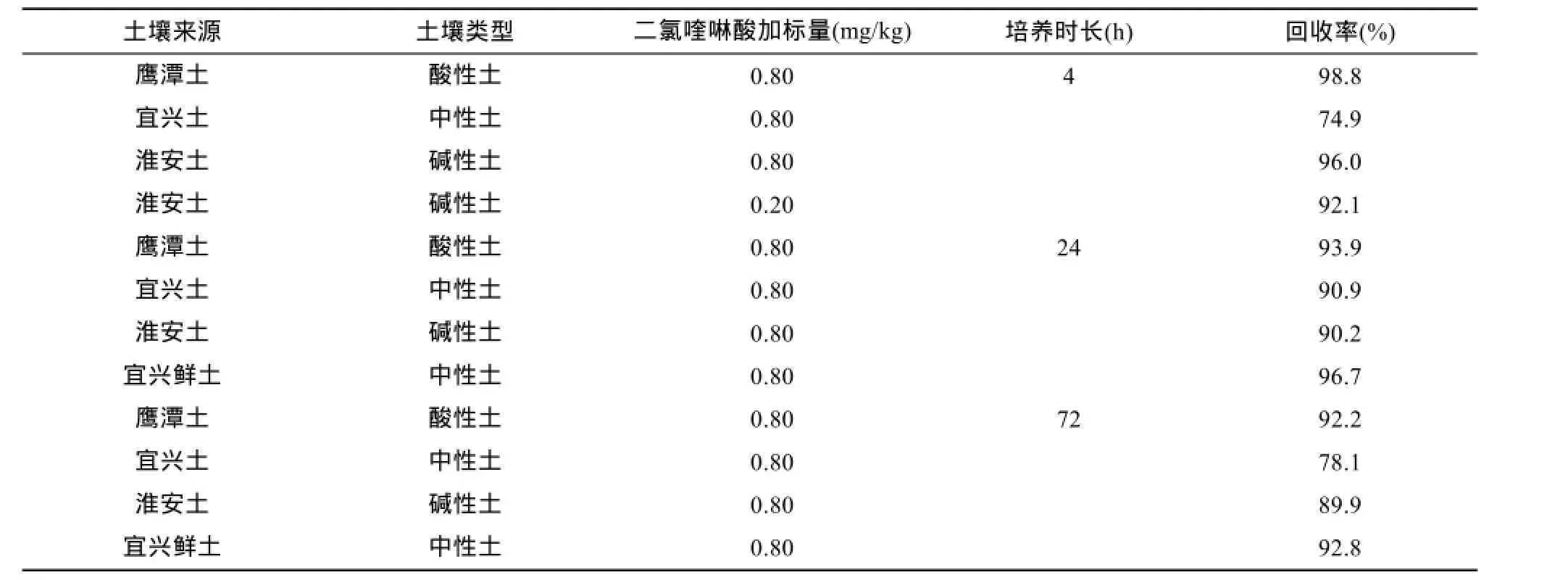
表1 不同类型土壤样品加标回收率(n = 3)Table 1 Recovery rates of Quinclorac in different type soil samples
由表1可看出,除宜兴风干土这一中性偏弱酸性土,其加标土壤样品在培养4 h和72 h后回收率略偏低(但均>50%,且接近 80%),其他不同酸度的加标土壤在培养不同的时长后,依方法所测得的加标回收率均可达90% 左右,表明此方法可行。而对宜兴新鲜土壤样品进行加标培养24 h和72 h 后,二氯喹啉酸的回收率均>90%,表明本方法对鲜土和风干土均适用。对淮安碱性土进行低浓度加标回收实验,二氯喹啉酸的回收率为92.1%,结果良好,本法对低浓度土壤样品仍适用。实际分析时,当样品中二氯喹啉酸残留量低时,可适当地增加称样量,若残留量高,则可适当减少称样量。
2.4实际样品的测定
为验证该方法的实用性,对送样者送来的实际样品进行分析,结果见表2。由表2见,该批次样品二氯喹啉酸的残留量均较低,其中S4样品重复3次,其RSD% = 9%,符合有机样品分析要求。而根据李儒海等[9]研究发现当二氯喹啉酸施药量在 150 g/hm2时,对后茬作物有轻度药害;谢建平等[5]认为施药量在25 g/hm2以内是安全的,最多不超过50 g/hm2;而李丽春等[6]分析数据表明,发生药害的土壤的二氯喹啉酸的残留量为0.130 6 mg/kg。据此以土壤深度为50 cm,土壤密度约2.7 Mg/m3计,并且不考虑二氯喹啉酸的降解,以最大施入量50 g/hm2考虑,土壤中二氯喹啉酸的安全残留量限值应≤0.06 mg/kg,该残留限值较低,故样品S2、S3、S4和S5均有药害的高度可能性,此类土壤不宜种植对二氯喹啉酸敏感的后茬作物如茄科、豆科等。图6是S2土壤样品提取液的液相色谱图。
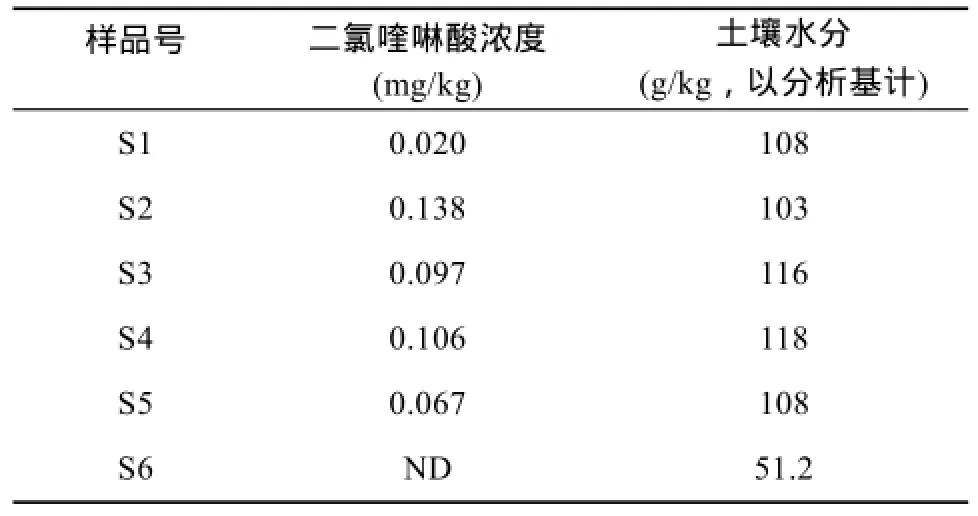
表2 土壤样品中二氯喹啉酸含量Table 2 Quinclorac contents in soil samples

图6 土壤样品S2提取液液相色谱图Fig. 6 Liquid chromatogram of the extracts from soil sample S2
3 结论
综上所述,本研究所建立的土壤中二氯喹啉酸残留量检测方法精密度为6%,检出限为0.012 mg/kg,该方法对不同类型的土壤加标回收率为 74.9% ~ 98.8%,满足相关分析要求,方法适用范围广;且该方法不仅简捷,还可以满足土壤中低浓度二氯喹啉酸的测定。故最终确定为:用50 ml甲醇 : 0.05 mol/L硼砂溶液(pH = 10)(9 : 1,v/v)对20 g(或适量)土壤样品振荡提取2 h,然后离心过滤,分取滤液25 ml浓缩、甲醇定容至2 ml,滤膜过滤后待HPLC测定。HPLC仪器测定条件为:以1.0 ml/min的甲醇 : 1%乙酸水溶液(55 : 45,v/v)为流动相,柱温45℃,选取238 nm的紫外光波长进行外标法定量。
参考文献:
[1] 张庆富, 黄松青, 张万良, 等. 二氯喹啉酸残留分析方法研究进展[J]. 现代农业科技, 2013(12): 149-150, 156
[2] 宋稳成, 杨仁斌, 郭正元, 等. 二氯喹啉酸除草剂残留与降解研究进展[J]. 世界农药, 2005, 27(3): 42-44
[3] Koo S J, Neal J C, Ditomaso J M. Mechanism of action and selectivity of Quinclorac in grass roots[J]. Pesticide Biochemistry and Physiology, 1997, 57: 44-53
[4] Norsworthy J K, Bangarwa S K, Scott R C, et al. Use of propanil and quinclorac tank mixtures for broadleaf weed control on rice (Oryza sativa) levees[J]. Crop Protection, 2010, 29: 255-259
[5] 谢建平, 练德进. 二氯喹啉酸对水稻秧苗的药害及预防措施[J]. 湖北植保, 2013(1): 45-46
[6] 李丽春, 陈泽鹏, 张万良, 等. 二氯喹啉酸在土壤、畸形烟叶和烤烟中残留量的比较分析[J]. 农药, 2012, 51(2):127-129, 152
[7] Lamoureux G L, Rusness D G. Quinclorac absorption, translocation, metabolism, and toxicity in leafy Spurge(euphorbia esula). [J] Pesticide Biochemistry and Physiology, 1995, 53: 210-226
[8] 黄翅, 罗坤. 降解菌J3对茄科作物二氯喹啉酸药害的修复作用[J]. 现代农业科技, 2015(12): 131, 139
[9] 李儒海, 褚世海. 二氯喹啉酸对水稻后茬作物的安全性研究[J]. 湖北农业科学, 2013, 52(23): 5 749-5 751
[10] Pareja L, Perez-Parada A, Aguera A, et al. Photolytic and photocatalytic degradation of quinclorac in ultrapure and paddy field water: Identification of transformation products and pathways[J]. Chemosphere, 2012, 87(8): 838-844
[11]张倩, 郭伟, 宋超, 等. 二氯喹啉酸在不同土壤中的降解规律及其影响因子[J]. 中国烟草科学, 2013, 34(6) 83-88
[12] 陈泽鹏, 王静, 万树青, 等. 烟区土壤残留二氯喹啉酸的消解动态[J]. 农药, 2007, 46(7): 479-480, 483
[13] 王一茹, 刘长武, 牛成玉, 等. 二氯喹啉酸在稻田水、土壤和作物中残留动态研究[J]. 环境科学, 1996, 17(1):27-30
[14] 刘春梅, 万凯, 冯莉, 等. 二氯喹啉酸在水稻田环境中的消解动态研究[J]. 广东农业科学, 2014(8): 206-208, 213
[15] 毛官杰, 孟南, 刘华山, 等. 不同微生物制剂对二氯喹啉酸胁迫下烟草根际土壤生物活性的影响[J]. 江西农业学报, 2014, 26(5): 25-28
[16] 张世敏, 刘晓霞, 徐淑霞, 等. 二氯喹啉酸对土壤微生物的影响[J]. 江苏农业学报, 2012, 28(3): 538-541
[17] 张妤, 郭爱玲, 崔烨, 等. 培养条件下二氯喹啉酸对土壤微物群落结构的影响[J]. 生态学报, 2015, 35(3):849-857
[18] 潘光伟, 孟南, 刘华山, 等. 外源菌肥对二氯喹啉酸危害下烟草根际土壤微生物量及呼吸速率的影响[J]. 河南农业科学, 2014, 43(11): 45-48
[19] 黄国联, 张顺, 许家来, 等. 烟田二氯喹啉酸污染的修复技术研究进展[J]. 安徽农业科学, 2014, 42(6): 1 678-1 680, 1690
[20] 钟美娥, 李季, 龚道新, 等. 均相 Co(II)/PMS体系对二氯喹啉酸的降解特性研究[J]. 中国环境科学, 2015, 35(11): 3 282-3 287
[21] 王一茹, 刘长武, 牛成玉, 等. 二氯喹啉酸及其代谢物在稻田水土作物中的气谱和液谱残留分析方法研究[J].农业环境保护, 1996, 15(3): 102-106
[22] 刘姗. 二氯喹啉酸的高效液相色谱法测定[J]. 福建分析测试, 2012, 21(2): 48-51
[23] 李来生. 高效液相色谱法测定除草剂中二氯喹啉酸的含量[J]. 分析试验室, 1997, 15(5): 49-51
[24] 蒙若兰, 胡德斌. 高效液相色谱法测定二氯喹啉酸[J].重庆建筑大学, 1999, 21(5): 103-105
[25] 贾菲, 高贵, 郑良玉. 除草剂二氯喹啉酸的毛细管电泳分析[J]. 分析化学, 2008, 36(10): 1 440-1 442
[26] 陈虹, 韩勇, 钟明, 等. GC/ECD法测定土壤中残留的酰胺类除草剂[J]. 化学试剂, 2010, 32(12): 1 103-1 107
[27] 欧阳彬, 郭正元, 蔡智华. 二氯喹啉酸及基代谢体在3种土壤中的吸附[J]. 湖南农业大学学报(自然科学版), 2006, 32(1): 73-76
Determination of Quinclorac in Soil Samples with High Performance Liquid Chromatography (HPLC)
CHEN Hong, ZHONG Ming, TANG Haoye, HAN Yong, JIN Wei
(Soil and Environment Analysis Center, Institute of Soil Science, Chinese Academy of Sciences, Nanjing210008, China)
Abstract:Quinclorac is an effective herbicide commonly used in rice plantation. But Quinclorac residue in soil probably brings teratogenesis to some Quinclorac sensitive rotation crops, like Solanaceae plants, Leguminosae emblements. So the residue in soil should be accurately detected. Quinclorac residue in soil sample was extracted on a to-and-fro shaker for 2 hours with 50 ml extractant, which was the mixture of methanol and 0.05 mol/L borax solution (pH = 10) at the ration of 9︰1 (v/v). The extracts was centrifuged and subsequently filtered. 25 ml filtrate was concentrated to about 1 ml and then diluted to 2 ml with methanol for high performance liquid chromatography (HPLC) determination. Content of Quinclorac in extracts was calculated according to external standard method by HPLC under optimized condition. Briefly, 1.0 ml/min methanol: 1% (v/v) acetic acid solution (55︰45, v/v) was selected as mobile phase to elute the target compound for ultraviolet (UV) detection at 238 nm wavelength. The Quinclorac detection limit of this method was 0.012 mg/kg; the recovery rates of different type soil samples lingered in the scope of 74.9% - 98.8% with precision being 6.0% (n=6). All demonstrate that the method meets the requirements of organic analysis. The method is relatively simple and easy to operate. As well as it can be used to analyze the low concentration of Quinclorac residue in soil sample.
Key words:HPLC; determination; Soil sample; Quinclorac
中图分类号:O65
DOI:10.13758/j.cnki.tr.2016.02.019
基金项目:①中国科学院南京土壤研究所所基金支撑课题项目(20752010028)资助。
作者简介:陈虹(1977—),女,江苏沭阳人,硕士,工程师,主要从事仪器分析及研究工作。E-mail: chenhong@issas.ac.cn

