中心性肥胖人群胰岛素抵抗和颈动脉内膜中层厚度的相关性研究
张 楠,高政南,牛 敏,罗 兰,李 珅
(大连医科大学附属大连市中心医院 内分泌科,辽宁 大连 116033)
中心性肥胖人群胰岛素抵抗和颈动脉内膜中层厚度的相关性研究
张楠,高政南,牛敏,罗兰,李珅
(大连医科大学附属大连市中心医院 内分泌科,辽宁 大连 116033)
[摘要]目的探讨中心性肥胖人群颈动脉内膜中层厚度与胰岛素抵抗的相关关系。方法采用REACTION研究中在大连地区参加调查的10207人,选取其中5029例非糖尿病的中心性肥胖人群作为本研究的研究对象。所有受试者均测量身高、体重、腰围、臀围、收缩压、舒张压,同时测定空腹血糖(FPG)、75 g OGTT 2h血糖(2hPG)、空腹胰岛素(FINS)、糖化血红蛋白(HbA1c)、血尿酸(UA)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)及高密度脂蛋白(HDL-C)、颈动脉内膜中层厚度(CIMT),计算腰臀比、BMI及稳态模型胰岛素抵抗评估指数(HOMA-IR)。根据HOMA-IR值将研究人群分为胰岛素抵抗组(HOMA-IR≥1.73)3247例和非胰岛素抵抗组(HOMA-IR<1.73)1782例。比较上述各指标在两组间的差异,研究HOMA-IR与颈动脉内膜中层厚度的相关关系。结果(1)胰岛素抵抗和非胰岛素抵抗两组间年龄、CIMT、收缩压、FPG、2hPG、HbA1c、UA、LDL-C、HDL-C、BMI等指标差异存在显著性意义(P<0.05);(2)偏相关分析显示,在控制年龄、HDL-C、LDL-C、TC、TG、UA及血压等因素的影响后,HOMA-IR仍与CIMT呈正相关(r=0.033, P=0.007);Logistic回归分析显示, 年龄、HOMA-IR、腰围、LDL-C是CIMT的独立危险因素(P<0.05)。HDL-C是 CIMT的保护因素(P<0.05)。结论胰岛素抵抗是非糖尿病的中心性肥胖人群颈动脉内膜增厚的独立危险因素。
[关键词]中心性肥胖;颈动脉内膜中层厚度;胰岛素抵抗
[引用本文]张楠,高政南,牛敏,等.中心性肥胖人群胰岛素抵抗和颈动脉内膜中层厚度的相关性研究[J].大连医科大学学报,2016,38(2):162-164,193.
随着社会、经济的发展,肥胖已成为一种严重威胁人民群众健康的社会公共卫生问题。而胰岛素抵抗(insulin resistance,IR)被视为肥胖、2型糖尿病、糖耐量异常、高血压、高脂血症及动脉硬化的共同危险因素[1]。动脉粥样硬化(atherosclerosis,AS)是一种全身动脉广泛受累的病理状态,会累及冠状动脉、颈动脉等,最终发展会导致冠心病、脑卒中等血管疾病[2]。颈动脉内膜中层厚度(carotid intima-media thickness,CIMT)增厚是动脉粥样硬化的早期诊断标准,其变化与大血管病变密切相关[3-5]。目前,不少对2型糖尿病患者的研究已证实,IR与CIMT增厚密切相关[6]。但是关于非糖尿病的中心性肥胖人群IR与CIMT的相关性研究尚较少,本研究旨在探讨非糖尿病的中心性肥胖人群IR和CIMT的相关关系,为此类人群动脉硬化疾病的防治提供依据。
1资料与方法
1.1研究对象
采用REACTION研究中在大连地区参加调查的10207人,根据2007年《中国成人血脂异常防治指南》的诊断标准(腰围:男性≥90 cm,女性≥ 85 cm)作为中心性肥胖的依据,收集符合标准的人群共5029例作为研究对象,年龄在40~80岁,其中男性1257例,女性3772例。
1.2方法
向参加普查者签订知情同意书并发放调查问卷,由专人测量身高、体重、腰围、臀围、血压,采集隔夜空腹12 h以上右上臂静脉血,测定空腹血糖(FPG)、空腹胰岛素(FINS)、糖化血红蛋白(HbA1C)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)及血尿酸(UA),行75 g口服葡萄糖耐量试验测定2 h血浆葡萄糖(2hPG)水平。计算体重指数(BMI)、腰臀比及HOMA-IR(FINS×FPG/22.5)。采用PHILPS公司IU22型彩色多普勒超声诊断仪(美国),对研究对象测量CIMT[7]。将入选人群根据HOMA-IR值分为胰岛素抵抗组(HOMA-IR≥1.73)和非胰岛素抵抗组(HOMA-IR<1.73)[8],对两组间上述各临床指标进行比较,同时研究HOMA-IR与CIMT的相关关系。
1.3统计学方法
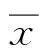
2结果
2.1两组各项指标检测结果比较
入选对象5029例中,胰岛素抵抗组年龄、CIMT、收缩压、腰围、腰臀比、FPG、2hPG、HbA1c、UA、TG、TC、LDL-C、BMI较非胰岛素抵抗组升高,而HDL-C较非胰岛素抵抗组降低,差异均有显著性义(P<0.05),见表1。
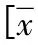
表1 两组人群的一般临床资料比较
1)与非胰岛素抵抗组比较,P<0.001;2)与非胰岛素抵抗组比较,P<0.01。除UA为非正态分布以外,其余均为正态分布
2.2CIMT增厚的相关因素分析
偏相关分析显示,在控制年龄、血压、血尿酸、HDL-C及LDL-C等因素的影响后,HOMA-IR与CIMT呈正相关(r=0.033,P=0.007);以CIMT为因变量,年龄、HOMA-IR、BMI、腰围、LDL-C、HDL-C、HbA1c、收缩压及UA为自变量进行多因素Logistic回归分析,结果显示,年龄、HOMA-IR、腰围、LDL-C是CIMT增厚的独立危险因素(P< 0.05),HDL-C是CIMT增厚的保护因素(P<0.05),见表2。
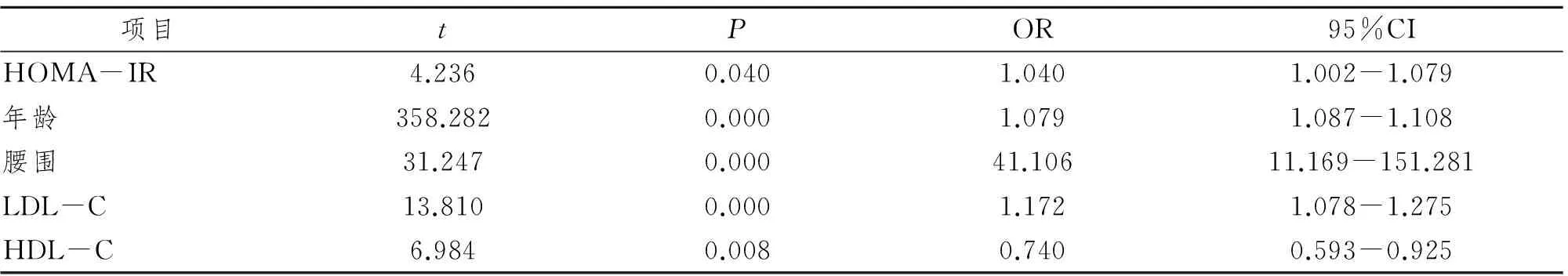
表2 以CIMT为因变量的Logistic回归
3讨论
世界卫生组织(WHO)警告称,超重和肥胖是全球引起死亡的第五大风险[3]。大量证据表明,肥胖可导致IR,从而并发2型糖尿病、糖耐量异常、高血压、高脂血症及动脉硬化等代谢疾病。而脂肪组织的存储部位和存储形式在肥胖相关性疾病的发生发展中起着重要的作用,内脏脂肪的增加是多种代谢性疾病的主要危险因素。研究表明,相比皮下脂肪组织,内脏脂肪组织具有更多的心血管危险因素。已有研究发现,随着单位体表面积的内脏组织脂肪体积的增加,机体葡萄糖的处理能力逐渐下降,提示胰岛素抵抗增加。而随着皮下脂肪体积的增加,体内葡萄糖的处理能力无明显改变,提示内脏肥胖与胰岛素抵抗相关[9]。
本研究发现,胰岛素抵抗组CIMT值明显高于非胰岛素抵抗组,且年龄、收缩压、腰围、腰臀比、FPG、2hPG、HbA1c、UA、TG、TC、LDL-C、BMI均明显升高,而HDL-C明显降低。与靳京美等[10]的研究相一致。同时本研究经矫正年龄、血压、血尿酸、HDL-C及LDL-C等明确影响CIMT的因素后发现,CIMT与HOMA-IR呈正相关,说明胰岛素抵抗可促进动脉硬化发生、发展。此外,本研究Logistic回归分析显示,年龄、HOMA-IR、腰围、LDL-C是CIMT增厚的独立危险因素,HDL-C是CIMT增厚的保护因素。这一结果也与文献报道一致[11-13]。进一步提示中心性肥胖人群颈动脉硬化的发生与胰岛素抵抗密切相关。研究表明,肥胖时由于脂肪细胞肥大及数量增多,导致其分泌激素的表达增强或减弱,从不同层次影响胰岛素的效应,从而导致IR。研究发现,脂肪细胞分泌的游离脂肪酸、瘦素、肿瘤坏死因子-α(TNF-α)、抵抗素、脂联素等与IR关系密切。而过氧化物酶体增殖体激活物受体γ(PPAR-γ)亦是肥胖导致IR的重要机制[14]。而IR及其所伴发的高胰岛素血症可能通过各种机制导致动脉粥样硬化,其中主要包括:(1)引起血管内皮细胞损伤,导致其功能紊乱;(2)促使血管平滑肌细胞增生;(3)造成脂质代谢紊乱,加速动脉粥样硬化的进程[15-16]。总之,肥胖,特别是中心性肥胖已成为严重影响人们的生活质量,并且其发展形势不容乐观。预防超重和肥胖是控制颈动脉硬化的关键,而在其中发挥极为重要纽带作用的IR,值得今后进行更加深入的研究。
参考文献:
[1] 曾龙驿.肥胖与胰岛素抵抗[J].中华医学杂志,2012,92(30):2091-2092.
[2] Folsom AR, Evans GW,Carr JJ,et al. Association of traditional and nontraditional cardiovascular risk factors with coronary artery calcification [J]. Angiology,2004,55(6):613-623.
[3] Singh AS,Atam V,Jain N, et al.Association of carotid plaque echogenicity with recurrence of ischemic stroke[J].N Am J Med Sci,2013,5(6):371-376.
[4] Lundervik M,Fromm A,Haaland ØA,et al.Carotid intima-media thickness—a potential predictor for rupture risk of intracranial aneurysms[J].Int J Stroke,2014,9(7):866-872.
[5] George JM,Bhat R,Pai KM,et al.The carotid intima media thickness:a predictor of the clinical coronary events[J].J Clin Diagn Res,2013,7(6):1082-1085.
[6] Fujiwara S,Emoto M,Komatsu M,et al.Arterial wall thickness is associated with insulin resistance in type 2 diabetic patients[J].J Atheroscler Thromb,2003,10(4):246-252.
[7] Polak JF,Backlund JY,Cleary PA,et al. Progression of carotid artery intima-media thickness during 12 years in the Diabetes Control and Complications Trial/Epidemiology of
Diabetes Interventions and Complications (DCCT/EDIC)study[J]. Diabetes,2011,60(2):607-613.
[8] Furuhashi M,Ura N,Nakata T,et al.Insulin sensitivity and lipid metabolism in human CD36 deficiency[J]. Diabetes Care,2003,26(2):471-474.
[9] Banerji MA,Lebowitz J,Chaiken RL,et al. Relationship of visceral adipose tissue and glucose disposal is independent of sex in black NIDDM subjects [J]. Am J Physiol,1997,273(2):E425-E432.
[10] 靳京美,刘青,尤欣. 2型糖尿病胰岛素抵抗与颈动脉内膜厚度相关性分析[J]. 中国老年学杂志,2012,32(7):1355-1356.
[11] 刘秀娟,辛绍南,肖秋,等. 南昌地区健康军人颈动脉内膜中膜厚度和粥样斑块形成的危险因素分析[J]. 中国动脉硬化杂志,2008,16(5):403-405.
[12] 赵江波,王蓓,俞力,等.肥胖者颈动脉内膜中层厚度和血铁蛋白Apelin及胰岛素抵抗关系的研究[J].中国糖尿病杂志,2012,20(4):277-278.
[13] Maher V,O' Dowd,M Carey M,et al. Association of central obesity with early carotid intima-media thickness is independent of that from other risk factors [J]. Int J Obes(Lond), 2009,33(1):136-143.
[14] 杨凌辉,邹大进.肥胖致胰岛素抵抗的机制[J]. 中华内分泌代谢杂志,2002,18(3):246-248.
[15] 马芳义,魏芳晶. 胰岛素抵抗与动脉粥样硬化的关系研究进展[J]. 医学综述,2010,16(14):2112-2114.
[16] Fujii N,Tsuchihashi K,Sasao H,et al. Insulin resistance functionally limits endothelium-dependent coronary vasodilation in nondiabetic patients[J].Heart Vessels,2008,23(1):9-15.
Relationship between insulin resistance and carotid intima-media thickness in central obesity patients
ZHANG Nan,GAO Zheng-nan,NIU Min,LUO Lan,LI Shen
(DepartmentofEndocrine,DalianMunicipalCentralHospitalAffiliatedofDalianMedicalUniversity,Dalian116033,China)
[Abstract]Objective To analyze the relationship between insulin resistance and carotid intima-media thickness (CIMT) in central obesity patients. Methods We recruited 5029 nondiabetic central obesity from the population of the 10207 data of REACTION research in Dalian. All participants were tested for their anthropometric indices (height,weight,waist circumference, hip circumference,systolic/diastolic pressure) and biochemical indices (fasting plasma glucose (FPG),2 h postprandial blood glucose (2hPG),fasting insulin (FINS),glycosylated hemoglobin (HbA1c),uric acid (UA),triglycerides (TG),total cholesterol (TC),low density lipoprotein (LDL-C),high-density lipoprotein (HDL-C) and carotid intima-media thickness (CIMT)). Furthermore, BMI, waist-to-hip ratio as well as the HOMA-IR were calculated. Participants were then stratified into two groups according to their HOMA-IR:insulin-resistant group(HOMA IR≥1.73,n=3247)and non insulin-resistance group(HOMA IR<1.73,n=1782). We compared the differences with indices between the two groups and analyzed relationship between HOMA-IR and CIMT. Results (1) There was statistically significant difference (P<0.05) in all indices between two groups stratified by HOMA-IR. (2) The partial correlation analysis showed that HOMA IR(r=0.033, P=0.007)was positively correlated with CIMT when excluding the influence of age, blood pressure, UA, LDL-C and HDL-C. Logistic regression analysis showed that age,HOMA IR,waist circumference and LDL-C were independent risk factors of CIMT(P<0.05). HDL-C was the protection factor of CIMT(P<0.05). Conclusion Insulin resistance is the independent risk factor of carotid intima-media thickening in nondiabetic central obesity.
[Key words]nondiabetic central obesity;insulin resistance;carotid intima-media thickness
作者简介:张 楠(1982-),辽宁普兰店人,主治医师。E-mail:zhangnan_1982@126.com 通信作者:高政南,主任医师。E-mail:gao2008@163.com
doi:论著10.11724/jdmu.2016.02.15
[中图分类号]R589.9
[文献标志码]A
文章编号:1671-7295(2016)02-0162-03
(收稿日期:2015-12-24;修回日期:2016-03-20)

