共表达猪流行性腹泻病毒S1与GM-CSF蛋白重组腺病毒的构建
赵攀登,董建国,邓同炜,陈 益,徐耀辉,蒋增海,卢建洲,王晓晔,王 岩*
(1.河南牧业经济学院 动物医学院,河南郑州 450046;2.信阳农林学院 牧医工程学院,河南信阳 464000;3.广西大学 动物科学技术学院,广西南宁 530004)
共表达猪流行性腹泻病毒S1与GM-CSF蛋白重组腺病毒的构建
赵攀登1,董建国2,邓同炜1,陈益1,徐耀辉1,蒋增海1,卢建洲1,王晓晔3*,王岩1*
(1.河南牧业经济学院 动物医学院,河南郑州 450046;2.信阳农林学院 牧医工程学院,河南信阳 464000;3.广西大学 动物科学技术学院,广西南宁 530004)
摘要:为构建表达猪流行性腹泻病毒(PEDV)S1与GM-CSF融合基因的重组腺病毒,通过FMDV的2A基因序列做为Linker将密码子优化的S1基因和粒细胞巨噬细胞集落刺激因子(GM-CSF)基因连接。构建重组穿梭质粒pShuttle-GM-CSF 2A-S1(m),并将其电转化至含有腺病毒骨架载体pAdEasy-1的大肠埃希菌BJ5183感受态细胞中,通过同源重组制备重组腺病毒质粒pAd-GMCSF2A-S1(m)。重组腺病毒质粒经PacI线性化后转染HEK-293A细胞,获得重组腺病毒rAd- GMCSF2A-S1。间接免疫荧光和Western blot结果显示,S1和GMCSF蛋白在重组腺病毒感染的HEK-293A细胞中获得表达。该重组腺病毒的制备为PEDV重组活载体疫苗的研究奠定了基础。
关键词:猪流行性腹泻病毒;S1基因;粒细胞巨噬细胞集落刺激因子;重组腺病毒
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的以腹泻、呕吐、脱水为特征的一种肠道急性传染病[1]。自2010年冬天开始,PED在中国大范围流行,此次暴发具有感染性强、流行性广、致死率高、不易防控等特点,给我国的养猪业带来了巨大的经济损失[2]。
PEDV属于冠状病毒,是有囊膜的单股正链RNA病毒[3]。PEDV编码4个结构蛋白,即S蛋白(spike protein)、E蛋白(small member protein)、M蛋白(member protein)和N蛋白(nucleoprotein)。S蛋白是Ⅰ型膜蛋白,在病毒结合细胞、诱导产生中和抗体、促进病毒和细胞融合、促进病毒从细胞表面释放等方面发挥着重要的作用,是新型疫苗研究的候选蛋白[4]。
粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)属于造血生长因子,在机体免疫调节中起着重要作用,能够刺激免疫细胞产生细胞因子,增加黏附分子和协同刺激分子的表达,增强抗原递呈细胞功能,增加淋巴细胞MHC分子表达。已有研究报道,GM-CSF能够增强疫苗的免疫效果,具有免疫佐剂的功能[5-8]。
人5型腺病毒载体已被广泛用于疫苗开发,是一种安全有效的活病毒载体。由于其基因组缺失E1区,重组腺病毒不能自主复制,安全性比较高[9]。本研究利用腺病毒表达系统,构建了由FMDV 2A蛋白串联表达GM-CSF和PEDV S1蛋白的重组腺病毒,为PEDV重组病毒活载体疫苗的研究奠定基础。
1材料与方法
1.1材料
1.1.1菌株、质粒和细胞大肠埃希菌BJ5183菌株、pShuttle-CMV质粒、pAdEasy-1质粒、HEK-293A细胞均购自QbioGen公司;经密码子优化的S1(m)质粒、含有GM-CSF和2A序列的pShuttle-GMCSF2A质粒、E.coliDH5α由本实验室保存。
1.1.2试剂T4 DNA连接酶、限制性内切酶、高保真DNA聚合酶primerSTAR购自Takara公司;质粒提取试剂盒购自QIAGEN公司;DNA回收试剂盒购自BIOMEGA公司;辣根过氧化物酶标记兔抗鼠IgG、FITC-羊抗兔IgG购自博士德公司;PacI和PmeI购自New England Biolabs公司;反转录试剂盒购自Invitrogen公司;TransFastTMTransfection Reagent 购自Promega公司;GM-CSF蛋白多抗和PEDV S1蛋白多抗由本实验室制备保存。
1.2方法
1.2.1重组腺病毒穿梭载体的构建以S1(m)质粒为模板,引物Ad-S1(m)-F/Ad-S1(m)-R(表1)经PCR扩增目的片段S1(m);以pShttle-GMCSF2A质粒为模板,引物Ad-GMCSF2A-F/ Ad-GMCSF2A-R(见表1)经PCR扩增含有FMDV 2A基因的GM-CSF基因(GMCSF2A)。将目的基因GMCSF2A和S1(m)定向克隆至pShuttle-CMV载体获得重组穿梭质粒,转化至DH5α感受态细胞,将疑似克隆进行测序,正确的命名为pShuttle-GMCSF2A-S1(m)。
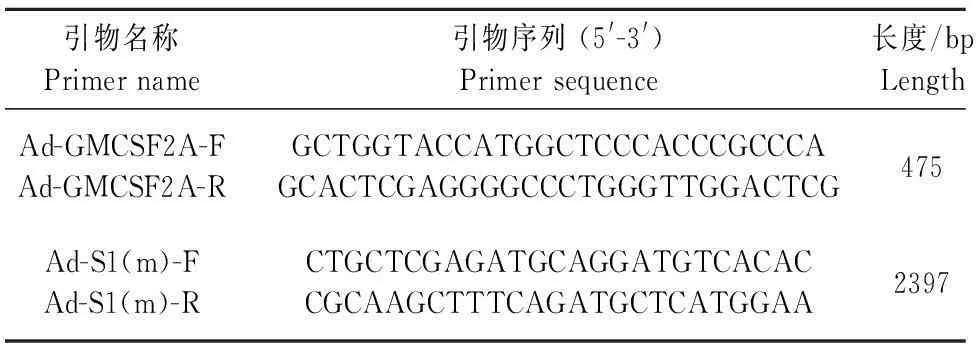
表1 用于构建重组载体pShuttle-GMCSF2A-S1(m)的引物
1.2.2重组腺病毒质粒的构建用限制性内切酶PmeI线性化重组穿梭质粒pShuttle-GMCSF2A-S1(m),电转化至含有腺病毒骨架载体pAdEasy-1的大肠埃希菌BJ5183感受态细胞中。用QIGEN质粒提取试剂盒提取重组质粒,限制性内切酶PacI酶切鉴定,命名为pAd-GMCSF2A-S1(m)。
1.2.3重组腺病毒质粒的转染提取重组腺病毒质粒pAd-GMCSF2A-S1(m),经PacI酶切后,用 Trans FastTMTransfection Reagent转染HEK-293A细胞。在灭菌的离心管中先后加入200 μL不含血清的DMEM、5 μg重组腺病毒质粒和6 μL转染试剂,涡旋混匀,室温静置15 min;从细胞培养箱中取出24孔细胞板,弃去细胞培养基;将混合液轻轻加入细胞表面上;轻轻混匀使混合液覆盖整个细胞表面,将细胞板置于细胞培养箱中作用1.0 h,轻轻加入500 μL预热的含有50 mL/L胎牛血清的DMEM;将细胞板置于细胞培养箱中培养14 d左右,直至产生细胞病变。
1.2.4重组腺病毒的PCR鉴定将初代出现病变的细胞培养物反复冻融,离心取上清,接种HEK-293A细胞,连续传9代,观察细胞病变(CPE)。取第3代和第9代病变细胞培养物,抽提DNA,用PCR检测目的基因。同时将第9代重组腺病毒感染HEK-293A细胞,用GM-CSF和S1蛋白多抗进行Western blot和间接免疫荧光(IFA)检测目的基因的表达情况。将鉴定为阳性的重组腺病毒命名为rAd- GMCSF2A-S1(m)。
1.2.5重组腺病毒的IFA鉴定将10 mol重组腺病毒rAd-GMCSF2A-S1(m)感染HEK-293A细胞,培养24 h后,弃去细胞液,用预冷的无水乙醇固定,一抗为GM-CSF多抗或者S1蛋白多抗,二抗为荧光标记羊抗兔IgG,荧光显微镜下观察结果。
1.2.6重组腺病毒的Western blot鉴定收集rAd-GMCSF2A-S1(m)感染的HEK-293A细胞,进行SDS-PAGE电泳及转印,设立HEK-293A细胞和wtAd感染的HEK-293A细胞做为阴性对照。一抗为GM-CSF多抗或者S1蛋白多抗,二抗为荧光标记羊抗兔IgG。
1.2.7重组腺病毒的一步生长曲线分别用10 mol rAd-GMCSF2A-S1(m)和wtAd接种HEK-293A细胞,在接种后12、24、36、48、60 h和72h收取病毒并进行毒价测定,建立rAd-GMCSF2A-S1(m)和wtAd一步生长曲线。
2结果
2.1重组腺病毒的制备
将重组腺病毒质粒pAd-GMCSF2A-S1(m)经PacI线性化后转染HEK-293A细胞,转染10 d出现细胞病变,细胞变圆、脱落、拉丝、出现空洞。第12天收获病毒进行传代。提取第3代和第9代重组腺病毒DNA,经PCR扩增均能检测出约为2 397 bp的S1基因和475 bp的GM-CSF基因,而wtAd和HEK-293A细胞中均未检测这两种基因(图1)。
2.2IFA鉴定重组腺病毒中S1和GMCSF蛋白表达
将第9代重组腺病毒rAd-GMCSF2A-S1(m)感染HEK-293A细胞,以S1蛋白多抗或GMCSF蛋白多抗为一抗,FITC-IgG为二抗,通过IFA鉴定S1和GM-CSF蛋白表达。结果表明,S1和GM-CSF蛋白在重组腺病毒感染的HEK-293A细胞中获得有效表达(图2)。
2.3Western blot鉴定重组腺病毒中S1和GMCSF蛋白表达
将重组腺病毒rAd-GMCSF2A-S1(m)和wtAd分别感染HEK-293A细胞,收获细胞,经裂解后通过S1蛋白多抗或GM-CSF蛋白多抗进行Western blot鉴定。结果表明,重组腺病毒rAd-GMCSF2A-S1(m)在HEK-293A细胞能够表达S1蛋白和GM-CSF蛋白,分子质量分别约为86 ku和17 ku,而wtAd在HEK-293A细胞没有蛋白表达(图3和图4)。
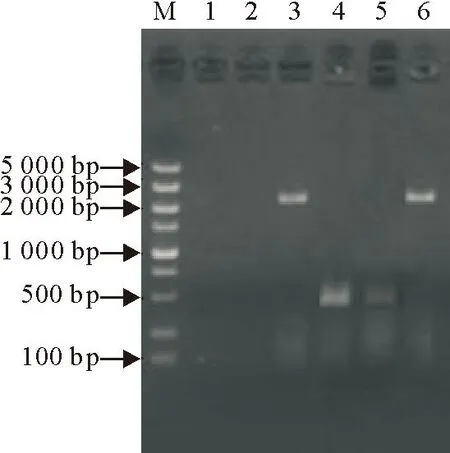
M.DNA 标准 DL 5 000;1.HEK-293A细胞;2.野生型腺病毒;3.第3代rAd-GMCSF2A-S1(m)的S1基因PCR产物;4.第3代rAd-GMCSF2A-S1(m)的GM-CSF基因PCR产物;5.第9代rAd-GMCSF2A-S1(m)的S1基因PCR产物;6.第9代rAd-GMCSF2A-S1(m)的GM-CSF基因PCR产物
M.DNA Marker DL 5 000; 1.HEK-293A cell; 2.wtAd; 3.S1 gene of 3rd generation rAd-GMCSF2A-S1(m); 4.GM-CSF gene of 3rd generation rAd-GMCSF2A-S1(m); 5.GM-CSF gene of 9rd generation rAd-GMCSF2A-S1(m) ; 6.S1 gene of 9rd generation rAd-GMCSF2A-S1(m)
图1重组腺病毒rAd-GMCSF2A-S1(m)的PCR鉴定
Fig.1Identification of the recombinant adenovirus
rAd-GMCSF2A-S1(m) by PCR
2.4重组腺病毒的生长特性
将重组腺病毒rAd-GMCSF2A-S1(m)和wtAd以10 mol剂量分别接种HEK-293A细胞,每隔12 h进行病毒滴度测定,绘制一步生长曲线。结果表明,随着重组腺病毒感染细胞培养时间的延长,病毒滴度逐渐升高,在60 h病毒滴度达到峰值,随后开始下降(图5)。
3讨论
猪流行性腹泻病毒 S蛋白是一种纤突蛋白,位于病毒粒子表面,具有受体结合、诱导中和抗体、促进病毒和细胞融合等作用。研究表明S蛋白含有1个中和表位区域COE和3个线性表位,只有1个线性表位位于S2,其余均位于S1。将近年来流行毒株和疫苗毒株CV777全基因组比对分析发现,S蛋白变异性最大,包括氨基酸插入和缺失、糖基化位点改变和中和表位区域及线性表位中氨基酸变异[10-12]。粒细胞巨噬细胞集落刺激因子(GM-CSF)是能够促进树突状细胞和巨噬细胞的分化和成熟,增强巨噬细胞和中性粒细胞的吞噬和杀伤功能和抗体依赖性细胞介导的细胞毒作用,增强抗原递呈细胞(antigen presenting cell,APC)的抗原递呈作用及促进APC向疫苗接种或病原感染部位迁移[13-14]。
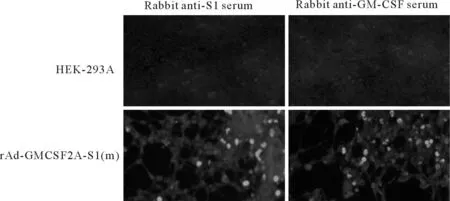
图2 IFA检测S1和GM-CSF蛋白在rAd-GMCSF2A-S1(m)感染HEK-293A细胞中表达

1.HEK-293A细胞;2.野生型腺病毒;3.重组腺病毒rAd-GMCSF2A-S1(m)
1.HEK-293A cells; 2.wtAd; 3.recombinant adenovirus rAd-GMCSF2A-S1(m)
图3Western blot检测S1蛋白在rAd-GMCSF2A-
S1(m)感染HEK-293A细胞中表达
Fig.3Detection of S1 gene expression in HEK-293A cells infected
with rAd-GMCSF2A-S1(m) by Western blot

1.HEK-293A细胞;2.野生型腺病毒;3.重组腺病毒rAd-GMCSF2A-S1(m)
1.HEK-293A cells; 2.wtAd; 3.Recombinant adenovirus rAd-GMCSF2A-S1(m)
图4Western blot检测GM-CSF蛋白在rAd-GMCSF2A-
S1(m)感染HEK-293A细胞中表达
Fig.4Detection of GM-CSF gene expression in HEK-293A
cells infected with rAd-GMCSF2A-S1(m) by Western blot
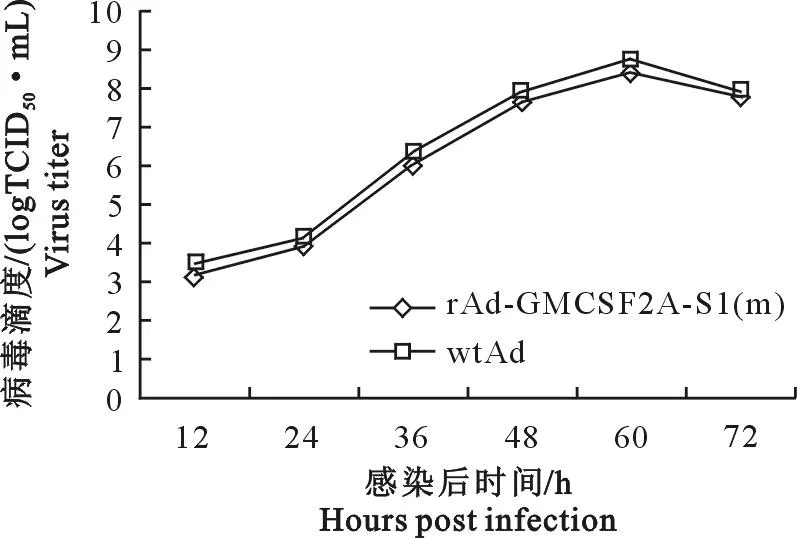
图5 rAd-GMCSF2A-S1(m)与wtAd的一步生长曲线
本研究以FMDV的2A蛋白作为连接肽将S1和GMCSF基因串联后构建重组腺病毒活载体疫苗。S1基因为PEDV变异毒株基因,进行密码子,采用宿主偏爱的密码子以提高外源蛋白的表达。FMDV 2A是一个顺式裂解元件,含有16个氨基酸残基,可以用于几种抗原基因的同时表达,并且可以使其上游和下游蛋白表达量相当[15]。本研究中重组腺病毒表达的S1蛋白和GM-CSF蛋白,经IFA鉴定,均出现荧光,表明重组腺病毒成功表达外源蛋白;经Western blot鉴定,重组腺病毒表达的S1蛋白和GM-CSF蛋白大小分别约为86 ku和17 ku,表明FMDV的2A蛋白实现了自我剪切。通过病
毒滴度测定,重组腺病毒rAd-GMCSF2A-S1与其亲本病毒的一步生长曲线并无明显差异,表明rAd-GMCSF2A-S1复制能力较好。本研究构建的重组腺病毒rAd-GMCSF2A-S1为进行猪体免疫效果评价和PEDV新型疫苗研制奠定了基础。
参考文献:
[1]Olanratmanee E O,Kunavongkrit A,Tummaruk P.Impact of porcine epidemic diarrhea virus infection at different periods of pregnancy on subsequent reproductive performance in gilts and sows [J].Anim Reprod Sci,2010,122(1-2):42-51.
[2]Sun R Q,Cai R J,Chen Y Q,et al.Outbreak of porcine epidemic diarrhea in suckling piglets,China [J].Emerg Infect Dis,2012,18(1):161-163.
[3]Pensaert M B,de Bouck P.A new coronavirus-like particle associated with diarrhea in swine [J].Arch Virol,1978,58(3):243-247.
[4]Bosch B J,van der Zee R,de Haan C A,et al.The coronavirus spike protein is a class I virus fusion protein:structural and functional characterization of the fusion core complex [J].J Virol,2003,77(16):8801-8811.
[5]Lawson D,Lee S,Tarhini A,et al.E4697:Phase Ⅲ cooperative group study of yeast-derived granulocyte macrophage colony-stimulating factor (GM-CSF) versus placebo as adjuvant treatment of patients with completely rescued stage Ⅲ-Ⅳ melanoma [J].J Clin Oncol,2010,74(12):8504-8813.
[6]Sasaki M G,Foccacia R.Efficacy of granulocyte-macrophage colony-stimulating factor (GM-CSF) as a vaccine adjuvant for hepatitis B virus in patients with HIV infection [J].Vaccine,2003,21(31):4545-4549.
[7]Robinson H L,Montefiori D C,Villinger F,et al.Studies on GM-CSF DNA as an adjuvant for neutralizing Ab elicited by a DNA/MVA immunodeficiency virus vaccine [J].Virology,2006,352(2):285-294.
[8]Singh N,Mandal S,Thakur A,et al.Efficacy of GM-CSF as an adjuvant to hepatitis B vaccination in patients with chronic renal failure-results of a prospective,randomized trial [J].Renal failure,2003,25(2):255-266.
[9]Graham F L,Smiley J,Russell W C,et al.Characteristics of a human cell line transformed by DNA from human adenovirus type 5 [J].J Gen Virol,1977,36(1):59-74.
[10]Chen J,Liu X,Shi D,et al.Detection and molecular diversity of spike gene of porcine epidemic diarrhea virus in China [J].Viruses,2013,5(10):2601-2613.
[11]Li Z L,Zhu L,Ma J Y,et al.Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field strains in south China [J].Virus Genes,2012,45(1):181-185.
[12]Chen X,Yang J,Yu F,et al.Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) samples from field cases in Fujian,China [J].Virus Genes,2012,45(3):499-507.
[13]Disis M L,Bernhard H,Shiota F M,et al.Granulocyte-macrophage colony-stimulating factor:an effective adjuvant for protein and peptide-based vaccines [J].Blood,1996,88(1):202-210.
[14]Chen Q,He F,Kwang J,et al.GM-CSF and IL-4 stimulate antibody responses in humanized mice by promoting T,B,and dendritic cell maturation [J].J Immunol,2012,189(11):5223-5229.
[15]Tan Y,Liang H,Chen A,et al.Coexpression of double or triple copies of the rabies virus glycoprotein gene using a self-cleaving 2A peptide-based replication-defective human adenovirus serotype 5 vector [J].Biologicals,2010,38(5):586-593.
Construction of Recombinant Adenovirus Co-expressing PEDV S1 and GM-CSF Proteins
ZHAO Pan-deng1,DONG Jan-guo2,DENG Tong-wei1,CHEN Yi1,XU Yao-hui1,JIANG Zeng-hai1,LU Jian-zhou1,WANG Xiao-ye3,WANG Yan1
(1.CollegeofVeterinaryMedicine,HenanUniversityofAnimalHusbandryandEconomy,Zhengzhou,Henan450046,China;2.CollegeofAnimalScienceandVeterinaryMedicine,XinyangCollegeofAgricultureandForestry,Xinyang,Henan464000,China;3.CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning,Guangxi,530004,China)
Abstract:In order to construct the recombinant adenovirus expressing PEDV S1 and GM-CSF genes,the codon optimized S1 gene was linked with GM-CSF gene by FMDV 2A gene.Recombinant shuttle plasmid pShuttle-GMCSF2A-S1(m) was constructed and transformed intoEscherichiacoliBJ5183 competent cells containing adenovirus backbone vector pAdEasy-1 to produce pAd-GMCSF2A-S1(m) by homologous recombination.The recombinant adenovirus plasmid was linearized byPacI and was transfected into HEK-293A cells.The recombinant adenovirus rAd-GMCSF2A-S1 was rescued and identified by indirect immunofluorescence and Western blot assay.The results showed that S1 and GM-CSF proteins were expressed in HEK-293A cells infected with rAd-GMCSF2A-S1.This study laid a foundation for the development of recombinant live vector vaccine against PEDV.
Key words:Porcine epidemic diarrhea virus; S1 gene; GM-CSF; recombinant adenovirus
收稿日期:2016-01-20
作者简介:赵攀登(1986-),男,河南商丘人,讲师,博士,主要从事动物医学研究。*通讯作者
中图分类号:S852.65
文献标识码:A
文章编号:1007-5038(2016)06-0068-05

