普通小麦类胡萝卜素组分的超高效液相色谱分离方法
李文爽夏先春何中虎,2,*
1中国农业科学院作物科学研究所/国家小麦改良中心, 北京100081;2CIMMYT中国办事处, 北京100081
普通小麦类胡萝卜素组分的超高效液相色谱分离方法
李文爽1夏先春1何中虎1,2,*
1中国农业科学院作物科学研究所/国家小麦改良中心, 北京100081;2CIMMYT中国办事处, 北京100081
摘 要:类胡萝卜素是影响小麦面粉及面制品颜色和营养品质的重要因素。本研究以中麦 175 (软质麦)和中优 206(硬质麦)的面粉为试验材料, 旨在优化小麦类胡萝卜素提取方法, 建立超高效液相色谱(ultra performance liquid chromatography, UPLC)测定其组分的技术体系。研究表明, 用含0.1% BHT的正己烷∶丙酮(80∶20, v/v)混合液作为提取液, 结合恒温振荡法(300转 min-1, 35℃, 振荡1 h)的提取效果最好。以YMC C30胡萝卜素分析专用色谱柱(高100 mm, 直径4.6 mm, 粒径3 µm)洗脱, 乙腈∶甲醇∶水∶三乙胺(81∶14∶5∶0.05, v/v/v/v)为流动相A, 甲醇∶乙酸乙酯∶三乙胺(68∶32∶0.05, v/v/v)为流动相B, 流速0.4 mL min-1, 柱温35℃, 分离时间25 min; 以二极管阵列检测器(photodiode array, PDA)在450 nm波长下, 能有效检测叶黄素、玉米黄质和β-胡萝卜素3种组分。该技术体系可作为普通小麦类胡萝卜素组分及营养品质研究的有效方法。
关键词:普通小麦; 类胡萝卜素组分; 超高效液相色谱
本研究由引进国际先进农业科学技术计划(948计划)项目[2011-G(3)4]和科技部小麦玉米高效分子标记体系的研发和应用项目(2013DFG30530)资助。
This study was supported by the Program of Introducing International Super Agricultural Science and Technology [2011-G(3)4]and Ministry of Science and Technology (2013DFG30530).
第一作者联系方式∶ E-mail∶ lwshuang2012@163.com
URL∶ http∶//www.cnki.net/kcms/detail/11.1809.S.20160311.1605.008.html
类胡萝卜素是呈红色、黄色和橙色的一类碳氢化合物及其氧化衍生物, 属脂溶性色素, 其结构由8个类异戊二烯单位通过首尾连接而成, 包括 700多个家族成员。类胡萝卜素在人类营养和健康方面有重要作用, 一些类胡萝卜素是维生素 A的前体物质。维生素 A又称视黄醇, 是脂溶性维生素, 其动物性来源的称维生素 A, 而植物性来源的称维生素A原, 即类胡萝卜素, 人体摄入后可以转化成有生理活性的维生素A。维生素A有很多重要生理功能,能维持正常视觉功能, 预防老年性黄斑变性和夜盲症的发生, 维持骨骼正常生长发育以及抑制肿瘤生长。维生素 A缺乏症在第三世界国家非常严重, 导致死亡率上升[1]。同时, 所有类胡萝卜素都具有抗氧化能力, 可以降低慢性病发生, 增强免疫[2-3]。人类和动物自身不能合成类胡萝卜素, 必须从外界摄取[4-5]。近年来, 谷物籽粒中的类胡萝卜素组分及其含量研究受到越来越多的关注[6], 已克隆了一些与类胡萝卜素生物合成相关的基因[7-10], 并定位了与类胡萝卜素含量相关的QTL[11-12]。大部分研究集中在类胡萝卜素含量较高的玉米, 主要做法是通过遗传育种方法提高类胡萝卜素的含量或改变籽粒中不同类胡萝卜素组分的比例。通过转入与胡萝卜素合成相关的基因, 已获得外表为金黄色的转基因大米, 被称为“黄金大米”, 可帮助人体增加维生素A的吸收[13-15]。
普通小麦是世界性的重要谷物, 约占全球作物种植面积的 17%, 为人类提供了约20%的能量和蛋白[16]。我国是全球小麦生产和消费量最大的国家,常年种植面积约为2400万公顷, 总产量约为1.2亿吨[17]。随着经济发展、生活质量提高, 面粉及面制品的营养和外观品质越来越受到重视, 并已成为小麦品质改良的重要方向[18-19]。黄色素是小麦籽粒中最主要的天然色素, 其含量高低是评价面粉色泽的重要指标, 与面粉及面团黄度的相关系数高达 0.8~0.9[20]。类胡萝卜素是黄色素的主要成分, 影响面粉颜色和营养品质。虽已对黄色素含量进行QTL定位,并发掘验证了相关功能标记[21-22], 但国内有关小麦类胡萝卜素组分及其含量的研究尚未见报道。
测定植物类胡萝卜素的常用方法有分光光度法和高效液相色谱法(high performance liquid chromatography, HPLC), 其中, 分光光度法易操作且对类胡萝卜素提取纯度要求不高, 但该方法只能测定类胡萝卜素总量, 不能检测各组分的含量; 高效液相色谱法可用于多种类胡萝卜素组分的分离, 但分离非极性的类胡萝卜素(如 β-胡萝卜素)时, 分析时间过长, 并且尚未建立测定普通小麦类胡萝卜素的通用方法[23-24]。随着色谱学的发展, 超高效液相色谱法(ultra performance liquid chromatography, UPLC)应运而生, UPLC是在HPLC理论与原理的基础上形成的, UPLC所配套的分析柱, 使用的填料更小, 整个 UPLC系统体积降低, 从而提高了色谱峰容量、灵敏度及分析通量。Hung等[25]利用UPLC检测了硬粒小麦类胡萝卜素组分, 但仅获得了叶黄素和 β-胡萝卜素含量, 没有检测到玉米黄质含量, 而有关普通小麦类胡萝卜素组分含量的UPLC分析尚未见报道。
针对上述问题, 本研究旨在建立灵敏、快速的普通小麦类胡萝卜素组分定量分析的 UPLC方法,为类胡萝卜素的遗传改良及相关研究提供表型测定方法。
1 材料与方法
1.1 试验材料及磨粉方法
中麦175 (软质麦)和中优206 (硬质麦)用于体系建立, 2011—2012年度种植于北京。20份冬小麦品种用于UPLC与HPLC方法比较, 其中北部冬麦区品种6个, 包括晋麦61、晋麦67、京冬8号、CA9719、CA9722和京9428; 黄淮麦区品种12个, 包括晋麦45、烟农18、烟优361、鲁麦23、高优503、豫麦50、85中33、兰考24、豫麦49、豫麦63、皖麦19和皖麦38; 长江中下游麦区品种2个, 包括徐州25和扬麦158。这20份品种于2011—2012年度分别种植于北京、河南安阳和安徽濉溪, 没有发生穗发芽,收获后将籽粒自然晒干, 低温贮藏。
用Perten Instruments North America公司(Reno,NV, Sweden)生产的4100型单籽粒谷物特性测试仪(Single Kernel Characterization System, SKCS)测定籽粒硬度和水分含量。用 Brabender Quandrmat Junior (Brabender Inc., Duisberg, Germany)磨, 按AACC 26-50 (1995)方法润麦和制粉。为避免色素被一些酶类氧化, 将面粉储存于18℃暗光环境。
1.2 类胡萝卜素组分及混合样品制备
谷物中类胡萝卜素主要有玉米黄质、叶黄素、α-胡萝卜素和β-胡萝卜素[26]。叶黄素(纯度≥90%)、玉米黄质(纯度≥95%)和β-胡萝卜素(纯度≥95%)标样购自Sigma公司, α-胡萝卜素(纯度≥97%)标样购自CaroteNature公司。
叶黄素、玉米黄质、α-胡萝卜素和 β-胡萝卜素的固体标准样品先用四氢呋喃彻底溶解, 再用甲醇稀释获得0.1 mg mL-1叶黄素、0.1 mg mL-1玉米黄质、0.1 mg mL-1α-胡萝卜素和0.05 mg mL-1β-胡萝卜素标准溶液, 叶黄素、玉米黄质、α-胡萝卜素和β-胡萝卜素按体积比为 8∶2∶4∶6配置成混合标准样品。利用HPLC和UPLC对4种单组分标样和混合标样进行分析, 根据单组分标准样品的保留时间,确定混合标样中各组分。将配好的混合标准样品用甲醇稀释为原浓度的1/2、1/4、1/8、1/10, 制作标准曲线, 峰面积为纵坐标, 样品浓度为横坐标。
1.3 试验样品提取方法
从提取类胡萝卜素的常用溶剂中选取 5种混合溶剂, 其成分组成和比例(v/v)分别是正己烷∶丙酮(80∶20)、丙酮∶甲醇(70∶30)、丙酮∶石油醚(50∶50)、甲醇∶四氢呋喃(50∶50)和甲醇∶二氯甲烷(45∶55)。混合溶剂中加入 0.1%的抗氧化剂——丁羟甲苯(butylated hydroxytoluene, BHT)。
用超声波法提取时, 先准确称取8.0 g面粉, 置于三角瓶中, 加入 40 mL样品提取液, 漩涡振荡 2 min, 然后放入KQ-500DB数控超声清洗器中, 在20℃、100 Hz条件下超声提取1 h。然后, 将上清液转移到50 mL塑料离心管中, 23 500 × g离心15 min;上清液过0.45 μm的油性滤膜后转入液相小瓶中。
用恒温振荡法提取时, 先称取8.00 g小麦面粉,加入40 mL样品提取液, 漩涡振荡2 min, 再于35℃恒温振荡器中300转 min-1振荡1 h; 然后将上清液转移到50 mL塑料离心管中, 23 500 × g条件下离心 15 min; 将上清液转移到 100 mL烧杯中, 用TTL-DCII型氮吹仪(北京同泰联公司)将溶剂吹干,所得残渣即为类胡萝卜素。再用1.5 mL含0.1% BHT的甲醇∶乙酸乙酯(68∶32, v/v)溶解, 置于2 mL棕色离心管中, 在分析使用之前置于-20℃条件下保存, 经4℃条件下15 000 × g离心20 min后, 取上清液过 0.22 μm油性滤膜至进样小瓶中, 进样量为 8 μL。所有提取样品需在24 h内完成分析。
1.4 洗脱条件及类胡萝卜素组分含量计算
1.4.1 HPLC法 流动相A为乙腈∶甲醇∶三乙胺(85∶15∶0.05, v/v/v), 流动相B为甲醇∶乙酸乙酯∶三乙胺(68∶32∶0.05, v/v/v), 配制的流动相应以 0.45 μm油性滤膜过滤, 流动相使用前超声脱气20 min。洗脱梯度为0 min时100%流动相A, 5 min 时100%流动相A, 45 min时0%流动相A, 55 min时100%流动相A。胡萝卜素分析专用色谱柱YMC C30 (4.6 mm × 250.0 mm, 粒径5 μm), 流速为1.0 mL min-1, 检测波长450 nm。HPLC色谱系统为Waters 2695, 利用工作站软件 Millennium 32, 根据标准样品的保留时间判断样品中类胡萝卜素的组分。
1.4.2 UPLC法 流动相A为乙腈∶甲醇∶水∶三乙胺=81∶14∶5∶0.05 (v/v/v/v), 流动相 B为甲醇∶乙酸乙酯∶三乙胺=68∶32∶0.05 (v/v/v), 配制的流动相应以 0.22 μm油性滤膜过滤, 流动相在使用前超声脱气20 min。洗脱梯度为0 min时100%流动相A, 0.3 min时100%流动相A, 12 min时0%流动相A, 20 min时0%流动相A, 22 min时100%流动相A, 25 min时100%流动相A。YMC C30胡萝卜素分析专用色谱柱(高100 mm, 直径4.6 mm, 粒径3 μm), 流速为0.4 mL min-1, PDA检测波长450 nm。UPLC色谱系统为Waters Acquity系统, 利用工作站软件Empower Pro (version 2.0), 根据标准样品的保留时间判断样品中类胡萝卜素的组分, 并采用不同浓度的混合标准样品与对应的峰面积值间的关系制作标准曲线(R2> 0.9990), 采用自动积分获取样品的峰面积, 再根据标准曲线计算样品相关组分含量。
1.5 统计分析
用Statistical Analysis System (SAS9.1)进行基本统计量分析和差异显著性比较。
2 结果与分析
2.1 提取液选择
选择5种类胡萝卜素提取溶液(均含0.1%的BHT), 分别提取中麦175和中优206面粉样本的类胡萝卜素, 用叶黄素含量来判断提取效果。结果表明,正己烷∶丙酮(80∶20, v/v)的提取效果最好, 而另4种提取方法没有显著差异。因此, 本试验选用正己烷∶丙酮(80∶20, v/v)作为小麦类胡萝卜素的提取溶剂(表1)。
2.2 提取方法选择
比较超声和恒温振荡两种常用方法的提取效果,可以看出, 两种对中麦175面粉中叶黄素提取量的影响差异不显著, 而对中优206面粉叶黄素提取量有显著影响(P<0.05); 从提取量看, 恒温振荡法在2个品种提取到的叶黄素含量均高于超声法。同时,恒温振荡法对温度控制较稳定, 而超声法中水温会逐渐升高, 降低了样品间提取条件的重复性。因此,本文最终选用恒温振荡法作为小麦类胡萝卜素的提取方法(表2)。
2.3 保留时间确定
根据类胡萝卜素4种组分(叶黄素、玉米黄质、α-胡萝卜素和β-胡萝卜素)单个标准样品的保留时间确定混合标准样品的保留时间, 如图 1所示, 各组分的保留时间可明显区分, 其中叶黄素的保留时间为12.173 min, 玉米黄质为13.203 min, α-胡萝卜素为18.472 min, β-胡萝卜素为20.836 min。在检测4种组分时, 没有检测到 α-胡萝卜素, 玉米黄质和 β-胡萝卜素分离出的峰形小且响应值较低。
2.4 UPLC分析方法重复性验证
对制作标准曲线的 5种不同浓度的标准样品连续进样进行测定, 检测到的峰形从左到右依次为叶黄素、玉米黄质、α-胡萝卜素、β-胡萝卜素(图2)。可以看出, 类胡萝卜素的4种组分在UPLC洗脱梯度下保留时间重复性相对稳定。加样回收率, 叶黄素为 92.3%, 玉米黄质为 94.8%, β-胡萝卜素为51.0%, 3种组分总量为85.9%。为了便于观察提取及分离量化的稳定性, 在多样品分析中需增加对照样品, 每20个样品增加一个对照。根据对照样品中测定的类胡萝卜素各组分峰形图的保留时间及含量的分析, 判断系统的稳定性及检测的准确性, 从而保证所有样品测定结果的一致性。

表1 不同提取液提取小麦样品叶黄素含量比较Table 1 Lutein contents in samples using different solvents

表2 不同提取方法提取小麦样品叶黄素含量比较Table 2 Lutein contents in samples using different methods
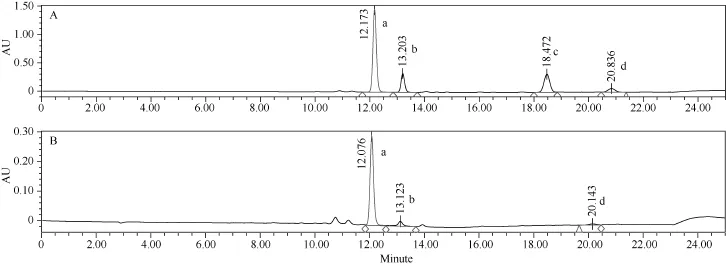
图1 样品中叶黄素(a)、玉米黄质(b)、α-胡萝卜素(c)和β-胡萝卜素(d)的UPLC峰形图Fig.1 UPLC chromatograms of lutein (a), zeaxanthin (b), α-carotene (c), and β-carotene (d)
2.5 UPLC与HPLC法比较
选取晋麦61等20份小麦品种, 分别利用UPLC体系与 HPLC体系测定其面粉叶黄素含量, 两种方法的决定系数为0.96 (图3), 说明本研究建立的UPLC方法用于小麦类胡萝卜素组分含量测定可行。HPLC体系对玉米黄质和 β-胡萝卜素无法进行定量分析, 而 UPLC体系则可以将这两种组分分离并定量。因此, UPLC方法具有分析通量高、检测灵敏度高的特点, 与 HPLC相比, 还提高了叶黄素与玉米黄质的分离度。
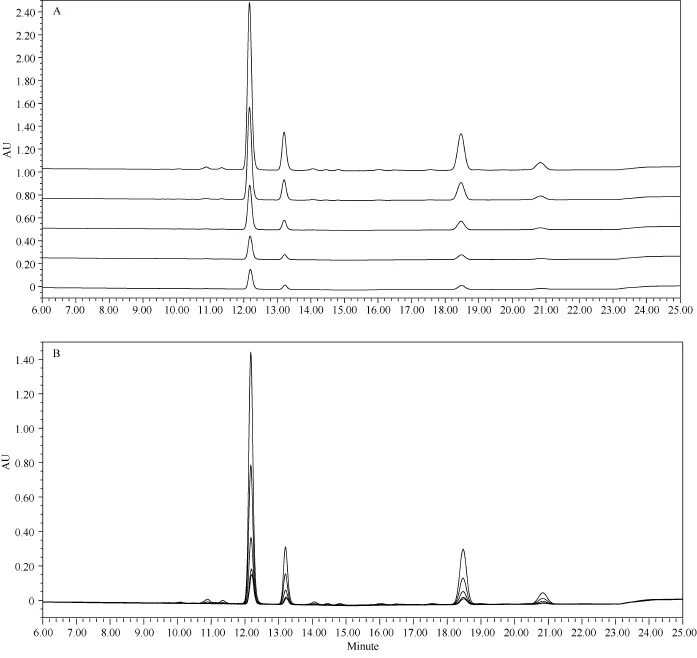
图2 连续5次进标准样品峰形图Fig.2 Consecutive UPLC separations of carotenoids standards in calibration curves with optimized conditions
3 讨论
3.1 类胡萝卜素提取方法优化
普通小麦类胡萝卜素各组分定量研究尚无统一提取方法, 以水饱和正丁醇提取法较为常用[28-29],但所使用的有机溶剂——水饱和正丁醇与UPLC体系中使用的流动相不兼容, 且该溶剂黏度大, 氮气吹干过程时间很长, 因此, 本研究建立了能够适应UPLC检测体系并能大批量提取小麦类胡萝卜素的方法。Burkhardt和Böhm[30]曾使用甲醇和四氢呋喃混合液提取硬粒小麦类胡萝卜素, 但我们发现该方法的提取效果不及丙酮与甲醇混合液和正己烷与丙酮混合液。Oliver等[31]还使用过皂化方法进行提取类胡萝卜素, 但提取时间长, 且可能破坏类胡萝卜素的结构。Hung和Hatcher[25]用水饱和正丁醇作为提取溶剂, 需在黑暗环境下过夜提取; 与之相比,本研究的提取过程更短、效率较高、重复性好, 两次提取相关性为 0.99, 因此认为, 该方法可用于提取普通小麦类胡萝卜素。

图3 UPLC体系与HPLC体系提取类胡萝卜素相关性分析Fig.3 Correlation between lutein contents in wheat flour extracts from UPLC and HPLC systems
3.2 UPLC体系建立
利用HPLC体系测定小麦籽粒中类胡萝卜素含量, 单个样品所用时间约为60 min[30, 32-34], UPLC体系测定类胡萝卜素的分离度、测定速度和灵敏度更高, 本文中的UPLC测定体系检测时间仅为25 min。HPLC体系进样量为50 μL, 而UPLC仅为8 μL, 用量减少约80%。同时HPLC法每针进样所需流动相总用量约为60 mL, 而UPLC法仅需约10 mL, 约为HPLC法的1/6。通过计算加样回收率, 该体系对叶黄素和玉米黄质的回收率较高, 达到 90%以上, 但对于 β-胡萝卜素回收率相对较低, 这是由于 β-胡萝卜素极不稳定, 在样品处理和分离过程中都会有一定损失。
色谱柱是液相色谱分离分析的关键硬件[35], 本研究选用YMC C30胡萝卜素分析专用色谱柱, 与传统的 C18色谱柱比, 它提供了足够的相位厚度, 可增强与长链分子之间的相互作用, 利于分离双键键合系统的异构体。叶黄素与玉米黄质为同分异构体,区别仅在一个双键位置的不同, 因此使用YMC C30胡萝卜素分析色谱柱能将两者很好分离。
本研究中, UPLC法使用是高100 mm、直径4.6 mm、粒径3 μm的色谱柱, 一般认为粒径低于2 μm的小颗粒作为固定相, 可以增加色谱柱的效能, 提高分离度。但小颗粒不仅要求系统能承受高于目前极限压力(6000 psi/400 bar), 更小的死体积, 并且能适应只有几秒峰宽的高速检测器。目前尚无用于检测类胡萝卜素的固定相粒径更小的色谱柱, 我们曾使用现有的小颗粒填充的 UPLC色谱柱(ACQUITY UPLC BEH C18 2.1 mm × 100.0 mm, 粒径1.7 μm),但并不能很好分离叶黄素和玉米黄质两种组分, 且 β-胡萝卜素出峰时间比较靠后, 所以最终选用了粒径为3 μm的YMC C30胡萝卜素专用分析色谱柱。在本试验中, 实际小麦样品 β-胡萝卜素保留时间较之标准样品有些提前, 不过在误差范围内, 这是由于有机溶剂直接提取得到的类胡萝卜素中会有杂质影响。随着技术的发展以及 UPLC使用的普及, 若未来能设计一款专门测定类胡萝卜素的固定相粒径小于2 μm的色谱柱, 可更有效分析研究植物中类胡萝卜素。
流动相可影响相关组分的分离效果, UPLC体系的流动相与 HPLC体系流动相组分相同, 只是在流动相 A中加入 5%纯水, 目的是在超高压的环境下,减少流动相的黏度。Hung和Hatcher[25]利用UPLC方法测定硬粒小麦类胡萝卜素, 洗脱时间为 6 min,但只检测到叶黄素与β-胡萝卜素, 且根据Kean等[36]的研究推测色谱图中的玉米黄质色谱峰, 并没有利用标准样品或是质谱检测到玉米黄质。本研究可以将4种组分分离, 但多次进样之后, β-胡萝卜素的保留时间会延后, 这是由于类胡萝卜素的提取过程相对简单, 而 UPLC对样品的前处理要求较高, 会因一些杂质残留而使出峰时间延后。经过多次试验,最终选定25 min的洗脱时间, 保证在最短的时间内更稳定地测定类胡萝卜素组分。
4 结论
以类胡萝卜素组分的 HPLC测定方法为基础,通过技术条件改进和参数优化, 建立了 UPLC测定技术体系。该体系以含有0.1% BHT的正己烷∶丙酮(80∶20, v/v)混合溶液作为提取液, 利用恒温振荡法(300转 min-1, 35℃, 振荡1 h)提取面粉中的类胡萝卜素, 采用胡萝卜素分析专用色谱柱 YMC C30 (4.6 mm × 100.0 mm, 粒径3 µm); 流动相A为乙腈∶甲醇∶水∶三乙胺(81∶14∶5∶0.05, v/v/v/v);流动相B为甲醇∶乙酸乙酯∶三乙胺(68∶32∶0.05,v/v/v), PDA检测波长450 nm, 流速0.4 mL min-1。流动相洗脱梯度为0 min时100%流动相A, 0.3 min 时100%流动相A, 12 min时0%流动相A, 20 min时0%流动相A, 22 min时100%流动相A, 25 min时100%流动相A。
致谢: 江苏省农业科学院农业生物技术研究所张平平副研究员对本文提出了宝贵修改建议。
References
[1]Fawzi W W, Hunter D J.Vitamins in HIV disease progression and vertical transmission.Epidemiology, 1998, 9∶ 457-466
[2]Ribaya-Mercado J D, Blumberg J B.Lutein and zeaxanthin and their potential roles in disease prevention.J Am Coll Nut, 2004,23∶ 567S-587S
[3]Nishino H, Murakoshi M, Tokuda H, Yoshiko S.Cancer prevention by carotenoids.Arch Biochem Biophys, 2009, 483∶ 165-168
[4]Harjes C E, Rocheford T R, Bai L, Brutnell T P, Kandianis C B,Sowinski S G, Stapleton A E, Vallabhaneni R, Williams M,Wurtzel E T, Yan J B, Buckler E S.Natural genetic variation in lycopene epsilon cyclase tapped for maize biofortification.Science, 2008, 319∶ 330-333
[5]Cazzonelli C I, Pogson B J.Source to sink∶ regulation of carotenoid biosynthesis in plants.Trends Plant Sci, 2010, 15∶ 266-274
[6]Howitt C A, Pogson B J.Carotenoid accumulation and function in seeds and non-green tissues.Plant Cell Environ, 2006, 29∶435-445
[7]Matthews P D, Luo R B, Wurtzel E T.Maize phytoene desaturase and zeta-carotene desaturase catalyse a poly-Z desaturation pathway∶ implications for genetic engineering of carotenoid content among cereal crops.J Exp Bot, 2003, 54∶ 2215-2230
[8]Singh M, Lewis P E, Hardeman K, Bai L, Rose J K C, Mazourek M, Chomet P, Brutnell T P.Activator mutagenesis of the pink scutellum1/viviparous7 locus of maize.Plant Cell, 2003, 15∶874-884
[9]Gallagher C E, Matthews P D, Li F Q, Wurtzel E T.Gene duplication in the carotenoid biosynthetic pathway preceded evolution of the grasses.Plant Physiol, 2004, 135∶ 1776-1783
[10]Li F, Murillo C, Wurtzel E T.Maize Y9 encodes a product essential for 15-cis-ζ-carotene isomerization.Plant Physiol, 2007, 144∶1181-1189
[11]Wong J C, Lambert R J, Wurtzel E T, Rocheford T R.QTL and candidate genes phytoene synthase and zeta-carotene desaturase associated with the accumulation of carotenoids in maize.Theor Appl Genet, 2004, 108∶ 349-359
[12]Chander S, Guo Y, Yang X, Zhang J, Lu X, Yan J, Song T,Rocheford T, Li J.Using molecular markers to identify two major loci controlling carotenoid contents in maize grain.Theor Appl Genet, 2008, 116∶ 223-233
[13]Ye X D, Al-Babili S, Kloti A, Zhang J, Lucca P, Beyer P, Potrykus I.Engineering the provitamin A (beta-carotene) biosynthetic pathway into (carotenoid-free) rice endosperm.Science,2000, 287∶ 303-305
[14]Beyer P, Al-Babili S, Ye X D, Lucca P, Schaub P, Welsch R, Potrykus I.Golden rice∶ Introducing the beta-carotene biosynthesis pathway into rice endosperm by genetic engineering to defeat vitamin A deficiency.J Nutr, 2002, 132∶ 506S-510S
[15]Paine J A, Shipton C A, Chaggar S, Howells R M, Kennedy M J,Vernon G, Wright S Y, Hinchliffe E, Adams J L, Silverstone A L,Drake R.Improving the nutritional value of Golden Rice through increased pro-vitamin A content.Nat Biotechnol, 2005, 23∶482-487
[16]Gupta P K, Mir R R, Mohan A, Kumar J.Wheat genomics∶ present status and future prospects.Int J Plant Genomics, 2008, DOI∶ 10.1155/2008/896451
[17]Jin H, Zhang Y, Li G Y, Mu P Y, Fan Z R, Xia X C, He Z H.Effects of allelic variation of HMW-GS and LMW-GS on mixograph properties and Chinese noodle and steamed bread qualities in a set of Aroona near-isogenic wheat lines.J Cereal Sci, 2013, 57∶ 146-152
[18]Mares D J, Campbell A.Mapping components of flour and noodle colour in Australian wheat.Aust J Agric Res, 2001, 52∶1297-1310
[19]何中虎, 晏月明, 庄巧生, 张艳, 夏先春, 张勇, 王德森, 夏兰芹, 胡英考, 蔡民华, 陈新民, 阎俊, 周阳.中国小麦品种品质评价体系建立与分子改良技术研究.中国农业科学, 2006,39∶ 1091-1101 He Z H, Yan Y M, Zhuang Q S, Zhang Y, Xia X C, Zhang Y,Wang D S, Xia L Q, Hu Y K, Cai M H, Chen X M, Yan J, Zhou Y.Establishment of quality evaluation system and utilization of molecular methods for the improvement of Chinese wheat quality.Sci Agric Sin, 2006, 39∶ 1091-1101 (in Chinese with English abstract)
[20]Symons S J, Dexter J E.Computer analysis of fluorescence for the measurement of flour refinement as determined by flour ash content, flour grade colour, and tristimulus colour measurements.Cereal Chem, 1991, 68∶ 454-460
[21]He X Y, Zhang Y L, He Z H, Wu Y P, Xiao Y G, Ma C X, Xia X C.Characterization of phytoene synthase 1 gene (Psy1) located on common wheat chromosome 7A and development of a functional marker.Theor Appl Genet, 2008, 116∶ 213-221
[22]Dong C H, Ma Z Y, Xia X C, Zhang L P, He Z H.Allelic variation at the TaZds-A1 locus on wheat chromosome 2A and development of a functional marker in common wheat.J Integr Agric 2012, 11∶ 1067-1074
[23]Abdel-Aal E S M, Young J C, Wood P J, Rabalski I, Hucl P, Fregeau-Reid J.Einkorn∶ A potential candidate for developing high lutein wheat.Cereal Chem, 2002, 79∶ 455-457
[24]Adom K K, Sorrells M E, Liu R H.Phytochemical profiles and antioxidant activity of wheat varieties.J Agric Food Chem, 2003,51∶ 7825-7834
[25]Hung P V, Hatcher D W.Ultra-performance liquid chromatography (UPLC) quantification of carotenoids in durum wheat∶ Influence of genotype and environment in relation to the colour of yellow alkaline noodles (YAN).Food Chem, 2011, 125∶1510-1516
[26]周毅, 付志远, 李青, 徐淑兔, Chander S, 杨小红, 李建生, 严建兵.高油和普通玉米自交系类胡萝卜素和生育酚含量的比较.作物学报, 2009, 35∶ 2073-2084 Zhou Y, Fu Z Y, Li Q, Xu S T, Chander S, Yang X H, Li J S, Yan J B.Comparative analysis of carotenoid and tocopherol compositions in high-oil and normal maize (Zea mays L.) inbreds.Acta Agron Sin, 2009, 35∶ 2073-2084 (in Chinese with English abstract)
[27]Digesù A, Platani C, Cattivelli L, Mangini G, Blanco A.Genetic variability in yellow pigment components in cultivated and wild tetraploid wheats.J Cereal Sci, 2009, 50∶ 210-218
[28]Hidalgo A, Brandolini A, Pompei C, Piscozzi R.Carotenoids and tocols of einkorn wheat (Triticum monococcum ssp.monococcum L.).J Cereal Sci, 2006, 44∶ 182-193
[29]Ndolo V U, Beta T.Distribution of carotenoids in endosperm,germ, and aleurone fractions of cereal grain kernels.Food Chem,2013, 139∶ 663-671
[30]Burkhardt S, Böhm V.Development of a new method for the complete extraction of carotenoids from cereals with special reference to durum wheat (Triticum durum Desf.).J Agric Food Chem, 2007, 55∶ 8295-8301
[31]Oliver J, Palou A, Pons A.Semi-quantification of carotenoids by high-performance liquid chromatography∶ saponification-induced losses in fatty foods.J Chromatogr A, 1998, 829∶ 393-399
[32]Konopka I, Czaplicki S, Rotkiewicz D.Differences in content and composition of free lipids and carotenoids in flour of spring and winter wheat cultivated in Poland.Food Chem, 2006, 95∶ 290-300
[33]Abdel-Aal El-SM, Young J C, Rabalski I, Hucl P, Fregeau-Reid J.Identification and quantification of seed carotenoids in selected wheat species.J Agric Food Chem, 2007, 55∶ 787-794
[34]Mashaba C S, Barros E.Screening South African potato, tomato,and wheat cultivars for five carotenoids.Saf J Sci, 2011, 107∶34-39
[35]Lookhart G L, Bean S R, Bietz J A.Reversed-phase high performance liquid chromatography in grain applications.Cereal Food World, 2002, 48∶ 9-16
[36]Kean E G, Hamaker B R, Ferruzzi M G.Carotenoid bioaccessibility from whole grain and degermed maize meal products.J Agric Food Chem, 2008, 56∶ 9918-9926
DOI:10.3724/SP.J.1006.2016.00706
*通讯作者(
Corresponding author)∶ 何中虎, E-mail∶ zhhecaas@163.com
收稿日期Received()∶ 2015-09-07; Accepted(接受日期)∶ 2016-03-02; Published online(网络出版日期)∶ 2016-03-11.
Establishment of Ultra Performance Liquid Chromatography (UPLC) Protocol for Analyzing Carotenoids in Common Wheat
LI Wen-Shuang1, XIA Xian-Chun1, and HE Zhong-Hu1,2,*
1Institute of Crop Science/National Wheat Improvement Center, Chinese Academy of Agricultural Sciences (CAAS), Beijing 100081, China;2CIMMYT-China Office, c/o CAAS, Beijing 100081, China
Abstract:Carotenoids is an important criterion in the assessment of color and nutritional qualities of end-use products in common wheat.In this study, grain powders of Zhongmai 175 (soft wheat) and Zhongyou 206 (hard wheat) were used as samples to develop an optimal procedure for extraction and separation of carotenoids compositions extracted from flours using ultra performance liquid chromatography (UPLC).The most effective extraction of carotenoids extraction was obtained using the solvent system of N-hexane; acetone of 80∶20 (v/v, 0.1% BHT w/v) under the oscillation condition of 300 r min-1, 35ºC, and 1 h.The separation was conducted using YMC C30 Carotenoid column (100.0 mm × 4.6 mm, 3 µm) with photodiode array (PDA) detector, and the column was thermostated at 35°C.Under a gradient system consisting of acetonitrile∶methanol∶water∶triethylamine (81∶14∶5∶0.05, v/v/v/v) (A) and methanol∶ ethylacetate∶triethylamine (68∶32∶0.05, v/v/v) (B) at a constant flow rate of 0.4 mL min-1, the carotenoids of common wheat flour samples can be well separated in less than 25 min.Carotenoids were detected at 450 nm.All the present results provided useful information for carotenoids compositions and quality improvement.
Keywords:Triticum aestivum L.; Carotenodis compositions; UPLC

