11种杨属植物的倍性鉴定及山杨天然三倍体的发现1)
赵奉彬 尚策 张莉梅 张志翔
(北京林业大学,北京,100083)
11种杨属植物的倍性鉴定及山杨天然三倍体的发现1)
赵奉彬尚策张莉梅张志翔
(北京林业大学,北京,100083)
摘要在西藏芒康的山杨居群中发现有叶型明显偏大的山杨植株,通过与该地其他居群正常山杨的叶型比较推测其为三倍体山杨,后经流式细胞述验证了上述推测,确定为中国首次发现的山杨天然三倍体植株,同时以白杨组物种山杨和圆叶杨,青杨组物种冬瓜杨、梧桐杨、康定杨、滇杨、川杨、青杨、辽杨、德钦杨及大叶杨组大叶杨为研究对象,采用流式细胞仪对每个种代表样本的染色体倍性进行检测。结果表明:这11个物种全部为二倍体,青杨、辽杨、大叶杨的倍性与前人报道结果一致,其余8个种为首次报道。试验结果显示杨属物种的倍性相对稳定,没有发现四倍体。倍性研究结合叶片研究表明,在青杨组中叶形大小仅为不同种之间存在的形态上的差异,而在白杨组山杨中可能就是倍性的差异。
关键词流式细胞仪;天然三倍体;杨树;倍性
杨树是杨柳科杨属(PopulusL.)植物的统称,由于其具有速生丰产和分布范围广的特点,一直被广泛应用于防护林建设、用材林培育和城市绿化中,对解决我国木材短缺问题起到了至关重要的作用[1]。杨属的倍性研究开展较早,BLACKBURN K B et al.[2]首先报道了欧洲黑杨为二倍体,康向阳[3]报道毛白杨、新疆杨、河北杨和胡杨等都为二倍体,随后银白杨、小叶杨、大叶杨和欧洲山杨陆续被报道都为二倍体,齐力旺[4]和张守攻[5]报道辽杨、大青杨、青杨、香杨、毛果杨、欧洲黑杨等都为二倍体。因而,杨树天然野生物种多为二倍体。
在多倍体生物中,由于染色体数的增加导致基因数量增多和细胞容积变大[6],进而多倍体植物在叶型、生长量和适应性方面具有显著的优势[7-8]。三倍体营养器官的巨大性和不育性使得其在以获取材积为目标和无性系繁殖体为途径的杨树育种中具有极高的利用价值[9]。自1935年NILSSON E H[10]于瑞典首次发现天然的欧洲山杨三倍体后,各国研究人员陆续发现美洲山杨、银白杨、香脂杨等的天然三倍体植株,朱之梯等[11]于1992年发现易县天然毛白杨三倍体雌株,这些天然三倍体往往在材积、叶片大小、抗性、干型通直度和纤维特性等方面都优于自然二倍体[12-13]。天然三倍体的发现不仅为杨树育种提供优良的种质资源,更是研究三倍体形成机制的重要材料,为人工诱导三倍体提供理论支撑。
以往的研究发现三倍体杨树植株都具有叶片明显增大和树形明显增高的特征[14-15]。在西藏芒康采集到的叶型明显偏大的山杨植株,较其他山杨树形高大,经形态学研究推测其为三倍体山杨。传统的倍性鉴定方法主要是染色体压片法,但是由于山杨扦插难以生根的特性,使得本研究中难以利用这一方法。流式细胞术是一种对生物颗粒进行定量分析分选的技术[16-17],由于其对材料的分裂时期没有要求使得其比传统染色体压片法的取材更加广泛,同时易于实验操作,使得其在植物倍性研究中应用广泛,在杨树育种和三倍体鉴定中也较为常用[18-20]。本研究即通过使用流式细胞术对大叶型山杨、普通山杨和青杨组丰富遗传资源的代表种冬瓜杨、梧桐杨、康定杨、滇杨、川杨等11个种进行倍性研究,以期补充我国丰富乡土杨树资源倍性数据的空白,促进对我国特有乡土杨树资源进行开发与保护。同时探讨青杨组物种分类与叶片大小的关系,以及不同叶片大小的山杨个体间的关系。
1材料与方法
2011年起,在云南、四川、西藏等地采集杨树标本并记录地理位置信息,2014—2015年3—4月到挂牌记录地采集具冬芽的枝条,带回北京林业大学树木学实验室,插于清水中,待其幼叶刚生出时,选取生长中的新鲜叶片作为试验材料。对照样品二倍体垂柳采自北京林业大学,二倍体银白杨采自中国科学院植物研究所,待测大叶型山杨共两个样本,其他物种每个采集地点各3个样本。凭证标本存放于北京林业大学标本馆(BJFC),具体材料的采集信息详见表1。
测量芒康采集的叶型较大的山杨植株标本,与同一地点的普通的山杨植株的标本中各50片成熟叶子的长度和宽度;同时测量在雾灵山采集的辽杨和梧桐杨标本中各20片成熟叶片的长度和宽度;最后测量在太白县采集的冬瓜杨和青杨标本中各20片成熟叶片的长度和宽度。对上述3组数据分别进行方差分析。
试验的具体操作步骤参照田新民等[21]的方法:取幼嫩叶片(约1 g)于培养皿里,加入预冷的解离液WPB(约3 mL),用锋利的刀片一次性快速切碎(每次试验以垂柳材料为外参,三倍体山杨检测时以二倍体的银白杨为内参;以垂柳和待测杨树以及银白杨和待测杨树的混合材料为试验材料),吸取培养皿内的解离液,用400目的滤膜过滤到1.5 mL离心管中,离心(转速1 000 r/min,4 ℃,5 min)弃上清后,再加入100 μL解离液,同时加入150 μL PI(碘化丙啶)染液。然后4 ℃避光染色10 min,移至上样管,上机检测。

表1 杨属材料来源
试验分析设备采用清华大学生物医学测试中心美国BD公司的BD Calibur流式细胞分析仪,数据获取通过CellQuest软件,所得数据用美国Yerity Software House公司的ModFit软件进行分析。已知PI染料可以和核DNA结合放出荧光,流式细胞仪可检测单个细胞的荧光强度,即可根据荧光强度与核DNA含量成正比推算出核DNA的相对含量[22]。ModFit软件分析出的待测杨树的DNA相对含量分布图中,黄色的峰代表垂柳的DNA相对含量,红色的峰代表杨树的DNA相对含量,根据Bennett等[23]测定的垂柳与银白杨的2C值分别为1.54和1.04,可算出待测杨树样品的2C(C代表生物体中单倍体基因组的DNA含量),其中DI为对照样本垂柳与待测样荧光强度的比值,公式如下:
2C(待测样)=2C(垂柳)/DI。
2结果与分析
2.1三倍体山杨的发现与验证
叶片测量结果表明两种山杨之间、梧桐杨和辽杨之间及冬瓜杨和青杨之间在叶子长度和宽度上均差异显著(p<0.01)(表2)。由图1可得出:在叶形上,待测山杨与普通二倍体山杨相似;而在叶片大小上,待测山杨叶片明显巨大化。故推测大叶型样本为三倍体山杨。
表2 不同杨属物种叶片性状描述统计与方差分析
注:表中数据为平均值±标准差;** 表示差异显著(P<0.01)。
在用流式细胞仪检测待测山杨样本的过程中,首先以垂柳为对照,得到图2中M的分布图,由于组织细胞中以分裂间期和分裂前期的细胞占多数,其核DNA含量代表样本的2C,在荧光强度50处的主峰代表相对核DNA含量为2C,荧光强度100处为4C,以此类推,图中待测样品的2C与垂柳相差不大,接着以银白杨为内参测定结果如N、O所示,黄色的峰代表待测山杨的DNA相对含量,红色的峰代表银白杨的DNA相对含量,检测出图N、O的DI值分别为1.61和1.56,可知待测山杨的核DNA相对含量大约是二倍体银白杨的1.5倍,即可初步鉴定待测山杨为三倍体。

图1 三倍体山杨与二倍体山杨叶形对比
2.211种杨树染色体倍性的检测
在图3中的DNA相对含量分布图中,根据与已知二倍体银白杨的2C值比较,可初步鉴定待测杨树物种的倍性。由图3、表3可知,所有样本的2C值都在1.00上下浮动,表明表中所有物种DNA含量与二倍体银白杨相近,故推测都为二倍体,不存在多倍体现象。大叶杨、辽杨和青杨经流式细胞仪的检测结果与前人研究一致。
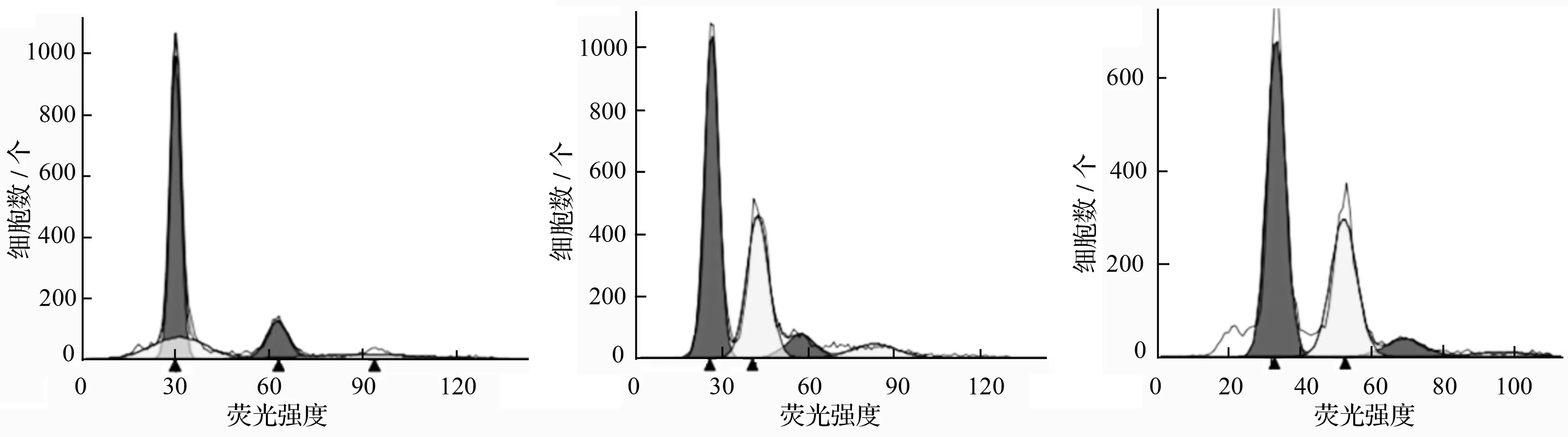
M.垂柳+三倍体山杨N.银白杨+三倍体山杨O.银白杨+三倍体山杨

图2 三倍体山杨不同对照的流式细胞仪检测图
注:表中数据为平均值±标准差。
3结论与讨论
3.1野生杨属物种的倍性
使用流式细胞仪鉴定杨属物种的倍性,其结果准确可靠,并且可在1天的时间内分析大量材料,而且对材料不需要做复杂的处理,大幅度节省时间、提高效率。通过对我国杨属白杨组2种,青杨组8种,大叶杨组1种倍性的研究,发现除山杨有天然三倍体居群外,其余全部为二倍体,3个种青杨、大叶杨和辽杨与前人报道结果一致,其余8个种为首次报道。结合前人研究,可知已报道的杨属20余种都为二倍体,天然三倍体植株普遍存在,但仅限于白杨组和少部分黑杨组物种,没有发现混倍体、非整倍体或者四倍体。我国具有丰富的杨树资源,特有的青杨组物种32种,占我国杨属的大部分,我国是世界青杨组的分布中心和变异中心,其中西南地区更是我国青杨组物种的分布中心[24-25]。本研究选取了西南地区有代表性的青杨组物种,包括已广泛用于育种研究的滇杨,分布广泛的冬瓜杨、青杨、川杨和具有特殊地理分布的德钦杨、康定杨,为西南青杨组的倍性研究提供参考,同时又选取位于我国东北部的辽杨和梧桐杨,结果表明地理隔离下不同青杨组物种的倍性没有差异。在植物中,营养体的大小往往和倍性有关,多倍体往往伴随着营养体的巨大化如叶大株高[13],而在杨属物种中,青杨组包括大叶型的冬瓜杨等和小叶型的青杨等,本次取样包括有大叶型的冬瓜杨、梧桐杨等和小叶型的辽杨和青杨等,实验结果表明,待测青杨组物种都为二倍体,不论是大叶型还是小叶型,叶形大小仅为不同种之间存在的形态上的差异。而在白杨组山杨物种中,叶形大小可能表明植株之间的倍性差异,而不是物种之间的差异。同时本研究依据这一形态学性状结合野外观察首次发现了山杨的天然三倍体植株,经流式细胞仪检测也验证了其倍性。
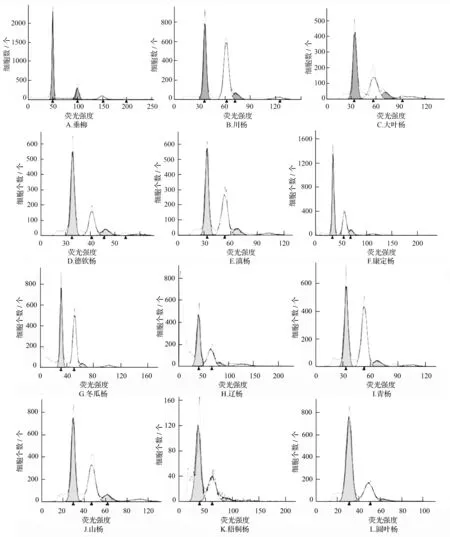
图3 杨属11个种和垂柳的流式细胞仪的检测图
3.2天然三倍体山杨的价值及成因
山杨是我国广泛分布的乡土树种,从东北大小兴安岭、完达山至华北、西北、华中乃至西南的众多省区,包括黑龙江、河北、甘肃、青海、江苏、云南、西藏等23个省[26],山杨为高海拔强阳性树种,根孽力强,常在撂荒地、采伐迹地和火烧迹地成片或散生。本次发现三倍体山杨在叶型大小上与此前发现的欧洲山杨和美洲山杨类似[13-15],同时枝条也更加粗壮,因此在干形、生长速率等方面可能也具有三倍体普遍的优势,故此优质的山杨遗传资源对山杨育种的发展有重要的意义。
Montzing[15]认为欧洲山杨三倍体的起源是受环境影响诸如森林火灾、异常低温或者高温的刺激,二倍体杨树的花粉母细胞不正常的减数分裂产生2n花粉,2n花粉较正常的花粉体积明显偏大,此2n雄配子与正常减数分裂的雌配子受精进而长成天然三倍体。朱之悌等[11]在大量观察毛白杨不同种源地无性系的花粉后证实存在有大花粉粒,经研究是2n花粉。天然三倍体除以单株存在外,也有以林分形式存在的,特别是北美西部发现的美洲山杨三倍体[19]。白杨组三倍体植株的发现与报道比较普遍,这跟白杨组物种的根萌繁殖特性有极大关系:在美国西部发现的由47 000棵根萌无性系组成的美洲山杨是世界最大的生物体[27]。白杨组三倍体植株通过无性繁殖,在母树根部萌发出幼树,因而白杨组三倍体植株可呈群落分布。杨树天然三倍体在欧洲和北美西部的广泛分布表明三倍体杨树更能适应当地的气候。以北美西部为例,由科迪勒拉山系形成的高原山地气候寒冷干燥,在此地区发现根萌的克隆植株与三倍体植株的分布区重叠,可推测寒冷的气候可能有利于产生未减数孢子,同时在低温、干旱条件下,根萌的无性繁殖方式比有性繁殖消耗的营养更少,是更有效的种群适应机制。由于三倍体植株在细胞大小、细胞含水量、气孔大小和密度、生长速率等方面与普通二倍体有明显差别,这也使得其更适应严酷的生境[19]。本次发现的天然三倍体山杨地处横断山脉最北端,海拔3 700 m,该处寒冷干燥,山杨往往成群落分布,可能根萌无性系占多数。三倍体山杨的生境与前人发现欧洲山杨和美洲山杨的三倍体高海拔生境类似,说明三倍体的形成及白杨组物种特有的根萌现象与生境有极大的关系。
此次的三倍体山杨为我国首次发现的天然三倍体山杨植株,性状优良,是良好的育种资源。因为山杨的广布性和我国生态环境的多样性,山杨的天然三倍体在我国一定还有大量的分布,特别是在西藏芒康、云南迪庆等高海拔高寒地区。由于白杨组的根萌特性使得三倍体植株能够很好的保留下来并且实现快速繁殖,因而成居群形式的三倍体植株更容易被发现和利用。相信在不久的将来会有更多的山杨天然三倍体被发现,为杨树育种提供更多优良资源。
参考文献
[1]王战,方振富,赵士洞,等.中国柳属新植物(一)[J].东北林学院植物研究室汇刊,1984(9):1-21.
[2]BLACKBURN K B, HARRISON J W H. A preliminary account of the chromosomes and chromosome behaviour in the Salicaceae[J]. Annals of Botany,1924,38:361-378.
[3]康向阳.杨树染色体数目和形态观察[J].甘肃农业大学学报,1996,31(1):67-70.
[4]齐力旺,张守攻,韩素英,等.杨属青杨组种(品种)间核型比较[J].云南植物研究,2004,26(5):537-542.
[5]张守攻,陈成彬,韩素英,等.中国部分杨属植物的染色体数目[J].植物分类学报,2005,43(6):539-544.
[6]QI C L, JIN C L, LI K L, et al. Comparison of photosynthetic characteristics and leaf anatomy structure of different ploidyPopulusussuriensisKom.[J]. Plant Physiology Journal,2010,46(9):917-922.
[7]康向阳.林木多倍体育种研究进展[J].北京林业大学学报,2003,25(4):70-74.
[8]邢新婷,张志毅,张文杰.三倍体毛白杨无性系木材热学性质变异初探[J].北京林业大学学报,2000,22(6):21-23.
[9]李云.杨树三倍体选育研究进展[J].植物学通报,2001,18(4):451-458.
[10]NILSSON E H. Note regarding the gigas form ofPopulustremulafound in nature[J]. Hereditas,1936,21(1/2):372-382.
[11]朱之悌,康向阳,张志毅.毛白杨天然三倍体选种研究[J].林业科学,1998,34(4):22-31.
[12]康向阳.关于杨树多倍体育种的几点认识[J].北京林业大学学报,2010,32(5):149-153.
[13]QIAN Z, SHAN Z L, HUI Q Z, et al. Expression profiling of NBS-encoding genes in a triploid white poplar[J]. Journal of Plant Biochemistry and Biotechnology,2015,24(3):283-291.
[14]BUIJTENEN J P, JORANSON P N, EINSPAHR D W. Diploid versus triploid aspen as pulpwood sources with reference to growth, chemical, physical and pulping differences[J]. Tappi,1958,41(4):170-175.
[15]MONTZING A. The chromosomes of a giantPopulustremala[J]. Hereditas,1936,21(1/2):383-393.
[16]ANNA J W, WILLIE M C, CHRISTINE V, et al. Level 2 validation of a flow cytometric method for detection of Escherichia coli O157:H7 in raw spinach[J]. International Journal of Food Microbiology,2015,215:1-6.
[17]MIHO S, ICHIRO S, TAKAFUMI S, et al. A high-throughput direct fluorescence resonance energy transfer-based assay for analyzing apoptotic proteases using flow cytometry and fluorescence lifetime measurements[J]. Analytical Biochemistry,2015,73(6):10-17.
[18]杨倩,陈欣,张平冬,等.杨树2n花粉形态判别方法的比较[J].东北林业大学学报,2015,43(2):33-46.
[19]MOCK K E, CALLAHAN C M, IALAM F M N, et al. Widespread triploidy in western north american aspen (Populustremuloides)[J]. PloS One,2012,7(10):1310-1315.
[20]白凤莹,曾青青,康宁,等.毛白杨基因库优树倍性检测及性状对比分析[J].北京林业大学学报,2015,37(4):113-119.
[21]田新民,周香艳,弓娜.流式细胞术在植物学研究中的应用—检测植物核DNA含量和倍性水平[J].中国农学通报,2011,27(9):21-27.
[22]汪艳,肖媛,刘伟,等.流式细胞仪检测高等植物细胞核DNA含量的方法[J].植物科学学报,2015,33(1):126-131.
[23]BENNETT M D, LEITCH I J. Nuclear DNA amounts in angiosperms-targets, trends and tomorrow[J]. Annals of Botany,2011,107(3):467-590.
[24]尹春英,彭幼红,罗建勋,等.杨属遗传多样性研究进展[J].植物生态学报,2004,28(5):711-722.
[25]王明福.基于ISSR与ITS序列分析四川乡土杨属植物的亲缘关系[D].成都:四川农业大学,2012.
[26]白卉.山杨遗传多样性研究与核心种质构建及利用[D].哈尔滨:东北林业大学,2010.
[27]GRANT M C, MITTON J B, LINHART Y B. Even larger organisms[J]. Nature,1992,360:216-216.
Ploidy Testing of 11 Poplar Species and Discovery of Natural TriploidPopulusdavidianaDode
Zhao Fengbin, Shang Ce, Zhang Limei, Zhang Zhixiang
(Beijing Forestry University, Beijing 100083, P. R. China)//Journal of Northeast Forestry University,2016,44(6):23-27.
We found a large leaves form ofPopulusdavidianaat Mangkang in in Xizang. Compared with leaves type between the big leaves aspen and norsmal aspen speculate the large one is triploid aspen. Then, we verified it using flow cytometry. It was the first time that the natural triploid aspen was reported. We used the flow cytometry to determine the ploidy level of the 11 species containingP.davidiana,P.rotundifoliain Section Leuce,P.lasiocarpain Section Leucoides andP.cathayana,P.haoana,P.maximowiczii,P.pseudomaximowiczii,P.purdomii,P.yunnanensis,P.szechuanica, andP.kangdingensisin Section Tacamahaca. All 11 species were diploid. The results ofP.cathayana,P.maximowiczii,P.lasiocarpawere the same with those of previous research, and the rest was reported for the first time. Results manifested that the species of the genusPopulusshared stabilized ploidy level without tetraploid. Ploidy studies combining blade research show that the leaves size is the only morphological difference in different species in SectionTacamahaca, but it may be ploidy difference in speciesP.davidiana.
KeywordsFlow cytometry; Natural triploid; Poplar; Ploidy
第一作者简介:赵奉彬,男,1991年2月生,北京林业大学自然保护区学院,硕士研究生。E-mail:zhaofengbin@bjfu.edu.cn。 通信作者:张志翔,北京林业大学自然保护区学院,教授。E-mail:zxzhang@bjfu.edu.cn。
收稿日期:2015年10月20日。
分类号S722.3;Q949.4
1)国家自然科学基金项目(J1310002)。
责任编辑:潘华。

