125I-MIL50在大鼠体内的药代动力学及生物分布
雷 晓,朱晓霞,王德才,孟志云,甘 慧,顾若兰,吴卓娜,郑 颖,李 俭,吕 明,窦桂芳
(1.泰山医学院,山东 泰安 271000;2.军事医学科学院 野战输血研究所,北京 100850;3.军事医学科学院 基础医学研究所,北京 100850)
125I-MIL50在大鼠体内的药代动力学及生物分布
雷晓1,2,朱晓霞2,王德才1,孟志云2,甘慧2,顾若兰2,吴卓娜2,郑颖2,李俭2,吕明3,窦桂芳2
(1.泰山医学院,山东 泰安271000;2.军事医学科学院 野战输血研究所,北京100850;3.军事医学科学院 基础医学研究所,北京100850)
摘要:为探究125I标记重组抗蓖麻毒素(Ricin)人源化单克隆抗体(125I-MIL50)在大鼠体内的药代动力学、生物分布及排泄特点,采用Iodogen法对MIL50进行125I标记,结合TCA法测定不同时间125I-MIL50在大鼠血清、组织、体液和排泄物中的含量。结果表明:Ricin染毒组和直接给药组血药浓度在14 d内没有差异,14 d后染毒组125I-MIL50消除快于未染毒组;血清中125I-MIL50浓度高于其他组织和体液,肾、膀胱组织中浓度较高,脑、脊髓、脂肪等脂性组织中浓度一直较低;125I-MIL50给药后27 d内经尿累积排泄率约为62.6%,经粪便的排泄率为15.5%。研究结果为临床实验和给药方案提供参考依据。
关键词:蓖麻毒素;125I-MIL50;药代动力学;生物分布;排泄
蓖麻毒素蛋白(Ricin)是从蓖麻籽中提取的一种核糖体失活蛋白,由A、B两个肽链以二硫键共价连接[1],A链是效应链,通过B链几乎能与所有的真核细胞结合。中毒后在人体内的潜伏期约为8 h,随后出现发烧、呕吐、肌肉疼痛、无力等症状[2]。一分子的Ricin进入细胞,可以使细胞蛋白质的合成抑制或停止,其毒性是氰化物的6000倍[3]。Ricin为白色粉末或结晶性固体,相对分子质量约为66 kD,溶于酸性稀释液或盐类水溶液[4],性质稳定,在半乳糖溶液中保存半月不失活。基于这些特点,美国疾病控制中心把蓖麻毒素列为具有中度威胁的 “B”武器,因此研究预防与治疗策略十分必要。
蓖麻毒素的解毒剂一直是研究热点,主要包括中和抗体、拮抗肽、底物类似物解毒剂、小分子拮抗剂等[5-7],如美国研制的重组RTA突变体RiVax,已经完成临床前研究[8-9]。重组抗蓖麻毒素人源化单克隆抗体注射液(MIL50)是军事医学科学院基础医学研究所在鼠源单抗4C13基础上进行人源化改造获得的抗蓖麻毒素的中和抗体[10-12],能有效降低血清中Ricin的浓度。蛋白类药物容易受体内其他物质干扰,不易直接测定,目前常用的方法是同位素示踪法[13-14]。放射性核素125I半衰期为60 d,发出的γ射线能量为35.5 keV,便于检测,多采用Iodogen法对蛋白多肽类药物进行125I标记后测定放射性活度[15-17]。
本文采用同位素示踪法研究放射性125I-MIL50在大鼠体内的药代动力学、生物分布及排泄特征,为临床研究提供参考。
1实验材料
1.1主要药品与试剂
MIL50:浙江海正药业股份有限公司生产,北京天广实生物技术股份有限公司检验;125I- MIL50:北京市北方生物技术研究所标记和纯化;Ricin:军事医学科学院基础医学研究所提供;Iodogen试剂:SIGMA-ALORICH公司;三氯乙酸:国药集团化学试剂有限公司。
1.2实验动物
Wistar大鼠:共54只,雄性48只,雌性6只,购于军事学科学院实验动物中心。动物生产许可证编号:SCXK(军)2012-004;实验动物使用许可证编号:SYXK-(军)2012-0021。
2实验方法
2.1125I-MIL50制备
用Iodogen法标记MIL50:称取1 mg Iodogen试剂溶于0.5 mL氯仿中,取50 μL混合液加至试管底部,经氮气吹干后依次加入0.2 mL MIL50(蛋白含量为5.63 g/L), 1.1×105kBq的Na125I,室温下震荡反应10 min。标记反应混合物经10 mm×500 mm的sephadex-G50凝胶柱分离纯化,洗脱液为0.01 mol/mL的磷酸盐缓冲液(PBS,pH=7.4),流速为1.0 mL/min。
纯化后的标记混合物经分子排阻色谱法(molecular exclusion chromatography,MEC)测定放化纯度,放射性活度为18.358 GBq/L。岛津LC-20T系统,配以部分收集器,300 mm×7.8 mm的TSK-GEL G3000SWXL凝胶柱,洗脱液为0.01 mol/mL的PBS(pH=7.4)。分别采用蛋白质定量试剂盒(BCA法)和酶联免疫吸附剂测定法(ELISA)法测定蛋白含量和标记前后免疫活性。
2.2125I-MIL50的方法学测定
用大鼠血清做方法学全验证,代表组织做方法学部分验证,以保证测定结果的可靠性。
2.2.1标准样品配制和处理
用空白大鼠血清将125I-MIL50稀释成放射性比活度为16.667、33.333、66.667、133.333、333.333、666.667、1 666.667、3 333.333、10 000 Bq/mL的标准样品,制备低、中、高(放射性比活度分别为33.333、333.333、10 000 Bq/mL)的质控样品。取100 μL样品,加入等体积的20%三氯醋酸(trichloroacetic acid,TCA)终浓度为10%,测定总放射性活度;离心,去上清液,测定酸沉放射性活度。
2.2.2酸沉率
制备不同放射性活度(Bq/mL)的标准样品和质控样品100 μL,测定总放射性活度和酸沉放射性活度,测定酸沉率。
2.2.3血清精密度和准确度测定
放射性比活度为33.333、333.333、10 000 Bq/mL的质控样品,每一浓度配置6个样本,重复3批,测定总放射性和酸沉放射性活度,随行当天配置的标准曲线,计算质控样品的浓度,计算准确度和精密度。
2.2.4血清样品稳定性
放射性为33.333、333.333、10 000 Bq/mL质控样品,每个浓度采6个样品,4 ℃冰箱放置2 d,随行当天配置的标准曲线,测定总放射性活度和酸沉放射性活度。
2.2.5组织方法学
匀浆制备大鼠的肝、肾、小肠空白组织,用空白组织制备标准曲线和质控样品,测定总放射性活度和酸沉放射性活度。
2.3药代动力学比较
受试品为125I-MIL50,进行动物实验前用非标记的MIL50稀释至2.0 g/L,药物比活度为1.695×105Bq/mg。
为比较125I-MIL50在Ricin染毒大鼠和未染毒大鼠体内的药代动力学特征,取12只雄性Wistar大鼠,分为染毒组和未染毒组,每组6只。染毒组腹腔注射剂量12 μg/kg的Ricin,染毒后1 h尾静脉注射剂量为1 mg/kg(每kg重的大鼠给予1.0 mg 的125I-MIL50)的125I-MIL50,放射性比活度1.695×105Bq/kg,该剂量下抗体和毒素的摩尔比为36∶1。未染毒组直接给予相同剂量的125I-MIL50。给药后5 min、1 h、4 h、8 h、24 h、2 d、3 d、4 d、5 d、6 d、7 d、9 d、10 d、12 d、14 d、16 d、18 d、21 d、29 d、34 d眼眶取血(每次取血约250 μL),离心分离后取100 μL血清,测定总放射性和酸沉放射性活度,用血清中的放射性活度计算MIL50含量。
2.4125I-MIL50在大鼠体内的生物分布
24只雄性Wistar大鼠,平均分成4组,每组6只,静脉给予2.2 mg/kg的125I-MIL50,放射性比活度为3.730×105Bq/kg,分别于给药后1 h、24 h、8 d、35 d处死。
6只雌性Wistar大鼠,编号A、B、C、D、E、F,静脉给予2.2 mg/kg 的125I-MIL50,放射性比活度为3.730×105Bq/kg,于给药后1 h处死。
分别取共23种组织或体液。每种组织称重,匀浆,测定总放射性活度和酸沉放射性活度。
2.5125I-MIL50在大鼠体内代谢
6只雄性Wistar大鼠,静脉给予2.2 mg/kg的125I-MIL50,放射性比活度为3.730×105Bq/kg,单独饲养。给药后不同时间点收集尿样和粪样,记录体积和称重,粪便用生理盐水混悬,测定放射性活度,计算排出放射性占给药放射性总量的百分比。
6只雄性Wistar大鼠,用戊巴比妥钠麻醉后实施胆汁插管术,引流胆汁,静脉注射剂量2.2 mg/kg的125I-MIL50,放射性比活度为3.730×105Bq/kg,于不同时间点收集胆汁,测定胆汁的放射性,计算排出放射性占给药放射性总量的百分比。
2.6数据处理
组织分布实验中,采用配对t检验的统计方法比较雌、雄之间有无差异,药代组统计学比较采用Student’s-t检验,其他数据用Microsoft Excel和MicroCal Origin 7.5软件进行数据处理和制图。
3结果与讨论
3.1125I-MIL50的制备
标记化合物纯化后与非标记的MIL50经分子排阻色谱法分析,非标记的MIL50的保留时间为7.573 min,125I-MIL50的放射性主峰为第8管。表明洗脱出的放射性主峰为标记蛋白,放化纯度为98.1%。125I-MIL50蛋白含量为0.269 g/L,标记后其生物活性为标记前的95.6%。
3.2125I-MIL50的方法学确定
不同组织和体液加入125I-MIL50,在1.667~10 000 Bq范围内,TCA沉淀放射性的线性关系良好,相关系数均大于0.99。定量下限为5倍本底1.667 Bq。批间精密度10.5%~13.9%,批内精密度1.1%~10.8%,准确度误差-10.1%~0.2%。血清样品放置2 d测定相对误差(RE)为-15.4%~0.7%。方法学确证结果符合方法学要求。
3.3125I-MIL50在大鼠体内的药代动力学
Wistar大鼠尾静脉注射1.0 mg/kg125I-MIL50 后,平均血药浓度-时间曲线示于图1。由图1可知,Wistar大鼠经尾静脉注射125I-MIL50后,体内药物浓度逐渐降低,14 d之内,染毒组与空白组两种给药方式的血药浓度基本保持一致,14 d之后,染毒组药物浓度消除速率快于未染毒组。34 d、14 d主要药代动力学参数分别列于表1、表2。由表1可知,用34 d之内的血药浓度计算药代动力学参数,AUC0-t、Vd、MRTlast、CL等均有统计学差异;由表2可知,用14 d之内的血药浓度计算,主要参数无统计学差异。结果表明,两种给药方式的差异出现在14 d后,可能是在低浓度下,抗原抗体结合形成抗原-抗体复合物,加快其在大鼠体内的消除。因此,在临床中对Ricin染毒患者进行救治时,要考虑抗原抗体复合物对MIL50在体内代谢过程和药效的影响,给予患者最佳的治疗方案。

图1 125I-MIL50 血药浓度-时间曲线Fig.1 Plasma concentration-time curve
3.4125I-MIL50在大鼠体内的生物分布
Wistar大鼠静脉给予2.2 mg/kg的125I-MIL50后,不同时间各组织和体液内的药物浓度列于表3。由表3可知,给药后,体内组织中均检测到放射性,MIL50分布于各个组织和器官;主要放射性集中在血清中,且血清中的浓度一直高于组织中的浓度,表明125I-MIL50不会与组织特异性结合,在组织中无蓄积性;胃肠内容物种的放射性可能是由125I-MIL50在体内被各种酶代谢,产生酸性和碱性片段,通过胃肠壁的分泌进入胃肠道;肾和膀胱中的含药量一直较高,125I-MIL50可能经尿排泄,可进一步经体内排泄实验进行证明;脂肪、脑、脊髓等组织中的药物浓度一直较低,125I-MIL50不易进入脂性强的组织,不易透过血脑屏障;24 h组织和体液的药物浓度在雌、雄个体之间的差异无统计学意义,125I-MIL50在大鼠体内的分布无性别差异。
3.5125I-MIL50在大鼠体内的排泄
Wistar大鼠静脉注射2.2 mg/kg的125I-MIL50后,粪、尿、胆汁累积排泄率示于图2。由图2可知,0~120 h内,从胆汁排泄的放射性活度占总给药量放射性活度的4.5%±1.6%。 0~27 d内,从尿液排泄的放射性活度占总给药量放射性活度的62.6%±4.4%,从粪便中排泄的放射性药物量占总给药量放射性的15.5%±0.9%。表明MIL50主要经尿排泄,与组织分布中肾脏内药物浓度一直较高相符。
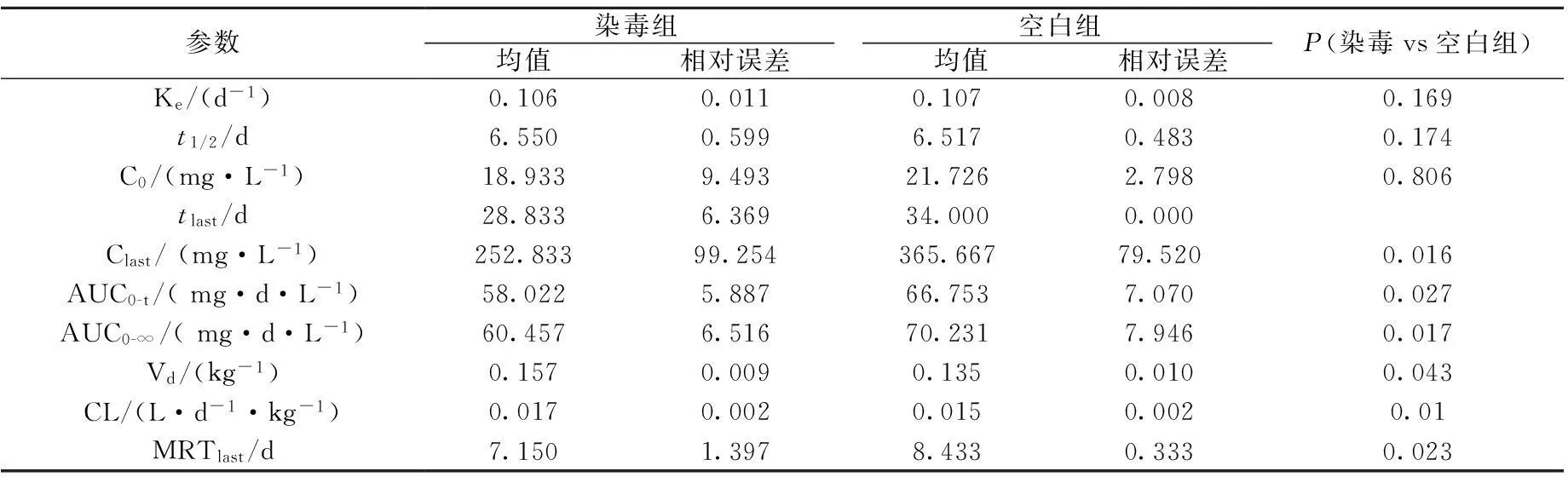
表1 125I-MIL50 34 d药代动力学参数(n=6)
注:AUC0-t为药时曲线下面积,Vd为表观分布容积,MRTlast为平均驻留时间,CL为清除率

表2 125I-MIL50 14 d药代动力学参数(n=6)

表3 Wistar大鼠尾静脉注射125I-MIL50后各组织中的药物浓度
注:1) 雌雄个体之间无差异,P>0.05;— 表示低于定量下限。

图2 Wistar 大鼠静脉注射125I-MIL50累积排泄率Fig.2 Cumulative excretion rateof125I-MIL5 after iv. injection to Wistar rats
4小结
本研究建立了灵敏度高、操作简便、重现性好的同位素示踪法研究MIL50在大鼠体内的动力学、生物分布和排泄特点,同时探究Ricin染毒对MIL50在大鼠体内动力学的影响。Ricin染毒在低浓度时加快125I-MIL50在大鼠体内的消除;125I-MIL50与组织无特异性结合,不易进入脂性组织;125I-MIL50在体内主要经尿排泄。
参考文献:
[1]Griffiths G D. Understanding ricin from a defensive viewpoint[J]. Toxins, 2011, 3(11): 1 373-1 392.
[2]李楠,黎继烈,朱晓媛. 蓖麻毒蛋白的研究进展[J]. 中国油脂,2013,38(6):24-27.
Li Nan, Li Jilie, Zhu Xiaoyuan. Research progress on ricin[J]. China Oils and Fats, 2013, 38(6): 24-27(in Chinese).
[3]张任鹏. 蓖麻毒素单克隆抗体的制备[D]. 吉林:吉林大学,2013.
[4]常春,焦媛媛,方琪,等. 蓖麻中毒与检测方法的研究进展[J]. 西北药学杂志,2012,27(4):394-397.
Chang Chun, Jiao Yuanyuan, Fang Qi, et al. Progress in the intoxication and detection of castor[J]. Northwest Pharmaceutical Journal, 2012, 27(4): 394-397(in chinese).
[5]Smallshaw J E, Vitetta E S. Ricin vaccine development[J]. Curr Top Microbiol Immunol, 2012, 357: 259-272.
[6]Yermakova A, Klokk T I, Cole R, et al. Antibody-mediated inhibition of ricin toxin retrograde transport[J]. Mbio, 2014, 5(2): e00995-e00995.
[7]Hu W G, Yin J, Chau D, et al. Humanization and characterization of an anti-ricin neutralization monoclonal antibody[J]. PLoS One, 2012, 7(9): e45595.
[8]Smallshaw J E, Richardson J A, Pincus S, et al. Preclinical toxicity and efficacy testing of RiVax, a recombinant protein vaccine against ricin[J]. Vaccine, 2005, 23(39): 4 775-4 784.
[9]Smallshaw J E, Richardson J A, Vitetta E S. RiVax, a recombinant ricin subunit vaccine, protects mice against ricin delivered by gavage or aerosol[J]. Vaccine, 2007, 25(42): 7 459-7 469.
[10]Guo J, Shen B, Sun Y, et al. A novel neutralizing monoclonal antibody against both ricin toxin A and ricin toxin B, and application of a rapid sandwich enzyme-linked immunosorbent assay[J]. Hybridoma, 2006, 25(4): 225-229.
[11]Wang Y, Guo L, Zhao K, et al. Novel chimeric anti-ricin antibody C4C13 with neutralizing activity against ricin toxicity[J]. Biotechnol Lett, 2007, 29(12): 1 811-1 816.
[12]Luo L, Luo Q, Guo L, et al. Structure-based affinity maturation of a chimeric anti-ricin antibody C4C13[J]. Biomol Struct Dyn, 2014, 32(3): 416-423.
[13]杨婷婷,廖建民,江欣,等. 多肽ADWX-1在大鼠体内的药代动力学研究[J]. 药物生物技术,2012,19(4):334-337.
Yang Tingting, Liao Jianmin, Jiang Xin, et al. Pharmacokinetic study of polypeptide ADWX-1 in rats[J]. Pharmaceutical Biotechnology, 2012,19(4): 334-337(in Chinese).
[14]谢瑛. 生物大分子药物的标记及其药代动力学研究[D]. 上海:第二军医大学,2010.
[15]于秋菊,朱晓霞,王德才,等.125I-rAncrod在大鼠体内的组织分布与代谢[J]. 同位素,2015,28(2):107-112.
Yu Qiuju, Zhu Xiaoxia, Wang Decai, et al. Tissue distribution and metabolism of125I-rAncord in Wistar Rats[J]. Journal of Isotopes, 2015,28(2): 107-112(in Chinese).
[16]Gupta S, Batra S, Jain M. Antibody labeling with radioiodine and radiometals[J]. Methods Mol Biol, 2014, 1 141(2): 147-157.
[17]Lindegren S, Andrade L N, Bäck T, et al. Binding affinity, specificity and comparative biodistribution of the parental murine monoclonal antibody MX35(Anti-NaPi-2b) and its humanized version rebmab200[J]. PLoS One, 2015, 10(5): e0126298.
Pharmacokinetics and Biodistribution of125I-MIL50 in Wistar Rats
LEI Xiao1,2, ZHU Xiao-xia2, WANG De-cai1, MENG Zhi-yun2, GAN Hui2,U Ruo-lan2, WU Zhuo-na2, ZHENG Ying2, LI Jian2, LÜ Ming3, DOU Gui-fang2
(1.TaishanMedicalUniversity,Tai’an271000,China;2.InstituteofTransfusionMedicine,AcademyofMilitaryMedicalScience,Beijing100850,China;3.InstituteofBasicMedicalScience,AcademyofMilitaryMedicalScience,Beijing100850,China)
Abstract:In order to study the impact of Ricin on the pharmacokinetics of125I-MIL50 and to investigate the tissue distribution and excretion of125I-MIL50 in Wistar rats, MIL50 was labeled with125I using the Iodogen method. Then, the concentration of125I-MIL50 in serum、tissues、body fluids and excretions was measured by TCA method at different time. The results showed that25I-MIL50 was eliminated faster after 14 days in the Ricin administrated group. The concentration of125I-MIL50 in serum was always higher than that in other tissues. The level in kidney and bladder were high and in brain, spine and fat were low. The cumulative excretion rate of125I-MIL50 was 62.6% in urine, and 15.5% in feces within 27 days. Ricin could fasten the elimination of125I-MIL50 when the concentration of125I-MIL50 was low in Wistar rats. It might because of the interaction between antigen and antibody.125I-MIL50 had no specific combination with tissues and it could hardly entered into lipophilic tissues. Urinary excretion represented the major pathway of elimination of125I-MIL50. The results of the study provide a reference for clinical trials and drug administration program.
Key words:Ricin;125I-MIL50; pharmacokinetics; biodistribution; excretion
收稿日期:2016-01-26;修回日期:2016-03-10
基金项目:国家高技术研究发展计划项目(2012AA022001-05)
作者简介:雷晓(1990—),女,山东泰安人,药理学专业 通信作者:窦桂芳,博士,研究员,E-mail: douguifang@vip.163.com;王德才,教授,E-mail: dcwang@tsmc.edu.cn
中图分类号:TL92+3
文献标志码:A
文章编号:1000-7512(2016)02-0065-06
doi:10.7538/tws.2016.29.02.0065

