纳米二氧化锰对水中Cu2+和Cd2+的吸附特性
黄一帆,于志红,廉菲,沈跃,宋正国
农业部环境保护科研监测所,天津 300191
纳米二氧化锰对水中Cu2+和Cd2+的吸附特性
黄一帆,于志红,廉菲,沈跃,宋正国*
农业部环境保护科研监测所,天津300191
摘要采用水相-有机相两相法合成了纳米二氧化锰(nMnO2),观测了其对水中Cu2+和Cd2+的吸附性能,并应用Langmuir、Freundlich、准一级动力学、准二级动力学和Elovich等方程分析了nMnO2对Cu2+和Cd2+的吸附特征。结果表明:nMnO2比表面积为141.66 m2�g;nMnO2对Cu2+和Cd2+的吸附分别在750和300 min达到平衡,吸附过程符合准二级动力学模型与Elovich模型,nMnO2对Cd2+的吸附速率要高于Cu2+;nMnO2对Cu2+和Cd2+的吸附特征符合Langmuir方程,其对Cu2+和Cd2+的最大吸附量分别为104.5和89.1 mg�g;nMnO2对Cu2+和Cd2+的吸附过程中,ΔG<0,ΔH<0,而ΔS>0,温度升高有利于吸附反应的进行,提高温度会提高nMnO2对重金属离子的吸附性能;nMnO2对Cu2+和Cd2+的吸附能力受pH(3~6)影响较大,提高体系的pH,会明显增加nMnO2对Cu2+和Cd2+的吸附量。该nMnO2合成工艺简单,对重金属Cu2+和Cd2+具有较好的吸附性能,是较好的吸附材料。
关键词铜;镉;纳米二氧化锰(nMnO2);吸附
工业污泥和垃圾农用、污水农灌、大气中的污染物沉降以及农药长期施用等活动正加剧农田土壤中重金属的累积[1]。如何有效控制环境(土壤、水体)中重金属生物活性,一直是该领域的研究热点。水体环境中的重金属处理方法有多种,如调节pH沉淀絮凝法、电动修复法、吸附剂吸附法、离子交换法、生物修复法等。其中,吸附剂吸附法由于其效果好、周期短及成本低等优势,成为热门的修复方法[2]。
近年来,活性炭、吸附树脂、污泥、改性纤维素和改性壳聚糖等吸附方法常见报道[2-3]。Luo等[4]利用改性污泥对模拟废水中的Cr6+进行吸附,吸附量为6.84 mgg。戴静等[5]在不同温度下热解制备生物炭后发现,700 ℃热解制备的生物炭对Cd2+的平衡吸附量可达60.61 mgg,远超过300~600 ℃下热解制备的生物炭。叶林顺等[6]将稻草改性制成吸附材料,开展了铜吸附研究,发现改性后稻草对铜的吸附量可达46.8 mgg。Fei等[7]以3-氨丙基三乙氧基硅烷、丙烯酸共聚物和丁烯酸制备了磁性纳米铁氧化物改性的树脂材料,其对Cu2+和Cd2+的吸附量分别为126.9和29.6 mgg。
纳米材料具有不饱和性,易与其他原子相结合而稳定下来的特性,被广泛用于水体环境中重金属离子的去除与固化,纳米微孔材料特殊表面结构和表面化学特性使其对重金属具有吸附能力[8-10],但较为复杂的制备工艺制约其发展及应用。纳米二氧化锰(nMnO2)是一种过渡金属氧化物,其物理化学性质稳定,粒径小且具有多孔结构,有较大的比表面积,表面存在大量的羟基活性基团[11],易于质子化以及脱质子化,能够为金属离子提供结合位点[12],对重金属离子具有明显的吸附作用。邹卫华等[13]用盐酸与高锰酸钾制备δ型MnO2粉末,对Cu2+和Pb2+进行吸附研究,结果表明,该种MnO2对Cu2+和Pb2+的最大吸附量分别为72.4和351.9 mgg,其吸附行为符合准二级动力学模型。赵颖等[14]用甲苯还原高锰酸钾制备了nMnO2,该材料表面含有大量的活性羟基基团,对Cd2+的去除率可达99.36%。Zhang等[15]用介孔δ型MnO2吸附Cu2+,吸附量达97.9 mgg,吸附过程可用Elovich方程很好地拟合,更加符合准二级动力学模型。
目前,将锰氧化物作为吸附材料用于污染物的处理是研究热点,在水处理领域应用广泛。但nMnO2吸附水体环境中Cu2+和Cd2+的研究较为鲜见。本试验参考Subramanian等[16]的方法,在常温中性条件下,利用高锰酸钾与无水乙醇直接反应制备出nMnO2,研究其吸附Cu2+和Cd2+的特性,以期为Cu2+和Cd2+污染水体修复提供技术支撑。
1材料与方法
1.1材料
nMnO2使用水相-有机相两相法制备:向16.67 gL的高锰酸钾溶液中逐滴加入10 mL无水乙醇,全程电磁搅拌机(IKA Rct B S25)搅拌,用滤纸(Whatman No.42)抽滤后60 ℃烘干,在玛瑙碾钵碾碎后过100目尼龙筛,储存备用。制备的nMnO2是棕黑色粉末状固体,经XRD(X射线衍射)检测,其为无定形二氧化锰,纯度大于99%。nMnO2扫描电子显微镜照片见图1。由图1可以看出,该方法制备的MnO2已经达纳米级,呈微球状,粒径多数在20~30 nm以内。

图1 纳米二氧化锰扫描电子显微镜照片Fig.1 The photos of SEM for nMnO2
1.2吸附动力学
1.3吸附热力学
吸附试验采用平衡法。分别称取0.02 g nMnO2,置于40 mL棕色玻璃瓶中,加入0.01 molL的硝酸钠溶液后,添加0.01 molL硝酸铜或硝酸镉溶液至20.0 mL;使溶液中Cu2+浓度为15.89、31.78、47.66、63.55、79.44、95.33、142.99和190.65 mgL,Cd2+浓度为14.05、28.10、42、56.21、70.26、84.31、126.46和168.62 mgL;玻璃瓶密封后水平放置于摇床中,分别在15、25和35 ℃下振荡24 h后,用滤纸过滤;利用原子吸收光谱仪测定滤液中Cu2+或Cd2+浓度;根据吸附平衡前后Cu2+或Cd2+浓度差计算nMnO2吸附量。试验重复3次,取平均值。
1.4pH对吸附的影响
采用平衡法进行试验,称取0.02 g nMnO2,分别置于40 mL棕色玻璃瓶中;向棕色玻璃瓶中加入0.01 molL的硝酸钠溶液,然后添加0.01 molL硝酸铜或硝酸镉溶液至20.0 mL;使溶液中Cu2+浓度为15.89、31.78、47.66、63.55、79.44、95.33、142.99和190.65 mgL,Cd2+浓度为14.05、28.10、42、56.21、70.26、84.31、126.46和168.62 mgL;用优级纯硝酸和分析纯氢氧化钠溶液调整体系pH为3~6,在25 ℃下振荡24 h后,滤纸过滤;原子吸收光谱仪测定滤液中Cu2+和Cd2+浓度。试验重复3次,取平均值。
1.5数据拟合与分析
采用准一级和准二级动力学模型拟合nMnO2吸附Cu2+和Cd2+过程。
准一级动力学模型:
qt=Qe·(1-e-k1t)
(1)
准二级动力学模型:
tqt=1(k2·Qe2)+tQe
(2)
式中:qt为t时刻时的平衡浓度,mgL;t为吸附时间,min;Qe为平衡吸附量,mgg;k1为准一级动力学模型参数,Lmin;k2为准二级动力学模型参数,g(mg·min)。
采用Elovich模型对试验结果进行分析,模型如下:
Qe=ln(αE·βE)βE+lntβE
(3)
式中:αE为1 min内吸附量,mg(g·min);βE为Elovich模型解吸参数,gmg。
采用Langmuir和Freundlich方程来描述吸附平衡。
Langmuir等温式:
CeQe=1(Qm·b)+CeQm
(4)
Freundlich等温式:
lgQe=1n·lgCe+lgK
(5)
式中:Ce为平衡后溶液中吸附质的浓度,mgL;Qm为单分子层饱和吸附量,mgg;b为Langmuir常数,mg-1;n为Freundlich模型参数;K为Freundlich常数。
吸附过程的吉布斯自由能变化(ΔG)、焓变(ΔH)以及熵变(ΔS)等热力学参数根据下列公式确定:
ΔG=-RTlnka
(6)
ΔG=ΔH-TΔS
(7)
式中:R为理想气体常数,8.314 J(mol·K);T为热力学温度,K;ka为平衡常数,Lmg。
试验所有数据均采用Excel 2003和SPSS 21.0统计软件进行处理。
2结果与分析
2.1吸附动力学试验
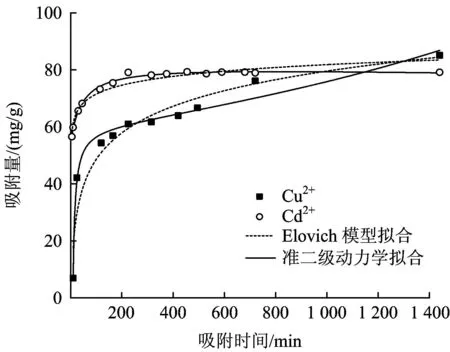
图2 nMnO2对Cu2+和Cd2+的吸附动力学拟合Fig.2 Adsorption of Cu2+and Cd2+kinetics equation by nMnO2
nMnO2对Cu2+和Cd2+的吸附动力学见图2。从图2可以看出,nMnO2对Cu2+和Cd2+吸附量随着时间增加而不断增加,但二者的吸附平衡时间存在差异。在前200 min, nMnO2对Cd2+的吸附量迅速增加,此后吸附量增幅变缓,在300 min达到平衡状态。在前250 min,nMnO2对Cu2+的吸附量迅速增加,在750 min逐渐达到平衡状态。由此可知,nMnO2对Cu2+和Cd2+吸附过程可能存在差别。
为研究nMnO2吸附Cu2+和Cd2+的动力学特征,采用准一级动力学模型和准二级动力学模型对吸附过程进行模拟,模拟结果见表1。从表1可以看出,利用准二级动力学模型拟合nMnO2对Cu2+和Cd2+的吸附,效果较好,且化学吸附是吸附速率的限定步骤。

表1 nMnO2吸附Cu2+和Cd2+的吸附动力学方程拟合参数
为进一步描述nMnO2吸附Cu2+和Cd2+的化学过程,采用Elovich模型对Cu2+和Cd2+动力学参数进行拟合(图2)。Elovich模型中,参数αE可看作1 min内求得的最初的重金属离子的吸附量,βE表示对重金属离子吸附速率快慢的度量,与吸附速率有关。结果表明,Elovich模型可以较好地拟合nMnO2对Cu2+和Cd2+的吸附过程(表1)。Cd2+的βE较Cu2+更大,说明nMnO2对Cd2+的吸附速率更快,综合对比二者的拟合结果可知,Elovich模型对Cd2+吸附过程的模拟要优于Cu2+。
2.2等温吸附曲线
nMnO2对Cu2+和Cd2+的吸附能力不同(图3)。在Cu2+和Cd2+初始浓度较低时,nMnO2对Cu2+和Cd2+的吸附较完全。对Cu2+和Cd2+的吸附特征进行拟合,相关系数均在0.84以上,拟合效果较好(表2)。其中,用Langmuir方程的拟合效果明显优于Freundlich方程,说明nMnO2吸附可能更趋向于均匀介质表面的单层吸附。nMnO2对Cu2+的饱和吸附量(Qm)为104.5 mgg,对Cd2+的饱和吸附量为89.1 mgg,表明nMnO2材料对Cu2+和Cd2+均有较强的吸附作用。

图3 nMnO2吸附Cu2+和Cd2+的等温曲线Fig.3 Adsorption isotherms of Cu2+and Cd2+by nMnO2

表2 Langmuir和Freundlich方程拟合参数
2.3温度对nMnO2吸附Cu2+和Cd2+的影响
在不同温度下,nMnO2对Cu2+和Cd2+的吸附曲线趋势差别不明显,表明温度变化对其吸附Cu2+和Cd2+的影响不大(图4)。根据热力学方法,分别求得nMnO2对Cu2+和Cd2+吸附反应的吉布斯自由能变,进而求得焓变与熵变(表3)。其中,ΔG<0,ΔS<0,ΔH>0,说明该吸附过程是自发过程。该反应的ΔH>0,说明温度越高,吉布斯自由能变绝对值越大,反应越容易进行。

图4 温度对nMnO2吸附Cu2+和Cd2+的影响Fig.4 Effect of temperature on adsorption ofCu2+and Cd2+by nMnO2

离子T∕KΔH∕(kJ∕mol)ΔS∕〔J∕(mol·K)〕ΔG∕(kJ∕mol)Cu2+288.15298.15308.1521.3422.7924.86-87.81-87.81-87.81-21.31-22.77-24.83Cd2+288.15298.15308.1563.8266.1972.47-214.16-214.16-214.16-63.76-66.13-72.40
2.4pH对nMnO2吸附Cu2+和Cd2+的影响
不同pH下,nMnO2对Cu2+和Cd2+的吸附能力明显不同(图5)。pH为3~6时,nMnO2对Cu2+的吸附性能随着pH的增加而明显增大,pH为6时其对Cu2+的吸附能力达到最大。pH为3~6时,随着pH的增加,nMnO2对Cd2+的吸附能力有增加的趋势。但pH为4、5、6时,nMnO2对Cd2+的吸附能力差别不大;而pH为3时,nMnO2对Cd2+的吸附能力最低,最大吸附量降低约30%。nMnO2对Cu2+和Cd2+吸附性能受体系的pH影响较大。
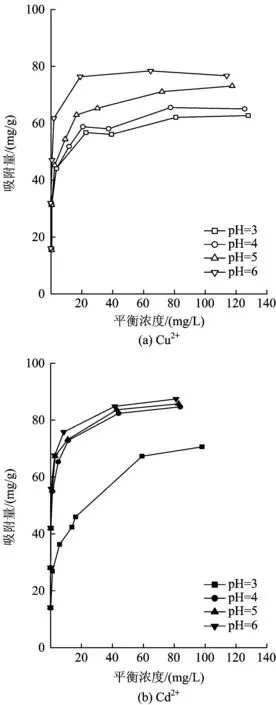
图5 pH对nMnO2吸附Cu2+和Cd2+的影响Fig.5 The effect of different pH on adsorption ofCu2+and Cd2+by nMnO2
3讨论
本试验采用的nMnO2是利用滴加乙醇至高锰酸钾溶液,形成有机-无机两相界面缓慢反应生成的微孔结构[17-18],这与韩玲等[19]利用高锰酸钾和葡萄糖通过一步水热法合成的纺锤形nMnO2明显不同。试验制得的nMnO2为微球状,经测定,nMnO2的比表面积达141.6 m2g,是曾超等[20]合成的nMnO2改性多壁碳纳米管比表面积的1.38倍,是商业二氧化锰比表面积的2.33倍[21],较大的比表面积使nMnO2具有更多的吸附位点。
不同条件下的吸附试验表明,nMnO2在水相中吸附重金属离子的过程可以很快达到平衡,在较广的pH范围和较大的温度范围内适用。nMnO2在水溶液中吸附Cu2+和Cd2+初始的3 h内速率很快,但随着吸附时间的增加,吸附量增速减慢。Zhang等[15]采用δ型MnO2吸附Cu2+,吸附量在初期提高很快,与本试验结果一致。nMnO2对重金属离子的吸附过程是溶液中的重金属离子聚集到nMnO2表面,导致表面离子吸附位点达到饱和,然后出现离子交换,将重金属离子交换下来,最后完成内部扩散达到平衡。通过Elovich模型分析,nMnO2吸附Cu2+和Cd2+的速率不同,对Cu2+的吸附速率要低于Cd2+,nMnO2吸附重金属离子是由于表面羟基等化学基团的作用,反应开始时,nMnO2表面具有大量的吸附位点,此时的吸附可能是反应速率较快的单分子层吸附[22]。
不同温度对nMnO2吸附Cu2+和Cd2+性能没有明显影响。试验合成的nMnO2吸附量皆随着温度的升高而增加。Cu2+和Cd2+的水合离子半径分别为4.19和4.26×10-1nm[23],nMnO2对Cu2+和Cd2+的吸附性能差异并不明显。吸附热力学反映了nMnO2吸附重金属离子可能存在物理和化学吸附2种形式。温度的升高既活化了nMnO2的吸附位点,增加了位点数目,又降低了反应的活化能,有利于化学键的形成。温度与nMnO2吸附重金属离子的性能呈正相关关系。
nMnO2对Cu2+和Cd2+的吸附性能受到pH的影响较大,在pH为3~6时,随着pH的升高,其对Cu2+的吸附能力显著升高。刘艳等[24]研究表明,纳米二氧化钛吸附Cu2+和Cd2+的性能也随着pH的升高而升高。过渡金属氧化物材料表面具有丰富的羟基,致使其电荷零点(PZC)较低(PZC≈2.3)[25]。试验合成的nMnO2的PZC为2.4,小于试验设定的pH(3~6);nMnO2表面所带的负电荷会随着pH的升高而增多。相比高pH,较低pH的溶液中的H+浓度较高,竞争性结合nMnO2表面的负电荷,减弱了Cu2+和Cd2+的吸附能力。随着溶液pH的变化,表面因为发生质子化以及脱质子反应而带电荷,在较低pH时,nMnO2表面质子化程度较高,使得表面带有正电,从而降低了材料的吸附能力。
nMnO2作为新型吸附材料,在不同pH、不同温度水体中对Cu2+和Cd2+都有较好的去除能力。众所周知,nMnO2作为一种表面能巨大的无机金属氧化物纳米材料,在水溶液中很容易自发团聚而失去吸附能力。因此,容易团聚的问题仍待解决。
4结论
(1)采用水相-有机相两相法合成了nMnO2,其比表面积为141.66 m2g。
(2)nMnO2对Cu2+和Cd2+的吸附分别在750和300 min达到平衡,吸附过程符合准二级动力学模型及Elovich模型,表明其对Cd2+的吸附速率要高于Cu2+。
(3)nMnO2对Cu2+和Cd2+的最大吸附量分别为104.5和89.1 mgg;吸附过程中,ΔG<0,ΔH<0,而ΔS>0,表明温度升高有利于吸附反应的进行。
(4)nMnO2对Cu2+和Cd2+的吸附能力受pH影响较大。
参考文献
[1]宋正国,唐世荣,丁永祯,等.不同磷肥对棕壤吸附铜的影响[J].生态环境学报,2010,19(8):1964-1968.
SONG Z G,TANG S R,DING Y Z,et al.Effects of different phosphate fertilizers on copper sorption in brown soil[J].Ecology and Environmental Sciences,2010,19(8):1964-1968.
[2]DIVAKARAN R,ANTONY P A J,ANOOP K K,et al.Adsorption of nickel(Ⅱ) and chromium(Ⅵ) ions by chitin and chitosan from aqueous solutions containing both ions[J].International Journal of Scientific & Technology Research,2012,1:43-50.
[3]DENG S,WANG P,ZHANG G,et al.Polyacrylonitrile-based fiber modified with thiosemicarbazide by microwave irradiation and its adsorption behavior for Cd(Ⅱ) and Pb(Ⅱ)[J].Journal of Hazardous Materials,2016,215:64-72.
[4]LUO J,PANG Z H,HU Y Y,et al.Characterization of Cr(Ⅵ) removal and total Cr equilibrium adsorption by sulfate reducing granular sludge in stimulant wastewater[J].Environmental Science,2010,31(11):2691-2698.
[5]戴静,刘阳生.四种原料热解产生的生物炭对Pb2+和Cd2+的吸附特性研究[J].北京大学学报(自然科学版),2013,49(6):1075-1082.
DAI J,LIU Y S.Adsorption of Pb2+and Cd2+onto biochars derived from pyrolysis of four kinds of biomasses[J].Acta Scientiarum Naturalium Universitatis Pekinensis,2013,49(6):1075-1082.
[6]叶林顺,刘慧璇,谢咏梅,等.改性稻草吸附铜离子的动力学机理[J].环境科学与技术,2006,29(8):28-30.
YE L S,LIU H X,XIE Y M,et al.Kinetics of adsorption of copper ion by modified rice straw[J].Environmental Science & Technology,2006,29(8):28-30.
[7]FEI G,MENG M L,YE H,et al.Effective removal of heavy metal ions Cd2+,Zn2+,Pb2+,Cu2+from aqueous solution by polymer-modified magnetic nanoparticles[J].Journal of Hazardous Materials,2012,211:366-372.
[8]GUPTA K,MAITY A,GHOSH U C.Manganese associated nanoparticles agglomerate of iron(Ⅲ) oxide:synthesis,characterization and arsenic(Ⅲ) sorption behavior with mechanism[J].Journal of Hazardous Materials,2010,184:832-842.
[9]BISWAS B K,INOUE J,INOUE K,et al.Adsorptive removal of As(Ⅴ) and As(Ⅲ) from water by a Zr(Ⅳ)-loaded orange waste gel[J].Journal of Hazardous Materials,2008,154:1066-1074.
[10]SONG Z G,LIAN F,YU Z H,et al.Synthesis and characterization of a novel MnOx-loaded biochar and its adsorption properties for Cu2+in aqueous solution[J].Chemical Engineering Journal,2014,242:36-42.
[11]EDELSTEIN A S,CAMMARATRA R C.Nanomaterials:synthesis,properties and applications[M].Boca Raton:CRC Press,1998.
[13]邹卫华,刘晨湘,江利,等.二氧化锰对铜、铅离子的吸附研究[J].郑州大学学报(工学版),2006,26(3):15-19.
ZOU W H,LIU C X,JIANG L,et al.Single and binary component adsorption of copper cation and lead cation from aqueous solutions using fresh δ-MnO2[J].Journal of Zhengzhou University (Engineering Science),2006,26(3):15-19.
[14]赵颖,王仁国,曾武,等.纳米二氧化锰的制备及其对Cd2+的吸附研究[J].环境科学与技术,2012,35(3):112-116.
ZHAO Y,WANG R G,ZENG W,et al.Preparation of nano-MnO2and adsorption of Cd2+[J].Environmental Science & Technology,2012,35(3):112-116.
[15]ZHANG H,XU M,WANG H,et al.Adsorption of copper by aminopropyl functionalized mesoporous delta manganese dioxide from aqueous solution[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2013,435:78-84.
[16]SUBRAMANIAN V,ZHU H,WEI B.Alcohol-assisted room temperature synthesis of different nanostructured manganese oxides and their pseudocapacitance properties in neutral electrolyte[J].Chemical Physics Letters,2008,453(4):242-249.
[17]姚士芹,施文健,刘正豪,等.新生态二氧化锰对水中碱性染料的脱色作用[J].化学教育,2008,28(12):48-49.
[18]BAILEY S E,OLIN T J,BRICKA R M,et al.A review of potentially low-cost sorbents for heavy metals[J].Water Research,1999,33(11):2469-2479.
[19]韩玲,倪纪朋,张良苗,等.纺锤形介孔纳米二氧化锰的控制合成[J].物理化学学报,2011,27(3):743-748.
HAN L,NI J P,ZHANG L M,et al.Controlled synthesis of mesoporous MnO2nanospindles[J].Acta Physico-Chimica Sinica,2011,27(3):743-748.
[20]曾超,俞亭超,王晓卉,等.二氧化锰改性多壁碳纳米管吸附水中Sb(Ⅲ)[J].浙江大学学报(工学版),2013,47(11):1951-1957.
ZENG C,YU T C,WANG X H,et al.Adsorption of Sb(Ⅲ)in aqueous by MnO2-modified carbon nanotubes[J].Journal of Zhejiang University(Engineering Science),2013,47(11):1951-1957.
[21]樊耀亭,吕秉玲,徐杰,等.水溶液中二氧化锰对铀的吸附[J].环境科学学报,1999,19(1):42-46.
FAN Y T,LÜ B L,XU J.et al.Adsorption of uranium on manganese dioxide in aqueous solution[J].Acta Scientiat Cicumstantite,1999,19(1):42-46.
[22]于志红,黄一帆,廉菲,等.生物炭-锰氧化物复合材料吸附砷(Ⅲ)的性能研究[J].农业环境科学学报,2015,34(1):155-161.
YU Z H,HUANG Y F,LIAN F,et al.Adsorption of arsenic(Ⅲ) on biochar-manganese oxide composites[J].Journal of Agro-Environment Science,2015,34(1):155-161.
[23]Jr NIGHTINGALE E R.Phenomenological theory of ion solvation:effective radii of hydrated ions[J].The Journal of Physical Chemistry,1959,63(9):1381-1387.
[24]刘艳,梁沛,郭丽,等.负载型纳米二氧化钛对重金属离子吸附性能的研究[J].化学学报,2005,63(4):312-316.
LIU Y,LIANG P,GUO L,et al.Study on the adsorption behavior of heavy metal ions on nanometer TiO2supported on silica gel[J].Acta Chimica Sinica,2005,63(4):312-316.
[25]白德奎,朱霞萍,王艳艳,等.氧化锰,氧化铁,氧化铝对砷(Ⅲ)的吸附行为研究[J].岩矿测试,2010,29(1):55-60.
BAI D K,ZHU X P,WANG Y Y,et al.Study on adsorption behaviors of As(Ⅲ) by manganese oxide,iron oxide and aluminum oxide[J].Rock and Mineral Analysis,2010,29(1):55-60.□
Adsorption Properties of Nano MnO2for Cu2+and Cd2+in Water
HUANG Yifan, YU Zhihong, LIAN Fei, SHEN Yue, SONG Zhengguo
Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China
AbstractNano manganese dioxide (nMnO2) was synthesized by the two-phase method of aqueous phase and organic phase, its adsorption property of Cu2+and Cd2+in water observed, and the Cu2+and Cd2+adsorption characteristics analyzed by Langmuir, Freundlich, Pseudo-first-order kinects, Pseudo-sceond-order kinects and Elovich model. The results showed that the nMnO2specific surface area is 141.66 m2g. The adsorption of Cu2+and Cd2+reached equilibrium in 750 min and 300 min, respectively, the adsorption process followed pseudo-second-order kinetics model and Elovich model, and the adsorption rate of Cd2+was higher than that of Cu2+. The adsorption characteristics of nMnO2on Cu2+and Cd2+fit the Langmuir equation, and the maximum adsorption amount of Cu2+and Cd2+was 104.5 mgg and 89.1 mgg respectively. In the adsorption process of Cu2+and Cd2+,ΔG<0,ΔH<0 andΔS>0, temperature increase favored the adsorption reaction, so the temperature improving would increase the adsorption of nMnO2on heavy metal ions. The adsorption ability of nMnO2on Cu2+and Cd2+was greatly influenced by pH in the range of 3-6. The improvement of the system pH would increase the adsorption capacity of nMnO2on Cu2+and Cd2+. The synthesis process of nMnO2is simple and it has good adsorption performance on heavy metal Cu2+and Cd2+, and it can thus be used as a good adsorption material.
Key wordscopper; cadmium; nMnO2; adsorption
收稿日期:2015-12-28
基金项目:国家自然科学基金项目(41273136);国家高技术研究发展计划(863计划)项目(2012AA101404-5)
作者简介:黄一帆(1991—),男,硕士研究生,主要从事污染环境的生物化学修复研究,yifan_huang@outlook.com *通讯作者:宋正国(1975—),男,研究员,博士,主要从事污染环境的生物化学修复研究,forestman1218@163.com
中图分类号:X52
文章编号:1674-991X(2016)04-0350-07
doi:10.3969�j.issn.1674-991X.2016.04.052
黄一帆,于志红,廉菲,等.纳米二氧化锰对水中Cu2+和Cd2+的吸附特性[J].环境工程技术学报,2016,6(4):350-356.
HUANG Y F, YU Z H, LIAN F, et al.Adsorption properties of nano MnO2for Cu2+and Cd2+in water[J].Journal of Environmental Engineering Technology,2016,6(4):350-356.

