胡椒生物碱提取、几何结构以及红外光谱的研究
李 鑫,史金儒,羊梦诗,鲁 燚,陈 亮,曹华茹,2*
1. 浙江农林大学工程学院,浙江 临安 311300
2. 浙江省林业生物质化学利用重点实验室,浙江 临安 311300
3. 郑州大学生命科学学院,河南 郑州 450001
胡椒生物碱提取、几何结构以及红外光谱的研究
李 鑫1,史金儒3,羊梦诗1,鲁 燚1,陈 亮1,曹华茹1,2*
1. 浙江农林大学工程学院,浙江 临安 311300
2. 浙江省林业生物质化学利用重点实验室,浙江 临安 311300
3. 郑州大学生命科学学院,河南 郑州 450001
以海南胡椒果为原料,95%乙醇溶液为溶剂,采用回流法提取胡椒生物碱。通过调节pH值除去胡椒酸,乙醚除去脂溶物,用丙酮为溶剂重结晶纯化胡椒生物碱,并用高效液相色谱仪检测其纯度,以及对胡椒生物碱进行了红外光谱表征。同时运用密度泛函B3LYP/6-31G(d, p)方法,对胡椒生物碱的结构进行优化、频率和能量的计算,得到四种构型(构型Ⅰ胡椒碱、构型Ⅱ异胡椒碱、构型Ⅲ异胡椒脂碱和构型Ⅳ胡椒脂碱)的64种构象的稳定结构,并利用吉布斯自由能计算常温(298.15 K)下四种构型分子体系稳定构象的热力学平衡分布。并对实验红外光谱与理论红外光谱的特征峰进行了对比。结果表明,所提取的胡椒生物碱主要以构型Ⅰ中的构象1结构存在,即胡椒碱结构; 经纯化后得到胡椒碱含量为7%,纯度达99%。经分析建立的胡椒生物碱提取、分离和纯化方法效果良好,建立的胡椒生物碱模型能与实验结果相吻合。该研究对指导胡椒生物碱的提取、结构模型的建立、表征和应用有重大意义。
胡椒生物碱; 分离纯化; 结构模型; 热力学分布; 红外光谱
引 言
胡椒作为重要的热带香辛料植物,在各种方面都广泛的应用[1-2]。1951年初就引进到我国海南琼海县和兴隆都有华侨农场种植[3]。胡椒果不仅可以做成许多药剂[4],而且胡椒中的胡椒碱由于独特的性质,药用价值更大,具有抗菌杀虫[5]、抗氧化[6-9]、治疗腹泻[10-12]、抗抑郁症[13-14]、增强免疫[15-16]和抗癌[17]等功效。胡椒果中的主要成分为生物碱,挥发性油脂,蛋白质类,树脂油脂质,矿物成分和淀粉等[18-19]。其中,胡椒碱是从胡椒中提取、分离后得到的最具有实用价值的成分。胡椒碱的药用价值主要归功于分离得到含哌啶的生物碱成分。在抗肿瘤作用方面,胡椒碱有着独特的功效[17]。实验证明,在患有黑色素肿瘤的细胞上,胡椒碱可有效的抑制基质金属蛋白的产生,抑制NF-kappaB,CREB,c-Fos,ATF-2以及导致炎症的细胞因子的表达[20]。胡椒碱可降低促进肿瘤细胞增殖物质和多胺类的合成,其原理是保护蛋白质不受损伤,又有效抑制肿瘤细胞的增殖[21]。Sunila等[22]证明胡椒碱可以抑制埃利希氏腹水癌细胞和腹水淋巴瘤的细胞毒作用,抑制肿瘤的产生,还可增加Bal b/c 小鼠的白细胞和血小板数量。胡椒碱还可增加药物的生物利用度,但其原理仍不明确,Khajuria等[23]认为可能与改变膜质的动力学,或改变肠道中某些酶的构型,而促进药物的利用价值。
胡椒生物碱的提取包括有溶剂提取法[24-25],酸水提取法[26],超声波提取法[27],微波提取法[28],超临界流体二氧化碳提取法[29],超声波离子液体提取法[30]等。提取的胡椒生物碱按结构可分为4种构型异构体[31-32],胡椒碱是从胡椒中提取的这4类生物碱中活性最强,最具医用价值的。林子敬等[33-37]用密度泛函理论对多种氨基酸的构型性质,构型平衡分布,红外光谱性质和分子内相互作用进行了详细研究。于文博等[38-41]分析了五种类型的二肽分子构型的性质,氨基酸与二肽稳定构型的相关性以及对比了理论计算和实验的红外光谱图,通过新找到的构型完善前期实验结果的解释。本研究组前期运用密度泛函理论方法对寡肽链、低聚壳聚糖和丙烯腈单体[42-46]的几何结构、红外光谱、态密度和电子性质等物理化学属性进行了研究。
本文以95%的乙醇溶液为溶剂,采用溶剂提取法中的回流法提取胡椒生物碱,并用丙酮为溶剂对其进行了重结晶和纯化,用高效液相色谱仪检测胡椒生物碱的纯度,以及对胡椒生物碱进行了红外光谱表征。同时也通过密度泛函理论对实验提取胡椒生物碱的四种异构体的结构模型进行优化、能量和构型平衡分布的计算,并对每种构型中稳定构象的红外光谱分析。结合实验和理论分析,表明研究结果对胡椒生物碱的提取纯化,结构模型建立,红外特性表征,性能应用以及验证实验提取的胡椒生物碱的成分结构分析有着重要的作用。
1 实验部分
1.1 仪器及材料
海南胡椒果(海南特产黑胡椒粒,红土种植); 6.0 mol·L-1盐酸; 2.8 mol·L-1氢氧化钠; 95%乙醇(分析纯); 无水乙醇(分析纯); 甲醇(色谱纯); 乙醚(分析纯); 丙酮(分析纯); TG16G台式高速离心机(湖南凯达科学仪器有限公司); SENCO旋转蒸发仪(上海申生科技有限公司); LC-2000高压液相色谱仪(上海天美科学仪器厂); BS224S电子天平(北京赛多利斯科学仪器有限公司); UV-2550紫外可见分光光度计(北京普析通用仪器有限责任公司); DGG-9240A电热恒温鼓风干燥箱(上海森信实验仪器有限公司); DK-S22恒温水浴锅(国华电器有限公司); Nicolet 6700傅立叶红外光谱仪(赛默飞世尔科技分子光谱部)。
1.2 理论方法及模型
应用密度泛函理论B3LYP方法在6-31G(d,p)水平对胡椒生物碱4种构型的各种构象结构分别进行几何优化、频率、能量和热力学性质的计算。胡椒生物碱四种构型分别为构型Ⅰ胡椒碱(反,反),构型Ⅱ异胡椒碱(反,顺),构型Ⅲ异胡椒脂碱(顺,反)和构型Ⅳ胡椒脂碱(顺,顺)。其中构型Ⅰ胡椒碱分子的一系列构象结构由分子内的4个内在单键旋转决定,如C—Cα,C—Cβ,C—Cγ和C—N单键,如图1。经优化后得到四种构型的64种稳定构象,通过对稳定构象的能量和热力学平衡分布的比对,选出每种构型中平衡分布最多和能量最低的一种构象。同时分析胡椒生物碱四种构型理论红外光谱与实验光谱的特征峰,说明本实验中提取的胡椒生物碱的构型与构象。密度泛函理论采用的模型为托马斯-费米-狄拉克模型(1)[47]
(1)
B3LYP方法中交换能以Becke形式表示[48],相关能以LYP形式表示[49]。本文的计算和结果分析均使用Gaussian09[50]软件包。

图1 胡椒碱单键旋转自由度示意图
经优化得到了胡椒生物碱的四种构型中64种稳定构象,其几何结构如图2所示。物质的结构决定其物理化学性质,研究胡椒生物碱的功能首先需要确定其稳定的构象。所讨论的胡椒生物碱分子体系的稳定结构,对寻找胡椒生物碱可能最稳定的构型和构象以及分析其红外光谱、药理性质和构型构象变化等的研究都有着重要意义。
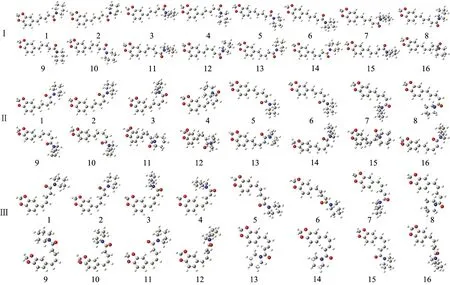

图2 胡椒生物碱优化后的4种构型64种稳定构象的结构模型
1.3 方法
1.3.1 胡椒生物碱的提取
以胡椒果为原料,将其研磨成60目粉末,取10 g胡椒粉末加入100 mL 95%乙醇溶液于80 ℃温度下回流2 h。进行抽滤收集滤液,将滤液进行减压蒸馏浓缩,对得到的滤渣用40 mL 95%乙醇浸泡和再次回流,回流条件与上述条件相同。将两份滤液合并进行减压蒸馏浓缩,浓缩至10~15 mL,用6 mol·L-1的盐酸调节pH 4,静置4 h。离心后过滤,除去不溶于酸的胡椒酸,滤液用NaOH溶液调节pH 11,静置2 h,然后在热水浴中缓慢加入20 mL蒸馏水,溶液变浑浊状,加适量蒸馏水,待有黄色沉淀析出,将溶液置于冰水中充分冷却4 h,在1 200转下离心10 min得到的黄色粉状固体,即粗胡椒生物碱。
1.3.2 胡椒生物碱的纯化
在得到的粗胡椒生物碱中加入25 mL丙酮,微热溶解。若有固体析出则进行热过滤; 若没有固体析出则加入与丙酮等量的蒸馏水,待有大量固体析出,进行离心、过滤得到固体,再向滤液中加入与丙酮等量的蒸馏水,待固体析出,再离心、过滤得到固体,重复此步骤2~3次。将得到的固体用乙醚去除脂溶性物质,经干燥得到较高纯度的淡黄色粉末胡椒生物碱,称量计算其产率。
1.3.3 胡椒生物碱的表征
(1)高压液相色谱表征
称0.1 g的胡椒生物碱溶解在20 mL甲醇中,用微滤膜过滤后测液相色谱。色谱柱为Diamonsil C18柱,流动相为甲醇,流速为0.25 mL·min-1,检测器为紫外检测器,柱温25 ℃,进样量为0.2 μL,检测波长为341 nm(紫外光谱测得的最大吸收波长)。
(2)红外光谱表征
压制溴化钾的空白片和含有胡椒生物碱的溴化钾样品片。先将100~200 mg干燥的KBr在玛瑙研钵中研磨,压成空白片; 再取纯化后干燥好的胡椒生物碱约1 mg,与100~200 mg干燥的KBr在玛瑙研钵中研磨,压成样品片。将溴化钾空白片放入光谱仪样品架上,采集参比背景光谱。再放入含有胡椒生物碱的样品片进行测定。得到胡椒生物碱的红外光谱,并在图谱库中进行了检索比对。
2 结果与讨论
2.1 胡椒生物碱的含量及纯度测定
由计算式(2)可求得胡椒生物碱在胡椒粉中的含量
样品中胡椒生物碱含量=
(2)
实验中所用的胡椒粉质量为10 g,经回流法提取和重结晶处理,得到纯度较高的胡椒生物碱为0.7 g。由上式计算可得胡椒粉中的胡椒生物碱含量为7%。对胡椒生物碱的液相色谱图进行了表征,根据面积归一法求得纯化后的胡椒生物碱的纯度。图3为胡椒生物碱的液相色谱图,根据紫外光谱所得结果,液相色谱检测的最大吸收波长为341 nm。由上式计算得到胡椒生物碱的纯度高达99.96%。

图3 胡椒生物碱的高效液相色谱图
上述结果表明本实验方法能够提取到较高产率的胡椒生物碱,是一种可用于提取胡椒生物碱的良好方法,且避免了传统提取方法中常用有机溶剂(如甲醇、氯仿等有毒性)的不足之处,也避免了酸提取法对水环境的污染。因此,该实验方法对胡椒生物碱的提取和开发应用有着重要的参考意义。
2.2 胡椒生物碱的能量和平衡分布
由于分子的构型和构象对偶极矩也非常敏感,因而分别计算了四种构型的64种构象的总能量(经零点能校正)、热力学数据和偶极矩,并计算了不同构象的相对能和同种构型的不同构象的热力学分布计算结果见表1。
表1 在298.15 K温度下不同构象的相对能、热力学平衡分布和偶极矩
Table 1 The relative energy, thermodynamic distribution and dipole moment of different conformations from different configurations at 298.15 K

构型构象异构体相对能/(kcal·mol-1)热力学平衡分布/%偶极矩/(a u )Ⅰ10 00041 6781 52220 02328 4351 52250 58315 1731 35960 57714 4361 401Ⅱ11 68033 9770 70121 69329 7630 79752 15719 9220 89762 20416 0170 774Ⅲ14 16630 9920 82054 13825 1020 89824 10624 7850 80864 09618 4440 871Ⅳ26 35827 4491 37316 39218 4901 37366 39217 1691 283136 44612 8031 28056 44912 4291 280146 45410 9001 265
注: 含量小于1%的未在表中列出。
根据统计学原理,利用体系准确计算的热力学数据可以计算出298.15 K温度下的吉布斯自由能数据,由此计算出常温下(298.15 K)胡椒生物碱的4种构型的64种构象的热力学平衡分布。如表1列出的含量大于1%的稳定构象的相对能、偶极矩和同种构型不同构象的平衡分布数据。Stepanian[51]等利用实验的红外光谱和各稳定构型的计算光谱估算出了实验条件下的缬氨酸分子结构的分布。本文运用另一种与林子敬[34]等同样的方法计算了常温下胡椒生物碱不同构型体系下的构象的分布情况。由表1中所有胡椒生物碱构象的相对能ER可知,胡椒生物碱四种构型中构型Ⅰ,Ⅱ,Ⅲ,Ⅳ的能量依次增高,其中构型Ⅰ中构象1的能量最低。由同种构型不同构象的热力学分布可知,在构型Ⅰ中有构象1,2,5,6这四种重要的构象共占整体99.722%的含量,其中构象1的分布最多为41.678%; 在构型Ⅱ中有构象1,2,5,6这四种重要的构象共占整体99.679%的含量,构象1的分布最多为33.977%; 构型Ⅲ中有构象1,5,2,6这四种重要的构象共占整体99.323%,构象1的分布最多为30.992%; 构型Ⅳ中有构象2,1,6,13,5,14这六种重要的构象共占整体99.240%的含量,构象2的分布最多为27.449%。由此可以得出胡椒生物碱能量越低的构型中的某一构象的分布含量越高,构象分布越集中,能量越高的构型中的某一构象的分布含量越低,构象分布越分散; 其中构型Ⅰ中的构象1的几何结构最稳定。
胡椒生物碱的稳定性与其几何结构有着重要的联系。由表1可知,胡椒生物碱四种构型中都以构象1的结构较稳定,结合图2所示,胡椒生物碱四种构型中构象1结构的共轭体系原子在同一平面内,这类构象比扭曲共轭键形成了氢键的构象结构更稳定。
2.3 胡椒碱红外光谱表征与对比
上述实验从胡椒果中提取到了纯度高达99.96%的胡椒生物碱,并用压片法对胡椒生物碱进行了红外光谱图的表征,如图4(a)为实验提取的胡椒生物碱的红外光谱图。此外也利用密度泛函理论建立了稳定的胡椒生物碱模型,计算得出四种构型中分布最多的构象分别为构型Ⅰ构象1、构型Ⅱ构象1、构型Ⅲ构象1和构型Ⅳ构象2,图4(b)为这四种结构胡椒生物碱的理论模拟的红外光谱图。

图4 (a) 实验中提取的胡椒生物碱的红外光谱图; (b) 理论模拟的胡椒生物碱四种构型的红外光谱图
Fig.4 (a) IR spectra of pepper alkaloid extracted in this experiment; (b) IR spectra of 4 kinds of pepper alkaloid configurations in the simulation

由图4(a)可知,实验所提取的胡椒生物碱在418.2 cm-1存在一个弱吸收峰; 在1 580~1 700 cm-1之间存在三个吸收峰,两个强吸收峰和一个中强吸收峰。图4(b)中构型Ⅰ构象1在424.44 cm-1处存在一个弱吸收峰; 在1 656.67和1 725.56 cm-1处存在羰基与六氢吡啶环振动的强吸收峰以及在1 681.08 cm-1处存在共轭体系的伸缩振动的中强吸收峰。由此说明实验提取的胡椒生物碱结构主要是以构型Ⅰ构象1的几何结构存在,即胡椒碱结构。将实验谱图4(a)与胡椒碱的标准谱图相比较,得到匹配度为88.61%。
综上所述,从胡椒生物碱的构型构象、能量、平衡分布以及红外光谱图可知,从实验中所提取胡椒生物碱的结构主要是以构型Ⅰ构象1的几何结构存在,即胡椒碱结构。同时也说明了实验提取的胡椒碱类物质为四种构型异构体的混合物。
3 结 论
采用回流法提取胡椒生物碱,并对其进行重结晶纯化以及红外光谱的表征。同时运用密度泛函B3LYP/6-31G(d, p)方法,对胡椒生物碱的结构进行优化、频率和能量的计算,并利用吉布斯自由能计算常温(298.15 K)下胡椒生物碱体系稳定构象的热力学平衡分布。对实验红外光谱与理论红外光谱的特征峰进行了对比。结果表明: (1)经理论模拟得到胡椒生物碱的四种构型(构型Ⅰ胡椒碱、构型Ⅱ异胡椒碱、构型Ⅲ异胡椒脂碱和构型Ⅳ胡椒脂碱)的64种构象的稳定模型; (2)构型Ⅰ的构象1的能量最低、几何结构最稳定; (3)实验所提取的胡椒生物碱为四种构型异构体的混合物,但主要以构型Ⅰ中的构象1结构存在,即胡椒碱结构; (4)采用以95%乙醇为溶剂的回流法提取胡椒碱,经丙酮为溶剂重结晶纯化后得到胡椒碱含量为7%,纯度达99%; (5)本文改进的提取胡椒生物碱的高效方法,能提取到含量较高的强活性和具有良好医用价值的胡椒碱。改进的胡椒碱提取、分离和纯化方法效果良好,建立的胡椒生物碱模型能与实验结果相吻合。本研究对指导胡椒生物碱的提取、结构模型的建立、表征和应用有重要意义。
[1] Pino J,Rodriguez-Feo G,Borges P,et al. Die Nahrung,1990,34(6): 555.
[2] Koul I B,Kapil A. Planta Med.,1993,59(5): 413.
[3] LONG Yu-zhou(龙宇宙). Processing and Utilizing of Product of Tropical Unique Spice and Beverage Crops(热带特色香辛饮料作物农产品加工与利用). Haikou: Hainan Press(海口: 海南出版社),2007. 63.
[4] WEI Kun,DOU De-qiang,PEI Yu-ping,et al(韦 琨,窦德强,裴玉萍,等). Chinese Materia Medica(中国中药杂志),2002,27(5): 328.
[5] Govindarajan V S. Crit. Rev. Food Sci. Nutr.,1977,9: 117.
[6] Mittal R,Gupta R L. Methods Find Exp. Clin. Pharmacol.,2000,22(5): 271.
[7] Vijayakumar R S,Surya D,Nalini N. Redox. Rep.,2004,9(2): 105.
[8] Ramasamy S V,Namasivayam N. Cell Biochemicalistry and Function,2006,24(6): 491.
[9] Lee C S,Han E S,Kim Y K. Eur. J. Pharmacol.,2006,537(1-3): 37.
[10] Bajad S,Bedi K L,Singla A K,et al. Planta Med.,2001,67(3): 284.
[11] Bajad S,Bedi K L,Singla A K,et al. Planta Med.,2001,67(2): 176.
[12] Capasso R,Izzo A A,Borrelli F,et al. Life Science,2002,71(19): 2311.
[13] Lee S A,Hong S S,Han X H,et al. Chem. Pharm. Bull.(Tokyo),2005,53(7): 832.
[14] Kong L D,Cheng C H,Tan R X. J. Ethnopharmacol,2004,91(2-3): 351.
[15] Pathak N,Khandelwal S. Biochemieal Pharmacol,2006,72(4): 486.
[16] Dogra R K,Khalma S,Shanker R. Toxicology,2004,196(3): 229.
[17] Pradeep C R,Kuttan G. Clin. Exp. Metastas.,2002,19(8): 703.
[18] Menon A N,Padmakumari K. J. Essent Oil Res.,2005,2(17): 153.
[19] Bai Y F,Xu H. Acta Pharmacologica Sinica,2000,21(4): 357.
[20] Pradeep C R,Kuttan G. Int Immunopharmacol,2004,4(14): 1795.
[21] Selvendiran K,Banu S M,Sakthisekaran D. Clin. Chim. Acta,2004,350(1-2): 73.
[22] Sunila E S,Kuttan G. J. Ethnopharmacol,2004,90 (2-3): 339.
[23] Khajuria A,Thusu N,Zutshi U. Phytomedicine,2002,9(3): 224.
[24] Subramanian R,Subbramaniyan P,Noorul Ameen J,et al. Arabian Journal of Chemistry,2011,doi:10.1016/j.arabjc.2011.06.022.
[25] MENG Zhao-hui,WANG Zhen-hui,ZHOU Shu-ping(孟召辉,汪振辉,周漱萍). J. Anal. Chem.(分析化学),1994,22(12): 1163.
[26] Kanaki N,Dave M,Padh H,et al. J. Nat. Med.,2008,62: 281.
[27] FAN Xiu-yu,YIN Ai-qun,SU Wei-guo,et al(范秀玉,尹爱群,苏维国,等). Drug Standards of China(中国药品标准),2004,5(5): 28.
[28] Girija R,Vilas G G. Ind. Eng. Chem. Res.,2002,41(10): 2521.
[29] CHEN Jian-hua,WENG Shao-wei,LI Zhong,et al(陈建华,翁少伟,李 忠,等). Fine Chemicals(精细化工),2010,27(10): 991.
[30] Cao X J,Ye X M,Lu Y B,et al. Anal. Chim. Acta,2009,640: 47.
[31] Ternes W,Krause E L. Anal. Bioanal. Chem.,2002,374: 155.
[32] Kozukue N,Park M S,Choi S H,et al. J. Agric. Food Chem.,2007,55: 7131.
[33] Huang Z J,Yu W B,Lin Z J. J. Mol. Struct. THEOCHEM,2006,81: 7.
[34] Zhang M L,Huang Z J,Lin Z J. J. Chem. Phys.,2005,122: 134313.
[35] Huang Z J,Yu W B,Lin Z J. J. Mol. Struct. THEOCHEM,2006,758:195.
[36] Ling S L,Yu W B,Huang Z J,et al. J. Phys. Chem. A,2006,110: 12282.
[37] Huang Z J,Lin Z J. J. Phys. Chem. A,2005,109: 2656.
[38] Yu W B,Lin Z J,Huang Z J. Chem. Phys. Chem.,2006,7: 828.
[39] Yu W B,Liang L,Lin Z J,et al. J. Comput. Chem.,2009,30: 589.
[40] Yu W B,Wu Z Q,Chen H B,et al. J. Comput. Chem.,2009,30: 2105.
[41] Yu W B,Xu X E,Li H B,et al. J. Phys. Chem. B,2012,116: 2269.
[42] LI Xin,YANG Meng-shi,YE Zhi-peng,et al(李 鑫,羊梦诗,叶志鹏,等). Acta Phys. Sin.(物理学报),2013,15: 156103-1.
[43] Li X,Yu S,Yang M S,et al. Physica E,2014,57: 63.
[44] LI Xin,ZHANG Liang,YANG Meng-shi,et al(李 鑫,张 梁,羊梦诗,等). Acta Phys. Sin.(物理学报),2014,7: 076102-1.
[45] LI Xin,YANG Meng-shi,XU Can,et al(李 鑫,羊梦诗,徐 灿,等). Spectroscopy and Spectal Analysis(光谱学与光谱分析),2014,34(9): 2331.
[46] Li X,Yang M S,Shi X,et al,Physica E,2015,69: 273.
[47] Von Weizsacker C F,Z. Phys.,1935,96: 431.
[48] Becke A D. Phys. Rev. A,1988,38: 3098.
[49] Lee C,Yang W,Parr R G. Phys. Rev. B,1998,37: 785.
[50] Frisch M J,Trucks G W,Schlegel H B,et al. Gaussian09, Revision C. 01, Gaussian, Inc., Wallingford CT,2009.
[51] Stepanian S G,Reva I D,Radchenko E D,et al. J. Phys. Chem. A,1999,103: 4404.
*Corresponding author
(Received Apr. 24, 2015; accepted Aug. 16, 2015)
Study on the Extraction, Geometry Structure and Spectral Characterization of Piperine Alkaloid
LI Xin1,SHI Jin-ru3,YANG Meng-shi1,LU Yi1,CHEN Liang1,CAO Hua-ru1,2*
1. School of Engineering, Zhejiang A&F University, Lin’an 311300, China
2. Zhejiang Provincial Key Laboratory of Chemical Utilization of Forestry Biomass, Zhejiang A&F University, Lin’an 311300, China
3. College of Life Sciences, Zhengzhou University, Zhengzhou 450001, China
Using pepper fruit of Hainan as raw material and 95% ethanol as solvent, the alkaloid in pepper is extracted with reflux method in this paper. The piperonylic acid is removed by adjusting the pH; the fat-soluble substance being removed by adding ethyl ether; the piperine alkaloid being purified with acetone by recrystallization anddetected with HPLC, as well as characterized with IR. The characterizations of piperine are discussed. Meanwhile, B3LYP/6-31G (d,p) method of DFT is applied to optimize the structure, calculate frequency and energy of pepper alkaloid, then obtain four kinds of configurations (configuration Ⅰ as Piperine, configuration Ⅱ as Iso Piperine, configuration Ⅲ as Iso Chavicine, configuration Ⅳ as Chavicine) with 64 kinds of stability conformational structure. The distribution of the thermodynamic equilibrium of stable conformations of four kinds of configurations of the molecular is calculated with Gibbs free energy at room temperature (298.15 K). And IR spectra of the experimental were compared with the IR spectra of the theoretical. The results show that the alkaloid extracted from pepper is mainly conformer 1 in configuration Ⅰ, that is, Piperine; after purifying, the content of piperine is 7% with the purity of 99%. With analysis, the methods of extraction, separation and purification of piperine in this paper achieve good results. Established models are in good agreement with the experimental results. This research is of great significance in guiding extracting process, building structural model and the characterization and application of piperine.
Piperine alkaloid; Separation and purification; Structural model; Thermodynamic distribution; IR spectrum
2015-04-24,
2015-08-16
国家自然科学基金项目(51103136)和浙江省大学生科技创新活动计划(新苗人才计划)项目(2014R412010)资助
李 鑫,1991年生,浙江农林大学高分子材料与工程专业本科生 e-mail: xin_li1991@foxmail.com *通讯联系人 e-mail: caohuaru@yeah.net
O641, O656.4
A
10.3964/j.issn.1000-0593(2016)07-2082-07

