漫反射光谱技术快速无创检测皮肤胆固醇
候华毅,董美丽,王贻坤,朱 灵,马祖长,刘 勇
1. 中国科学院合肥物质科学研究院应用技术研究所,安徽 合肥 230031
2. 中国科学技术大学,安徽 合肥 230026
3. 皖江新兴产业技术发展中心,安徽省生物医学光学仪器工程技术研究中心,安徽 铜陵 244000
漫反射光谱技术快速无创检测皮肤胆固醇
候华毅1, 2,董美丽1, 3*,王贻坤1, 3,朱 灵1, 3,马祖长1,刘 勇1, 3
1. 中国科学院合肥物质科学研究院应用技术研究所,安徽 合肥 230031
2. 中国科学技术大学,安徽 合肥 230026
3. 皖江新兴产业技术发展中心,安徽省生物医学光学仪器工程技术研究中心,安徽 铜陵 244000
针对皮肤胆固醇无创检测的迫切需求,设计了一种基于微型光谱仪的便携式和智能化的皮肤漫反射光谱实时测量系统。配制毛地黄皂苷—辣根过氧化物酶共聚物溶液,利用毛地黄皂苷可与皮肤胆固醇分子中的羟基特异性结合和辣根过氧化物酶能与TMB试剂(主要成分为3,3’,5,5’-四甲基联苯胺)反应显色的特性,实现皮肤胆固醇的高灵敏和高特异的识别与指示,并通过测量反应后颜色的变化程度来定量皮肤胆固醇的浓度。以与人体皮肤结构相近的猪皮肤为实验对象,采用萃取法获得梯度浓度的胆固醇样本,利用上述光谱测量系统检测样本内的胆固醇浓度来验证该方法的可行性。实验结果显示,相对漫反射率能够区分不同浓度的胆固醇样本,在特征单波长(442,450和463 nm)处和特征波段442~500 nm内,漫反射率强度因子均可以定量反映样本内的胆固醇浓度,经线性拟合,判定系数R2分别为0.960,0.959,0.958和0.958。研究结果表明,使用漫反射光谱技术可以实现皮肤胆固醇的快速无创检测,将其应用于动脉粥样硬化性疾病风险评估,对于该类疾病的防控具有重要意义。
皮肤胆固醇;无创检测;漫反射光谱;动脉粥样硬化
引 言
随着我国社会经济的发展,居民生活水平的提高,以及人口老龄化的加速,以动脉粥样硬化为基础的冠心病和缺血性脑卒中等心血管疾病的发病率正在逐步升高,成为国人健康的头号杀手。有效预防动脉粥样硬化性疾病的关键在于准确锁定高危人群。目前临床上广泛使用的动脉粥样硬化性疾病诊断方法是测定静脉血浆中的总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇和甘油三酯等指标[1]。上述方法需要在长时间空腹后采集血液样本以避免膳食中胆固醇的干扰。抽血会造成受试者疼痛,并伴有感染的风险,此外分析血浆胆固醇和脂蛋白水平过程复杂,需要特定的检测环境和昂贵的检测设备。以上这些不足,降低了人们进行血液胆固醇检测的意愿,不利于动脉粥样硬化性疾病的早发现。
皮肤是胆固醇新陈代谢的重要场所,人体内约11%的胆固醇存在于皮肤中[2]。研究结果显示,皮肤中胆固醇累积量与动脉粥样硬化性疾病的风险相关[3-5],并且相对于传统的血液胆固醇具有更好的相关性[6],皮肤胆固醇可以作为动脉粥样硬化性疾病的新型标志物。目前,皮肤胆固醇的常规测定方法是皮肤活检法,该方法在获取皮肤活体样本时会造成受试者疼痛,活检部位具有受感染的风险,需要经过训练的专业人员进行操作。而且,活检样本包含皮下脂肪等多层结构,其中一些是高度血管化的,这些样本包含了不同的胆固醇来源,不能得出可重复、可靠的胆固醇分析结果。因此,寻找新的皮肤胆固醇测量方法逐渐成为大家关注的焦点。
为准确检测皮肤组织中的胆固醇含量,Weerheim[7]利用胶带剥离和高效薄层色谱分离法来测量皮肤角质层脂质中的胆固醇,该方法使用三种连续的溶剂使脂质分离,然后通过染色和焦化的方法使组分显色,最后通过密度测定来确定脂质的相对含量,不是一种适于大范围简单快速测定胆固醇的方法;Hiroshi[8]通过分子印迹自组装单层膜电极探测器和高效液相色谱法,探测胆固醇萃取液前后的电流变化来反映皮肤胆固醇浓度,该方法的灵敏度受电极材料影响较大,临床使用有限;Mancini[9]通过光谱法在HSV颜色空间内对皮肤胆固醇进行定量测量,并结合Framingham风险评估方法实现了对动脉粥样硬化性疾病人群和正常人的分类,但在颜色空间内测量对光源等条件要求较高,需要特定的标准光源,限制了它的应用。
漫反射光谱技术是通过测量待测物对不同波长光的漫反射,获取有关物质信息的一种光谱分析技术。对通常吸收光谱无法直接测量的样品,它具有极大的优越性,并具有速度快、效率高、成本低、测试重复性高和测量方便等特点,已广泛应用于医药、食品加工等领域[10]。
在上述研究的基础上,本文根据胆固醇分子的化学特性,采用漫反射光谱技术,设计了一种基于微型光谱仪的光谱实时测量系统,检测特异性标记后的胆固醇。经光谱特性分析后,选择特征波长和波段,利用该波长处和波段内的相对漫反射率进行皮肤胆固醇浓度的定量分析。以与人体皮肤结构相近的猪皮肤为实验对象,采用萃取法获得梯度浓度的胆固醇样本,利用上述光谱测量系统实验验证了该方法的可行性,进而为利用该方法预测动脉粥样硬化性疾病风险打下基础。该方法克服了对光源的限制,并且具有活体、原位、实时和无创的优点,适用于大规模人群的筛查。
1 原理和测量系统设计
1.1 基于漫反射光谱的皮肤胆固醇检测原理
人体内的胆固醇以两种形式存在:游离胆固醇(约占30%)和胆固醇酯(约占70%)[11]。胆固醇酯在胆固醇酯酶的(cholesterol esterase, CHER)作用下水解成游离胆固醇[1],游离胆固醇分子中含有羟基(3β-OH),该羟基与毛地黄皂苷具有良好的亲和性,能以等分子的比例形成难溶于水的毛地黄皂苷—胆固醇化合物。辣根过氧化物酶(horseradish peroxidase, HRP)是一种含铁卟啉辅基的糖蛋白复合酶,在过氧化氢(H2O2)的作用下,与TMB显色剂(主要成分为3,3’,5,5’-四甲基联苯胺)发生显色反应。反应过程见式(1)—式(3)
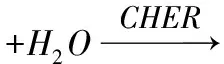
(1)
游离胆固醇+毛地黄皂苷→
毛地黄皂苷-胆固醇化合物+H2O
(2)
(3)
本文配制了毛地黄皂苷-辣根过氧化物酶的共聚物溶液,利用该共聚物中毛地黄皂苷和辣根过氧化物酶的特性实现胆固醇的标记,并产生显色反应。在一定条件下,漫反射光谱强度的变化与显色反应的颜色变化程度(胆固醇的浓度)呈对应关系,利用漫反射光谱测量显色反应后的颜色变化程度,进而定量皮肤胆固醇的浓度。
1.2 漫反射光谱实时测量系统的设计
根据上述检测原理,设计了一种基于微型光谱仪的漫反射光谱实时测量系统,该系统包括控制单元、光源单元、光学传输和耦合单元、光探测单元以及信息分析和处理单元。光源单元采用高亮度白光LED,出射光经准直透镜耦合进入入射光纤,并投射到显色反应后的液体(或标准漫反射白板)上,漫反射光经接收光纤耦合进入光探测单元,经A/D转换后由计算机进行数据处理与结果输出。光探测单元采用微型光栅光谱仪,检测波长范围为200~850nm,分辨率为5nm,内部光路采用MEMS结构,CCD采用SonyILX563A。测量系统结构原理图如图1所示。
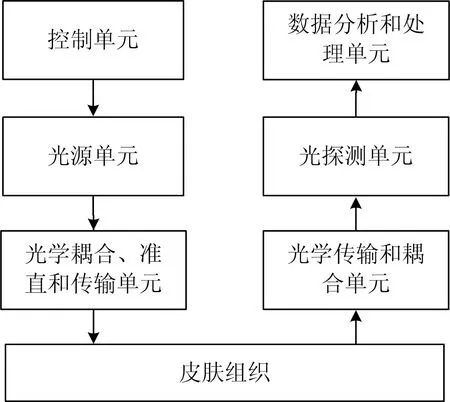
图1 测量系统结构原理图Fig.1 Block diagram of the measurement system
测量系统控制流程图如图2所示。采用功率计测量光源功率,并以光源工作标准功率为基准,进行校正以消除光源波动对结果的影响。若光源功率变化超过30%,则认为功率异常,结束该流程,检查光源和电路是否故障,并重新初始化。当光谱测量完成后,将数据输入计算机中进行光谱的去噪、平滑和数据处理,进而定量皮肤胆固醇浓度。
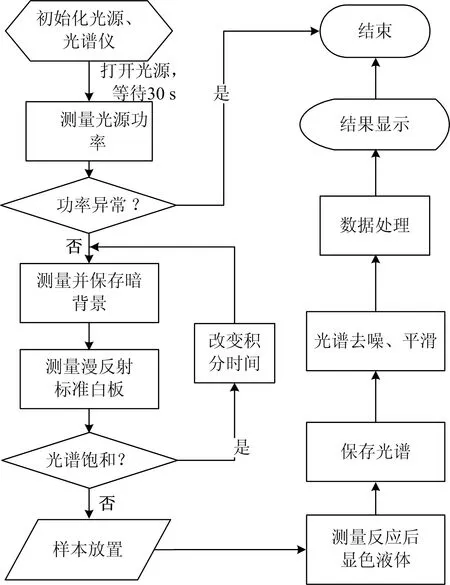
图2 测量系统控制流程图Fig.2 Control flowchart of the measurement system
2 实验部分
测量系统设计完成后,拟通过测量不同胆固醇浓度的皮肤样品对系统进行验证。然而,短时间内在体人体皮肤组织中胆固醇含量保持不变,无法形成系列梯度浓度胆固醇的样品组织。研究表明[12],利用萃取液对皮肤样品进行处理,通过控制萃取时间,即可获得具有梯度胆固醇浓度的皮肤样品。因此,前期实验选用了与人体皮肤结构相近的猪皮肤为实验对象,通过测量萃取处理后的猪皮肤样品来验证该方法和系统的可行性。
2.1 材料和试剂的准备
(1)猪皮肤样本。选取屠宰场新宰杀的生猪新鲜皮肤一块,大小为10cm×12cm,样本皮肤表面干净整洁、无毛发、斑点印迹等。
(2)所需试剂。0.8%的生理盐水,自配,高温杀菌;乙醚(分析纯,上海苏懿化学试剂有限公司);乙醇(分析纯,国药集团化学试剂有限公司);检测试剂:毛地黄皂苷-辣根过氧化物酶共聚物溶液,实验前根据制备流程配制,分为低浓度(1倍浓度)和高浓度(10倍浓度)两种;显色试剂:TMB显色液(上海碧云天生物技术有限公司)。
(3)萃取液的制备。将乙醇和乙醚按照体积比为3:1混合配制萃取液,萃取液在萃取实验前现配,且在通风柜中操作,避免操作人员吸入。
(4)粘贴板的制备。粘贴板如图3所示,用来粘贴在实验区域滴加试剂。上面有三个通孔,一个为检测孔,另外两个为对照孔。对照孔1(□)为阳性对照,用来指示试剂是否正常工作;对照孔2(◇)为阴性对照,用来指示皮肤表面是否存在影响反应结果的物质;检测孔(○)用来滴加检测试剂和显色试剂,用于对皮肤胆固醇浓度的检测。
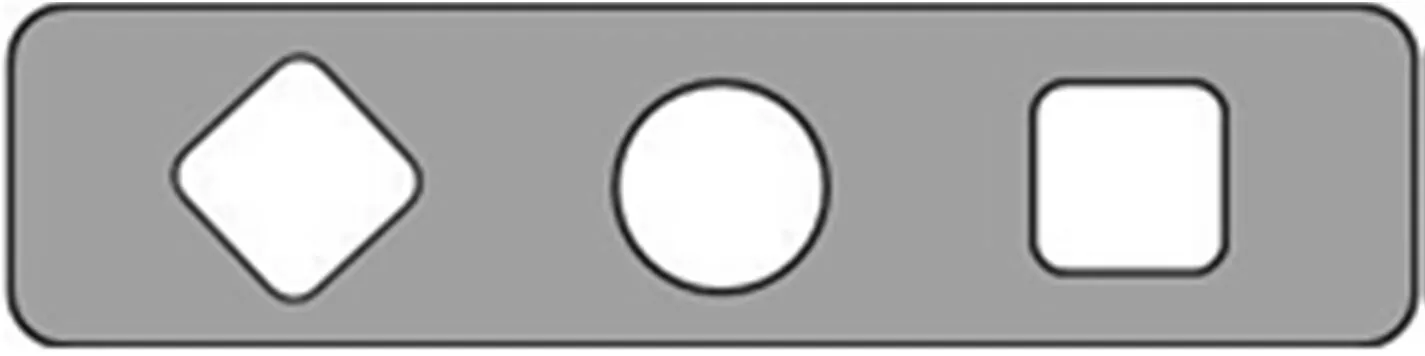
图3 粘贴板结构图Fig.3 The structural diagram of the pasting plate
2.2 方法
实验步骤流程如图4所示,共包括6步:
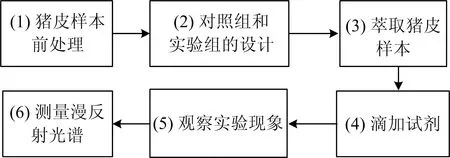
图4 实验步骤流程图Fig.4 Flow diagram of the experimental procedure
(1)猪皮肤样本前处理。用手术刀将新鲜猪皮肤样本切割为8份1cm×3.5cm大小的长方形小样本,分别标号为1#—8#,所有样本分配为随机分配。将8份样本浸泡在0.8%的生理盐水中,并放置于冰箱中冷藏,随后,每隔12h更换一次生理盐水,48h后,取出样本,自然阴干1h。
(2)对照组和实验组的设置。1#—4#样本为对照组,不进行萃取处理,视萃取时间为0min,5#—8#为实验组,进行萃取处理。
(3)萃取猪皮肤样本。取100mL烧杯4支,每支烧杯中加入萃取液30mL,将5#—8#样本分别放置其中,萃取时间分别为1,2,3和4min。每份样本在时间到后从烧杯中取出,用吸水纸吸干表面的萃取液,待用。
(4)滴加试剂。将所有样本放置在实验台上,在上面附上粘贴板,并保证粘贴板紧贴猪皮肤样本以防止漏液。用移液枪分别在检测孔(○)和对照孔1(□)中添加检测检测试剂(1倍浓度)和阳性对照试剂(10倍浓度)各30μl,等待2min后,用吸水棒吸取多余的试剂,然后分别在三个孔内加入显色试剂30μl,等待3min。
(5)观察实验现象。到达3min后,观察对照孔1(□)内是否呈现蓝色,对照孔2(◇)内是否为无色。
(6)测量漫反射光谱。若(5)中实验现象正常,将8份样本放置在设计好的夹具中,并移至检测系统中,测量颜色变化后溶液的漫反射光谱Wj(j=1,2,…,8)。
3 结果与讨论
3.1 实验现象
如图5(a)和(b)所示,对照孔1(□)为阳性对照,孔内液体呈现深蓝色,表明检测试剂有效;对照孔2(◇)为阴性对照,孔内液体呈现无色,说明皮肤表面没有影响反应结果的物质。在之前的探索实验中,发现对照孔2(◇)内滴加显色试剂,到达预定时间后,溶液呈现微蓝色,经过多次实验和分析,发现是皮肤中血红素的影响,因此在后来的实验中对样本做处理时,用0.8%的生理盐水浸泡48h,旨在消除血红素等因素的影响。

图5 对照组和实验组反应现象图 (a): 对照组; (b): 实验组Fig.5 The reaction phenomenon graph of thecontrol group and experimental group(a): Control group; (b): Experimental group
实验中,样本1#—4#作为对照样本,作用是为了验证来自于同一块猪皮肤样本中的胆固醇浓度是否一致,其反应后现象如图5(a)所示,4份样本的检测孔(○)内蓝色变化程度一致,采集其漫反射光谱如图6所示,4份样本反应溶液的漫反射光谱形状基本重合,将420~650nm波段内的漫反射光谱强度进行积分,得到各自的积分强度,变异系数为0.03,说明各样本间的胆固醇浓度差距较小。因此,可将1#—8#样本的初始胆固醇浓度视为一致。计算样本1#—4#的光谱强度的平均值,作为未经过萃取(萃取时间为0min)的样本胆固醇浓度对应的漫反射光谱强度。
5#—8#样本反应后现象如图5(b)所示,随着萃取时间的延长,检测孔(○)内蓝色变化程度逐渐变小,表明样本内胆固醇浓度逐渐降低。
3.2 数据处理
3.2.1 原始光谱及去噪处理
不同萃取时间T下的样本反应后溶液的原始漫反射光谱如图7所示。

图6 对照组样本原始漫反射光谱图Fig.6 The original diffuse reflectionspectrum of control group
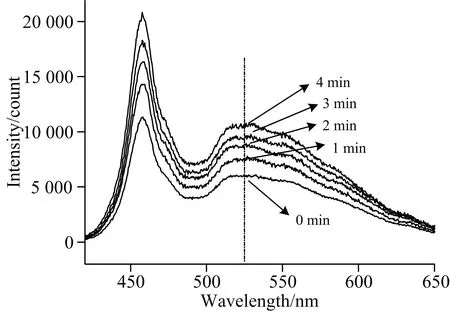
图7 不同萃取时间下的样本原始漫反射光谱图Fig.7 The image of original diffuse reflection spectrumunder different extraction time T
从图7中可以很直观的看出,随着萃取时间的增加,漫反射光谱形状保持不变,强度逐渐增强。但原始光谱存在噪声,为了提取有用信息,需要先对原始光谱进行去噪处理,利用三种常用的去噪方法,包括小波变换[13]、Savitzky-Golay平滑[14-15]和FFT变换对原始光谱进行去噪处理,并采用均方根误差(meansquareerror,MSE)和信噪比(signal-to-noiseratio,SNR)两种指标来评价三种方法的去噪效果。在使用小波变换去噪处理过程中,利用Matlab小波工具箱对小波包参数进行多次尝试后,选用具有紧支撑和近似对称的6层sym14小波包进行消噪,阈值选择方案采用“Fixedformthreshold”,阈值函数采用软阈值。
经过三种方法去噪处理后,光谱曲线整体平滑,保留了相应的波峰和波谷细节,毛刺等噪声明显下降。经过比较,小波变换去噪的效果要优于其他两种方法,具有更小的均方根误差和更大的信噪比。因此,采用小波变换的方法进行去噪,去噪处理后的光谱如图8所示。

图8 经过小波变换去噪后不同萃取时间T下的光谱图Fig.8 The image of spectrum after denoising by wavelettransform under different extraction time T
3.2.2 相对漫反射率
在获得的漫反射光谱中,由于携带了光源的光谱特性信息,不能直接反映胆固醇的浓度,而漫反射率去除了光谱特性信息,可以弥补这种不足。记Dλ为波长λ处的暗电流谱线强度,Cλ和Sλ分别为波长λ处的参考漫反射光谱和样本漫反射光谱,参考光谱是以标准漫反射白板为对象时获得。则反应后溶液在波长λ处的相对漫反射率ρ(λ)由式(4)得到
(4)
式(4)中,f(λ)是修正值,可以由更精密的测量仪器测量标准漫反射白板得到,由于求的是相对漫反射率,因此f(λ)取常数1。得到的不同萃取时间T下的相对漫反射率曲线如图9所示。
从图9中,可以很明显的根据相对漫反射率的变化来区分经过不同时间萃取处理的猪皮肤样本内胆固醇的浓度,随着萃取时间的延长(0~4 min),反应溶液颜色由深变浅,相对漫反射率增大。根据曲线的特征,可以将其分为3个阶段:阶段a(420~442 nm)分布在紫光区域,随着波长的增加,吸收增强,相对漫反射率下降,并在442 nm存在一个最低值;阶段b(442~500 nm)主要分布在蓝光区域,也是反应后溶液呈现的颜色区域,该区域内先增强,在463 nm处到达顶点,然后开始下降;阶段c(500~650 nm)分布在蓝光以后的区域,随着波长的延长,吸收增多,相对漫反射率开始逐渐下降,并保持基本平行。
3.2.3 特征波长和特征波段的选择
考虑到一些光谱区域容易受到其他因素干扰,或者基本不包含有效的信息,将全光谱带入分析会影响计算精度。因此,根据得到的光谱曲线特征,选择特征波长或者波段,利用该波长或者波段的相关信息来特异性表现对应的皮肤胆固醇浓度。
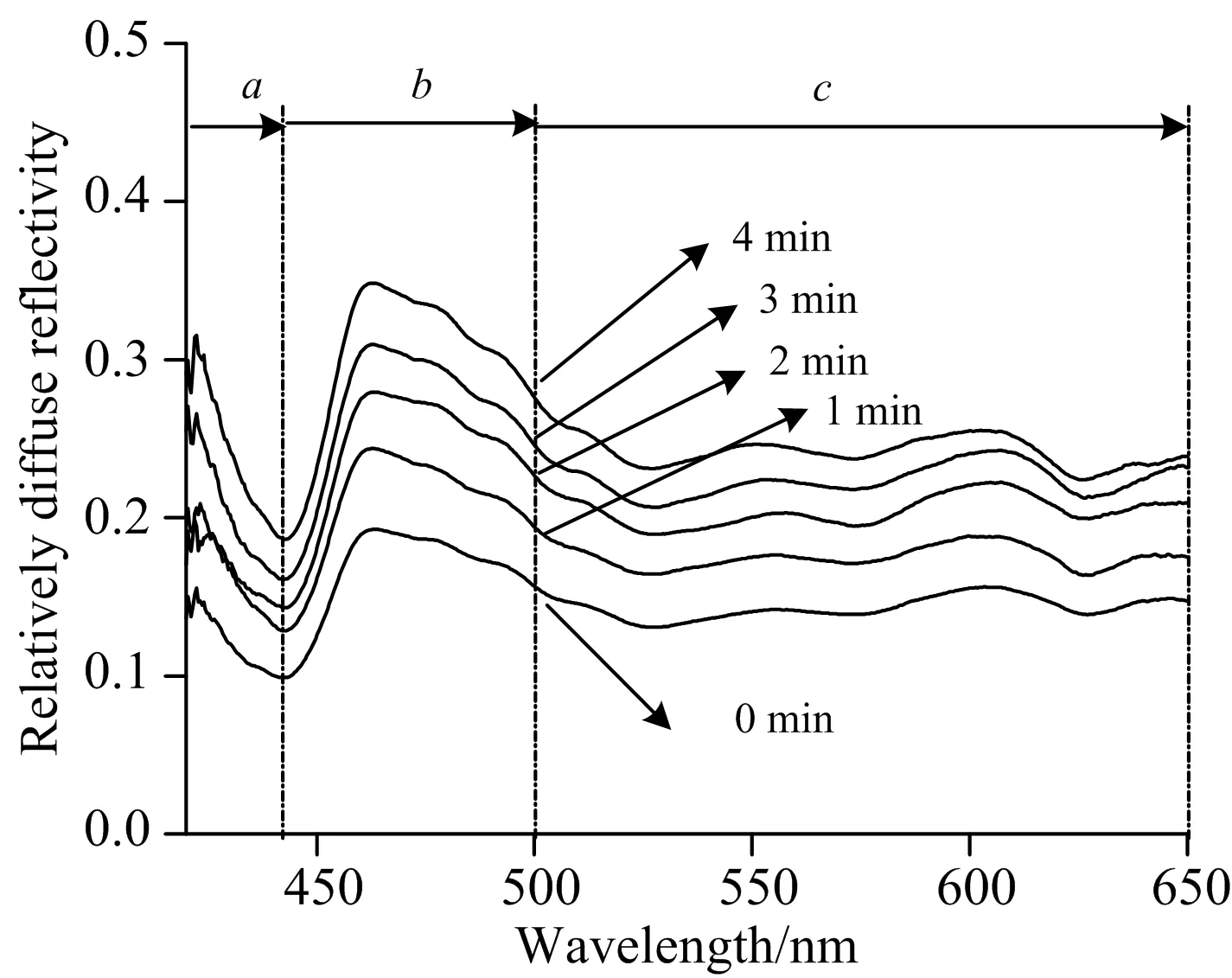
图9 不同萃取时间T下反应后溶液的相对漫反射率
特征单波长:
(1)吸收波长。HRP在以TMB为底物,pH为5.0反应时,产生可溶性蓝色产物,其特征吸收波长为450 nm,因此,将450 nm作为一个特征波长。
(2)峰值波长。相对漫反射率曲线中,分别在442和463 nm处达到最低值和最高值,因此把这两个波长也作为特征单波长。
特征波段:根据上述漫反射曲线特征的三个阶段中,阶段b(442~500 nm)内曲线易于区分,且该波段主要分布在蓝光区域,是反应后溶液的主要反射区域,因此选用该波段作为特征波段。
3.2.4 漫反射率强度因子S
相对漫反射率表征不同浓度的皮肤胆固醇,为了定量所测量皮肤胆固醇的浓度,根据相对漫反射率引入一个“漫反射率强度因子S”,其计算公式见式(5)

(5)
式(5)中,ρ(λ)为在特征单波长处的相对漫反射率或特征波段内的平均相对漫反射率。
根据上述公式,求得萃取实验中各样本中的漫反射率强度因子如表1所示。并以萃取时间T为横坐标,漫反射率强度因子S为纵坐标作图,如图10所示。

表1 漫反射率强度因子S
图10中,在特征波长处和特征波段内,随着萃取时间T的延长,漫反射率强度因子S呈线性下降。经过最小二乘法拟合后的方程判定系数R2分别为0.960(442 nm处)、0.959(450 nm处)、0.958(463 nm处)和0.958(442~500 nm波段内)。结果显示,无论是在特征单波长(442,450和463 nm)处,还是特征波段442~500 nm内,利用漫反射率强度因子S均可以定量反映猪皮肤样本内胆固醇的浓度。但单波长点存在出现畸变的风险,可能会对结果的准确性和重复性产生影响,而在特征波段442~500 nm内,采用平均相对漫反射率能够弥补这种不足,更加准确和稳定地反映皮肤胆固醇的含量。
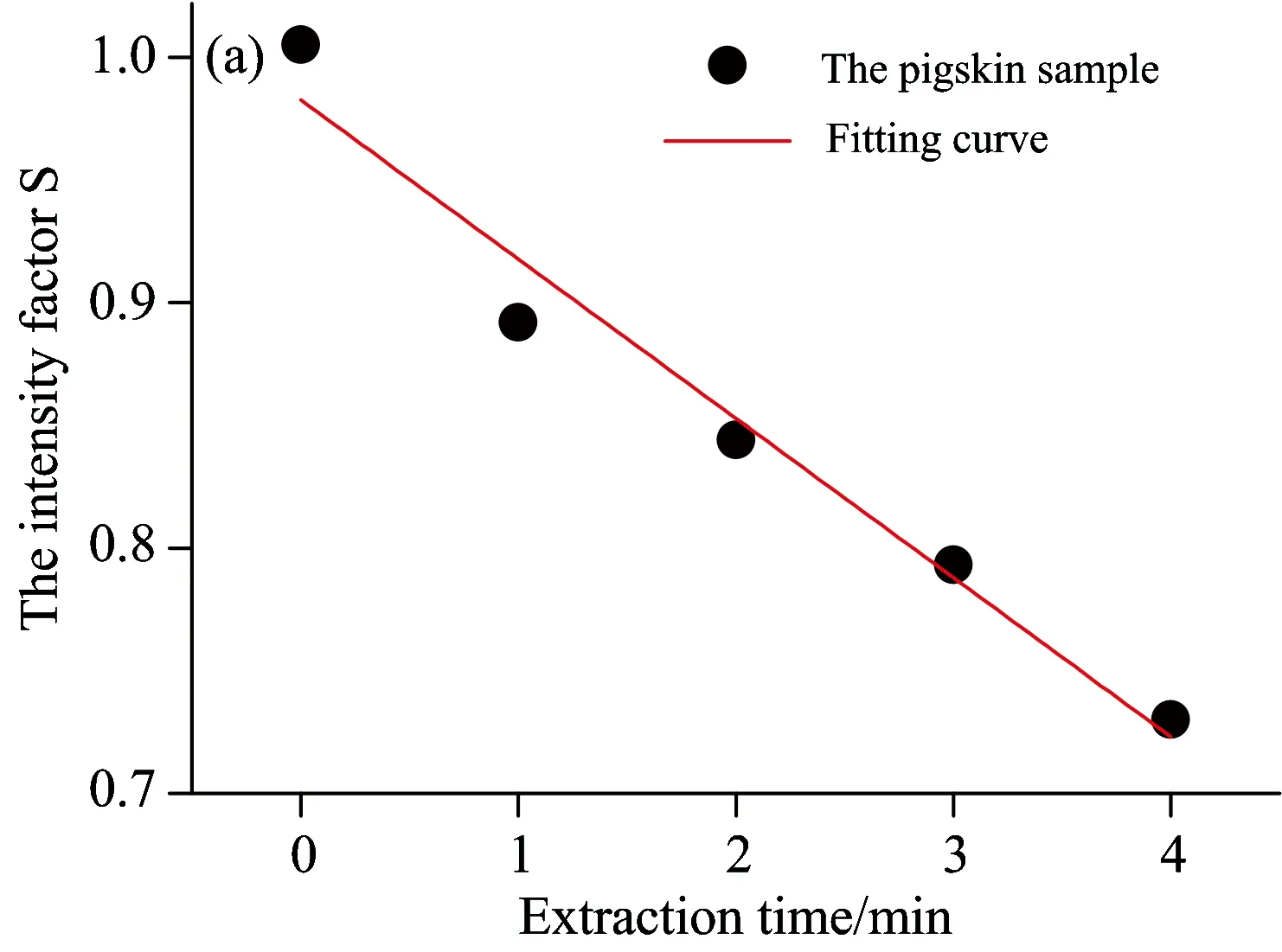
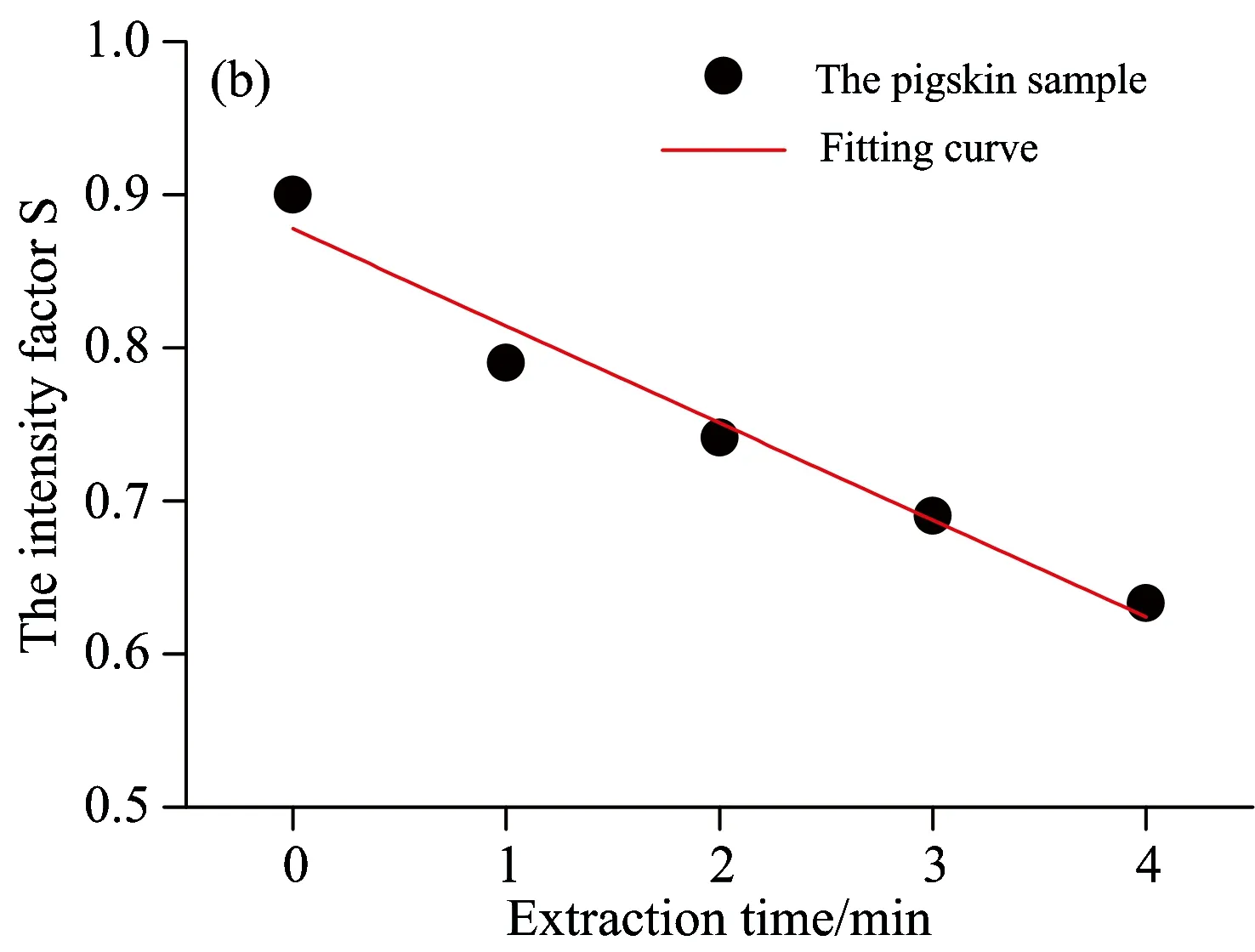
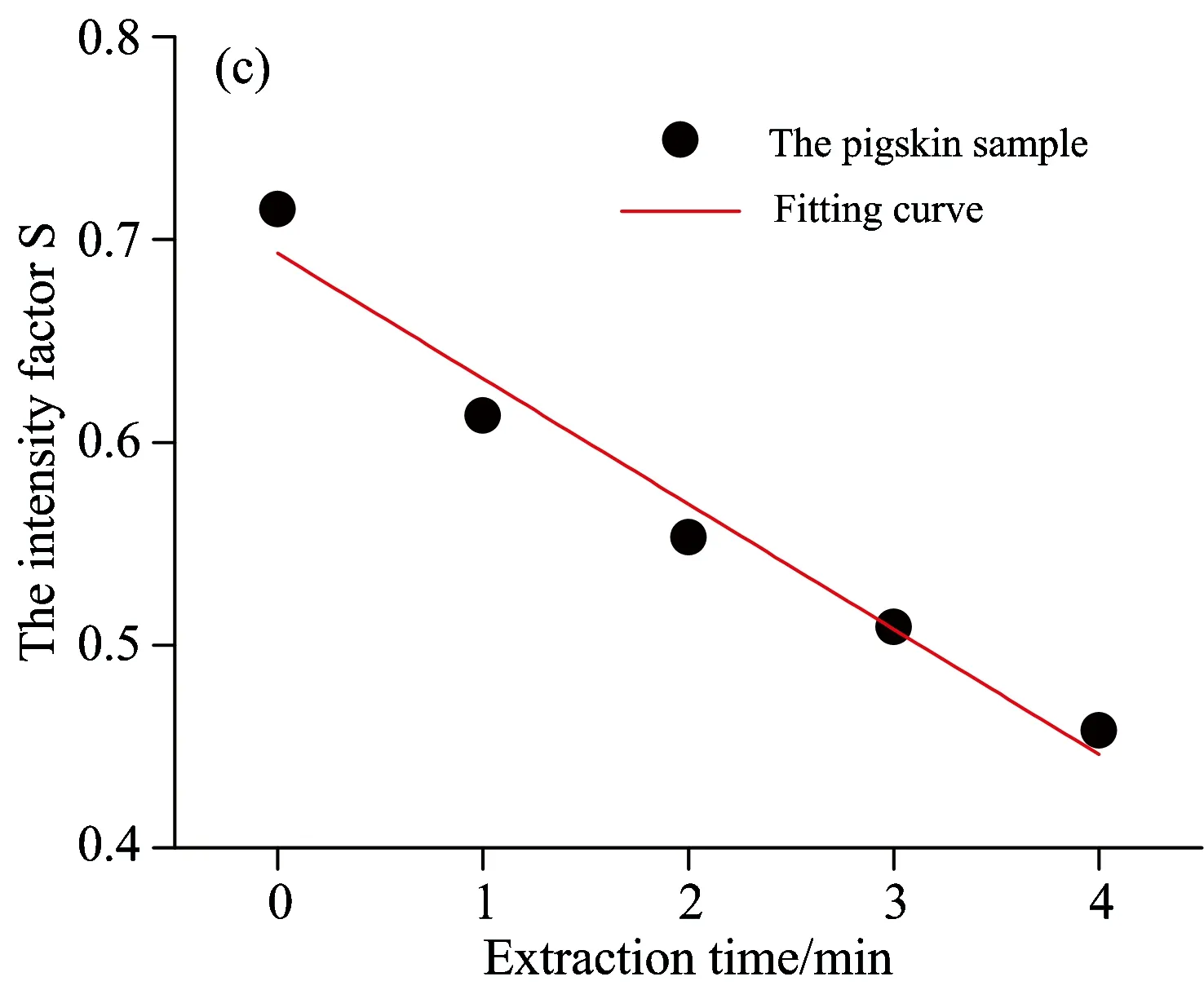
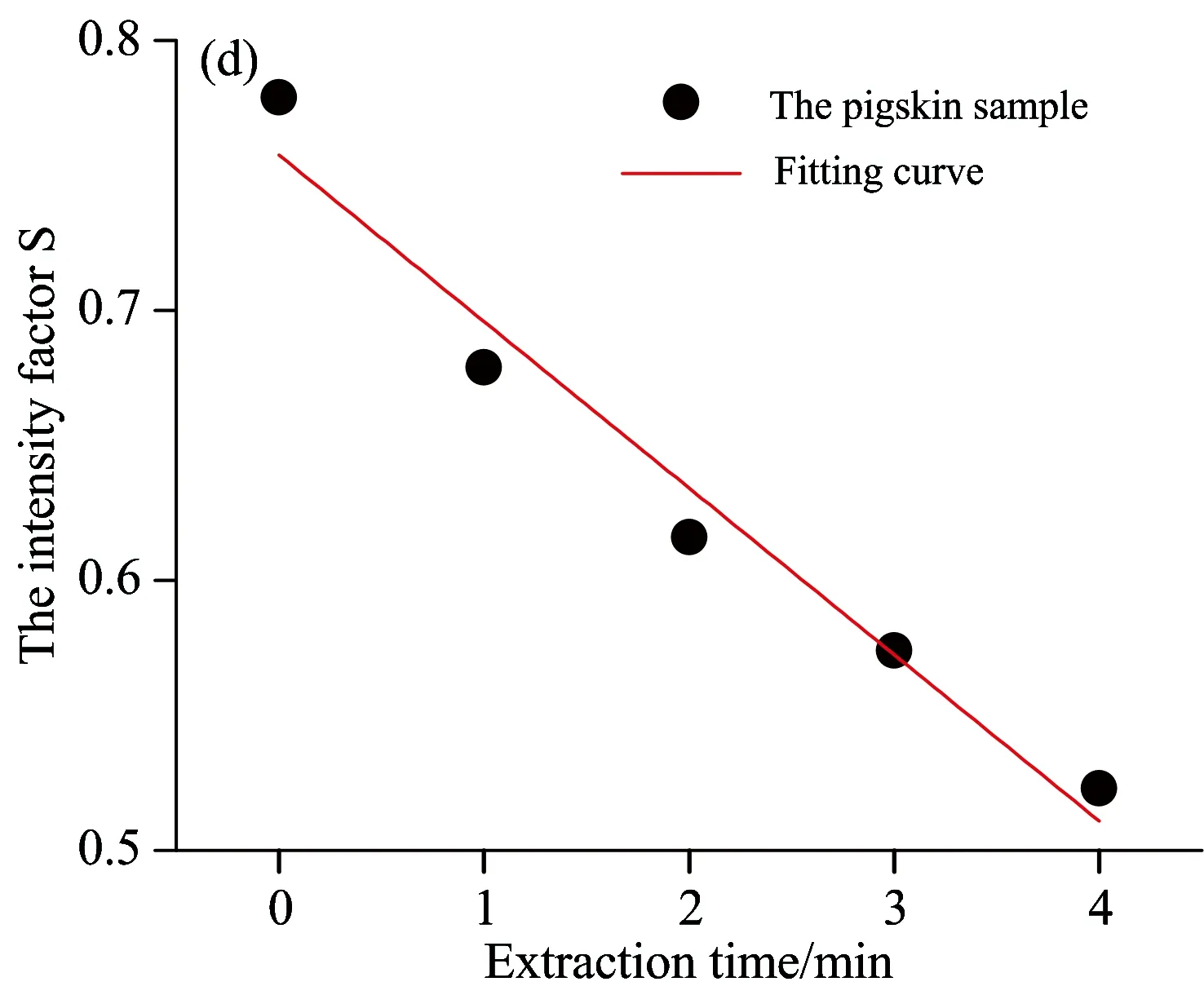
图10 漫反射率强度因子S随萃取时间T变化图
(a): At characteristic wavelength 442 nm; (b): At characteristic wavelength 450 nm; (c): At characteristic wavelength 463 nm;
(d): In characteristic wavelength band of 442~500 nm
4 结 论
研究了漫反射光谱快速无创测量皮肤胆固醇的方法,设计了基于微型光谱仪的皮肤漫反射光谱实时测量系统,并结合猪皮肤实验验证了该方法和测量系统的可行性。实验结果表明,相对漫反射率能够区分不同浓度的胆固醇样本,漫反射率强度因子S在特征单波长(442,450和463 nm)处和特征波段442~500 nm内,均可以定量反映猪皮肤样本内的胆固醇浓度,经线性拟合,判定系数R2分别为0.960,0.959,0.958和0.958。后续将通过检测在体人体皮肤组织内的胆固醇来进一步验证此方法的可行性和有效性。将此方法应用于皮肤胆固醇的临床检测,将有助于提高动脉粥样硬化性疾病的早期筛查率。
[1] YE Ping, CHEN Hong, WANG Lü-ya(叶 平, 陈 红, 王绿娅). Dyslipidemia Aiagnosis and Treatment(血脂异常诊断和治疗). Beijing: People’s Military Medical Press(北京: 人民军医出版社), 2013. 34.
[2] Sabine J R. Cholesterol. New York: Marcel Dekkar, 1977.
[3] Khalilov E M, Fortinskaia E S, Nikitina N A, et al. Klinicheskaia Laboratornaia Diagnostika, 1994, 5: 12.
[4] Bouissou H, Degraeve J, Legendre C, et al. Biomedicine & Pharmacotherapy, 1982, 36: 159.
[5] Bouissou H, Degraeve J, Solera M L, et al. Archives Des Maladies Du Coeur Et Des Vaisseaux, 1982, 75: 621.
[6] Bouissou H, Graeve J D, Thiers J C, et al. Biomedicine Express, 1979, 31: 236.
[7] Weerheim A, Ponec M. Arch. Dermatol. Res., 2001, 293: 191.
[8] Hiroshi Shiigi Hiroaki Matsumoto, Itaru Ota, Tsutomu Nagaoka. J. Flow Injection Anal., 2008, 25(1): 81.
[9] John Mancini G B, Sammy Chan, Jiri Frohlich, et al. The American Journal of Cardiology, 2002, 89(1): 1313.
[10] ZHANG Jun, CHEN Xing-dan, PIAO Ren-guan, et al(张 军, 陈星旦, 朴仁官, 等). Optics and Precision Engineering(光学精密工程), 2008, 16(6): 987.
[11] JIANG Li-ying, YAO Fei-fei, CHEN Qing-hua, et al(姜利英, 姚斐斐, 陈青华, 等). Sensor World(传感器世界), 2010,(1): 6.
[12] Torkhovskaya T I, Fortinskaya E S, Khalilov E M, et al. Biulleten’ Eksperimental’noǐ Biologii i Meditsiny, 1992, 113(5): 481.
[13] FANG Yong-hua, KONG Chao, LAN Tian-ge, et al(方勇华, 孔 超, 兰天鸽, 等). Optics and Precision Engineering(光学精密工程), 2006, 14(6): 1089.
[14] XIE Jun, PAN Tao, CHEN Jie-mei, et al(谢 军, 潘 涛, 陈洁梅, 等). Chinese Journal of Analytical Chemistry(分析化学), 2010, 38(3): 342.
[15] HUANG Fu-rong, PAN Tao, ZHANG Gan-lin, et al(黄富荣, 潘 涛, 张甘霖, 等). Optics and Precision Engineering(光学精密工程), 2010, 18(3): 588.
(Received Aug. 4, 2015; accepted Dec. 16, 2015)
*Corresponding author
Rapid and Noninvasive Detection of Skin Cholesterol with Diffuse Reflectance Spectroscopy Technology
HOU Hua-yi1, 2, DONG Mei-li1, 3*, WANG Yi-kun1, 3, ZHU Ling1, 3, MA Zu-chang1, LIU Yong1, 3
1. Institute of Applied Technology, Hefei Institutes of Physical Science, Chinese Academy of Sciences, Hefei 230031, China
2. University of Science and Technology of China, Hefei 230026, China
3. Wanjiang Center for Development of Emerging Industrial Technology, Anhui Provincial Engineering Technology Research Center for Biomedical Optical Instrument, Tongling 244000, China
Due to the urgent need for noninvasive detection of skin cholesterol, a portable, intelligent and real-time skin diffuse reflectance spectroscopy measurement system was designed based on a micro-spectrometer. Digitonin-horseradish peroxidase copolymer solution was prepared. According to the properties digitonin binds to the hydroxy of cholesterol molecular specifically and the horseradish peroxidase reacts with TMB color solution (the main component is 3,3’,5,5’-tetramethylbenzidine ) a color change was produced, by which the skin cholesterol was identified and instructed with high sensitivity and high specificity, and the concentration of skin cholesterol was quantified by measuring the degree of color change. In order to validate the feasibility of this method, pig skin which is similar to human skin was taken as the experimental subject, and cholesterol samples of gradient concentration were achieved through the extraction. After that the spectroscopy measurement system was adopted to detect the cholesterol concentration. The experiment result showed that, relative diffuse reflectance can distinguish the cholesterol samples with different concentrations, and the diffuse reflectance intensity factor can quantity the concentrations of cholesterol at characteristic wavelengths (442, 450 and 463 nm) and characteristic wavelength band of 442~500 nm. Linear fitting curves were obtained with the determination coefficientR2were 0.960, 0.959, 0.958 and 0.958, respectively. The study has shown that, using diffuse reflectance spectroscopy technology can realize noninvasive rapid detection of skin cholesterol, and applying it to the risk assessment of atherosclerotic diseases would contribute to the prevention and control of such diseases significantly.
Skin cholesterol; Noninvasive detection; Diffuse reflectance spectroscopy; Atherosclerosis
2015-08-04,
2015-12-16
国家科技支撑计划项目(2015BAI01B04),国家科技支撑计划项目(2013BAH14F01),安徽省自然科学基金项目(1508085QF141)和中国科学院安徽光学精密机械研究所所长基金项目(Y33J381141)资助
候华毅,1987年生,中国科学院合肥物质科学研究院应用技术研究所博士研究生 e-mail:hhy@mail.ustc.edu.cn *通讯联系人 e-mail:dongmeili@aiofm.ac.cn
TN29
A
10.3964/j.issn.1000-0593(2016)10-3215-07
- 光谱学与光谱分析的其它文章
- Gd靶激光等离子体光源离带辐射及其等离子体演化的研究
- Probing the Binding of Torasemide to Pepsin and Trypsin by Spectroscopic and Molecular Docking Methods
- Mn(Ⅱ)-5-Br-PADAP共沉淀-火焰原子吸收光谱法测定虾、贝样中的镉
- Near Infrared Spectroscopy Study on Nitrogen in Shortcut Nitrification and Denitrification Using Principal Component Analysis Combined with BP Neural Networks
- 内蒙古草原植被最大光能利用率取值优化研究
- 健康和糖尿病大鼠红细胞荧光光谱非线性程度差异

