泾渭河交汇区域平水期水体和表层沉积物溶解性有机质的光谱性质
范春辉,常 敏,张颖超
1.陕西科技大学环境科学与工程学院,陕西 西安 710021 2.清华大学环境学院,北京 100084
泾渭河交汇区域平水期水体和表层沉积物溶解性有机质的光谱性质
范春辉1,常 敏1,张颖超2
1.陕西科技大学环境科学与工程学院,陕西 西安 710021 2.清华大学环境学院,北京 100084
溶解性有机质;光谱性质;水体;沉积物
引 言
溶解性有机质 (Dissolved Organic Matter, DOM) 是一类稳定性较强、分子量分布较宽、组分结构复杂的天然有机高分子混合物,广泛分布于地表水体、土壤圈、泥炭、沉积物、海洋等各类生态系统中[1]。DOM富含羟基、羧基、羰基等活性官能团,对于生态系统的物质循环和环境污染物的迁移转化影响较大。DOM来源于外源输入和内源释放两种途径,国内外学者对其源解析、组分分级、赋存特征和转化行为等方面[2]做了大量探索性工作,发现DOM性质因时空条件不同而有异,这种DOM的非均质性也给相关研究带来了很大的不确定性。
河流是陆地与海洋联系的纽带,其层次分化不明显,自净能力较强,在生物圈的功能定位较为特殊。水体和水体沉积物是DOM的重要归宿和存在媒介[3],深入识别河流水体及沉积物DOM的性质差异,对于定性分析物质循环的动态路径和可能归趋,了解共存污染物的生物地球化学行为和生态环境效应意义重大。目前同类研究还不充分,同时限于研究尺度的局限性和分析对象的差异性(时空条件、地质条件、环境条件、社会条件等),相关结果的精准性和科学性尚有待完善和验证[4]。
渭河是黄河最大支流,而泾河则是渭河一级支流,同时也是黄河水系输沙量最大的二级支流。渭河和泾河的交汇区域形成了独具特色的“泾渭分明”景观和典型的湿地生态系统;在全球水体污染状况日趋复杂的背景下,渭河及泾渭流域的环境质量一直受到相关部门的优先关注。前期工作明确了工业废水DOM的动态变化规律,以及土壤圈体系DOM与固碳减排的构效关系;本文引入元素分析、UV、FTIR、Raman、3D-EEMs、NMR等手段,全面揭示泾渭交汇区域(陕西西安高陵段)平水期水体及表层沉积物DOM的理化性质,力图为后续泾渭流域的功能定位、污染防控、生态恢复和可持续开发利用提供参考和借鉴。
1 实验部分
1.1 样品采集
水体和表层沉积物样品取自泾渭河交汇区域之渭河陕西西安高陵段,具体为渭河大桥(泾渭路)北岸,桥下河流下游(50±1)m处 (如图1所示)。本文仅全面定性分析此处水体和沉积物DOM的光谱性质,其他取样点样品性质将在后续文章中体现。样品采集时间为2014年11月1日下午14—17点,当天天气晴好,风速适中,水体流量稳定,水体温度为(11.0±0.1)℃。采集水样时,将干净的广口瓶现场润洗3遍后,浸入水面下(30±1)cm,沿顺水流方向采样;使用自制柱状采样器采集(20±1)cm厚沉积物样品,取样深度为沉积物表层下(10±1)cm处 (此深度沉积物可以直接参与水体-沉积物界面的物质循环,具有代表性),装入带封口的聚四氟乙烯样品袋。除部分参数现场测定外,所有样品密封并避光保存后立即带回实验室,放入4 ℃冰箱中,并于一周内完成全部分析工作。实验用水体和沉积物样品部分理化性质见表1。

图1 水体和沉积物采样点示意

表1 水体和沉积物样品理化性质
注:表1数据仅适用于本实验样品,不具有其他代表意义;除pH外,其他参数单位均为mg·L-1
1.2 DOM提取
将水样于5 000 r·min-1条件下离心5 min,上清液过0.45 μm滤膜后得到水体DOM备用。沉积物样品去除残枝、石粒等杂物后冷冻干燥,用研钵将样品初步磨细;将所得样品过筛(100目)、超纯水混匀后振荡(24 h, 150 r·min-1, 25 ℃)、离心(5 000 r·min-1, 5 min)、上清液过滤(0.45 μm滤膜) 后,即得沉积物DOM备用[5]。
1.3 光谱分析
元素分析(Vario EL Ⅲ, ELEMERAOR)中的C,H和N含量为实测值,O含量采用差减法求得。紫外光谱(UV2300, 上海天美) 扫描波长为200~400 nm,扫描间隔0.5 nm,狭缝宽1.5 nm,扫描速度400 nm·min-1,以超纯水为参比,测定吸光度并绘制紫外全谱图。红外光谱(VECTOR-22, BRUKER) 测试采用KBr压片法,扫描范围4 000~400 cm-1,分辨率2 cm-1,扫描累加次数32次,样品与KBr质量比约为1∶100。拉曼光谱(INVIA, RENISHAW)扫描范围3 200~100 cm-1,曝光时间10 s,激光功率1%,累加次数1次,测试温度25 ℃。荧光光谱(F-4600, HITACHI) 激发光源为150 W氙灯,PMT电压为700 V。波长扫描范围λex为200~500 nm,λem为250~600 nm;扫描速度1 200 nm·min-1,狭缝宽度10 nm;带通:λex为10 nm,λem为10 nm;响应时间2 s。核磁共振波谱(ADVANCE Ⅲ 400 MHz, BRUKER)测试条件:13C NMR共振频率为75.47 MHz,溶剂为CDCl3,累加18 000次;1H NMR共振频率79.452 MHz,溶剂为DMSO-d6,取样时间2 s,脉冲间隔4 s。
1.4 质量控制
实验用水为Milli-Q超纯水(Millipore, 18.2 MΩ·cm);KBr等为光谱纯,其余常规试剂为优级纯。玻璃器皿使用前经10% HNO3浸泡24 h,超纯水洗净后备用。利用超纯水拉曼光谱强度衡量荧光光谱仪稳定性,仪器误差小于2%。所得数据采用Origin软件处理和绘图。
2 结果与讨论
2.1 元素组成
水体和沉积物样品DOM的元素分析结果如表2所示。沉积物DOM的C,H和N含量略高于水体DOM,且沉积物DOM的H/C比值大于水体DOM,说明沉积物DOM碳氢饱和度更高,羧基类组分和碳水化合物较多,而芳香类不饱和组分含量较低[6]。同时,沉积物DOM的N/C原子比大于水体DOM,暗示沉积物DOM可能含有更多的氨基糖、多肽和氨基酸等含氮组分。通常认为,河流水体的水位、径流量、流速等水文状况复杂多变,气液固界面及水体的动态更替行为较频繁,水体组分的稳定性和积累性较差;而沉积物源于河流水体的长期侵蚀、搬运和堆积作用,具有明显的层理和韵律性二元结构[7]。这种水体和沉积物的性质差异为不同种类微生物提供了栖息地,对不同组分的天然积累也创造了客观条件。
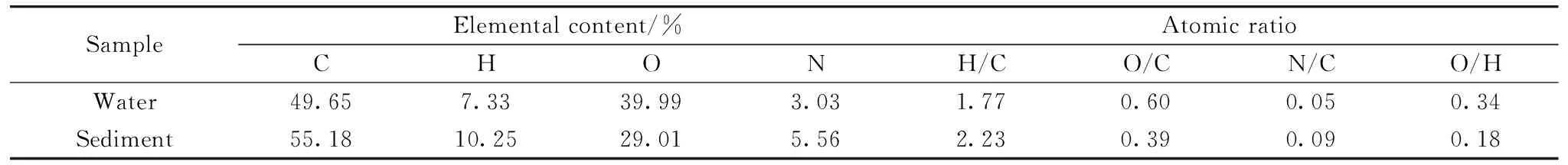
表2 水体和沉积物DOM的元素含量
2.2 UV
水体和沉积物样品DOM的UV光谱如图2所示。DOM的吸收强峰位于200~220 nm区域,表明DOM含有较多不饱和双键共轭结构,其中200 nm附近的极强峰源于水分子和溶解氧的能量吸收效应[8]。随着紫外吸收波长的增加,吸光度逐渐下降;当波长大于230和350 nm后,水体和沉积物样品DOM的紫外吸光度极低并趋于不变。水体DOM没有发现典型吸收峰,且特征吸收较弱,这与Loiselle[9]的研究结果相符。但沉积物DOM的吸收平台(240~310 nm)较明显,这是典型的π→π*跃迁精细结构吸收谱带,通常源于溶解性蛋白芳香族氨基酸残基的吸收,以及溶解性有机碳和类腐殖质等组分的存在。相比之下,沉积物DOM的UV全谱吸收特征更为复杂,这暗示了水体和沉积物DOM精细组分的结构差异,可能与光化学特性、水力环境和生物化学过程有关[10]。

图2 水体(a)和沉积物(b) DOM的紫外光谱
2.3 FTIR

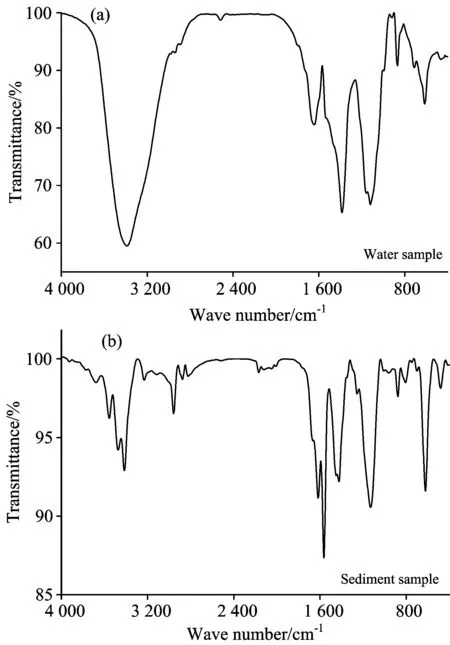
图3 水体(a)和沉积物(b) DOM的红外光谱
2.4 Raman
水体和沉积物样品DOM的Raman光谱详见图4。总体来看,Raman图谱走势较为接近,但水体DOM光谱的整体强度更高。对Raman图谱各峰进行归属,发现2 400 cm-1附近出现吸收平台,推测可能为C≡C伸缩振动和C—C倍频峰之间的费米共振产生;这个谱带在FTIR图谱中较弱,但在Raman图谱中属于中等强度吸收带。2 200~1 300 cm-1区间的密集弱峰信号为苯环的伸缩振动效应,这种振动引起的分子极化率变化较小,拉曼活性较低。Raman图谱的最强峰出现在1 200~1 000 cm-1,源于酯类和碳水化合物C—C的伸缩振动峰,也可能存在—CH3的面内摇摆振动和C—H面内弯曲振动的贡献[12]。一般认为,环状化合物的对称呼吸振动为最强的拉曼吸收谱带,本研究结果验证了这一点;对于该峰,水体DOM较沉积物DOM峰强更大,排除测试力场干扰等因素外,可能更多地暗示DOM精细组分含量和分子结构差异。在555 cm-1附近出现的次强峰为C—X(卤素)键的伸缩振动,其分子构象差异导致两组Raman图谱中特征峰性质略有区别。鉴于水体和沉积物DOM的Raman图谱较为接近,认为Raman图谱无法给予有效的区别信息。

图4 水体(a)和沉积物(b) DOM的拉曼光谱
2.5 3D-EEMs
水体和沉积物样品DOM的3D-EEMs光谱如图5所示。水体DOM的荧光峰较为集中,主要分布于λex/em=260/340和λex/em=250/400附近,经鉴定分别归属为可见光区类色氨酸(次强峰)和紫外区类富里酸(最强峰)荧光峰,荧光强度(无量纲)分别为2 517和3 345。其中类色氨酸荧光峰属于类蛋白荧光峰,通常与DOM中芳环氨基酸组分相关;这一方面说明河流微生物的活性较强,代谢过程生成的有机物质较多,同时也暗示水体DOM的荧光特性存在工业或生活污水的贡献[13]。而紫外区类富里酸荧光峰与DOM结构中的羧基和羰基有关,说明水体DOM以陆源有机质为主。除此之外,水体DOM没有发现典型可见光区类富里酸荧光峰和其他类蛋白荧光峰。沉积物DOM的荧光峰同样较为集中,主要分布于λex/em=250/380(峰强1 789)和λex/em=260/450(峰强2 021),均属于紫外区类富里酸荧光峰。值得注意的是,沉积物DOM图谱中没有发现典型的类蛋白、类多酚、类色氨酸或类酪氨酸类物质特征峰,这可能说明与沉积物微生物新陈代谢相关的类蛋白组分含量较低;同时,上述物质具有较强的活性和生物有效性,在生物生理活动过程中容易被矿化分解[14],这可能影响了相应荧光峰的显现。此外,水体和沉积物中生物质残体腐殖化过程可能会释放较多的化感物质[15],这些外源组分可能与内源组分共同影响荧光光谱的可视性,其中不排除DOM分子的聚集效应、能量转换和荧光猝灭效应导致某些荧光峰被掩蔽或弱化。
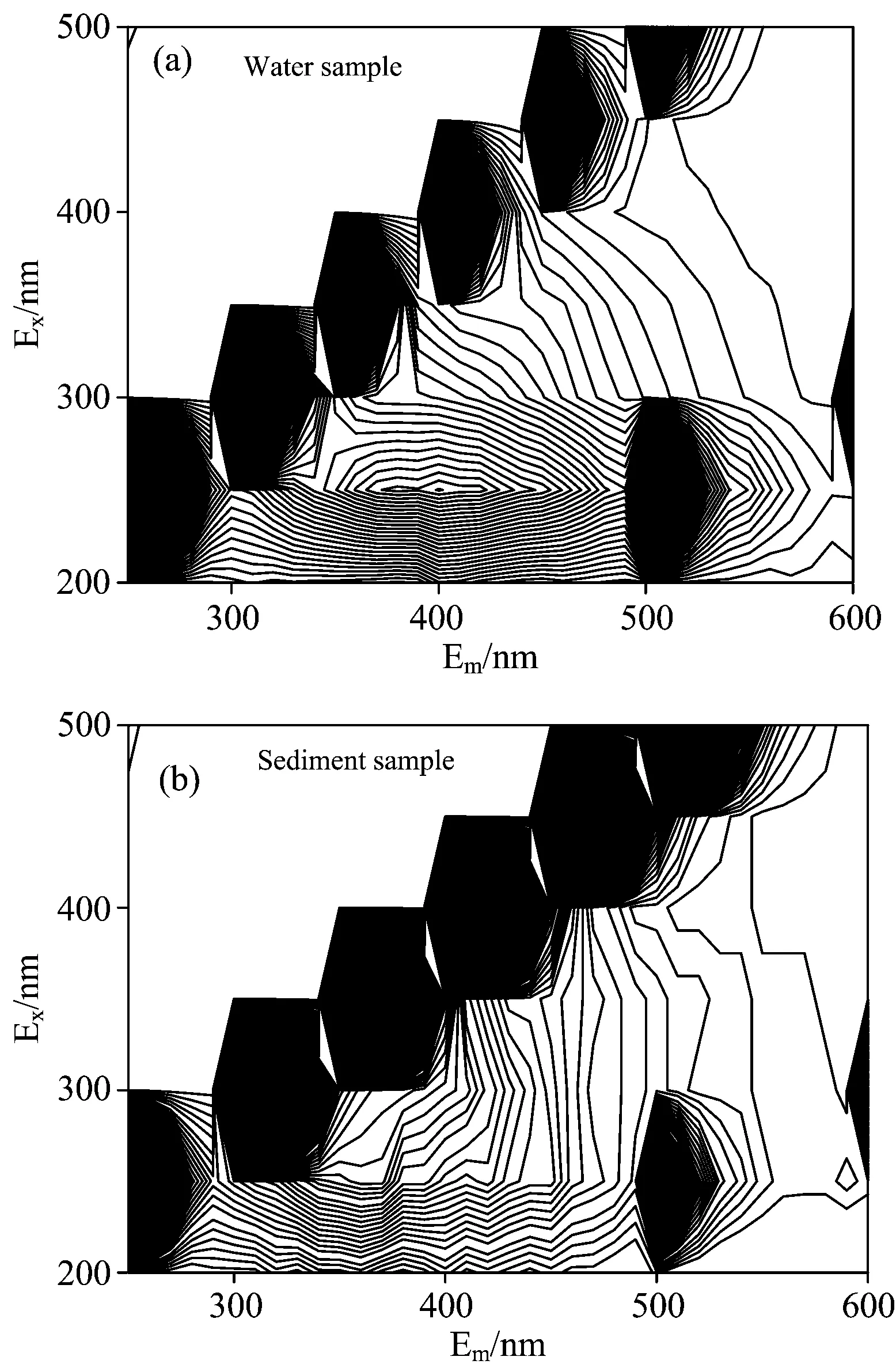
图5 水体(a)和沉积物(b) DOM的三维荧光光谱
2.6 NMR
2.6.113C NMR
水体和沉积物样品DOM的13C NMR结果见表3。研究表明:DOM的含C官能团可以分为烷基C(0~50 ppm)、烷氧C(50~110 ppm)、芳香C(110~165 ppm)、羧基C(165~190 ppm)和羰基C(190~220 ppm)五类[16],水体和沉积物DOM的主要含C官能团均为烷基C和烷氧C。水体和沉积物DOM含C官能团具有类似的化学特性和C骨架结构,但水体DOM的芳香C、羧基C和羰基C比例更高。沉积物DOM的烷基C和烷氧C含量略高于水体DOM,表明沉积物DOM的脂族特性更加明显;同时,略低的芳香C含量暗示了较低的分子氧化程度和复杂性;据此认为沉积物DOM较为“年轻”,这可能与沉积物体系较高的微生态活性有关。此外,极性含C官能团(烷氧C、羧基C和羰基C)含量的多寡与极性污染物的吸附量之间具有非绝对的正相关性[17],这也意味着沉积物DOM可能对污染物具有更大的吸持作用,沉积物的污染负荷和潜在风险值得关注。
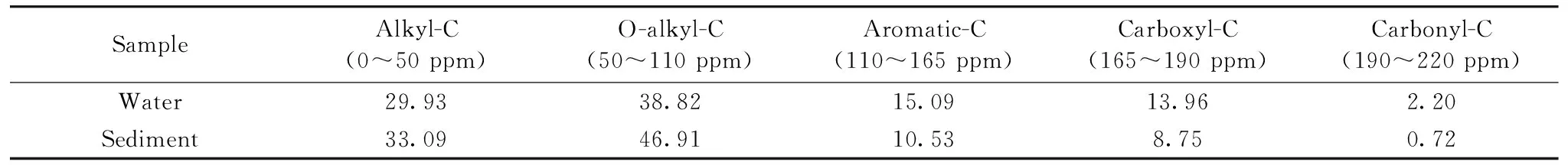
表3 水体和沉积物DOM含C官能团结构分布(%)
2.6.21H NMR
水体和沉积物样品DOM的1H NMR结果如表4所示。DOM的含H官能团归属为三个区域,分别为0.5~2.8 ppm (脂族组分—CH3或—CH2中的H)、2.8~5.5 ppm(脂环族或连氧碳上的H)和5.5~10.0 ppm(芳香结构中的H)[18]。对0.5~2.8 ppm区域进行精细划分,发现0.5~1.0 ppm区间为γ-H,源于亚甲基链和脂族链结构末端—CH3中的H;1.0~1.9和1.9~2.8 ppm区间分别代表β-H和α-H,归属为脂族结构—CH2中的H和与官能团连接的H。2.8~5.5 ppm区间为碳水化合物、甲氧基类组分和有机胺组分中的活泼H;5.5~10.0 ppm为含氧杂环等芳香结构中的H。在各类含H官能团结构中,碳水化合物H含量较高,而芳香族H、γ-H等含量较低;沉积物DOM的烷基链烃H(Alkyl-H)含量和n值略大于水体,说明沉积物DOM中烷基链烃支链更长,分支更少,含量更高。这可以与13C NMR结果互为验证和补充。当然,诸如诱导效应、磁各向异性效应等都会影响基团的分布形态和化学位移,因此,认为研究结果的精准性还有待深入验证。

表4 水体和沉积物DOM含H官能团结构分布(%)
光谱联用技术对于DOM分子层面解析效果较好,能够为DOM的全面识别提供关键证据。本研究有效揭示了泾渭河交汇区域(陕西西安高陵段)水体和沉积物DOM的微观性质,但与同类研究相比,相关结果也有不尽相同之处。比如,冯伟莹[19]发现洱海沉积物DOM的荧光组分(四种)更加多样化,且藻类和水生植物残体对DOM荧光光谱影响较大;而本文水体和沉积物DOM荧光特征峰数量较少,推测可能与水体污染性质及水循环体系有关:洱海为(半)封闭性富营养化深水湖泊,而本研究中的实验样品采集点径流量较大、水体交换频繁,可能影响有机组分的沉积转化、微生物的栖息环境和DOM的精细组成。不过,这种组分差异也有可能是季节性变化的结果,因为蔡明红[20]发现季节温度可能通过影响底栖生物活动规律而改变DOM的光谱指纹特征。因此,后续有必要通过大尺度的连续性研究深度揭示水体和沉积物DOM的动态行为,其中除了引入先进的现代仪器分析手段外,更要从方法学层面加强环境数学模型的应用。
3 结 论
光谱联用技术能够有效揭示DOM样品的微观特征。沉积物DOM碳氢饱和度更高,其紫外吸收平台明显(240~310 nm),而水体DOM的吸收平台几乎检测不出。沉积物DOM比水体DOM活性基团更加复杂,但两者的Raman图谱非常相似。水体DOM以陆源为主,荧光峰归属为可见光区类色氨酸和紫外区类富里酸;沉积物DOM荧光峰均属于紫外区类富里酸荧光峰。水体和沉积物DOM的含C骨架结构类似,但沉积物DOM的脂族特性更突出;1H NMR证实碳水化合物H含量较高,沉积物DOM烷基链烃H含量和n值略大于水体DOM。这种水体和沉积物DOM的光谱差异也暗示了其对水生生态系统物质循环调控的异质性贡献。后续应加强环境数学模型的引入,进而完善并验证光谱研究体系的科学性。
[1] Yang X M, Wander M M.Soil and Tillage Research, 1999, 52: 1.
[2] Kalbitz K, Solinger S, Park J H, et al.Soil Science, 2000, 165: 277.
[3] García-Ortega S, Holliman P J, Jones D L.Chemosphere, 2011, 83: 1117.
[4] Delgado-Moreno L, Wu L S, Gan J.Aquatic Toxicology, 2015, 165: 129.
[5] Ohno T, Bro R.Soil Science Society of America Journal, 2006, 70: 2028.
[6] Christensen J B, Jensen D L, Gron C, et al.Water Research, 1998, 32: 125.
[7] Chen M, Hur J.Water Research, 2015, 79: 10.
[8] HAO Rui-xia, CAO Ke-xin, ZHAO Gang, et al(郝瑞霞, 曹可心, 赵 钢, 等).Journal of Beijing University of Technology(北京工业大学学报), 2006, 32: 1062.
[9] Loiselle S A, Bracchini L, Dattilo A M, et al.Limnology and Oceanography, 2009, 54: 590.
[10] Schindler D W, Curtis P J, Parker B R, et al.Nature, 1996, 379: 705.
[11] Morrison R T, Boyd R N.Organic Chemistry (5th Edition).Newton, Massachussete: Allyn and Bacon, Inc.1987.574.
[12] Koyama Y, Long R A, Martin W G, et al.Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1979, 548: 153.
[13] Baker A.Environmental Science and Technology, 2001, 35: 948.
[14] Kalbitz K, Schmerwitz J, Schwesig D, et al.Geoderma, 2003, 113: 273.
[15] Pillinger J M, Cooper J A, Ridge I.Journal of Chemical Ecology, 1994, 20: 1557.
[16] Cortés-Francisco N, Harir M, Lucio M, et al.Water Research, 2014, 67: 154.
[17] Zhang F F, Harir M, Moritz F, et al.Water Research, 2014, 57: 280.
[18] Abdulla H A N, Minor E C, Dias R F, et al.Geochimica et Cosmochimica Acta, 2013, 118: 231.
[19] FENG Wei-ying, WANG Sheng-rui, ZHANG Sheng, et al(冯伟莹, 王圣瑞, 张 生, 等).Environmental Chemistry(环境化学), 2014, 33: 229.
[20] CAI Ming-hong, XIAO Yi-hua, WANG Feng, et al(蔡明红, 肖宜华, 王 峰, 等).Acta Oceanologica Sinica(海洋学报), 2012, 34: 102.
(Received Oct.1, 2015; accepted Feb.26, 2016)
Spectral Characteristics of Dissolved Organic Matter (DOM) Derived from Water and Sediment in Normal Flow Period of the Intersection Zone of Jing River and Wei River
FAN Chun-hui1, CHANG Min1, ZHANG Ying-chao2
1.School of Environmental Science & Engineering, Shaanxi University of Science & Technology, Xi’an 710021, China 2.School of Environment, Tsinghua University, Beijing 100084, China

Dissolved organic matter (DOM); Spectral characteristics; Water; Sediment
2015-10-01,
2016-02-26
国家自然科学基金项目(21407103), 中国博士后科学基金项目(2012M511968)和陕西科技大学科研基金项目(2014xhbz-06)资助
范春辉, 1982年生, 陕西科技大学环境科学与工程学院讲师 e-mail: frank_van391@163.com
O657.3
A
10.3964/j.issn.1000-0593(2016)09-2863-07

