金盏菊根际圈黄土溶解性有机质对Pb/Cd赋存形态原位调控机制的光谱学证据
范春辉,徐慧荟,张颖超
1.陕西科技大学环境科学与工程学院,陕西 西安 710021 2.清华大学环境学院,北京 100084
金盏菊根际圈黄土溶解性有机质对Pb/Cd赋存形态原位调控机制的光谱学证据
范春辉1,徐慧荟1,张颖超2
1.陕西科技大学环境科学与工程学院,陕西 西安 710021 2.清华大学环境学院,北京 100084

溶解性有机质;根际圈;黄土;Pb/Cd胁迫;金盏菊
引 言
溶解性有机质(dissolved organic matter, DOM)是生态系统中的活性化学组分,对于环境体系的组分循环和污染物迁移转化具有调控作用。土壤DOM主要来源于生物质腐殖化、微生物代谢产物和植物根系分泌物三方面,其中植物根系分泌物在土壤DOM中占有重要位置,日益成为学者们关注的焦点。植物根系分泌物是保持根际圈(rhizosphere)微生态功能的重要因子,其产生过程和产物性质具有天然可变性,能够有效暗示植物根系养分吸收和组分释放的动态行为。Edwards[1]指出,植物根系活动较为旺盛,代谢过程的根系分泌物将直接导致较高的根际C容量和微生物活性;Baetz[2]也认为作为屏障存在的植物根系分泌物可以降低土壤污染对植物的胁迫干扰。在污染土壤植物修复过程中,植物根系通过建立体外抗性作用保障植物的正常生理功能,这种主动防御过程通常更加积极有效。
植物根系(可溶性)分泌物包括可溶性糖(葡萄糖、果糖、麦芽糖等)、可溶性有机酸(草酸、柠檬酸、酒石酸等)和其他组分(胆碱、硫胺素、烟酸等)。这些组分的种类和含量变化代表了植物根系活动和生长发育的微观特性,也预示着根际圈土壤污染物的迁移转化和有效性差异。在重金属胁迫条件下,植物根系分泌物的特异性将更加明显,这种DOM特性的动态变化又会深度调控污染物的迁移转化过程,形成“修复植物-根际圈土壤-环境污染物”体系的反馈调节机制。现阶段,国内外学者对于土壤DOM的提取方法、来源解析、“质”“量”差别、环境效应等方面研究较多[3];而以光谱技术为切入点,研究复合重金属重度胁迫对植物幼苗根际圈土壤DOM性质的影响涉及很少。这也成为本研究的重要立足点和关键目标。
在前期研究中,笔者揭示了秸秆腐殖化对黄土DOM的影响、秸秆腐殖化DOM的性质等内容。本工作以金盏菊 (观赏花卉) 为修复植物,初步分析Pb/Cd重度复合胁迫条件下,金盏菊幼苗根际圈黄土Pb/Cd赋存形态变化,以及根际圈黄土DOM的光谱性质差异,力图为后续研究提供参考和借鉴。
1 实验部分
1.1 供试土样
黄土样品的采集、预处理方法参见文献[4],此处不再赘述。向黄土中均匀喷洒Pb(NO3)2和CdCl2溶液,充分搅拌使黄土润湿并混合均匀,人为配制Pb/Cd污染黄土。其中:黄土老化时间为15 d,Pb/Cd浓度分别为1 000 mg·kg-1黄土和30 mg·kg-1黄土。实验用水为桶装纯净水,化学试剂为光谱纯和分析纯。
1.2 盆钵实验
盆栽容器为44 cm×20 cm×14 cm的矩形塑料盆,每盆装有污染黄土(5.0±0.1)kg,金盏菊种子购于西安三色园艺有限责任公司。为了获得合适的金盏菊幼苗,采用盆栽土培实验培养:每盆均匀播种100粒,置于室外天然光照条件下培养并定期浇灌,使黄土含水量达到田间持水量的70%。从播种之日起,经过60 d的培养后衡量金盏菊生长情况;同时提取金盏菊根际圈黄土DOM组分,以供相关分析检测用。
1.3 根际圈黄土及DOM提取
根际圈黄土的提取采用抖落法[5-6],这种方法是被美国土壤学会(SSSA)接受的方法。其操作流程为:在金盏菊幼苗完成既定生长周期后,随机选取盆钵中若干株长势一致的健壮金盏菊样本连根提起;期间注意拔起力度,以避免破坏或改变金盏菊微根系环境。之后小心剪下带土的根,轻轻抖动,落下的土壤为非根际圈黄土,仍然粘附和残留于根系上的为根际圈黄土;用毛刷将根际圈黄土收集后装入带封口的聚四氟乙烯样品袋,标记后保存备用。
将根际圈黄土初步研磨后过筛(100目),土样与纯净水按1∶5的土水比(m∶V, g·mL-1) 混合后振荡 (24 h, 150 r·min-1, 25 ℃)、离心 (5 000 r·min-1, 5 min)、上清液过滤 (0.45 μm滤膜) 后,即得根际圈黄土DOM样品。
1.4 分析方法
为了考察金盏菊根际圈黄土Pb/Cd赋存形态的变化规律,设置CK (Pb/Cd污染黄土)、Lead(Pb污染黄土+金盏菊)、Cadmium(Cd污染黄土+金盏菊)和Lead/Cadmium(Pb/Cd污染黄土+金盏菊)四种处理;其中Pb/Cd总量采用混合酸消化法(HCl-HNO3-HF-HClO4)测定,Pb/Cd形态采用Tessier连续提取-石墨炉原子吸收(Z-2000, HITACHI) 法检测,具体分析步骤见表1。

表1 金盏菊根际圈黄土Pb/Cd赋存形态的Tessier连续提取法
实验中每个样品均做3次平行,黄土理化性质的测定以文献[7]为依据。SEM(TM-1000, HITACHI) 放大倍数分别为×500和×1 000;UV光谱(UV2300, 上海天美)扫描波长为200~700 nm;冻干后DOM样品的FTIR光谱(VECTOR-22, BRUKER)测试采用KBr压片法,扫描范围4 000~400 cm-1;荧光光谱(F-4600, HITACHI)的激发光源为150 W氙灯,PMT电压700 V。所得数据采用Origin软件处理和绘图。
2 结果与讨论
2.1 Pb/Cd赋存形态
金盏菊根际圈黄土Pb/Cd赋存形态分布规律如表2所示。根际圈黄土Pb/Cd均以残渣态和可交换态为主,两者合计占到Pb/Cd全量的65%以上,其余三种形态Pb/Cd含量较低。这种不同处理组可交换态Pb/Cd含量较高的情况,源于污染黄土老化时间较短;相比之下,Cd赋存形态的变化尺度更为明显,这可能与元素性质及其稳定性有关。相对于CK体系,金盏菊根际圈黄土有效态Pb/Cd含量有所增加,其中可能涉及根系分泌物、微生物活动以及根际圈黄土环境条件 (pH,Eh,DOM性质等) 的影响,因为有诸多学者发现植物根系可以通过泌氧作用、化感作用等“生物反馈”途径调控污染物形态,进而形成“隔离屏障”保障自身生长发育[8-9]。当然,具体原因还有待深入探究。
2.2 金盏菊生长状况
重金属胁迫对金盏菊幼苗生长发育的影响见表3。与CK(无胁迫)相比,重金属单一/复合胁迫对金盏菊株高和出苗率都具有抑制作用,源于重金属直接作用于植物细胞系统,导致自身代谢功能受损。在Pb/Cd高度胁迫条件下,金盏菊出苗率仍维持在45%以上,暗示了其对重金属胁迫的忍耐性和污染场地修复的内在潜力。黄土Pb/Cd对金盏菊生物量(根干重和植株干重)的影响不大,但胁迫后的根长略有增加。通常认为,重金属胁迫能降低植物根细胞有丝分裂速度,进而导致植物根长变短。但Ricken[10]指出重金属也可能通过调控作用间接促进植物根系生长,不排除根系对重金属胁迫产生的“回避机制”,这种微型“生态修复单元”可能有利于减缓重金属对植物根系的毒害作用。
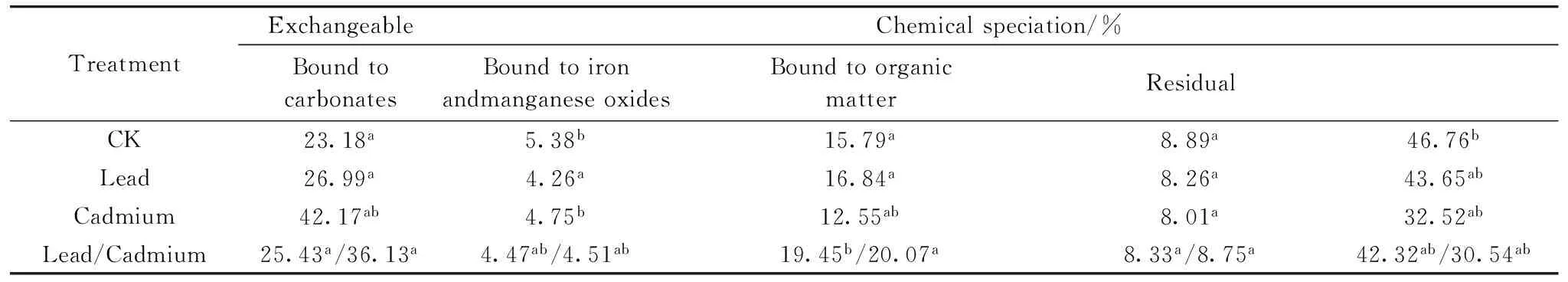
表2 金盏菊根际圈黄土Pb/Cd赋存形态分布

表3 Pb/Cd胁迫对黄土区金盏菊幼苗生长的影响
2.3 黄土理化性质
与黄土原样相比,无论是否存在Pb/Cd胁迫作用,金盏菊的生长过程都能一定程度上影响黄土体系理化性质 (表4)。幼苗期金盏菊能够降低黄土容重,说明修复过程黄土的团粒结构和孔隙特性有所变化,这有助于黄土体系水、热、气、肥的循环流通。金盏菊幼苗可以降低黄土pH值,推测其中可能存在金盏菊根系代谢分泌物 (有机酸、糖类等) 的贡献,也可能是金盏菊根系对黄土离子组分选择性吸收的结果。黄土CEC的降低可能与pH值的减小有内在关联,而有机质含量和电导率的升高则反映了植物/微生物的协同作用[11]。总体来看,在Pb/Cd植物修复过程中,金盏菊幼苗对黄土理化性质的影响是积极的,预期可以达到污染生态修复和黄土性质改良的双重目标。
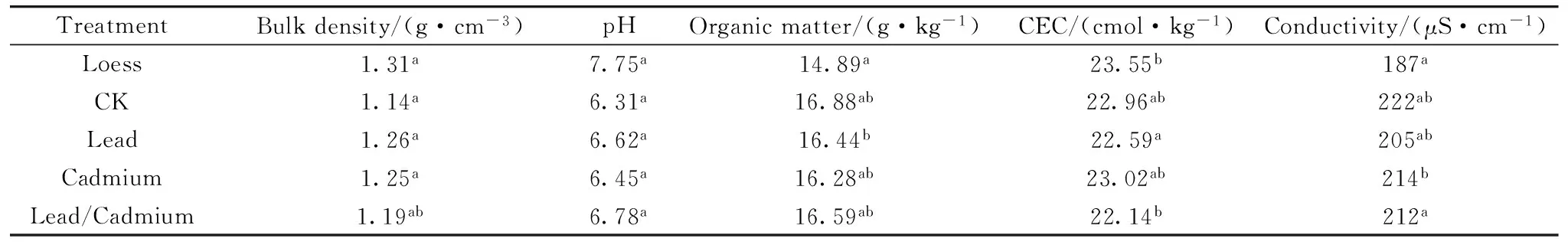
表4 Pb/Cd胁迫金盏菊幼苗生长对黄土性质的影响

图1 黄土区Pb/Cd胁迫金盏菊幼苗根系表观形态
2.4 扫描电镜
Pb/Cd复合胁迫对金盏菊根部表观形貌的影响见图1。正常条件下[图1(a)]的金盏菊根部直径较大,根毛浓密,侧根较多,根部微形态清晰可辨;而Pb/Cd胁迫[图1(b)]对金盏菊根部形态影响较大,根部整体呈现细长、弯曲且萎缩的状态,略有分叉和突起现象,根毛数量显著减少,但剖面组织较为光洁,基本无多余物质出现。这种根部表面形态差异可能暗示了根系表皮组织能够对Pb/Cd胁迫做出有效响应,进而(尽量)保障养分的吸收运输和新陈代谢的正常进行[12]。
2.5 紫外可见光谱
金盏菊根际圈黄土DOM的紫外可见吸收光谱如图2所示。随着紫外吸收波长的增加,吸光度呈现总体下降趋势。两种根际圈黄土DOM紫外光谱的最大吸收区间都出现在200~240 nm范围,但Pb/Cd胁迫对紫外光谱的波形和波峰影响较大。谱线a中主要吸收带位于213和226 nm附近;而谱线b中波峰更加尖锐,峰强更大,比如在209,215,222 nm等处。这种现象可能源于金属离子与配体络合后的电荷转移跃迁,也有可能叠加了某些阴离子(含氧酸根、过渡金属水合离子等)在低波段的强紫外吸收[13-14]。谱线a在240~360 nm区段出现若干杂峰,吸光度下降幅度平缓;而谱线b则没有出现杂峰,且吸光度急剧降低,至350 nm波长后紫外吸收强度趋于不变。一般认为,270~350 nm内的弱吸收峰代表化合物含有带n电子的未共轭发色团,主要是由n→π*跃迁引起。而谱线b中的弱峰消失,可能暗示金属离子的存在已导致发色团体系化学环境发生变化[15]。
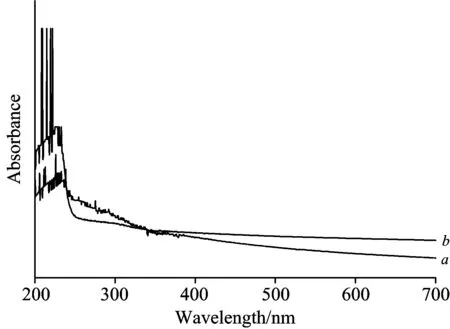
图2 Pb/Cd胁迫金盏菊幼苗根际圈黄土DOM的紫外可见吸收光谱
Fig.2 UV absorption spectra of DOM fromCalendulaofficinalisseedling’s Rhizosphere loess under lead/cadmium stress
2.6 红外光谱
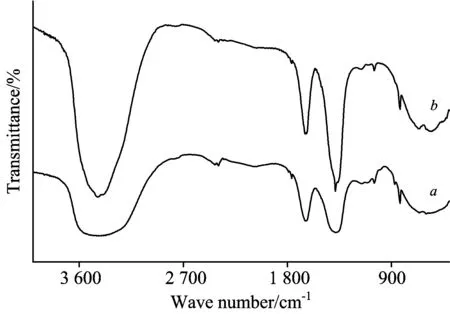
图3 Pb/Cd胁迫金盏菊幼苗根际圈黄土DOM的红外光谱
Fig.3 FTIR spectra of DOM fromCalendulaofficinalisseedling’s rhizosphere loess under lead/cadmium stress
2.7 三维荧光光谱
金盏菊幼苗根际圈黄土DOM的三维荧光光谱见图4。总体上看,Pb/Cd胁迫主要影响DOM的荧光峰强,而对荧光峰位干扰很小,不会造成新荧光峰产生或已有荧光峰消失。无胁迫金盏菊根际圈黄土DOM[图4(a)]荧光峰集中出现在λex/em=240/430附近,归属为紫外区类富里酸荧光峰,其荧光强度为2 253(无量纲, 下同);而Pb/Cd复合胁迫条件下DOM[图4(b)]荧光峰强降为1 561。两种体系荧光强度差异的原因在于:金属离子是典型的荧光猝灭剂,对于DOM的电荷浓度和共轭主链结构影响较大,极易导致配位作用和荧光猝灭现象发生[17]。此外,DOM荧光图谱没有出现类蛋白、类腐殖酸等其他特征荧光峰。这说明实验条件下,根际圈黄土微生物活性不强,使得微生物源的类蛋白荧光峰没有显现;而DOM分子间的聚合作用或较低的类腐殖酸含量也可能导致对应荧光信号的掩蔽[18]。当然,本荧光光谱结果可能涉及黄土理化性质(pH、共存离子强度等)、荧光自吸等外界干扰因子,对此可以尝试多种仪器分析方法的协同验证。
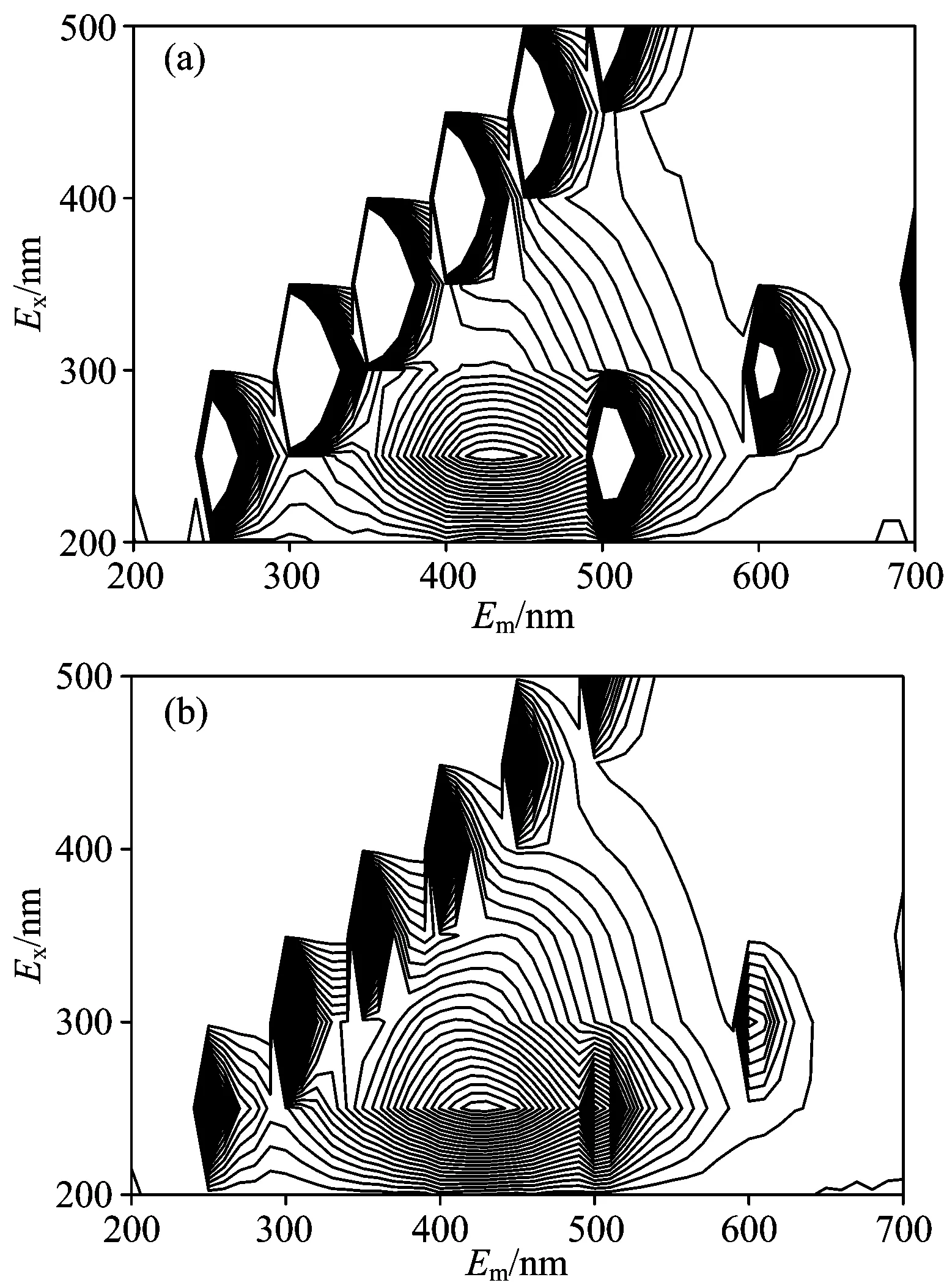
图4 Pb/Cd胁迫金盏菊幼苗根际圈黄土DOM的三维荧光光谱
Fig.4 Three-dimensional fluorescence spectrum of DOM fromCalendulaofficinalisseedling’s rhizosphere loess under lead/cadmium stress
近些年,植物根系分泌物相关研究变得异常活跃。这一方面源于其定性定量分析的不确定性,另一方面也因为其独特的生态调控效应(化感作用、金属抗性等)[19]。根系分泌物能有效反映植物生境的异质性,对于根际圈微生态群落的演替进化具有指示作用。本工作初步揭示了Pb/Cd胁迫对金盏菊根际圈黄土DOM影响的光谱学性质,但从现有资料看,尚有诸多问题还没有得到根本解决[20],比如根系分泌物的时空差异、信息传递机制和环境生态效应等。这要求今后不断加强实验深度和广度,要将宏观研究(盆栽实验、场地修复等)和微观证据(仪器技术、基因技术等)相结合,进而全面揭示并形成相关理论体系。
3 结 论

[1] Edwards N T, Harris W F.Ecology, 1977, 58: 431.
[2] Baetz U, Martinoia E.Trends in Plant Science, 2014, 19: 90.
[3] Haitzer M, Hoss S, Traunspurger W, et al.Chemosphere, 1998, 37: 1335.
[4] FAN Chun-hui, ZHANG Ying-chao, WANG Xiao-na, et al (范春辉, 张颖超, 王晓娜, 等).Spectroscopy and Spectral Analysis (光谱学与光谱分析), 2014, 34(4): 1035.
[5] Riley D, Barber S A.Soil Science Society of America Journal, 1969, 33: 905.
[6] McGahan D G, Southard R J, Zasoski R J.Geoderma, 2014, 226-227: 340.
[7] BAO Shi-dan(鲍士旦).Analysis on Soil & Agricultural Chemistry, 3rd Edition(土壤农化分析, 第3版).Beijing: China Agriculture Press(北京: 中国农业出版社), 2000.
[8] Colmer T D.Plant, Cell & Environment, 2003, 26: 17.
[9] Kato-Noguchi H, Seki T, Shigemori H.Journal of Plant Physiology, 2010, 167: 468.
[10] Ricken B, Hofner W.Journal of Plant Nutrition & Soil Science, 1996, 159: 189.
[11] Dhal B, Thatoi H N, Das N N, et al.Journal of Hazardous Materials, 2013, 250-251: 272.
[12] Lombi E, Scheckel K G, Kempson I M.Environmental & Experimental Botany, 2011, 72: 3.
[13] Hoffmann S K, Goslar J, Lijewski S, et al.Microporous & Mesoporous Materials, 2014, 186: 57.
[14] Mchedlov-Petrossyan N O, Palval I N, Lebed A V, et al.Journal of Molecular Liquids, 2009, 145: 158.
[15] Merdy P, Gharbi L T, Milori D M P, et al.Geoderma, 2009, 150: 179.
[16] WU Jin-guang(吴瑾光).Modern Fourier Transforms Infrared Spectroscopy & Applications, Vol.2(近代傅利叶变换红外光谱技术及应用-下卷).Beijing: Scientific & Technical Documentation Press(北京: 科学技术文献出版社), 1994.
[17] Louis Y, Pernet-Coudrier B, Varrault G.Science of the Total Environment, 2014, 490: 830.
[18] Abdulla H A N, Minor E C, Dias R F, et al.Geochimica et Cosmochimica Acta, 2013, 118: 231.
[19] Oburger E, Dellmour M, Hann S, et al.Environmental & Experimental Botany, 2013, 87: 235.
[20] Haichar F Z, Santaella C, Heulin T, et al.Soil Biology & Biochemistry, 2014, 77: 69.
(Received Oct.7, 2015; accepted Jan.30, 2016)
Spectral Evidence ofIn-SituRegulatory Mechanisms on Chemical Speciation of Lead/Cadmium Affected by Dissolved Organic Matter Extracted from Rhizosphere Loess ofCalendulaOfficinalisSeedling
FAN Chun-hui1, XU Hui-hui1, ZHANG Ying-chao2
1.School of Environmental Science & Engineering, Shaanxi University of Science & Technology, Xi’an 710021, China 2.School of Environment, Tsinghua University, Beijing 100084, China

Dissolved organic matter; Rhizosphere; Loess; Lead/cadmium stress;Calendulaofficinalis
2015-10-07,
2016-01-30
国家自然科学基金项目(21407103), 中国博士后科学基金项目(2012M511968)和陕西科技大学科研基金项目(2014xhbz-06)资助
范春辉, 1982年生, 陕西科技大学环境科学与工程学院讲师 e-mail: frank_van391@163.com
O657.3
A
10.3964/j.issn.1000-0593(2016)09-2852-06

