基于银溶胶表面增强拉曼光谱对菠菜毒死蜱农药的快速检测
翟 晨,徐田锋,彭彦昆,李永玉
中国农业大学工学院,国家农产品加工技术装备研发分中心,北京 100083
基于银溶胶表面增强拉曼光谱对菠菜毒死蜱农药的快速检测
翟 晨,徐田锋,彭彦昆,李永玉*
中国农业大学工学院,国家农产品加工技术装备研发分中心,北京 100083
利用表面增强拉曼光谱(SERS)技术,建立了一种用于菠菜中毒死蜱农药残留的非破坏、快速检测方法。以碱性环境下盐酸羟胺还原法制备的银溶胶作为表面增强剂滴涂于菠菜样品表面后,采用实验室自行搭建的拉曼系统直接采集样品的拉曼信息,该方法无需对样品进行前处理,可以实现菠菜中毒死蜱含量的实时在线定量分析。采集24片不同毒死蜱含量的菠菜样品拉曼光谱,每个样品采集20个点。拉曼信号采集后,用气相色谱法对24个菠菜样品中毒死蜱含量进行检测。为了消除光谱噪音以及荧光背景对分析建模的影响,分别采用Savitzky-Golay平滑和有效峰线性拟合法对原始拉曼光谱进行预处理。该表面增强拉曼方法具有较好的重复性,实验中对50个相同毒死蜱含量,但不同状态的菠菜进行光谱采集,其相对标准偏差为13.4%,说明该方法具有一定的普适性。光谱预处理后,选取615.5~626.4 cm-1波段为感兴趣区域,建立0.05~37.4 mg·kg-1浓度范围内毒死蜱含量的多元线性预测模型,结果表明感兴趣区域的拉曼信号和毒死蜱浓度呈良好的线性关系,其校正集和验证集相关系数RC和RP分别为0.961和0.954。该方法的最低检出含量为0.05 mg·kg-1,低于国家标准规定的农药残留最大限量。该方法简单快速,无需样品前处理,可以实现果蔬的农药残留快速、定量检测。
表面增强拉曼光谱;菠菜;毒死蜱;银溶胶
引 言
毒死蜱(C9H11Cl3NO3PS)是一种高效、应用广泛的有机磷农药,可抑制害虫体内乙酰胆碱酯酶的活性,对广泛植食性昆虫均有毒杀效果,有效适用于谷物、蔬菜、水果以及糖料作物[1]。气相色谱-质谱法、液相色谱-质谱法等[2]常用理化检测手段具有较低的检测限,但是存在前处理过程复杂、消耗时间长、仪器昂贵、需要专业人员操作等缺点,不适合应用于现场和实时检测,生物传感器法[3]、试纸条法等快速检测方法速度快,但是特异性差,结果受环境影响较大。
拉曼光谱技术具有无损、快速、实时的优点,通过对其散射光谱进行分析,得到分子振动、转动方面的信息,从而对待测分子结构进行研究[4-5]。但是,传统的拉曼散射信号较弱,导致采用该方法缺乏灵敏度[6],表面增强拉曼光谱(surface enhanced Raman spectroscopy, SERS)结合拉曼光谱与纳米技术可以使拉曼信号增强达15个数量级[7-8]。该技术采用表面粗糙的纳米金属材料(如金、银、铜等)[9],当分子吸附在这些纳米材料表面时,拉曼信号得到增强。相比于其他纳米金属材料,银溶胶的表面增强效应最强[10],本文采用盐酸羟胺还原法制备银溶胶,该方法稳定、快速,所制备的银溶胶可直接用于拉曼检测[11]。
目前,采用表面增强拉曼技术检测农药的研究有很多,但是,以农药溶液的检测为主,对于果蔬样品中农药残留的检测,大多数需要样品前处理。Fan等[12]采用SERS方法检测苹果中的亚胺硫磷含量,需要对样品打碎以及浓缩处理。Wijaya等[13]在检测苹果表面的啶虫脒农药时,需要拭擦样品表面,然后通过漩涡震荡等手段,将农药溶解于溶液中,再进行SERS检测。Xie等[14]利用SERS方法检测小白菜、韭菜等多种蔬菜中甲胺磷农药含量,也需要将蔬菜打碎后提取农药。目前,少有对果蔬样品不进行前处理,将纳米粒子直接滴涂于样品表面,进行SERS原位定量分析的研究报道。
本研究采用盐酸羟胺还原法制备的银溶胶作为表面增强剂,以菠菜作为载体,不需要对样品进行前处理,直接将银溶胶滴涂于菠菜表面进行SERS检测。采用Savitzky-Golay平滑和有效峰线性拟合法对原始拉曼光谱进行预处理以减小噪声和荧光背景对检测精度的影响,采用多元线性回归法建立菠菜毒死蜱含量的预测模型,通过该研究为实现菠菜中毒死蜱快速、定量检测提供一种新思路。
1 实验部分
1.1 试剂与材料
毒死蜱纯品(99.8%,Augsburg,Germany)用以获取毒死蜱特征峰,市售毒死蜱乳油农药(有效成分48%,河北省石家庄市伊诺生化有限公司)用以施加于菠菜表面进行定量分析。硝酸银生产于广东光华科技股份有限公司,盐酸羟胺生产于天津市津科精细化工研究所,硝酸、氢氧化钠、丙酮均生产于北京化工厂,所有试剂均为分析纯。
1.2 仪器
采用实验室自行搭建的拉曼光谱检测系统采集样品的光谱信息[15],该系统包括激光器(I0785MM0350MF-NL)、拉曼光谱仪(Raman Explorer 785)、CCD相机(Newton DU920N-BR-DD)、光纤、探针、平移台和计算机等硬件,电机控制平移台实现三维运动。该仪器有效光谱范围是0~2 352.0 cm-1,激发光波长为785 nm。
电子天平(ME204,METTLER TOLEDO);磁力搅拌器(88-1,常州国华电器有限公司);离心机(TDZ5-WS,湖南赫西仪器装备有限公司);漩涡混合器(QL-901,海门市其林贝尔仪器制造有限公司)。
1.3 样品制备
制备不同浓度的毒死蜱溶液各500 mL,以75%的丙酮溶液(丙酮和去离子水体积比为3∶1)作溶剂。取洗净的菠菜叶片24片,在不同浓度的毒死蜱溶液中分别浸泡7 s后自然晾干作为待测样品。
1.4 银溶胶的合成
根据Nicolae Leopold等的方法[11],首先制备浓度为1.1×10-3mol·L-1的硝酸银溶液,然后将盐酸羟胺和氢氧化钠溶解于10 mL的去离子水中,制备成浓度分别为1.5×10-2和3.0×10-2mol·L-1的混合溶液,将新鲜制备的混合液迅速倒入90 mL快速搅拌的硝酸银溶液中,溶液颜色迅速由透明变为灰褐色,持续搅拌30 min即得到纳米银胶,将得到的银溶胶离心,去除上清液,浓缩后的银溶胶置于4 ℃黑暗环境中待用。
1.5 光谱采集
保持激光功率为450 mW,相机曝光时间为2.5 s,光谱仪与相机狭缝为100 μm,光谱采集软件选择CCD自带的Andor SOLIS光谱采集软件。将样品放置于升降台上,调节样品与检测探头距离为7.5 mm。在菠菜待测位置上先滴加2.5 μL 75%的丙酮溶液,使吸附在菠菜表面的毒死蜱农药溶解,然后迅速滴加4 μL银溶胶溶液,2 s后采集拉曼光谱。每个样品采集20个点,20个点均匀分布于菠菜表面,拉曼光谱采集完成后,将采集光谱后的菠菜迅速放入密封袋中保存,参照标准方法SN/T 0148—2011,采用气相色谱法对菠菜中毒死蜱含量进行检测。
1.6 光谱处理及数据分析
拉曼信号获得过程中,因受外界环境变化、激光功率波动、检测器噪声以及样品本身所产生的荧光背景等多方面因素的影响,所获得的光谱数据除了被检测物质的信息外还包含了其他无关的信息和干扰噪声。因此,分析建模前需要对原始光谱进行预处理以降低噪声和扣除荧光背景。
本研究的光谱预处理方法为首先采用Savitzky-Golay(S-G)5点平滑法降低噪声,然后采用有效峰线性拟合法扣除荧光背景。S-G 5点平滑法基于多项式拟合,可有效去除光谱噪声,且较好地保留光谱原有信息。有效峰线性拟合法,通过判断波峰两侧有无波谷从而确定直线拟合的起始位置,进而通过直线拟合方程产生并替换原始光谱中波峰位的数据,该方法可有效消除拉曼信号荧光背景,使光谱数据优化。原始光谱及预处理后的光谱如图1所示,可见荧光背景得到了有效的去除,而原始光谱中的拉曼峰,如621.0,683.4 cm-1,甚至较为微弱拉曼峰,比如1 158.8 cm-1(拉曼峰强度小于150 count)也得到了有效的保留。
2 结果与分析
2.1 毒死蜱特征峰的确定

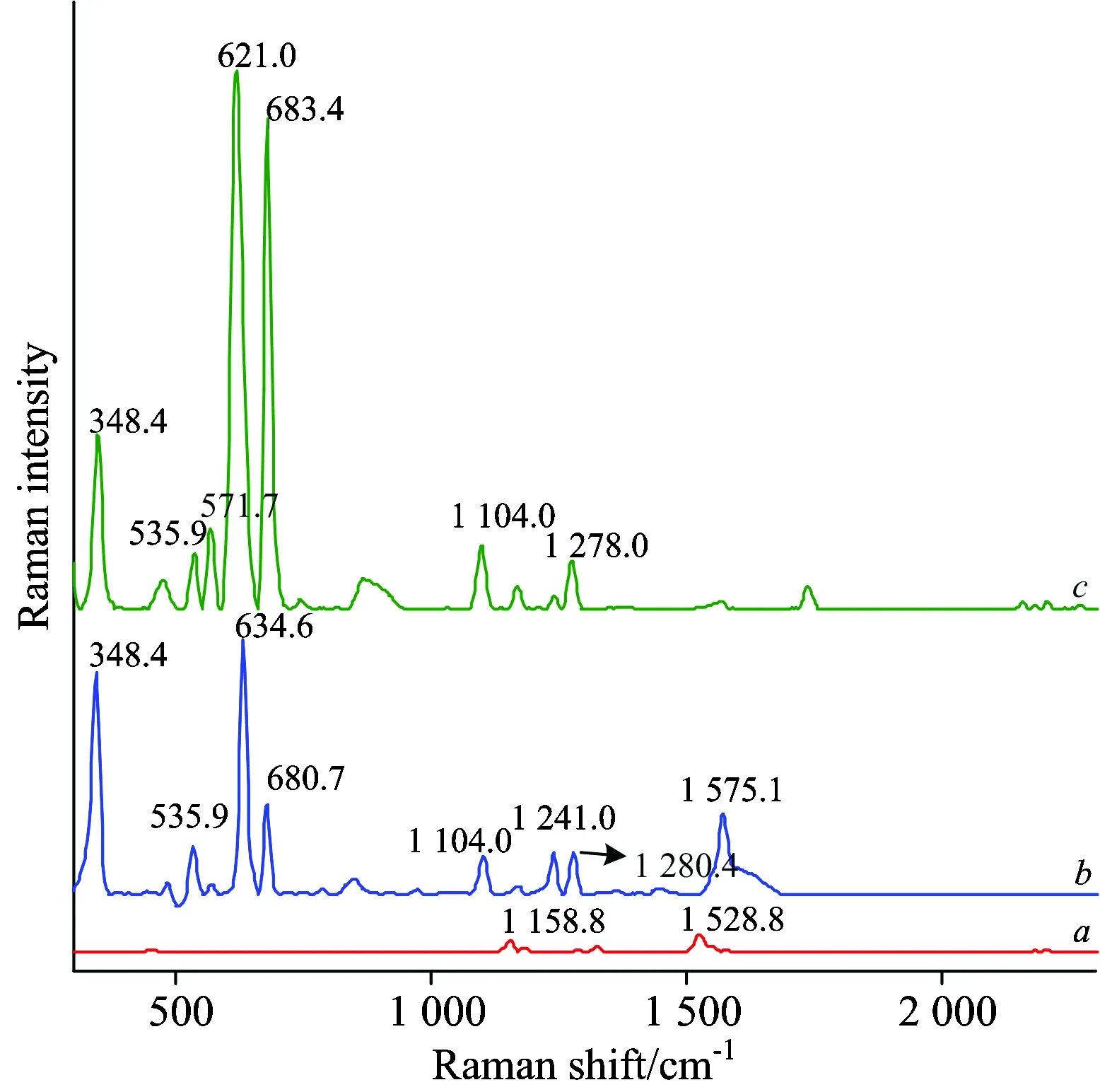
图2 无农药菠菜拉曼光谱a, 毒死蜱纯品拉曼光谱b和含有毒列蜱的菠菜SERS光谱c
Fig.2 Raman spectrum of spinach without chlorpyrifosa, Raman spectrum of chlorpyrifos powderband SERS spectrum of spinach with chlorpyrifos at Silver colloidsc
2.2 模型重复性验证
建立可靠稳定的模型,其系统以及方法的稳定性非常重要。本研究制备50组相同毒死蜱含量的菠菜样品,对其不同部位(如叶肉部位、叶脉部位、叶片正面、叶片反面),且在不同新鲜状态下分别进行了SERS信号采集。所得到的原始光谱曲线如图3(a)所示,可见不同采集部位、不同新鲜状态的菠菜叶片光谱曲线的荧光背景有较大的差别。对光谱进行预处理后,选取621.0 cm-1处特征峰强度进行比较,50个样品对应的特征峰强度如图3(b)所示,计算其相对标准偏差为13.4%,说明该方法具有较好的稳定性[18],虽然样品的差异导致光谱的荧光背景差异,但是对待测物毒死蜱的特征峰强度影响并不大。因此该方法具有一定的普适性,对新鲜度不同的样品及样品的不同部位均有实用性。

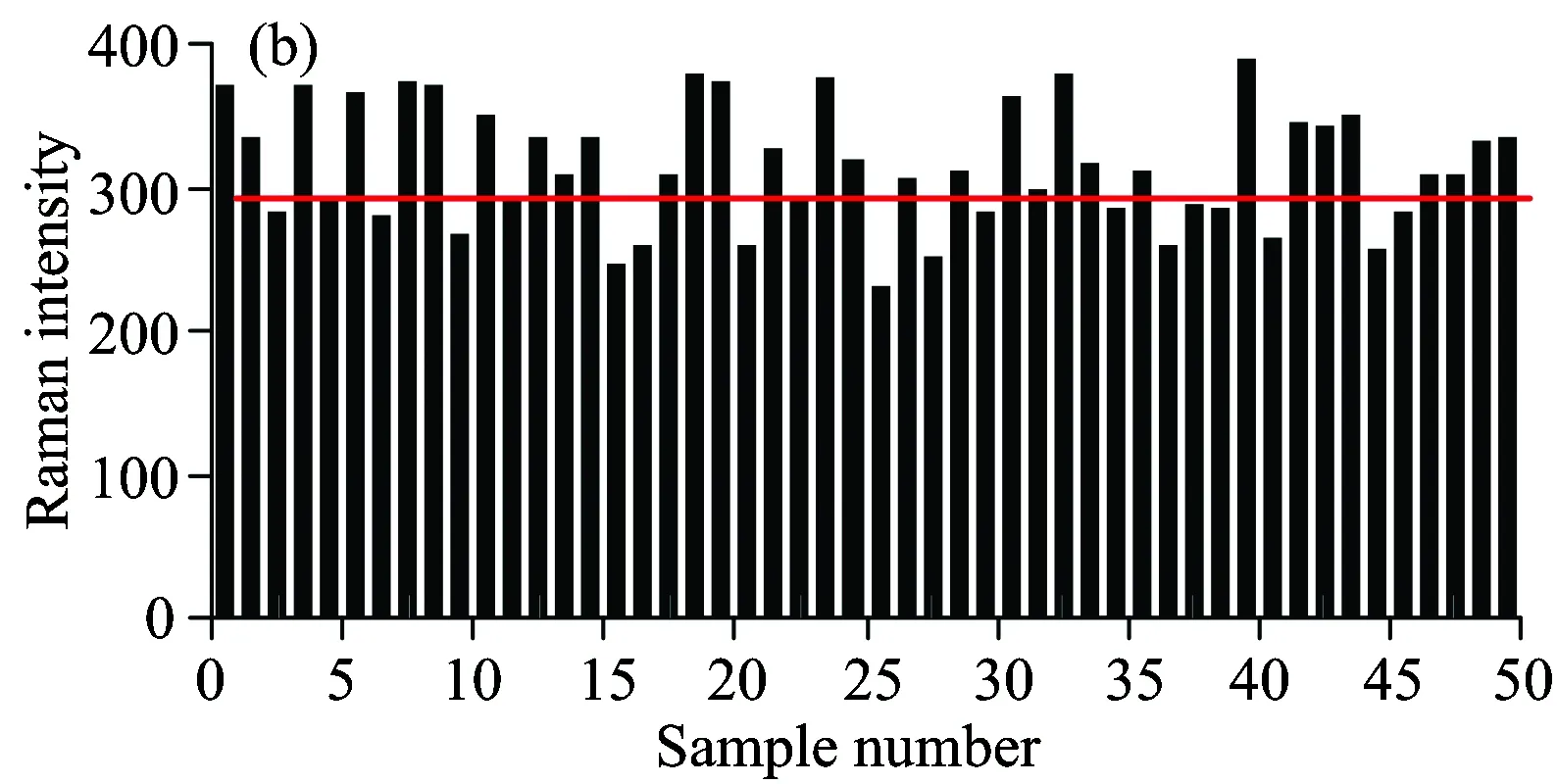
图3 相同毒死蜱含量的50个样品的原始拉曼光谱(a),621.0 cm-1处的峰强度柱状图(b)
Fig.3 Pure Raman spectra with same concentration of chlorpyrifos of 50 samples (a), the discrete states of Raman intensity at 621.0 cm-1of 50 samples (b)
2.3 菠菜中毒死蜱含量预测模型的建立
每个样品分别采集20个点的拉曼光谱,并对其20条光谱进行平均作为该样品的拉曼信息。24个样品所对应的平均拉曼光谱,通过S-G 5点平滑和有效峰线性拟合法降低噪声和扣除荧光背景,得到的光谱均在621.0和683.4 cm-1处有明显的毒死蜱拉曼特征峰,其强度随着毒死蜱含量的降低而呈下降趋势。因此,对621.0和683.4 cm-1处的拉曼峰强度与毒死蜱含量进行相关性分析。
为了减小毒死蜱含量跨度进而提高预测模型的稳健性,剔除了毒死蜱含量较高的313.4,133.9和83.49 mg·kg-13个菠菜样品。分别建立621.0和683.4 cm-1处峰强度与毒死蜱含量(0.05~37.4 mg·kg-1)之间的线性关系,但两个位置的峰强度与毒死蜱含量之间的相关性均不好,621.0 cm-1处的相关系数相对较好,也只有0.722。进一步选择621.0和683.4 cm-1处的峰强作为感兴趣数据建立与实际毒死蜱含量之间的二元线性回归模型,但所建立的线性回归方程相关性没有得到很大提高,相关系数为0.731。这可能因为采用先对光谱进行平均,后对其进行预处理的方法,没有较好的保留所采集的每条光谱中待测物的有效信息,直接影响了毒死蜱农药的预测模型准确度。
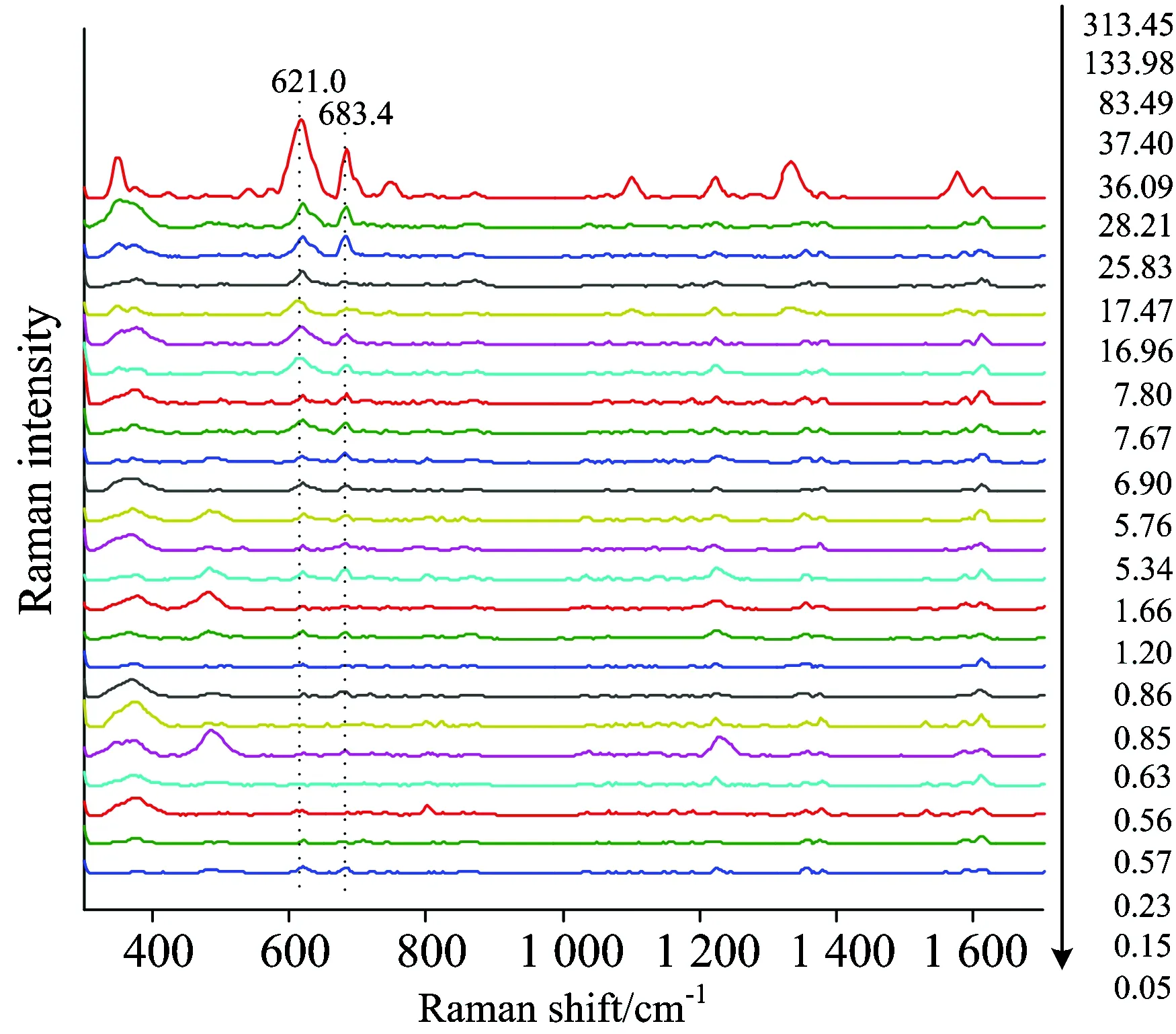
图4 不同毒死蜱含量的菠菜平均SERS光谱信号
因此本研究先对每个样品的20条光谱曲线分别进行荧光背景扣除,再对扣除荧光背景后的20条光谱曲线进行平均,这样可以较好的保留20条光谱曲线中毒死蜱的拉曼信息,增加了模型的准确性和稳定性。24个样品对应的原始光谱经光谱预处理,再进行平均后的光谱曲线如图4所示,所有样品的光谱曲线在621.0和683.4 cm-1等处均有明显的毒死蜱特征峰。特别是毒死蜱含量为0.05 mg·kg-1时,其拉曼光谱仍可清晰辨别出毒死蜱特征信号。
实验中首先对0~2 352.0 cm-1范围内所有点的拉曼峰强度与农药含量的相关性进行分析,相关性最高的前20个拉曼位移以及对应的相关系数如表1所示。结果显示,在615.5~626.4 cm-1范围内的相关系数均高于0.85,其中621.0 cm-1处相关系数最高为0.885。因此为了提高模型准确度,选取615.5~626.4 cm-1波段作为感兴趣区域,建立毒死蜱的多元线性回归预测模型。
剔除3个农药含量较高的样品,剩余的样品按照3∶1的比例分为校正集和验证集,建立了615.5~626.4 cm-1范围内的多元线性回归模型,所建模型校正集和验证集的散点图如图5所示。校正集相关系数(RC)为0.961,校正集均方根误差(RMSEC)为3.368 mg·kg-1,验证集相关系数(RP)为0.954,验证集均方根误差(RMSEP)为3.614 mg·kg-1。
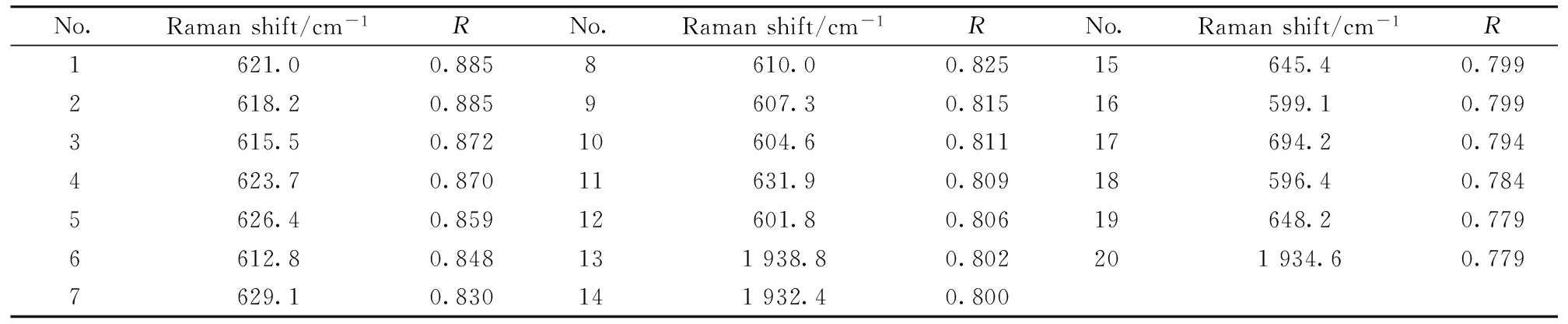
表1 拉曼峰强度与浓药含量相关性最高的前20个拉曼位移以及对应的相关系数
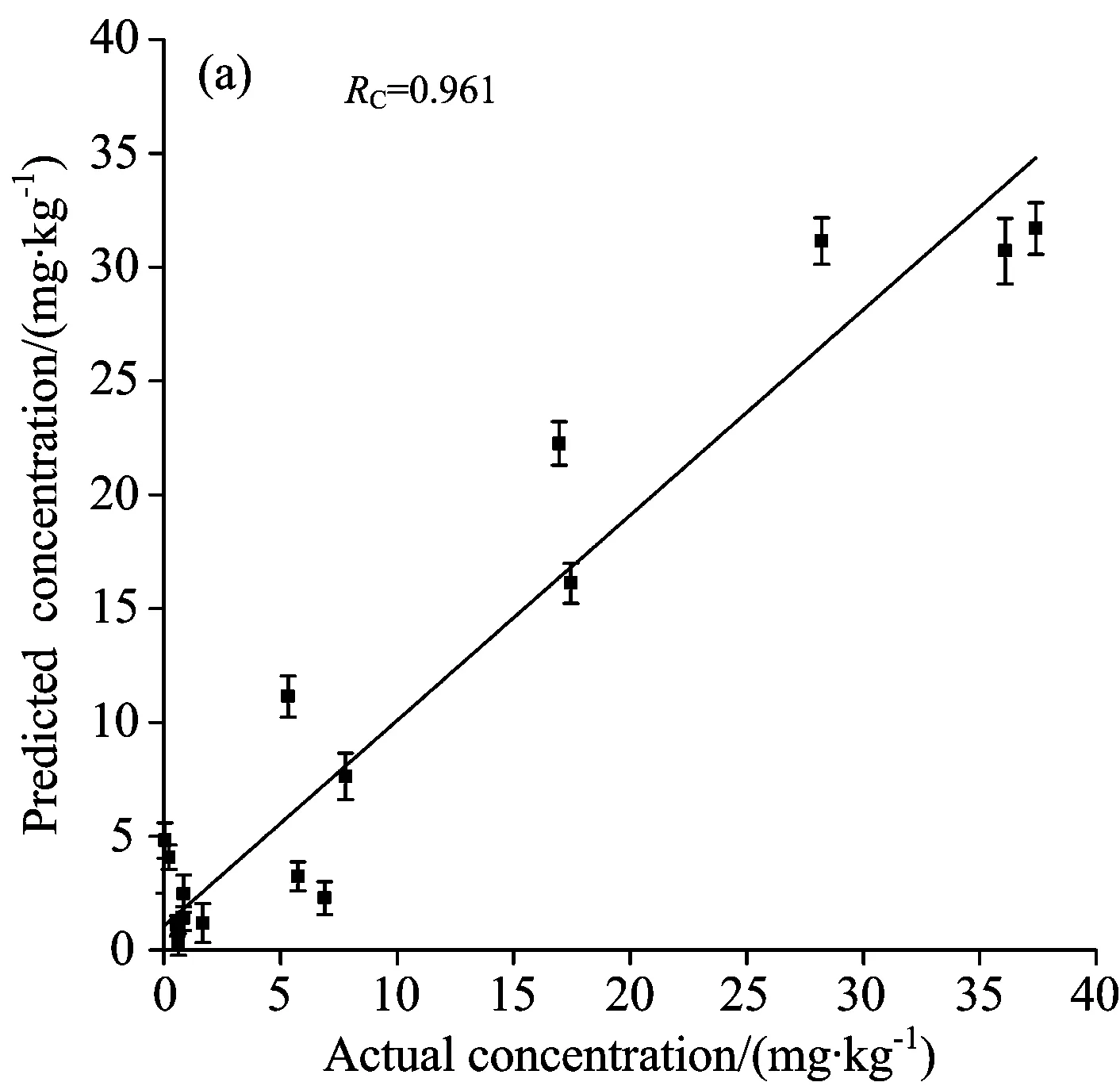
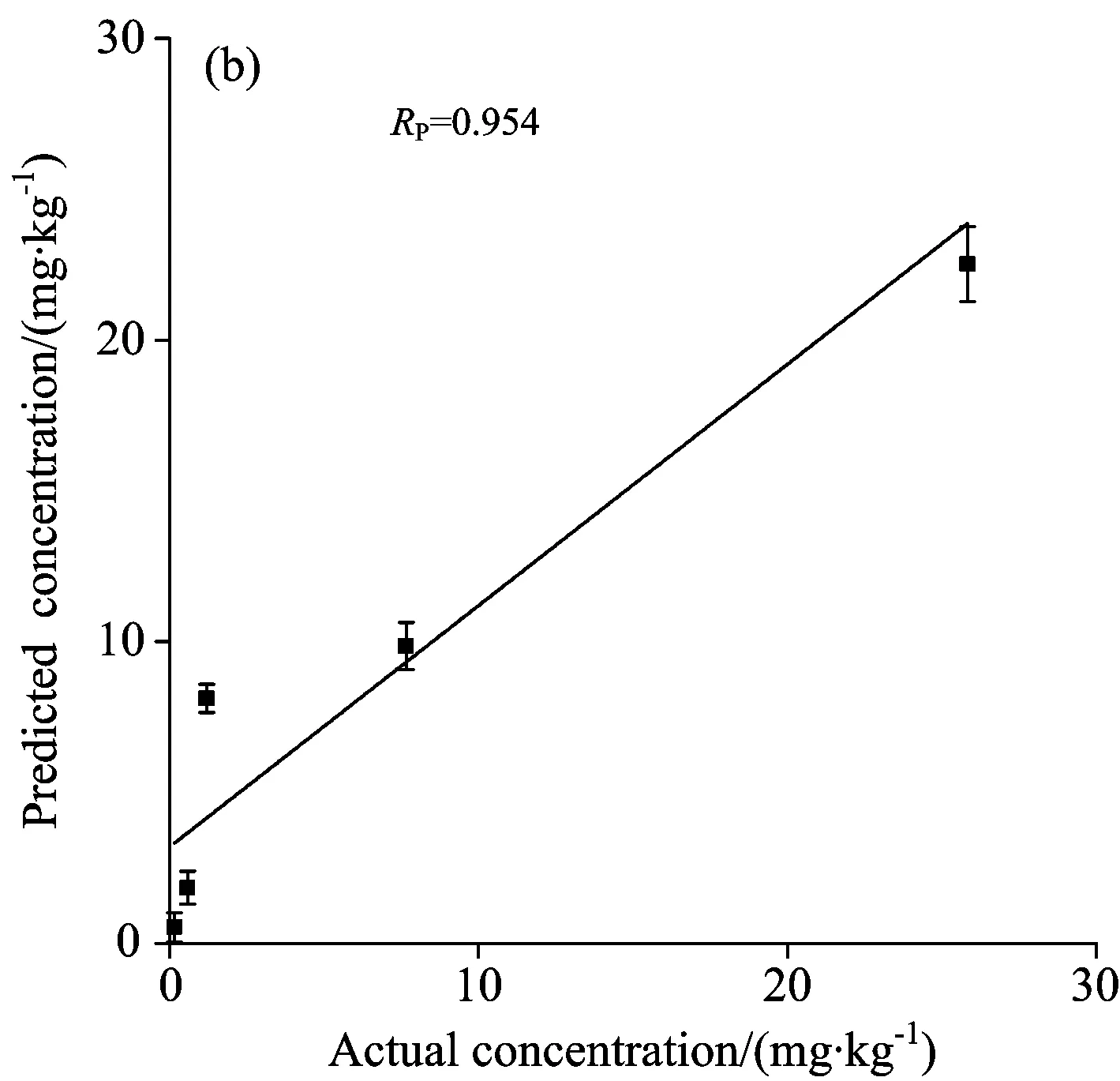
图5 菠菜中毒死蜱含量的校正集和验证集结果,误差线为三次检测的标准差
3 结 论
本研究基于实验室自主搭建的拉曼光谱系统结合表面增强拉曼光谱技术,对菠菜毒死蜱农药残留检测方法进行了研究。采用S-G 5点平滑和有效峰线性拟合的光谱预处理方法,选取615.5~626.4 cm-1波段,建立了菠菜毒死蜱含量预测的多元线性回归模型,其RC和RP分别为0.961和0.954,最低检出含量为0.05 mg·kg-1。该方法不需要对样品进行预处理,检测速度快,具有较好的稳定性与普适性,为果蔬农药残留的实时和在线检测提供了一种新方法。
[1] Li R, He L, Wei W, et al.Food Control, 2015, 51: 212.
[2] Zainudin B H, Salleh S, Mohamed R, et al.Food Chem., 2015, 172: 585.
[3] JIANG Xue-song, WANG Wei-qin, LU Li-qun, et al(蒋雪松,王维琴,卢利群,等).Transactions of the Chinese Society of Agricultural Engineering(农业工程学报), 2014, 30(12): 278.
[4] He S, Xie W, Zhang W, et al.Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 137: 1092.
[5] ZHAI Chen, PENG Yan-kun, LI Yong-yu, et al(翟 晨,彭彦昆,李永玉,等).Spectroscopy and Spectral Analysis(光谱学与光谱分析), 2015, 35(8): 2180.
[6] Lv M Y, Teng H Y, Chen Z Y, et al.Sensors and Actuators B: Chemical, 2015, 209: 820.
[7] Strickland A D, Batt C A.Analytical Chemistry, 2009, 81(8): 2895.
[8] Kubackova J, Fabriciova G, Miskovsky P, et al.Anal.Chem., 2015, 87(1): 663.
[9] GAO Si-min, WANG Hong-yan, LIN Yue-xia, et al(高思敏,王红艳,林月霞,等).Acta Physico-Chimica Sinica(物理化学学报), 2014, 30(10): 1916.
[10] CHEN Xu-cheng, ZHAO Ai-wu, GAO Qian, et al(陈旭成,赵爱武,高 倩,等).Acta Chimica Sinica(化学学报), 2014, (4): 467.
[11] Leopold N, Lendl B.Journal of Physical Chemistry B, 2003, 107(24): 5723.
[12] Fan Y X, Lai K Q, Rasco B A, et al.Food Control, 2014, 37: 153.
[13] Wijaya W, Pang S, Labuza T P, et al.Journal of Food Science, 2014, 79(4): T743.
[14] Xie Y, Mukamurezi G, Sun Y, et al.European Food Research and Technology, 2012, 234(6): 1091.
[15] Dhakal S, Li Y, Peng Y, et al.Journal of Food Engineering, 2014, 123: 94.
[16] XU Tian-feng, PENG Yan-kun, LI Yong-yu, et al(徐田锋,彭彦昆,李永玉,等).Journal of Food Safety & Quality(食品安全质量检测学报), 2014, (3): 707.
[17] Shende C, Inscore F, Sengupta A, et al.Sensing and Instrumentation for Food Quality and Safety, 2010, 4(3-4): 101.
[18] Zhang L, Wang B, Zhu G, et al.Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2014, 133: 411.
*Corresponding author
(Received Oct.13, 2015; accepted Jan.30, 2016)
Detection of Chlorpyrifos on Spinach Based on Surface Enhanced Raman Spectroscopy with Silver Colloids
ZHAI Chen, XU Tian-feng, PENG Yan-kun, LI Yong-yu*
National Research and Development Center for Agro-Processing Equipment, College of Engineering, China Agricultural University, Beijing 100083, China
In this research, the surface enhanced Raman spectroscopy (SERS) technique is used to develop a nondestructive and fast detecting method for the detection of residual chlorpyrifos on spinach.Silver colloids used for SERS spectroscopy is prepared by the reduction of silver nitrate with hydroxylamine hydrochloride at alkaline pH.The prepared silver colloids are dropped onto spinach samples, then the SERS spectra are collected non-destructively with a self-developed Raman system.This method can be made without physical contact to samples, and rapidly completed without time-consuming sample pre-treatments, and suited to the development of real-time on-line detection methods for trace pesticide residues.SERS signals are collected from 20 points on each spinach sample with 450 mW laser power and 2.5 s exposure time.Chlorpyrifos concentrations in 24 samples are determined with gas chromatography after SERS spectra taken.Savitzky-Golay (SG) smoothing filter and effective peak linear fitting method are used to remove the random noise and the fluorescence background for improving the accuracy of SERS results.The SERS signals are collected from different parts of 50 spinach samples with the same concentration of chlorpyrifos but at different fresh degrees.The relative standard deviation (RSD) of chlorpyrifos' characteristic peak intensities is 13.4%.Although the differences of samples lead to differences in the curves of Raman spectrum, they have little influence on the characteristic peak intensities, which indicates the stability of the proposed detecting method.After the fluorescent background removed, the 20 curves of each sample are averaged.Correlation analysis is done between chlorpyrifos concentration and signal intensity at every Raman shift.Results show that correlation coefficients are higher than 0.85 in the range of 615.5~626.4 cm-1.Signals in this range are used to establish multiple linear regression (MLR) model for the prediction of residual chlorpyrifos.MLR model was developed for chlorpyrifos concentration versus Raman signal intensity at 615.5~626.4 cm-1for predicting residual chlorpyrifos content in samples, the correlation coefficients of calibration (RC) and validation (RP) are 0.961 and 0.954, which indicate a good linear relationships between them.The minimum detectable threshold for this method is 0.05 mg·kg-1which is close to the value limited by the national standard of China (0.1 mg·kg-1for chlorpyrifos in spinach).The proposed practical method is sample, fast, without sample preparation, thus it shows great potential in safety detection of fruits and vegetables.
Surface enhanced Raman spectroscopy; Spinach; Chlorpyrifos; Silver colloids
2015-10-13,
2016-01-30
国家科技支撑计划项目(2014BAD04B05)资助
翟 晨,1988年生,中国农业大学工学院博士研究生 e-mail:270905844@qq.com *通讯联系人 e-mail:yyli@cau.edu.cn
O657.3
A
10.3964/j.issn.1000-0593(2016)09-2835-06

