阿霉素前药纳米粒/姜黄素联合递送系统的构建及其抗肿瘤研究
褚丽萍,刘金剑,杨翠红,黄帆,刘鉴峰,张玉民
(北京协和医学院&中国医学科学院放射医学研究所,天津 300192)
阿霉素前药纳米粒/姜黄素联合递送系统的构建及其抗肿瘤研究
褚丽萍,刘金剑,杨翠红,黄帆,刘鉴峰,张玉民Δ
(北京协和医学院&中国医学科学院放射医学研究所,天津 300192)
目的 以酸敏感阿霉素前药纳米粒为基础,通过负载姜黄素构建联合递送系统,从而在提高抗肿瘤细胞增殖效果的同时降低由阿霉素引起的心肌细胞毒性。方法 利用阿霉素(doxorubicin,DOX)的氨基与醛基化聚乙二醇(PEG-CHO)的醛基进行席夫碱反应得到PEG-DOX前药聚合物,通过疏水作用将疏水性抗肿瘤药物姜黄素(curcumin,Cur)负载到PEG-DOX的疏水内核中,最后通过纳米沉淀技术得到同时负载两种药物的前药纳米粒PEG-DOX/Cur NPs。通过核磁(1H-NMR)对PEG-DOX前药进行结构表征,利用动态光散射(DLS)和透射电镜(TEM)对PEG-DOX/Cur NPs的粒径和形貌进行表征;利用反相高效液相色谱法(RP-HPLC)研究PEG-DOX/Cur NPs在酸性条件下的药物释放行为;利用MTT法研究 PEG-DOX/Cur NPs的肿瘤细胞(H1975)增殖抑制效果以及评价PEG-DOX/Cur NPs对心肌细胞(H2C9)的毒性;通过H2C9细胞内的氧化自由基(ROS)水平检测(2′,7′-二氯荧光素二乙酸盐法,DCFH-DA法)揭示PEG-DOX/Cur NPs对DOX心肌细胞毒性改善的机理。结果 PEG-DOX/Cur NPs为直径约90 nm的均一的球形结构,在酸性条件下能够同步释放DOX和Cur;MTT结果表明PEG-DOX/Cur NPs的H1975细胞增殖抑制效果优于DOX和PEG-DOX NPs(P<0.05),且PEG-DOX/Cur NPs对H2C9细胞的毒性明显低于DOX和PEG-DOX NPs(P<0.05);H2C9细胞ROS含量检测结果表明PEG-DOX/Cur NPs处理的心肌细胞具有最低的ROS水平(P<0.05),由此说明PEG-DOX/Cur NPs较低的心肌细胞毒性可能源于Cur引起的胞内ROS的降低所致。结论 基于DOX前药纳米粒负载Cur构建联合递送系统在实现了理想的肿瘤细胞增殖抑制效果的同时,明显的降低了由DOX引起的心肌细胞毒性,实现了联合治疗的效益最大化。
纳米粒前药;阿霉素;姜黄素;联合治疗;心肌毒性
据世界卫生组织组织统计,全世界每年约有400多万人死于癌症,癌症已跃居死亡率的首位[1]。如何抗癌已成为现代医学科技的重大挑战之一。在各种肿瘤治疗中,由于小分子化疗药物对杀死肿瘤的高效性,成为了必不可少的选择。然而,由于其本身的物理化学特性导致的生物利用度差、血液/肾清除速率高、特异性差、肿瘤蓄积浓度低、毒副作用大,以及易产生肿瘤多药耐药等问题严重限制了其临床应用[2]。纳米药物递送系统的提出明显的改善了化疗制剂的水溶性、生物利用度、药代动力学特性,一定程度上提高了抗肿瘤效率及降低了对机体的毒副作用[3-6]。传统的纳米载体药物仅仅负载一种药物,由于其缓慢的释放药物并不能够从根本上改善抗肿瘤效果,以及彻底解决对机体的毒性反应[7-9]。因此,本实验设计了一个能够同时递送两种化疗药物的前药纳米粒,即疏水抗肿瘤药物1直接作为疏水内核,与合适尺寸的亲水段聚乙二醇(PEG)通过化学键合起来,二者通过亲疏水作用组装成具有一定形态的功能性前药纳米载体;前药纳米载体中的疏水内核(疏水性抗肿瘤药物1)通过与疏水性抗肿瘤药物2的疏水作用,将药物2包覆在前药纳米载体中,实现了对两种药物的同时递送。与联合单体药物治疗比较,能够彻底的降低系统毒性或其他副作用。此多药物递送系统保证有充足的药物能够到达肿瘤部位,确保联合治疗的协同效应以及改善抗肿瘤活性。
1 材料与方法
1.1 材料
1.1.1 试剂:端基醛基功能化的聚乙二醇(mPEG2000-CHO)购自于北京键凯科技有限公司;姜黄素(curcumin)和盐酸盐阿霉素(DOX-HCL)购自浙江海正药业有限公司;2′,7′-二氯荧光素二乙酸盐(DCFH-DA)购自于美国sigma-aldrich公司;其它生化试剂均购自于希恩思生化科技有限公司。小鼠肺癌细胞(H1975细胞)和小鼠心肌细胞(H2C9细胞)由南开大学杨志谋教授惠赠。
1.1.2 主要仪器:动态光散射粒度仪(DLS,Zetasizer Nano ZS90,Malvern Instruments,美国);透射电镜(TEM;Tecani G2 F20系统,美国);1H核磁共振波谱仪(VARIAN Unity Plus 400 MHz,Varian Instruments,美国);反相高效液相色谱仪(RP-HPLC,Waters,美国);全波长酶标仪(VARIOSKAN FLASH,Thermo scientific,美国)。
1.2 方法
1.2.1 PEG-DOX的合成及表征:通过DOX的氨基与mPEG2000-CHO的醛基反应形成席夫碱键,得到DOX前药聚乙二醇-阿霉素(PEG-DOX)。称取300 mg mPEG2000-CHO和80 mg DOX-HCL,共溶解于3.0 mL无水二甲基亚砜(DMSO)中,加入30 μL三乙胺(Et3N)催化该反应,40 ℃油浴条件下反应24 h,得到具有酸敏感的PEG-DOX。随后利用透析方法逐次地将未反应的DOX-HCL和DMSO透析出来,得到PEG-DOX水溶液,通过真空冻干48 h得到PEG-DOX冻干粉。通过1H核磁共振波谱仪对PEG-DOX进行化学结构表征。
1.2.2 PEG-DOX/Cur NPs和PEG-DOX NPs的制备及表征:称取10 mg PEG-DOX冻干粉和2 mg Cur充分溶解溶于2.0 mL N,N-二甲基甲酰胺(DMF)内,通过纳米沉淀技术缓慢地滴于8.0 mL磷酸盐缓冲液(PBS,pH7.4)中,震荡12 h后利用透析的方法除去有机溶剂DMF。得到基于DOX前药纳米粒的联合递送系统PEG-DOX/Cur NPs。PEG-DOX NPs的制备方法同上。通过DLS测定PEG-DOX NPs和PEG-DOX/Cur NPs的粒径,利用TEM对其纳米形貌进行表征。
1.2.3 体外药物释放:取2份2.0 mL PEG-DOX/Cur NPs溶液装入分子截留量为3500的透析袋内,分别置于装有50 mL PBS(pH 7.4和pH 5.0)的烧杯内,37 ℃恒温震荡,在不同孵育时间取5.0 mL透析液,通过RP-HPLC检测不同时间DOX和Cur的释放量并绘制释放曲线。
1.2.4 体外抗肿瘤试验用含10%胎牛血清,100 U/mL青霉素和100 μg/mL链霉素的 RMPI1640培养小鼠肺癌细胞系H1975细胞,置于37 ℃、 5% CO2的细胞培养箱中培养。取对数生长期细胞以每孔5×103个接种于96孔板内培养24 h,向各孔中分别加入一系列浓度梯度(按照DOX浓度为0.2、0.39、0.78、1.56、3.125、6.25、12.5和25 μg/mL和Cur浓度为0.08、0.16、0.312、0.625、1.25、2.5、5和10 μg/mL)的DOX-HCL、Cur、PEG-DOX NPs和PEG-DOX/Cur NPs,培养箱内孵育24 h后向孔内加入20 μL MTT溶液(5 mg/mL),继续培养4 h后向孔内加入150 μL DMSO溶液,充分震荡后利用酶标仪检测570 nm下各孔的吸光值。每个浓度设置6个复孔,根据公式细胞生存率=实验组吸光值/对照组吸光值×100%。计算每个浓度下的细胞生存率并绘制生存率曲线。
1.2.5 心肌细胞毒性:心肌细胞毒性试验采用小鼠心肌细胞系H2C9细胞,细胞培养方法和MTT试验步骤同1.2.4。每个浓度设置6个复孔。
1.2.6 心肌细胞ROS水平检测:采用2′,7′-二氯荧光素二乙酸盐(DCFH-DA)作为探针检测经不同药物处理后的心肌细胞内产生ROS的水平。该方法的原理为:DCFH-DA分子本身没有荧光,能够自由的穿过细胞膜进入细胞,然后被细胞内的酯酶水解生成DCFH。而DCFH不能够穿透细胞膜,所以探针被装载到细胞内。细胞内的ROS可以将DCFH氧化成具有荧光信号的DCF,细胞内ROS的含量与DCF的荧光强度成正比。按照1.2.4中所述方法培养H2C9细胞,取对数生长期细胞接种于24孔板内,培养过夜后分别将DOX-HCL、Cur、PEG-DOX NPs和PEG-DOX/Cur NPs(按照DOX浓度为20 μg/mL,Cur浓度为8 μg/mL)加入到孔内继续培养24 h,随后向每孔加入20 mM DCFH-DA溶液,继续培养1 h,用PBS清洗细胞2-3次后利用酶标仪检测细胞内DCF的荧光强度,每个浓度设置6个复孔。激发波长和发射波长分别为485 nm和525 nm。标准化荧光强度的计算公式为:实验组荧光强度值/对照组荧光强度值×100。

2 结果
2.1 PEG-DOX的合成及结构表征 在Et3N催化作用下合成PEG-DOX单体,通过图1的核磁数据比较分析,反应后mPEG2000-CHO的醛基(CHO)峰消失和DOX-HCL的氨基(NH2),证明席夫碱键(C=N)成功通过CHO与NH2合成,得到PEG-DOX单体。

图1 DOX-HCL(A),mPEG2000-CHO(B)和PEG-DOX单体(C)的核磁图谱分析Fig.1 1H NMR spectra of DOX-HCL (A), mPEG2000- CHO (B) and PEG-DOX (C)
2.2 PEG-DOX/Cur NPs和PEG-DOX NPs的粒径及形貌表征 通过纳米沉淀技术和透析得到PEG-DOX NPs和PEG-DOX/Cur NPs。表征结果见图2,通过DLS和TEM表征得到二者均为形貌均一的球形结构,粒径分别为64.2和88.4 nm。
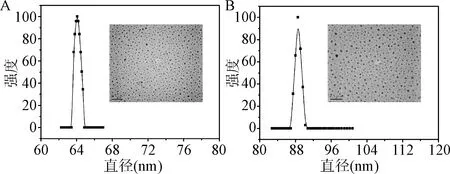
图2 PEG-DOX NPs(A)和PEG-DOX/Cur NPs(B)的DLS和TEM表征结果Fig.2 Hydrodynamic size distributions and TEM images of PEG-DOX NPs (A) and PEG-DOX/Cur NPs (B)
2.3 药物释放曲线 通过透析方法结合RP-HPLC检测PEG-DOX/Cur NPs在不同条件下的DOX和Cur的释放速率。结果见图3,表明DOX和Cur在正常生理条件下均稳定的装载到前药纳米粒内,释放率低于10%;在模拟肿瘤环境的酸性条件下(pH 5.0), DOX和Cur均表现出较灵敏、快速的同步释放,在24 h时释放率高达70~80%。
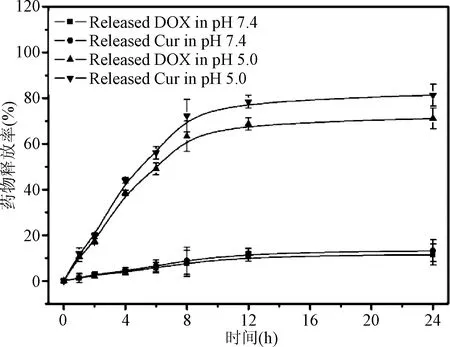
图3 PEG-DOX/Cur NPs中DOX和Cur在不同条件下的释放曲线Fig.3 DOX and Cur release profiles of PEG-DOX-Cur NPs under different pH values.
2.4 体外抗肿瘤试验 各个受试药物对H1975细胞的增殖抑制能力结果见图4。相对于DOX-HCL,PEG-DOX的肿瘤细胞增殖抑制能力稍差,但差异无统计学意义;而Cur 负载后的PEG-DOX/Cur NPs因可以同时递送DOX和Cur实现了对肿瘤细胞的联合杀伤,显著增强了PEG-DOX对H1975细胞的增殖抑制能力。在DOX浓度为1.56 μg/mL和Cur浓度为0.625 μg/mL时,F值为15.057,细胞生存率PEG-DOX/Cur NPs(56.1±10.2%) vs. PEG-DOX NPs (79.0±4.2%)的P值为0.01。
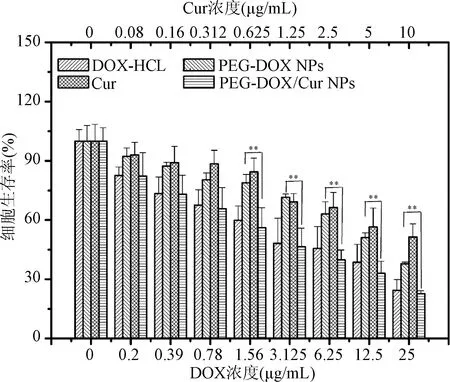
图4 不同药物对H1975细胞的生存率影响的比较(n=6)Fig.4 Cytotoxicity of free DOX, Cur, PEG-DOX NPs and PEG-DOX/Cur NPs against H1975 cells (n=6)
2.5 心肌细胞毒性 据文献报道[10-11]DOX在代谢过程中可诱导活性氧自由基(ROS)的产生。而ROS可通过线粒体依赖性的细胞凋亡信号转导引起心肌细胞凋亡。对正常心肌细胞H2C9的毒性结果见图5,与DOX-HCL和 PEG-DOX相比,PEG-DOX/Cur NPs同时递送DOX和Cur,但其对H2C9细胞的毒性明显降低(P<0.05)。在DOX浓度为1.56 μg/mL和Cur浓度为0.625 μg/mL时,F值为61.688, H2C9细胞的生存率PEG-DOX/Cur NPs(92.0±3.6%)相对于DOX(61.8±7.9%)和PEG-DOX NPs(56.5±5.6%)的P值分别为0.01和0.01。

图5 不同药物对心肌细胞的生存率影响的比较(n=6)Fig.5 Cytotoxicity of free DOX, Cur, PEG-DOX NPs and PEG- DOX/Cur NPs against H2C9 myocardial cells(n=6)
2.6 心肌细胞ROS水平检测 因Cur具有清除ROS的能力,为了进一步确证DOX的心肌毒性是否是由其在心肌细胞内产生的ROS所介导以及研究PEG-DOX/Cur NPs降低DOX心肌细胞毒性的机理,本研究进行了不同药物处理的心肌细胞内ROS水平检测。如图6所示,经DOX-HCL 和PEG-DOX处理的心肌细胞显示出了较高的ROS水平;而经PEG-DOX/Cur NPs处理的心肌细胞ROS水平明显降低,F值21.577,PEG-DOX/Cur NPs (67.0±3.3%)相对于DOX (162.4±25.9%)和PEG-DOX NPs(109.4±16.4%)的P值分别为0.01和0.027。由此说明在PEG-DOX/Cur NPs递送系统中,DOX产生的ROS可能被Cur彻底清除,从而DOX的心肌细胞毒性得到了明显的改善。
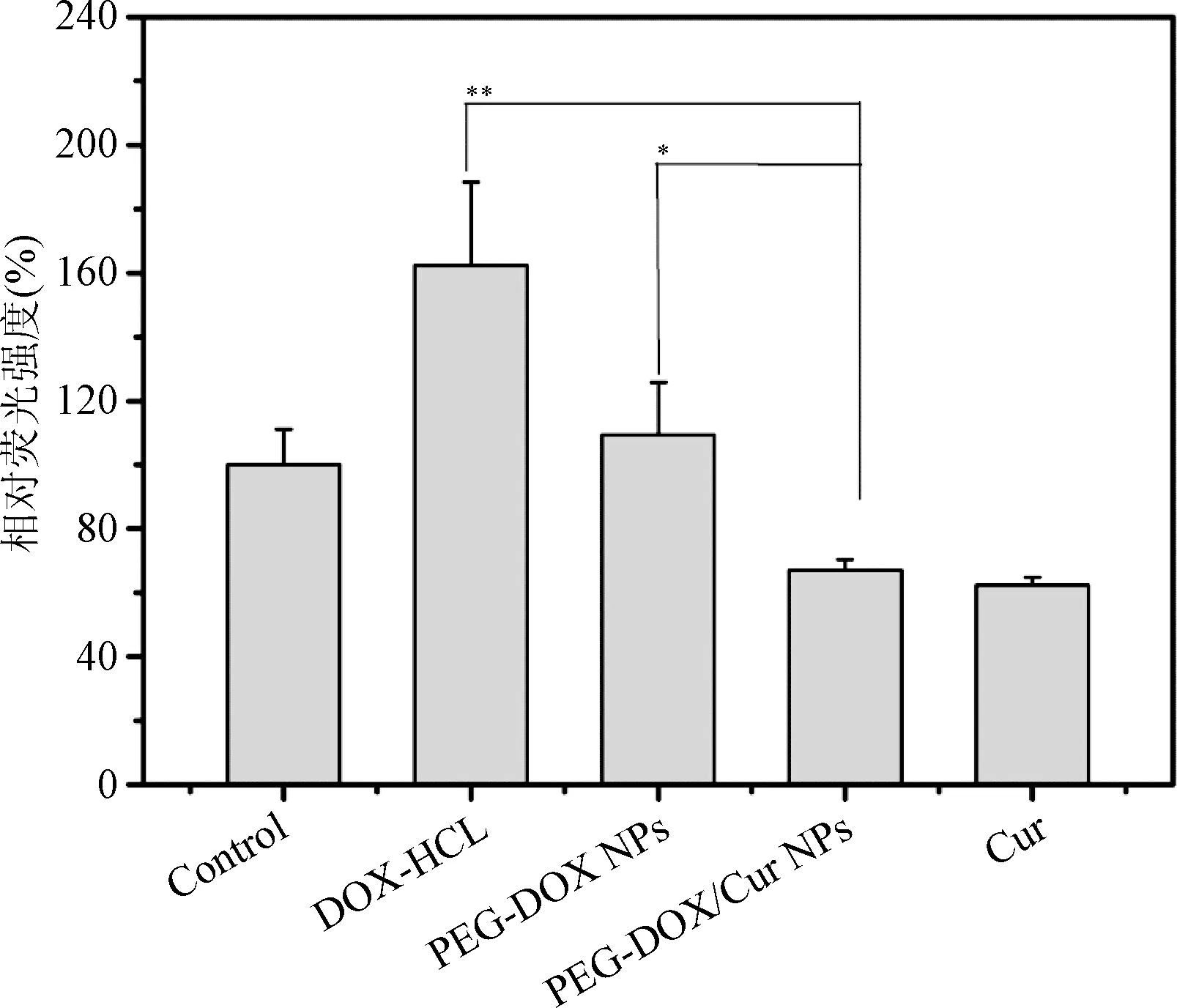
图6 不同药物处理后H2C9细胞内ROS的含量的比较(n=6)Fig.6 The differences of ROS in the H2C9 cells treated by free DOX, Cur, PEG-DOX NPs and PEG-DOX/Cur NPs(n=6)
3 讨论
基于嵌段共聚物作为纳米递送系统实现了对多个药物的联合递送,然而由于其复杂的递送体系降低了药物的释放效率,导致其联合治疗或协同治疗的效果并不明显[12]。本文中利用抗肿瘤药物DOX直接作为疏水内核组装的前药载体,通过疏水作用负载Cur制备PEG-DOX/Cur NPs,在到达酸性条件的肿瘤时,PEG-DOX/Cur NPs能够通过响应性解体,实现同步递送和高效释放DOX和Cur,实现了对肿瘤细胞的联合治疗。
体外抗肿瘤结果表明,单独的PEG-DOX NPs 显示了比 DOX-HCL 较温和的细胞毒性,这是由于纳米结构与小分子药物被肿瘤细胞摄取的机制不同所导致的[13]。即纳米粒子首先通过细胞内吞进入细胞,在细胞内开始杀伤作用还需通过一个释放过程。而小分子药物直接通过被动扩散进入细胞,然后直接发挥抗肿瘤作用。而通过Cur负载到PEG-DOX NPs 构建联合递送系统PEG-DOX/Cur NPs 之后,由于DOX 和Cur的不同抗肿瘤机制[10,11,14],二者在细胞内实现共同释放后实现了对肿瘤细胞的联合杀伤,即显示了比单独药物 (DOX-HCL 或Cur) 更强的细胞毒性。
由于文献报道DOX在代谢过程中可诱导活性氧自由基(ROS)的产生。而ROS可通过线粒体依赖性的细胞凋亡信号转导引起心肌细胞凋亡[10,11]。本文中DOX-HCL对正常H2C9心肌细胞造成了较强的细胞毒性。PEG-DOX NPs由于上段所述的不同于DOX-HCL的进入细胞的机制,其显示了相对较弱的细胞毒性。姜黄素作为天然的抗氧化药物能够很好清除体内的ROS[15]。通过共负载DOX 和Cur在取得理想的抗肿瘤效果的同时,Cur通过其天然的抗氧化活性降低由DOX化疗诱导产生的ROS水平,提高心肌细胞的生存率[16]。心肌细胞内ROS含量的检测进一步验证了PEG-DOX/Cur NPs能够降低心肌细胞内ROS的水平,进而降低对心肌细胞的毒性作用。
本课题制备的前药纳米粒系统PEG-DOX/Cur NPs在细胞水平上的研究结果表明,通过联合治疗实现了较理想的抗肿瘤效果的同时,也明显的降低了由DOX引起的心肌毒性,实现了联合治疗的效益最大化。
[1] World Cancer Report 2014.International Agency for Research on Cancer (IARC). 3 February 2014.
[2]Huang P, Wang D, Su Y, et al. Combination of Small Molecule Prodrug and Nanodrug Delivery: Amphiphilic Drug-Drug Conjugate for Cancer Therapy[J]. J AM CHEM SOC, 2014, 136(33): 11748-11756.
[3]Li J, Kuang Y, Shi J, et al. Enzyme-Instructed Intracellular Molecular Self-Assembly to Boost Activity of Cisplatin against Drug-Resistant Ovarian Cancer Cells[J]. Angew Chem Int Ed Engl, 2015, 127(45):13505-13509.
[4]Wang W, Song H, Zhang J, et al. An injectable, thermosensitive and multicompartment hydrogel for simultaneous encapsulation and independent release of a drug cocktail as an effective combination therapy platform[J]. J CONTROL RELEASE, 2015, 203:57-66.
[5]Pu K, Shuhendler A J, Jokerst J V, et al. Semiconducting polymer nanoparticles as photoacoustic molecular imaging probes in living mice[J]. NAT NANOTECHNOL, 2014, 9(3):233-239.
[6]Ding D, Mao D, Li K, et al. Precise and Long-Term Tracking of Adipose-Derived Stem Cells and Their Regenerative Capacity via Superb Bright and Stable Organic Nanodots[J]. ACS nano, 2014, 8(12):12620-12631.
[7]Yu Y, Chen C K, Law W C, et al. Polylactide-graft-doxorubicin nanoparticles with precisely controlled drug loading for pH-triggered drug delivery[J]. Biomacromolecules, 2014, 15(2): 524-532.
[8] Cheetham A G, Zhang P, Lin Y, et al. Supramolecular nanostructures formed by anticancer drug assembly[J]. J AM CHEM SOC, 2013, 135(8): 2907-2910.
[9]Shen Y, Jin E, Zhang B, et al. Prodrugs forming high drug loading multifunctional nanocapsules for intracellular cancer drug delivery[J]. J AM CHEM SOC, 2010, 132(12): 4259-4265.
[10]Arola O J, Saraste A, Pulkki K, et al. Acute doxorubicin cardiotoxicity involves cardiomyocyte apoptosis[J]. CANCER RES, 2000, 60(7): 1789-1792.
[11]Zhou S, Starkov A, Froberg M K, et al. Cumulative and irreversible cardiac mitochondrial dysfunction induced by doxorubicin[J]. CANCER RES, 2001, 61(2): 771-777.
[12]Lv S, Tang Z, Li M, et al. Co-delivery of doxorubicin and paclitaxel by PEG-polypeptide nanovehicle for the treatment of non-small cell lung cancer[J]. Biomaterials, 2014, 35(23): 6118-6129.
[13]Prabaharan M, Grailer J J, Pilla S, et al. Amphiphilic multi-arm-block copolymer conjugated with doxorubicin via pH-sensitive hydrazone bond for tumor-targeted drug delivery[J]. Biomaterials, 2009, 30(29): 5757-5766.
[14]Ketron A C, Gordon O N, Schneider C, et al. Oxidative metabolites of curcumin poison human type II topoisomerases[J]. Biochemistry, 2012, 52(1): 221-227.
[15]Barzegar A, Moosavi-Movahedi A A. Intracellular ROS protection efficiency and free radical-scavenging activity of curcumin[J]. PLoS One, 2011, 6(10): e26012.
[16]Cao J, Liu Y, Jia L, et al. Curcumin attenuates acrylamide-induced cytotoxicity and genotoxicity in HepG2 cells by ROS scavenging[J]. Journal of agricultural and food chemistry, 2008, 56(24): 12059-12063.
(编校:谭玲)
Construction of a co-delivery system based on doxorubicin prodrug nanoparticle and curcumin and its application in anti-tumor study
CHU Li-ping, LIU Jin-jian, YANG Cui-hong, Huang Fan, LIU Jian-feng and ZHANG Yu-minΔ
(Institute of Radiation Medicine, Chinese Academy of Medical Science and Peking Union Medical College, Tianjin 300192, China)
ObjectiveTo construct a joint delivery system by loading curcumin, acid sensitive adriamycin nanoparticles as the basis, as to improve the anti-tumor cell proliferation activity and simultaneously decrease the cardiotoxicity induced by doxorubicin.MethodsThe PEG-DOX conjugate was synthesized by schiff base reaction between the amino of doxorubicin and the aldehyde group of aldehyde functionalized polyethylene glycol, the hydrophobic curcumin was loaded by PEG-DOX conjugate through the hydrophobic interaction between curcumin and the core of PEG-DOX conjugate, and then the prodrug nanoparticle PEG-DOX/Cur NPs was obtained by nanoprecipitation technique. The structure of PEG-DOX conjugate was confirmed by1H NMR. The diameter and morphology of PEG-DOX/Cur NPs were detected by dynamic light scattering (DLS) and transmission electron microscope (TEM), and the DOX and Cur release kinetics under physiological and acidic condition were detected by reversed-phase high performance liquid chromatography (RP-HPLC) method. The in vitro combined antitumor effects and the cardiotoxicity of PEG-DOX/Cur NPs were evaluated by MTT method. The reactive oxygen species (ROS) within the myocardial cells was estimated by 2′,7′-dichlorofluorescin diacetate (DCFH-DA) method.ResultsThe PEG-DOX/Cur NPs showed spherical structure with diameter of about 100 nm with a narrow PDI. The PEG-DOX/Cur NPs could release DOX and Cur, simultaneously. The MTT results showed that PEG-DOX/Cur NPs had the best cytotoxicity on H197 cells and the lowest cardiotoxicity on H2C9 cells. Compared with DOX and PEG-DOX/Cur NPs, H2C9 cells administrated by PEG-DOX/Cur NPs showed the lowest ROS level, which indicated that the lowest cardiac myocyte toxicity of PEG-DOX/Cur NPs may result from the ROS clearance function of curcumin.ConclusionThe co-delivery system of PEG-DOX/Cur NPs based on PEG-DOX conjugate and curcumin achieved the maximum of effectiveness, with desirable anti-tumor proliferation effect and significantly improved cardiac myocyte toxicity induced by DOX.
prodrug nanoparticle; doxorubicin; curcumin; combination therapy; cardiotoxicity
国家自然科学基金(81471727);“协和青年基金资助”和“中央高校基本科研业务费专项资金资助”(3332015100);北京协和医学院2015年度“协和新星”项目(1579);中国医学科学院放射医学研究所发展基金(1609)
褚丽萍,女,学士,副研究员,研究方向:细胞生物学,E-mail:chulp89@163.com;张玉民,男,通信作者,硕士,助理研究员,研究方向:功能纳米药物的构建及其应用,E-mail:zhangyumin21@sina.cn。
R914.5
A
1005-1678(2016)01-0012-05

